La cistectomía radical constituye el tratamiento habitual del cáncer infiltrante de vejiga. Tiene una elevada morbilidad debido a la resección de estructuras y a las complicaciones metabólicas producidas por la derivación urinaria, como es la encefalopatía hiperamoniémica, complicación infrecuente y que puede producirse varios años después de la intervención quirúrgica1.
Se trata de una mujer de 78 años, sin antecedentes personales ni familiares de interés, diagnosticada 5 años antes de carcinoma de vejiga grado III, estadio B y tratado con cistectomía, histerectomía, doble anexectomía y ureterosigmoidostomía.
Cuatro años tras la cirugía, ingresó en otro centro por episodios de desconexión del medio, movimientos de chupeteo, sacudidas mioclónicas en cabeza y extremidades derechas, amnesia del episodio y confusión postictal. Se realizó resonancia magnética nuclear, que fue normal y electroencefalograma que mostró abundante actividad frontotemporal bilateral. Se diagnosticó de epilepsia idiopática y se inició tratamiento antiepiléptico (levetiracetam 500mg/12h).
Tres meses después, en contexto de cuadro febril, reingresó por la misma clínica y se evidenció acidosis metabólica hiperclorémica. Dado el antecedente de la derivación urinaria, se solicitó la determinación de niveles de amonio en sangre, que mostraron una amoniemia de 200μg/dl (niveles normales: 17-80μg/dl). Durante el periodo intercrítico, la paciente no presentó síntomas de hiperamoniemia crónica.
Se realizó análisis de autoinmunidad, hormonas (tirotropina 2,36μU/ml [0,27-4,2] y tiroxina libre 1,05ng/dl [0,93-1,7]) marcadores tumorales, serología vírica y ecografía abdominal para descartar el origen hepático de la hiperamoniemia que resultaron normales.
Ante el diagnóstico de encefalopatía con estatus no convulsivo de crisis parciales complejas de origen tóxico-metabólico y acidosis metabólica hiperclorémica secundaria a derivación uretero-intestinal, se inició tratamiento con dieta hipoproteica, hidratación con 2 l/día, bicarbonato oral 500mg/8h, lactulosa 10g/8h y levetiracetam 500mg/12h, y fue remitida a la unidad de nutrición de nuestro centro para ajuste del tratamiento nutricional.
La paciente refería pérdida de peso de un 8% desde la intervención quirúrgica. Pesaba 55kg con un índice de masa corporal de 27kg/m2, pliegue tricipital 18mm, circunferencia braquial 25cm, circunferencia muscular del brazo 19,35cm, valoración subjetiva global grado B. Presentaba tensión arterial de 120/80mmHg, exploración por aparatos y sistemas normal, y ausencia de edemas tibiomaleolares.
Tras la valoración del caso, se recomendó restricción completa de proteínas de origen animal con complementación de proteínas de origen vegetal.
Se solicitó evaluación de la ingesta dietética mediante un diario dietético de 3 días no consecutivos. En la visita de control se observó un consumo diario de 40g de proteínas y 1.300kcal.
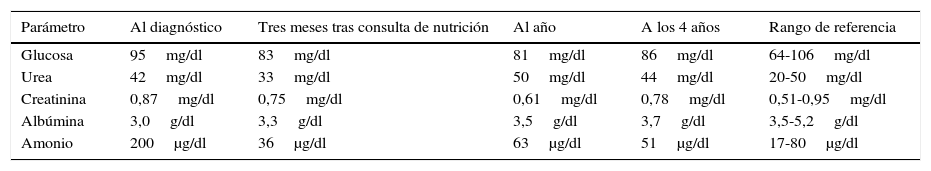
Los resultados del análisis sanguíneo al diagnóstico, tras la primera visita en consultas de nutrición y su evolución, se muestran en la tabla 1.
Bioquímica sanguínea al diagnóstico, tras la primera visita en consultas de nutrición, al año y a los 4 años de inicio del tratamiento nutricional
| Parámetro | Al diagnóstico | Tres meses tras consulta de nutrición | Al año | A los 4 años | Rango de referencia |
|---|---|---|---|---|---|
| Glucosa | 95mg/dl | 83mg/dl | 81mg/dl | 86mg/dl | 64-106mg/dl |
| Urea | 42mg/dl | 33mg/dl | 50mg/dl | 44mg/dl | 20-50mg/dl |
| Creatinina | 0,87mg/dl | 0,75mg/dl | 0,61mg/dl | 0,78mg/dl | 0,51-0,95mg/dl |
| Albúmina | 3,0g/dl | 3,3g/dl | 3,5g/dl | 3,7g/dl | 3,5-5,2g/dl |
| Amonio | 200μg/dl | 36μg/dl | 63μg/dl | 51μg/dl | 17-80μg/dl |
Insistimos en la restricción completa de proteínas de origen animal salvo algún huevo, ocasionalmente, en complementación de proteínas de origen vegetal, para lo que se realizó pauta de alimentación individualizada y, ante el déficit de vitamina D, se inició tratamiento con calcifediol 266μg/mes.
Tras 3 meses de dieta individualizada, la paciente no reingresó, mantuvo peso y presentó niveles de amonio en la normalidad (36μg/dl), con función renal, hepática y vitamina D normales.
En todos los seguimientos posteriores persistieron valores normales de amoniemia, sin datos clínicos ni bioquímicos de desnutrición proteica.
En este caso, la encefalopatía se debe a que los segmentos intestinales empleados para la derivación de los uréteres, mantienen su capacidad de absorción y secreción2, lo que conlleva un aumento de la absorción de amonio con saturación de la capacidad de metabolización del hígado e hiperamoniemia. La secreción de sodio y bicarbonato así como la reabsorción de hidrogeniones y cloro por la mucosa intestinal produce una acidosis metabólica hiperclorémica3.
En condiciones normales, el amonio procede principalmente del intestino, donde se genera tras el metabolismo de los productos nitrogenados de la dieta, la acción de la flora intestinal y el metabolismo de la glutamina por la glutaminasa intestinal. Se absorbe en el intestino delgado y alcanza la circulación portal, para finalmente llegar al hígado, donde el 90% será metabolizado mediante el ciclo de la urea4,5.
Las dietas ricas en proteínas y un crecimiento bacteriano intestinal con predominio de flora proteolítica producen un aumento en la síntesis y disponibilidad del amonio para su absorción.
En la derivación urétero-intestinal, la absorción del amonio se ve favorecida por la alcalinización de la luz intestinal, con lo que el amoniaco urinario pasa a su forma ionizada (NH4+), de carácter liposoluble con mayor capacidad de difusión a través de las membranas biológicas5 y el aumento de producción de amonio por sobrecrecimiento de bacterias proteolíticas6. Además, al producirse absorción de amonio por segmentos intestinales distales que drenan al plexo hemorroidal inferior, se produce paso directo a la circulación sistémica sin metabolismo hepático7, favoreciendo la encefalopatía hiperamoniémica.
El principal tratamiento de la hiperamoniemia de causa no hepática es la disminución de amonio en la luz intestinal. Los tratamientos propuestos son la disminución del aporte proteico exógeno y el uso de disacáridos no absorbibles, con el fin de disminuir la formación de amonio por la flora y favorecer su eliminación intestinal.
En cuanto a la restricción proteica, no existe consenso sobre los requerimientos para esta enfermedad. En nuestro caso, optamos por un aporte proteico de 0,8g/kg/día, sin que se detectaran datos clínicos de malnutrición energético-proteica. Se hicieron recomendaciones dietéticas para conseguir la máxima calidad proteica mediante el consumo combinado de las proteínas vegetales ya que los cereales son deficientes en lisina, el maíz pobre en triptófano y las leguminosas en metionina y cisteína. Además, la fibra que acompaña a estos alimentos favorece el crecimiento de la flora bacteriana sacarolítica sobre la proteolítica. También se le recomendó incluir algún huevo ocasionalmente, ya que se trata de la proteína de mayor calidad. Con estas modificaciones, la paciente ha mantenido un estado nutricional adecuado y no ha vuelto a presentar síntomas neurológicos.
Respecto al tratamiento farmacológico, los disacáridos no absorbibles (como la lactulosa) son metabolizados por la flora intestinal sacarolítica en el colon generando ácidos grasos de cadena corta, que disminuyen el pH intestinal y por ello la absorción de amonio. El tratamiento con fármacos antiepilépticos en casos de estatus epilépticos secundarios a causa tóxico-metabólica en pacientes sin antecedentes de epilepsia o lesión orgánica estructural cerebral puede disminuirse progresivamente si el paciente queda libre de crisis tras la corrección completa de la causa subyacente. En caso de que se prevea recurrencia de la alteración metabólica, puede mantenerse el fármaco indicado a dosis mínima eficaz de forma preventiva8.
Aunque infrecuente, la hiperamoniemia de causa no hepática puede deberse a alteraciones del ciclo de la urea, como el déficit de ornitina transcarbamilasa (OTC). El hecho de que el déficit de esta enzima codificada en el cromosoma X se manifieste por primera vez en la edad adulta suele deberse a la concurrencia en sujetos heterocigotos de factores precipitantes (infecciones, traumatismo, administración de valproato, cirugía, estrés o ingesta excesiva de proteínas)9. Es importante la sospecha clínica de estos déficits en caso de aparición en una misma familia de síntomas neurológicos (retraso mental, ataxia, irritabilidad, agresividad, confusión, alucinaciones) junto con hiperamoniemia.
En caso de persistencia de la clínica, podría plantearse la reconversión de la derivación urinaria a conducto ileal, que ha demostrado normalización de los niveles de amonio y cese de los síntomas en un caso refractario1.
Conflicto de interesesLos autores declaran que no existe conflicto de intereses.