La principal función endocrina del testículo a partir de la pubertad es la síntesis de testosterona, y determinar su concentración total en el adulto es suficiente, en la mayoría de los casos, para diagnosticar el hipogonadismo. Debido a las variaciones circadianas de la concentración de testosterona, la extracción debe realizarse a primera hora de la mañana. Existe una considerable variabilidad en los resultados de los diversos métodos comerciales de análisis. Además, el umbral que determina la aparición de los síntomas de hipogonadismo puede ser distinto en cada individuo. Por ello, valores moderadamente bajos deben considerarse con cautela antes de confirmar el diagnóstico. En estos casos, la determinación de la testosterona libre o la biodisponible puede ser de ayuda. Se pueden utilizar métodos de análisis directo o calcular las respectivas concentraciones a partir de la testosterona total y de la globulina transportadora de hormonas sexuales (SHBG), método más sencillo aunque menos preciso. La evaluación endocrinológica del testículo también debe incluir el análisis de las gonadotropinas (folitropina [FSH] y lutropina [LH]), que se describen en otro artículo de esta serie. La inhibina B es un indicador biológico de la cantidad de células de Sertoli y de su estado funcional en el testículo maduro. Se ha propuesto que la inhibina B puede complementar la información proporcionada por la FSH para determinar la reserva espermatogénica en la azoospermia no obstructiva, aunque su determinación no es sistemática en la actualidad. El seminograma es la prueba más importante para evaluar la función reproductiva en el varón, aunque su capacidad pronóstica está limitada por la considerable imprecisión analítica de los métodos disponibles, todos ellos manuales, y por la variabilidad biológica de la mayoría de sus componentes. Hay que prestar atención a las condiciones preanalíticas, que requieren de la comprensión y la participación del paciente. Diversos organismos y sociedades han propuesto métodos estandarizados para facilitar la mejora de la calidad de los resultados y el intercambio fiable de la información relativa al seminograma. Los marcadores bioquímicos de la próstata, las vesículas y los epidídimos en plasma seminal pueden ayudar a ubicar el nivel de la lesión en casos de hipospermia o azoospermia. Existen diversas pruebas para evaluar la capacidad fecundante de los espermatozoides, pero ninguna de ellas ha reemplazado hasta hoy los parámetros del seminograma básico. Entre las más frecuentes causas congénitas de hipogonadismo se encuentran ciertas alteraciones cromosómicas, especialmente aneuploidías de los cromosomas sexuales. Una amplia variedad de anomalías estructurales autosómicas puede ocasionar esterilidad. El cariotipo es la técnica citogenética principal para el estudio de la constitución cromosómica. Esta técnica puede ser complementada con la hibridación in situ mediante sondas fluorescentes (FISH) para detectar defectos submicroscópicos.
The main endocrine function of the testis after puberty is testosterone production. In most cases, hypogonadism in adult men can be diagnosed by determining total testosterone concentration. Due to the circadian rhythm of testosterone secretion, blood samples should be extracted early in the morning. The results of commercially available methods for analysis show considerable variability. Furthermore, the threshold for the symptoms of hypogonadism may differ in each individual. For these reasons, moderately low testosterone levels should be interpreted with caution before a diagnosis of hypogonadism can be established. In these cases, determination of either free or bioavailable testosterone can be useful. Direct methods can be used or the respective concentrations can be calculated on the basis of total testosterone and sex hormone-binding globulin (SHBG). This latter method is easy to perform but the results are less reliable. Endocrinological evaluation of the testes should also include analysis of the gonadotropins (follitropin [FSH] and lutropin [LH]), which are described in another article in this series. Inhibin B is a biological marker of the amount and the physiological status of Sertoli cells in the postpubertal testis. Inhibin B may improve the information given by FSH for the determination of spermatogenic reserve in non-obstructive azoospermia, but determination of this glycoprotein is not currently used for routine assessment. The most important laboratory test to study reproductive function in men is semen analysis. However, the predictive power of this test is limited by the analytical imprecision of current methods, all of which are manual, and by the biological variability of most of their components. Special attention should be paid to pre-analytical procedures, because they require the understanding and participation of the patient. Some organizations and societies have proposed standardized methods to help improve the quality of semen analysis and reliable exchange of the results of seminogram. Biochemical markers of the prostate, seminal vesicles and epididymis in seminal plasma can indicate the level of damage in hypospermia or azoospermia. The fertility potential of sperm cells can be investigated with a variety of tests and assays, but none of them can yet be recommended for routine practice. Congenital hypogonadism is frequently caused by chromosome abnormalities, particularly sex chromosomal aneuploidies. Other causes of infertility include structural aberrations of autosomes. The main cytogenetic technique performed to determine chromosome constitution is karyotyping. To detect submicroscopic defects, this test can be performed in conjunction with fluorescent in situ hybridization (FISH).
En esta revisión se describen los principales aspectos metodológicos de las pruebas de laboratorio aplicables al estudio de la función del testículo en el varón adulto. Por motivos de espacio y coherencia funcional, se han excluido las pruebas y los valores de referencia del eje gonadal correspondientes a la infancia y la adolescencia. Aunque la determinación de las gonadotropinas es fundamental para completar e interpretar el estudio endocrinológico del testículo (y así se menciona en el texto) la revisión de la lutropina (LH) y la folitropina (FSH) se puede encontrar en otro artículo de esta serie1.
TESTOSTERONALa testosterona (17β-hidroxi-4 androsten-3-ona) es la hormona androgénica producida por el testículo en mayor cantidad. Se sintetiza en las células de Leydig bajo el control de la LH hipofisaria. Su peso molecular es 288,4Da. La testosterona cumple múltiples acciones durante la vida fetal, prepuberal, puberal y adulta, que condicionan los cambios morfológicos y fisiológicos propios del sexo masculino. Algunas de estas acciones son ejercidas por la dihidrotestosterona (DHT) derivada de la 5α reducción de la testosterona en ciertos tejidos. A partir de la pubertad, las concentraciones de testosterona en sangre muestran notables cambios nictamerales, con máximos alrededor de las 8.00 y mínimos a las 20.00 horas. Estas variaciones se reducen en la vejez.
La determinación de la concentración de testosterona en el varón está indicada para el diagnóstico del hipogonadismo primario y secundario, en las alteraciones del desarrollo puberal y en el estudio de las anomalías del desarrollo sexual con cariotipo 46XY, entre ellas la resistencia androgénica.
Métodos de análisis de testosterona totalLa determinación de testosterona total se puede realizar mediante cromatografía líquida o cromatografía de gases seguida de espectrometría de masas (técnicas de referencia) e inmunoanálisis competitivos. En los radioinmunoanálisis la testosterona presente en el suero del paciente y la testosterona marcada con un ligando radioactivo compiten por un número limitado de sitios de unión a un anticuerpo. Los métodos más usados en la actualidad usan marcadores no radiactivos (enzimas, biotina) habitualmente unidos a la hormona o al anticuerpo primario. Un sustrato que reacciona con el complejo hormona-anticuerpo produce compuestos medibles por espectrofotometría o quimioluminiscencia, según el tipo de análisis.
Condiciones preanalíticasLa extracción de sangre debe realizarse por la mañana (de 8.00 a 10.00) coincidiendo con las máximas concentraciones. No se requiere ninguna preparación especial ni es imprescindible estar en ayunas. El suero puede mantenerse a 2-8°C hasta 7 días y al menos 2 meses a −20°C.
Características analíticasLa sensibilidad analítica de los métodos actualmente disponibles es de 0,3nmol/l por lo menos. La imprecisión intraanalítica es < 6% (coeficiente de variación [CV] en el rango de valores normales para el hombre) y llega al 16% en valores bajos. La imprecisión entre series es del 7,5% para valores normales y aumenta progresivamente hasta el 22% en valores bajos. La recuperación media de cantidades conocidas añadidas a las muestras es del 95%. La linealidad de los ensayos suele ser buena hasta 55nmol/l (1.587ng/dl). Para concentraciones superiores es necesario diluir la muestra. Los detalles de las características particulares de la mayoría de los métodos disponibles se pueden consultar2,3. Para convertir los valores de nmol/l a ng/dl hay que multiplicar por 28,86. Para pasar de ng/dl a nmol/l se multiplica por el factor 0,0347.
No se producen interferencias con bilirrubina o hemoblogina, aunque las muestras hemolizadas pueden indicar una inadecuada manipulación de la muestra. Los sueros lipémicos pueden requerir ultracentrifugación previa al análisis.
Hay baja reactividad cruzada para la mayoría de los esteroides (< 0,1%) excepto 5α-dihidrotestosterona (10%), metiltestosterona (3,5%) y androstendiona (0,5%).
Los diversos métodos comerciales disponibles son capaces de clasificar adecuadamente sueros de varones hipogonádicos adultos, aunque algunos sobrestiman (Bayer Centaur) y otros subestiman (Immulite 2000) los resultados obtenidos con un método de referencia basado en cromatografía líquida y espectrometría de masas2. Sin embargo, todos ellos son poco fiables para concentraciones prepuberales o femeninas.
Testosterona libre y biodisponibleAunque la determinación de testosterona total se considera suficiente para el correcto diagnóstico en la mayoría de los varones, en ciertas situaciones la fracción libre de testosterona (un 1-3% del total), que es la única activa sobre los tejidos diana, no se corresponde con la concentración total de hormona circulante. Ello ocurre cuando la globulina transportadora de hormonas sexuales (SHBG) está elevada o baja, en sujetos con hipoalbuminemia, y resulta especialmente relevante en varones con valores limítrofes o moderadamente bajos de testosterona. En estos casos, algunos autores consideran que la determinación de testosterona libre por diálisis de equilibrio es el método de referencia para evaluar la situación homeostática4 (calculador disponible en: http://www.issam.ch/freetesto.htm).
La determinación de testosterona biodisponible (fracción libre más la unida débilmente a la albúmina) puede realizarse por un procedimiento directo, y es otro método considerado como muy fiable. La testosterona es eliminada del suero mediante carbón activo y reemplazada por [3H]testosterona, que se une a la SHBG y otras proteínas del suero. La testosterona unida a SHBG se precipita con sulfato amónico, y la restante es la forma libre más la unida a la albúmina (biodisponible), que se mide como porcentaje de la total5. Se trata de un método poco usado por su complejidad ante otras alternativas igualmente útiles.
Otro procedimiento analítico para determinar la testosterona libre usa un análogo radioyodado, que compite por el anticuerpo pero no se une a las proteínas séricas. Sin embargo, los valores obtenidos con este método son significativamente más bajos e imprecisos que con los métodos de referencia6.
La testosterona medida en saliva es una alternativa fiable de las determinaciones de testosterona libre, pero su aplicación no se ha estandarizado y por el momento no se recomienda su empleo como método sistemático.
Con el fin de simplificar los métodos de análisis, se han desarrollado fórmulas para calcular la testosterona libre y la biodisponible a partir de la total y la SHBG.
InterferenciasEl ritmo circadiano que sigue la síntesis de testosterona origina amplias oscilaciones de las concentraciones. Además, hay notables variaciones intraindividuales a lo largo del tiempo7. Diversos medicamentos influyen negativamente en la producción de testosterona, como la corticoterapia, los anabolizantes esteroideos, los estrógenos, los progestágenos, los antiandrógenos, los análogos de la gonadorrelina, la digoxina, la espironolactona, el ketoconazol, las tetraciclinas, la carbamazepina y la ciclofosfamida. También la insuficiencia hepática, el etilismo, las enfermedades sistémicas y las situaciones de estrés metabólico agudo y crónico, hipercorticismos, obesidad y síndrome metabólico.
Se observa aumento de la testosterona por efecto de la gonadotropina coriónica (HCG), la LH, los antiestrógenos, los inhibidores de la aromatasa, los barbitúricos, la bromocriptina, la cimetidina, la difenilhidantoína, las hormonas tiroideas y la rifampicina.
Como en otros inmunoanálisis, los individuos expuestos a animales y sus productos pueden desarrollar anticuerpos heterofílicos que interfieran con los anticuerpos empleados en la prueba8.
Valores de referenciaDiversos factores dificultan el establecimiento de valores de referencia claros para la testosterona. Los síntomas de hipogonadismo son poco específicos, y puede aparecer como consecuencia de otras enfermedades sistémicas concomitantes. El umbral de testosterona a partir del cual aparecen los diversos síntomas no se conoce con precisión, pero parece variar en cada individuo y en cada órgano9, y también con la edad, el tipo de hipogonadismo y los tratamientos recibidos previamente10. El envejecimiento se asocia a una disminución progresiva de la testosterona −0,11nmol/l (3,17ng/dl) cada año– y a un aumento de la proporción de individuos posiblemente hipogonádicos11, por lo que los criterios de selección de pacientes pueden influir en los resultados.
La Sociedad Americana de Endocrinología propone como valores inferiores de normalidad 10,4nmol/l (300ng/dl) de testosterona total10. Este valor de carácter general coincide con el hallado en varones jóvenes y fértiles con un método de referencia, aunque para los mismos sueros los límites inferiores de referencia oscilaron entre 7,5 y 12,7nmol/l (216 y 366ng/dl) al usar siete técnicas analíticas distintas12. El límite superior de normalidad se sitúa entre 27 y 30nmol/l (779 y 866ng/ml). Los estudios poblacionales muestran que el percentil 2,5% se sitúa en 7,3nmol/l (210ng/ml) en varones de 50-59 años, y baja a 6,2nmol/l (179ng/ml) a los 70-79 años13. Un panel de expertos de diversas sociedades científicas europeas ha propuesto que una testosterona total confirmada en dos ocasiones < 8nmol/l (231ng/ ml) puede considerarse como diagnóstica de hipogonadismo en varones adultos siempre que además manifiesten síntomas de déficit androgénico14. Ante concentraciones "limítrofes" entre 8 y 12nmol/l (231-346ng/ml), aconsejan determinar la testostestora libre, que deberá ser < 180 pmol/l (52pg/ml) para confirmar el hipogonadismo. En la actualidad no se conoce exactamente a partir de qué valores el déficit de testosterona se asocia a mayor morbilidad o menor esperanza de vida.
Interpretación clínicaLos pacientes con fallo testicular primario muestran un patrón hormonal característico, con testosterona baja y concentraciones elevadas de gonadotropinas. Los hipogonadismos secundarios (por fallo ya sea adenohipofisario o hipotalámico) presentan concentraciones de gonadotropinas bajas o inapropiadamente normales. En varones añosos, puede verse testosterona baja con gonadotropinas normales por coexistencia de alteraciones hipotalamohipofisarias15. En los individuos con lesión circunscrita a los túbulos seminíferos suele observarse elevación aislada de la FSH con testosterona normal.
Debido a la variabilidad biológica, se recomienda confirmar con un segundo análisis cualquier hallazgo de testosterona moderadamente baja. Los principales expertos consideran que, ante valores limítrofes de testosterona, sólo está justificado iniciar tratamiento sustitutivo si hay síntomas compatibles con hipogonadismo y no se encuentran otras causas alternativas que los justifiquen14.
Los síndromes de resistencia androgénica parcial mínima (grados 1 y 2 con fenotipo masculino) pueden presentar valores elevados de testosterona, pero también cifras normales. En estos casos suele observarse SHBG elevada. Se ha propuesto el índice de sensibilidad androgénica16, definido como el producto de las concentraciones de testosterona y LH para identificar las situaciones de resistencia androgénica.
Pruebas funcionalesLa prueba de estimulación con HCG evalúa la presencia de células de Leydig funcionales en niños u hombres sin evidencia de testículos a la exploración. Tiene como objeto distinguir la criptorquidia bilateral de otras formas de hipogonadismo primario, especialmente la anorquia bilateral. Existen diversos protocolos, con administración única o múltiple (entre 3 y 5 días) de HCG intramuscular. Parece que una única dosis 5.000 UI/1,7m2 con determinación de testosterona basal y a las 72h aporta información diagnóstica suficiente17. La concentración de testosterona debe aumentar al menos 150ng/dl (5,2nmol/l) por encima de los valores basales18.
SHBGLa globulina transportadora de hormonas sexuales (SHBG) es una glucoproteína sintetizada en el hígado, que une dihidrotestosterona, testosterona y estradiol con alta afinidad según un coeficiente equimolar. Su peso molecular es 80-100kDa y está formada por dos subunidades similares.
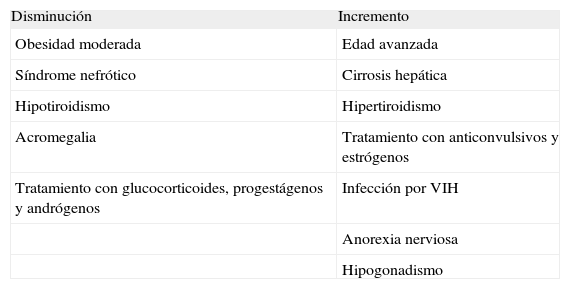
Aunque en la mayoría de los casos la determinación de testosterona total es suficiente, las situaciones en las que: a) los valores de testosterona son dudosos; b) se sospecha que hay factores que puedan modificar las concentraciones de SHBG (tabla 1), y c) si la situación clínica no concuerda con los resultados hormonales, conviene analizar la concentración real de SHBG con el fin de calcular la fracción libre de testosterona.
Factores que modifican la concentración de SHBG en varones
| Disminución | Incremento |
| Obesidad moderada | Edad avanzada |
| Síndrome nefrótico | Cirrosis hepática |
| Hipotiroidismo | Hipertiroidismo |
| Acromegalia | Tratamiento con anticonvulsivos y estrógenos |
| Tratamiento con glucocorticoides, progestágenos y andrógenos | Infección por VIH |
| Anorexia nerviosa | |
| Hipogonadismo |
SHBG: globulina trasportadora de hormonas sexuales; VIH: virus de la inmunodeficiencia humana.
Existen varios métodos enzimoinmunométricos y radioinmunométricos, que forman parte de plataformas automatizadas, para determinar las concentraciones de SHBG. No se requieren condiciones preanalíticas especiales para los sujetos. Los CV intraanalítica máximos publicados por los fabricantes oscilan entre el 4,4% (Immulite 2500) y el 9% (DGR Instruments) y los CV interanalíticos son del 7 y el 12% respectivamente.
Puede haber interferencias por anticuerpos heterófilos. No hay efecto de hemoglobina, bilirrubina o triglicéridos en las concentraciones encontradas habitualmente. La sensibilidad analítica es de 5nmol/l (0,12μg/ dl), y la linealidad con distintas diluciones se sitúa entre el 95 y el 100%. La recuperación a partir de concentraciones añadidas a los sueros es de un 90-95%. La especificidad es muy alta, y no se detecta reacción cruzada con otras proteínas de transporte, alfafetoproteína (AFP), albúmina, testosterona y otros esteroides, incluso a concentraciones extremas. Los valores de referencia en varones (intervalo de confianza [IC] del 95% central) son 13-71nmol/l (0,325-1,775μg/dl)19. La conversión de nmol/l a μg/dl se realiza multiplicando por 0,025. El factor de conversión de μg/dl a nmol/l es × 40.
Variabilidad biológicaLas concentraciones de SHBG varían de forma fisiológica a lo largo de la vida, en función del sexo y el estado de maduración puberal20. Tanto los andrógenos como los estrógenos regulan su síntesis, y diversas enfermedades afectan significativamente a las concentraciones de SHBG (tabla 1).
Cálculo de la testosterona libre y biodisponibleEl índice de testosterona libre se calcula fácilmente con la fórmula: testosterona total (nmol/l) / SHBG (nmol/l) × 100.
Se trata de una fracción sin magnitud, y resulta poco útil en los hipogonadismos21.
La testosterona libre y la biodisponible pueden ser calculadas también a partir de la ley de acción de masas en equilibrio4 o mediante regresión lineal múltiple tomando las concentraciones reales de SHBG y las distintas fracciones de testosterona21. Ésta es una alternativa defendida por diversos grupos de expertos para la evaluación del estado androgénico en varones adultos14.
INHIBINALa inhibina es una glucoproteína polipeptídica producida principalmente en la célula de Sertoli, cuya síntesis depende de la FSH y del estado de la espermatogénesis. La molécula madura con acción biológica en el hombre es la inhibina B, compuesta por dos cadenas (α y βB) que forman un heterodímero de 32-36kDa. Tiene una acción reguladora de la gametogénesis, inhibiendo específicamente la secreción de FSH. En la circulación se encuentran también cadenas α aisladas y dímeros de subunidades α y βA (inhibina A). Combinaciones de diversas cadenas β dan lugar a las activinas, de origen ubicuo y acciones preferentemente locales22. En el varón adulto, la FSH estimula la producción de inhibina B, y a su vez la inhibina B inhibe la secreción de FSH, con lo que ejerce una acción reguladora de la homeostasis de la FSH. Clínicamente ello se traduce en una correlación negativa entre las concentraciones de ambas hormonas23. Sin embargo, la producción de inhibina B depende también de la masa total de células germinales (probablemente espermatocitos paquiténicos) y del estado funcional de las células de Sertoli24.
En la actualidad, la determinación de inhibina B en el varón tiene aplicaciones de investigación clínica. Se ha propuesto que la inhibina podría ser un marcador de presencia testicular en niños con ambigüedad sexual y criptorquidia25. En el adulto, es posible que pueda aportar información complementaria en la evaluación funcional de la célula de Sertoli y del estado de la espermatogénesis.
Métodos de análisisExiste un único método de ELISA para inhibina B, basado en la aplicación combinada de dos anticuerpos en sandwich desarrollados por Serotec Ltd. Las muestras se incuban en pocillos cubiertos con un anticuerpo monoclonal contra la cadena βB. Después de lavar, se añade un anticuerpo contra la subunidad α marcado con biotina, y posteriormente estreptravidina marcada con peroxidasa (HRP). Después de una nueva incubación y lavado, se introduce el sustrato (tetrametilbencidina). La reacción se detiene mediante una solución ácida y se lee en un espectrofotómetro (absorbancia dual a 450 y 620nm).
Se requieren muestras de suero, que pueden mantenerse a 2-8°C durante 24h, y a −20°C durante 1 mes. Se desaconseja congelar y descongelar repetidamente las muestras. Tampoco deben usarse muestras hemolizadas o lipémicas. Diversos protocolos indican tratar el suero con calor (100°C) para destruir catalasas (muestras hemolizadas), proteasas y factores presentes en el suero que producen aumento de los valores de inhibina B (www.brookes.ac.uk/inhibin/tech.htm). De todos modos, el kit comercial disponible en la actualidad (DSL Inc.) no requiere este paso.
La variabilidad intraanalítica de las primeras versiones llegaba a un 15-18%23, aunque recientemente se han introducido mejoras y se ha reducido a un máximo de 7,6%. La sensibilidad analítica es de 7ng/l y la recuperación media, del 104%, con una linealidad media del 97% a diversas diluciones. El factor de conversión a pg/ml es 1.
Aplicación clínicaDesde que se dispone de métodos para medir la concentración de inhibina B dimérica, diversos estudios han señalado que esta molécula puede tener mayor eficacia que la FSH para determinar la reserva espermatogénica26 o, por lo menos, que la combinación de FSH e inhibina B aporta más información que la FSH sola en el diagnóstico de oligozoospermia27. La mayoría de los autores proponen un valor de corte de 40ng/l, por debajo del cual hay una alteración testicular grave. Los valores de referencia para varones adultos son de 97-330ng/l. La mayoría de los varones con espermatogénesis normal tienen concentraciones > 94ng/l25,27.
SEMINOGRAMAEl semen se produce en el momento de la eyaculación como resultado de la mezcla de las secreciones procedentes de los testículos y los epidídimos –que contienen espermatozoides en suspensión– junto con las secreciones de la próstata, las vesículas seminales y las glándulas bulbouretrales. El seminograma es el análisis sistemático de los distintos componentes que forman el eyaculado por medio de diversas técnicas. Constituye la prueba de laboratorio más importante para el estudio de la función reproductiva testicular. Por lo tanto, la principal indicación para realizar un seminograma es la evaluación del componente masculino en la subfertilidad o esterilidad conyugal.
La evaluación de la función reproductiva debe incluir una completa historia médica, una exploración física y al menos dos seminogramas realizados con un intervalo de 2-4 semanas. Si el primer seminograma es normal, se puede obviar el segundo análisis29. Cuando el resultado de ambos seminogramas es anormal, se plantearán otras exploraciones complementarias con el fin de: a) identificar alteraciones potencialmente corregibles; b) desvelar anormalidades genéticas transmisibles a la descendencia; c) diagnosticar afecciones relevantes para la salud del paciente, y d) orientar sobre las posibles técnicas de reproducción asistida con espermatozoides propios o asesorar acerca de alternativas en las alteraciones para las que no sea posible usar gametos propios28,29.
Componentes del seminograma básicoEl análisis básico del eyaculado comprende: a) la descripción de las características macroscópicas y fisicoquímicas del líquido seminal (volumen, pH, aspecto, licuefacción, viscosidad); b) la estimación porcentual de la movilidad de los gametos; c) la concentración de espermatozoides; d) la evaluación de la vitalidad; e) la determinación de aglutinación/agregación y de anticuerpos antiespermáticos fijados a los gametos, y f) el estudio citomorfológico de las células contenidas en el líquido seminal en una extensión fijada y teñida.
Causas de variabilidad y medidas de control de la calidadLa variabilidad observada en los principales parámetros del seminograma se debe a la combinación del error analítico (imprecisión, inexactitud) y a la variabilidad biológica. Su mención aquí es pertinente porque el estudio del semen presenta características especiales en comparación con otros análisis de laboratorio. Algunas de sus propiedades son perecederas, y deben evaluarse en un plazo estricto. No existen patrones o estándares internacionales de referencia para ninguno de sus parámetros. Los métodos usados son básicamente manuales y en muchos laboratorios están poco estandarizados. Finalmente, existe una amplia variabilidad biológica intraindividual e interindividual en la mayoría de las variables seminales.
La imprecisión analítica debida al error aleatorio puede reducirse aumentando el tamaño de la muestra (número de espermatozoides evaluados) y analizando replicados de la misma muestra. La imprecisión se mide como coeficiente de variación (CV) y –cuando se aplican métodos rigurosos– se sitúa alrededor del 10% para la concentración y del 15% para la movilidad y la morfología30. Sin embargo, puede ser mucho más elevada si no se atiende a los requisitos y los controles de calidad31. El control y la reducción de la imprecisión analítica dependen de la aplicación de métodos robustos y de un control de calidad interno continuado en cada laboratorio.
El error sistemático (causante de la inexactitud o sesgo) puede deberse a calibración inapropiada de los sistemas de medida y a diferencias de criterio entre observadores. Este tipo de error es la principal causa de variabilidad en los controles de calidad externa, que muestran un error total medio > 60% para morfología y > 30% para concentración y movilidad32. A falta de métodos y patrones de referencia, la reducción del error sistemático en el laboratorio de andrología debe conseguirse a partir de programas de control externo de calidad y de educación continuada para unificar criterios y métodos33.
Por su parte, la variabilidad biológica se define como la amplitud de las oscilaciones de un analito alrededor del punto de ajuste homeostático verdadero. Los estudios disponibles indican que la cociente de variación (CV) intraindividual es de un 27-48% para la concentración espermática, un 9-26% para la movilidad progresiva y un 20-30% para la morfología30,34. Para obtener una estimación fiable del valor homeostático de un individuo es necesario analizar dos o, preferiblemente, tres muestras de semen. De todos modos, para conseguir resultados más precisos (p. ej., con un intervalo de confianza [IC] del 95% de ±15% del valor diana), puede ser necesario analizar entre 6 y 14 muestras de un mismo individuo, según el parámetro de que se trate35.
Procedimientos estandarizadosPara superar en parte estas limitaciones, diversas sociedades científicas han propuesto métodos detallados con el fin de conseguir una efectiva estandarización que reduzca la variabilidad, facilite el control de calidad de los resultados y haga posible el intercambio fiable de la información científica36,37.
Condiciones preanalíticasLos pacientes deben recibir información escrita con instrucciones que faciliten una producción de la muestra en condiciones de homogeneidad, y con un registro de las incidencias que puedan afectar a la validez de los resultados, y que deberán rellenar antes de la entrega.
Instrucciones: a) abstinencia sexual completa entre 2 y 7 días (preferentemente 3 a 4) antes del análisis; b) producción por masturbación (los preservativos convencionales no son aceptables); c) recoger todo el volumen de la eyaculación en un recipiente de polipropileno de boca ancha y cerrar bien para evitar pérdidas; d) mantener la muestra a temperatura templada (en un bolsillo interior cerca del cuerpo) durante el transporte al laboratorio; e) entregar la muestra antes de transcurrida 1h desde la obtención, y f) debe ofrecerse la posibilidad de obtener la muestra en instalaciones apropiadas en el propio laboratorio.
Cuestionario: a) hora de la eyaculación; b) lugar de obtención (domicilio, laboratorio); c) muestra completa o incompleta; d) día y hora de la última eyaculación antes del análisis; e) enfermedades o episodios febriles (> 38°C) durantes los últimos 3 meses, y f) detalles de medicamentos recibidos en los últimos 3 meses.
Metodología analíticaLos detalles metodológicos más importantes pueden consultarse en la tabla 2. Después de registrar y etiquetar la muestra, el recipiente se coloca en un agitador lento (37°C) durante 20-25min para conseguir la homogeneización y licuefacción de la muestra.
Aspectos fundamentales de la metodología OMS/ESHRE para el análisis básico del semen31,32
| Parámetro | Procedimientos |
| Preparación | Realizar durante los primeros minutos |
| Condiciones preanalíticas | Registrar la abstinencia (preferentemente en horas) y otras incidencias |
| Medición volumen | Medir peso neto y convertir a ml |
| Homogeneización | Agitación mecánica a 37°C durante 20-25min |
| Examen macroscópico | Empezar el análisis a los 25-30minLicuefacción (completa, incompleta)Apariencia (opalescente, traslúcido)Color (normal, hemático, otros)Viscosidad (normal, aumentada)pH (papel indicador) |
| Examen de la movilidad en fresco | Empezar análisis a los 30-60minObjetivo contraste fases, × 400, 37°CAlícuota en portaobjetos-cubreobjetos con grosor de 20 μmaClasificar 400 espermatozoides (200 × 2 preparaciones distintas)b |
| Concentración | Dilución en cámara de Neubauer mejorada usando pipetas de desplazamiento positivoaRecuento por duplicado (200 × 2 espermatozoides)b |
| Leucocitos | Tinción en fresco con método de peroxidasa o anti-CD45Recuento en cámara de Neubauer |
| Vitalidad | Realizar si > 60% inmóvilesTinción con el método de eosina-nigrosinaMagnificación ×1.000 inmersión en aceiteContar 200 espermatozoides |
| Morfología | Tinción de Papanicolaou modificada Magnificación ×1.000 inmersión en aceiteContar 200 espermatozoides |
| Anticuerpos antiespermáticos | Objetivo contraste de fases, ×400Método inmunocitoadherencia en frescoContar 200 espermatozoides por duplicadob |
ESHRE: European Society of Human Reproduction and Embriology; OMS: Organización Mundial de la Salud.
A continuación se evalúa cualitativamente la licuefacción, la apariencia, el color y la viscosidad del semen. Si la licuefacción es incompleta (presencia de grumos o filamentos), puede mantenerse en el incubador algún tiempo más. Las muestras viscosas (filancia > 2cm) pueden tratarse para facilitar su análisis. Si el olor difiere claramente del habitual, se anotará en el informe.
El examen en fresco se realiza preferentemente a 37°C (10μl sobre un portaobjetos con un cubreobjetos de 22 × 22mm proporcionan una preparación de 20μm de profundidad) a una magnificación ×400 con óptica de contraste de fases. Si hay muy pocos o ningún espermatozoide en la preparación en fresco, hay que centrifugar la muestra y examinar el sedimento nuevamente (al menos 400 campos). La sensibilidad analítica (concentración mínima detectable con IC del 95%) conseguida así es de < 200 espermatozoides/ml. La agregación o aglutinación espermática y las células y detritos que pueda haber en el semen se evalúan en varios campos. No debe haber eritrocitos en el semen. Las células epiteliales (escamosas, cúbicas y transicionales) son habituales en pequeño número en el semen.
Si hay más de 1 millón de células redondas/ml, debe realizarse la detección de leucocitos mediante un método específico.
La movilidad porcentual se evalúa, según una clasificación en cuatro categorías: a, movilidad progresiva rápida (≥ 25μm/s); b, movilidad progresiva lenta (5-24μm/s); c, movilidad no progresiva (< 5μm/s), y d, inmóviles. La movilidad progresiva total es la suma de los porcentajes de a + b.
La concentración espermática se analiza mediante dilución y recuento en cámara de Neubauer mejorada. Deben realizarse recuentos duplicados de un número suficiente de espermatozoides para obtener resultados fiables.
La proporción de espermatozoides vivos (móviles) con anticuerpos (IgG y la IgA) unidos puede ser evaluada mediante pruebas de inmunocitoadherencia directamente en semen (MAR test, SpermMAR®, Ferti-Pro) o en espermatozoides lavados (Immunobead®, Irving Scientific).
Si la proporción de espermatozoides inmóviles es > 60%, debe determinarse la vitalidad por el método de eosina-nigrosina.
Para el análisis de la morfología se usará la tinción de Papanicolau en extensiones fijadas. Únicamente se consideran normales los espermatozoides que no tiene ningún defecto morfológico: a) cabeza perfectamente oval y contorno regular (4-5μm de largo y 2,5-3,5μm de ancho) y una relación largo:ancho entre 1,5 y 1,75; b) la región acrosómica debe ocupar un 40-70% de la zona anterior de la cabeza; c) cola única, de 45μm de longitud no enrollada, rota ni doblada, con inserción centrada en la cabeza siguiendo el eje; d) pieza intermedia de 1μm de ancho y 7-8μm de largo; e) gotas citoplásmicas de no mayores que un tercio del tamaño de la cabeza, y f) ausencia de vacuolas en la cabeza.
Los defectos espermáticos se clasifican según la ubicación topográfica (cabeza, cuello y pieza intermedia, cola, gotas citoplásmicas). Puesto que un mismo espermatozoide puede tener más de un defecto, se incluye el índice de teratozoospermia, definido como el número medio de anomalías por espermatozoide anormal.
Interpretación clínica y valores de referenciaAunque los resultados del análisis de semen pueden darnos información acerca de problemas en los órganos genitales del varón, no permiten determinar con certeza si un individuo es fértil o no. Otros factores contribuyen al pronóstico reproductivo: a) la duración de la esterilidad; b) la historia de fertilidad previa de ambos cónyuges, y c) la edad de la mujer y el estado de su función reproductiva.
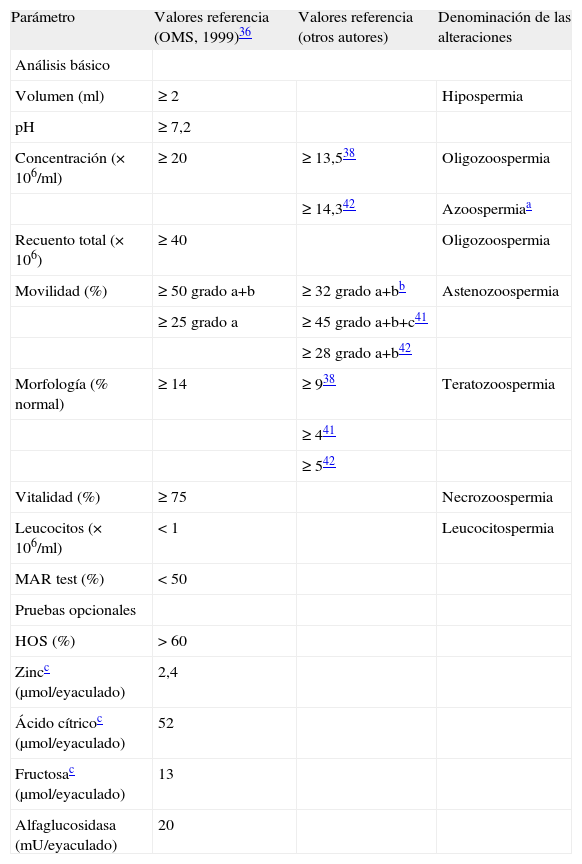
Los valores de referencia fijados por la Organización Mundial de la Salud (OMS)36 se detallan en la tabla 3. Sin embargo, muchos varones fértiles tienen parámetros seminales por debajo de estos valores de corte, de modo que existe una amplia zona de solapamiento que dificulta la correcta clasificación (sensibilidad y especificidad inaceptables) en más de la mitad de los pacientes presuntamente infértiles. Por este motivo se ha propuesto aplicar dos puntos de corte38, calcular la densidad de espermatozoides móviles con morfología normal39 o desarrollar modelos de análisis multivariable40. Al disponer de técnicas de reproducción asistida muy efectivas, como la inyección intracitoplásmica de espermatozoides, en la actualidad se considera preferible identificar los valores mínimos que ofrezcan una probabilidad razonable de concepción41,42.
Componentes y valores de referencia del análisis de semen
| Parámetro | Valores referencia (OMS, 1999)36 | Valores referencia (otros autores) | Denominación de las alteraciones |
| Análisis básico | |||
| Volumen (ml) | ≥ 2 | Hipospermia | |
| pH | ≥ 7,2 | ||
| Concentración (×106/ml) | ≥ 20 | ≥ 13,538 | Oligozoospermia |
| ≥ 14,342 | Azoospermiaa | ||
| Recuento total (×106) | ≥ 40 | Oligozoospermia | |
| Movilidad (%) | ≥ 50 grado a+b | ≥ 32 grado a+bb | Astenozoospermia |
| ≥ 25 grado a | ≥ 45 grado a+b+c41 | ||
| ≥ 28 grado a+b42 | |||
| Morfología (% normal) | ≥ 14 | ≥ 938 | Teratozoospermia |
| ≥ 441 | |||
| ≥ 542 | |||
| Vitalidad (%) | ≥ 75 | Necrozoospermia | |
| Leucocitos (×106/ml) | < 1 | Leucocitospermia | |
| MAR test (%) | < 50 | ||
| Pruebas opcionales | |||
| HOS (%) | > 60 | ||
| Zincc (μmol/eyaculado) | 2,4 | ||
| Ácido cítricoc (μmol/eyaculado) | 52 | ||
| Fructosac (μmol/eyaculado) | 13 | ||
| Alfaglucosidasa (mU/eyaculado) | 20 | ||
HOS: prueba de choque hipoosmótico; MAR test: prueba de aglutinación mixta con antiglobulina.
En las alteraciones gonadales primarias y en los hipogonadismos secundarios no se encuentran espermatozoides en semen (azoospermia) o la concentración está disminuida (oligozoospermia). Más a menudo, las alteraciones cuantitativas de la espermatogénesis se presentan de forma idiopática, junto con otros defectos cualitativos (movilidad y morfología). Las muestras en que se acumula mayor número de parámetros alterados tienen mayor riesgo de infertilidad y peor pronóstico reproductivo38.
La morfología espermática es uno de los parámetros que aportan más información sobre la calidad espermática, según algunos autores. Utilizando criterios estrictos de clasificación, los varones con menos del 4% de gametos normales tienen menor probabilidad de producir gestación natural41 o cuando sus parejas son tratadas con inseminación conyugal43 o fecundación in vitro44. Sin embargo, la disparidad de criterios entre diversos laboratorios (favorecida por la deriva de la propia OMS) dificulta la interpretación de los resultados a los clínicos.
La leucocitospermia se considera un indicador de infección de la vía seminal, que debe confirmarse con estudios microbiológicos y con la clínica subyacente. Sin embargo, la leucocitospermia aislada tiene poco valor diagnóstico, puesto que su origen puede deberse a causas no infecciosas45.
Pruebas opcionalesIntegridad de membranasEl estudio de la estabilidad de la membrana de la cola complementa el examen de la vitalidad. Habitualmente se realiza sometiendo a los espermatozoides a un choque hipoosmótico moderado (prueba HOS). Las colas cuya membrana plasmática mantiene una buena capacidad osmorreguladora se hincharán como consecuencia de la entrada de líquido y adoptarán patrones fácilmente reconocibles. En los casos de astenozoospermia sirve para distinguir las causas metabólicas de las situaciones en las que hay daño estructural46.
Cultivo de semenLa infección del tracto genital y de las glándulas genitales anexas puede alterar la función reproductiva por diversos mecanismos47,48: producción de radicales libres de oxígeno que afectan a la membrana espermática y la integridad del ADN; deterioro de la movilidad y la morfología espermáticas; disminución de la capacidad fecundante; cambios en la composición bioquímica del plasma seminal, y producción de anticuerpos antiespermáticos. Los efectos de la infección del tracto reproductivo pueden prolongarse incluso después de que se haya eliminado los agentes patógenos. Los microorganismos encontrados más frecuentemente en los cultivos de semen (Escherichia coli, enterococos y Proteus) proceden de la vía urinaria. Además, Ureaplasma urealyticum y Mycoplasma hominis podrían causar infecciones con poca expresión clínica. Chlamydia trachomatis puede producir uretritis o epididimitis y –por transmisión sexual a la mujer– salpingitis y obstrucción tubárica.
El estudio bacteriológico del semen se realiza cultivando una muestra de orina y otra de semen producida a continuación, recogidas ambas en condiciones de asepsia. Se considera que la bacteriospermia es significativa cuando se observan más de 1.000 ufc/ml y menor cantidad en la orina. La leucocitospermia concomitante refuerza el valor clínico de los hallazgos microbiológicos29.
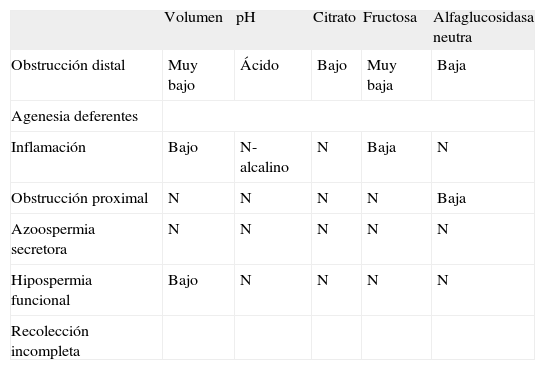
Marcadores bioquímicos en plasma seminalSe ha estudiado la utilidad de muchas sustancias presentes en el semen para reflejar la función de las glándulas accesorias o la capacidad fecundante del semen. En la actualidad parece aconsejable realizar un estudio simple limitado a tres marcadores que estudien el estado de la próstata, las vesículas seminales y el epidídimo. De este modo es posible orientar el origen de ciertas anomalías masculinas (tabla 4). La determinación de ácido cítrico o de cinc refleja adecuadamente la capacidad secretora de la próstata. Una licuefacción incompleta también puede indicar deficiente actividad proteinolítica de la próstata. La fructosa procede casi enteramente de las vesículas seminales, y suele estar disminuida en procesos inflamatorios o degenerativos. En casos de obstrucción distal de la vía seminal o hipoplasia congénita de las vesículas (que a menudo acompaña a la agenesia de los conductos deferentes), la fructosa es muy baja49. Un volumen y un pH bajos y la ausencia de coagulación respaldarán este diagnóstico. La alfaglucosidasa neutra parece ser un buen marcador epididimario. Está disminuida en las obstrucciones epididimarias y cuando la concentración de testosterona es baja50.
Principales patrones bioquímicos del plasma seminal en alteraciones de la función reproductiva
| Volumen | pH | Citrato | Fructosa | Alfaglucosidasa neutra | |
| Obstrucción distal | Muy bajo | Ácido | Bajo | Muy baja | Baja |
| Agenesia deferentes | |||||
| Inflamación | Bajo | N-alcalino | N | Baja | N |
| Obstrucción proximal | N | N | N | N | Baja |
| Azoospermia secretora | N | N | N | N | N |
| Hipospermia funcional | Bajo | N | N | N | N |
| Recolección incompleta | |||||
El análisis digital de las imágenes microscópicas de los espermatozoides en movimiento puede ser realizado por aplicaciones informáticas. Debe estudiarse el semen fresco en una cámara que permita el recuento directo (10-20μm de grosor). La adquisición se consigue por medio de una cámara de vídeo acoplada a la óptica de un microscopio dotado de contraste de fases. El estudio detallado de la cinética del espermatozoide por medio de los sistemas automatizados ofrece la posibilidad de medir parámetros que no pueden ser captados por el ojo humano, y añaden nueva información de la función espermática. Ciertas características, tales como la identificación de la fracción de espermatozoides hiperactivados, la medición de la frecuencia de batido o la amplitud del desplazamiento lateral de la cabeza, así como la evolución intraindividual de la velocidad, pueden ser evaluadas con precisión. Se han descrito diversos criterios que correlacionan mediciones obtenidas mediante sistemas de análisis automático con resultados reproductivos y con la capacidad fecundante del semen51. A pesar de su precisión y reproducibilidad, los sistemas automatizados no han sustituido el análisis manual, y actualmente se los considera un complemento del seminograma. Sus principales limitaciones se deben a que los espermatozoides inmóviles pueden ser confundidos con detritos presentes en el semen, los cruces de trayectos pueden ocasionar interpretaciones erróneas, no se han estandarizado las condiciones de utilización ni la equivalencia entre distintos equipos disponibles y no existen esquemas de control de calidad externo para esta metodología.
Pruebas de investigaciónLas limitaciones del seminograma convencional para distinguir a los varones con fertilidad normal de los subfértiles ha estimulado la investigación de pruebas para evaluar el poder fecundante del semen. Entre ellas destacan la capacidad de unión de los espermatozoides a la zona pelúcida52, la reacción acrosómica inducida por diversos productos53, la presencia de especies reactivas de oxígeno en el semen54, la integridad del ADN espermático55 y el análisis morfométrico objetivo de los gametos56. En la actualidad, ninguna de estas pruebas forma parte del estudio convencional de la fertilidad masculina.
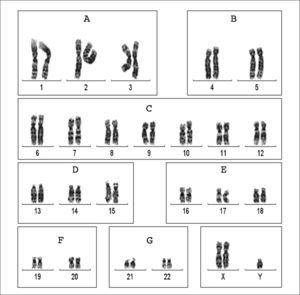
CARIOTIPOEl cariotipo se obtiene por el análisis numérico y estructural del conjunto de cromosomas, según una nomenclatura estandarizada. La representación gráfica de los cromosomas ordenados sistemáticamente se denomina cariograma (fig. 1). El estudio del cariotipo resulta obligado para investigar las causas del hipogonadismo primario y de la azoospermia no obstructiva, a fin de descartar el síndrome de Klinefelter y otras cromosomopatías. También es recomendable en varones con esterilidad idiopática cuando hay oligozoospermia grave (< 5 millones de espermatozoides/ml), y antes de realizar FIV/ICSI29.
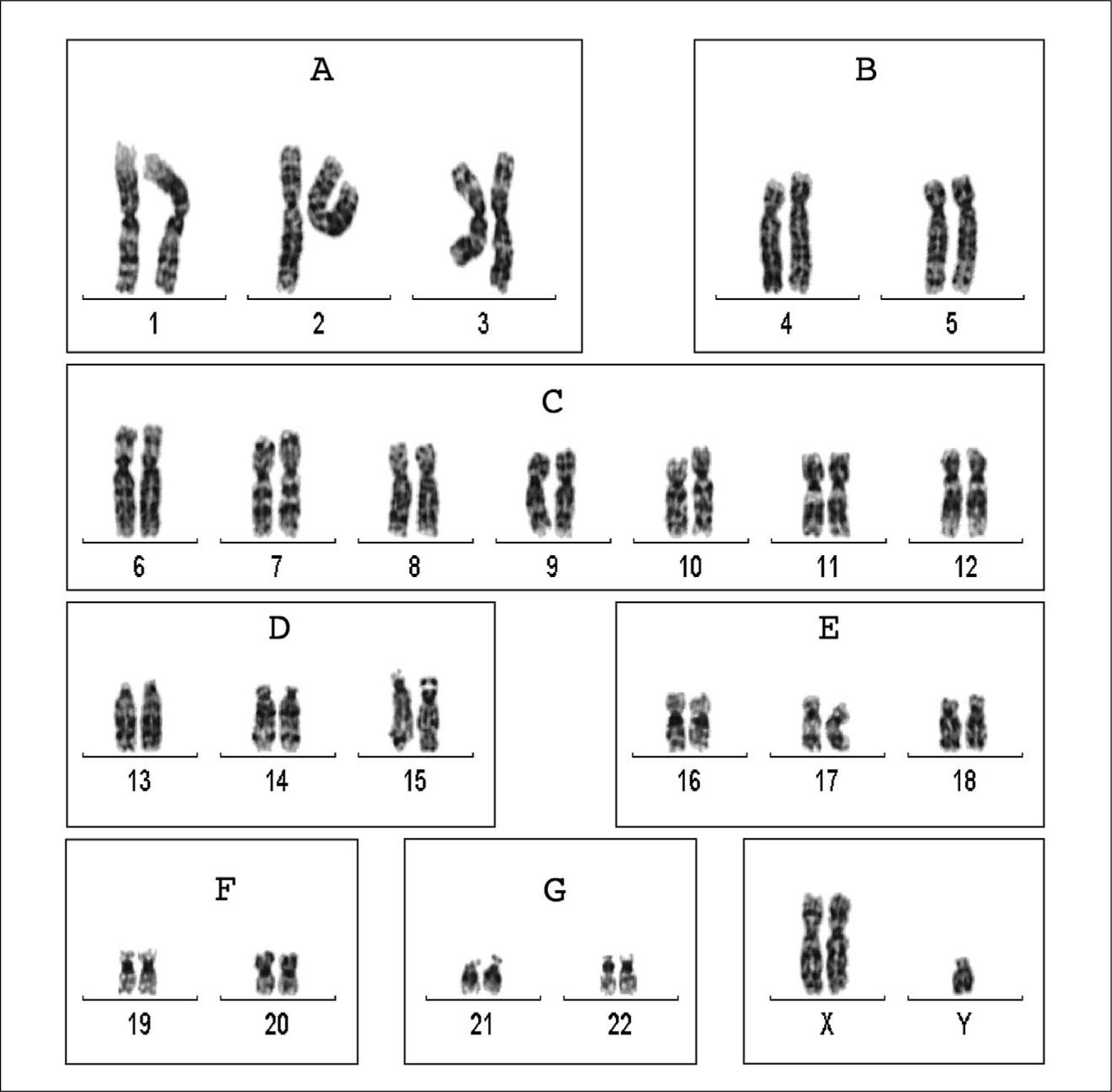
Cariograma con tinción de bandas G correspondiente a un varón con síndrome de Klinefelter. Los cromosomas se ordenan y clasifican en grupos según el tamaño y la posición del centrómero. A: grandes, metacéntricos. B: grandes, submetacéntricos. C: tamaño medio, metacéntricos o submetacéntricos; el cromosoma X se incluye también en este grupo. D: tamaño medio, acrocéntricos con satélites. E: relativamente pequeños, metacéntricos o submetacéntricos. F: pequeños, metacéntricos. G: pequeños, acrocéntricos con satélites; incluye el cromosoma Y.
El cariotipo se realiza habitualmente en linfocitos obtenidos de sangre periférica57. No se requieren condiciones preanalíticas especiales. Los linfocitos se tratan con fitohemaglutinina durante 48-72h para inducir su división, y con colchicina para detener la mitosis celular en metafase, cuando los cromosomas están condensados y son fácilmente identificables. A continuación se tratan con solución hipotónica, que causa rotura de los núcleos y separación de los pares de cromosomas individuales. La preparación se tiñe con productos que distinguen zonas más oscuras y otras más claras (bandas) características de cada cromosoma. La tinción más habitual se realiza con tripsina-Giemsa (bandeado G), y permite observar entre 300 y 450 bandas en todos los cromosomas. Existen otros métodos de tinción menos utilizados, y que producen patrones de bandas distintas, como las bandas Q (quinacrina), bandas R (Reverse, que da un patrón inverso al de las bandas G) o bandas C (que muestra las regiones de heterocromatina). Los cariotipos de alta resolución analizan cromosomas en profase o prometafase, cuando el grado de condensación es menor. De este modo se puede identificar hasta 800 bandas.
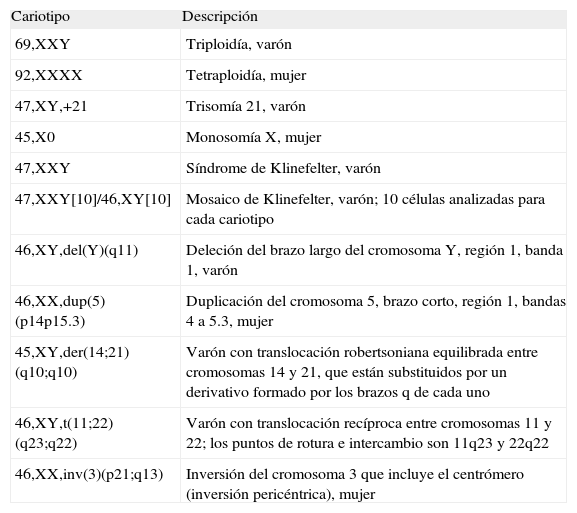
Lectura y nomenclatura del cariotipoLas imágenes microscópicas de los cromosomas se ordenan por tamaño y por la posición del centrómero. Para la definición de las anomalías primero hay que identificar si hay cromosomas ausentes o adicionales, y a continuación localizar posibles puntos de rotura de las reorganizaciones estructurales. Actualmente se pueden usar programas informáticos de captura y tratamiento de imágenes que facilitan la clasificación y visualización de los cromosomas. Existen guías y recomendaciones para la realización del cariotipo y para el uso de una nomenclatura estandarizada58 (tabla 5) que permite no sólo la descripción de las alteraciones, sino también explicar la forma en que se han originado.
Nomenclatura de las alteraciones del cariotipo
| Cariotipo | Descripción |
| 69,XXY | Triploidía, varón |
| 92,XXXX | Tetraploidía, mujer |
| 47,XY,+21 | Trisomía 21, varón |
| 45,X0 | Monosomía X, mujer |
| 47,XXY | Síndrome de Klinefelter, varón |
| 47,XXY[10]/46,XY[10] | Mosaico de Klinefelter, varón; 10 células analizadas para cada cariotipo |
| 46,XY,del(Y)(q11) | Deleción del brazo largo del cromosoma Y, región 1, banda 1, varón |
| 46,XX,dup(5)(p14p15.3) | Duplicación del cromosoma 5, brazo corto, región 1, bandas 4 a 5.3, mujer |
| 45,XY,der(14;21)(q10;q10) | Varón con translocación robertsoniana equilibrada entre cromosomas 14 y 21, que están substituidos por un derivativo formado por los brazos q de cada uno |
| 46,XY,t(11;22)(q23;q22) | Varón con translocación recíproca entre cromosomas 11 y 22; los puntos de rotura e intercambio son 11q23 y 22q22 |
| 46,XX,inv(3)(p21;q13) | Inversión del cromosoma 3 que incluye el centrómero (inversión pericéntrica), mujer |
Para el diagnóstico de alteraciones gonadales se recomienda analizar al menos 10 metafases. Si se encuentra alguna aneuploidía sexual, es conveniente contar 50 metafases, puesto que se observan mosaicismos de baja frecuencia en varones con esterilidad59.
Los cromosomas metafásicos poseen dos cromátides unidas a nivel del centrómero, el cual divide cada cromátide en dos brazos. Según la posición del centrómero, los cromosomas se denominan metacéntricos (en el centro), acrocéntricos (cerca de un extremo) y submetacéntricos (lo que da brazos asimétricos). El brazo corto se denomina p (petite) y el brazo largo, q. Se distinguen diversas regiones, definidas por los extremos de los brazos, los centrómeros y ciertas bandas distintivas. Las regiones y las bandas se numeran en cada brazo a partir del centrómero. Para definir un punto de un cromosoma se sigue el siguiente orden: número de cromosoma, brazo, región, banda, subbanda.
La constitución cromosómica normal (diploide) es de 22 pares de autosomas, y un par de cromosomas sexuales o gonosomas (46,XY en el varón y 46,XX en la mujer). Las alteraciones numéricas de los cromosomas se denominan poliploidías si hay 69 (triploidía) o 92 (tetraploidía) cromosomas. Las aneuploidías afectan al número de copias de un cromosoma (monosomía, trisomía). Las alteraciones estructurales implican pérdida (deleciones), ganancia (duplicaciones) o reorganización (inversiones, translocaciones) de segmentos cromosómicos.
Técnicas complementariasLa técnica de FISH puede usarse para la detección de deleciones submicroscópicas de 1Mb o mayor tamaño (en genes de copia única) y también de duplicaciones o translocaciones en cromosomas metafásicos. Para ello se usan sondas marcadas con fluorocromos para la región o regiones seleccionadas de los cromosomas afectados. Por ejemplo, en los varones que presentan inversión sexual (46,XX) se puede analizar la ubicación del gen SRY y determinar si se encuentra en el brazo corto de uno de los cromosomas X o en un autosoma.
La FISH se puede realizar también en núcleos interfásicos, con lo que se puede identificar la presencia de señales de hibridación en una muestra relativamente grande de células. Esto es útil para estudiar con más detalle los mosaicismos en diversos tejidos, como linfocitos, mucosa bucal, testículo, etc.
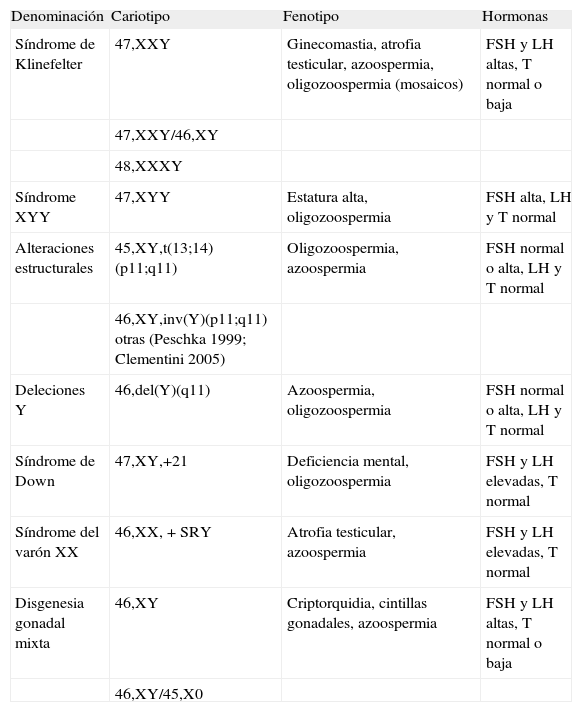
Alteraciones cromosómicas y testiculopatíasLas principales cromosomopatías numéricas y estructurales causantes de afección testicular se resumen en la tabla 6. El síndrome de Klinefelter es el cuadro clínico más frecuente de hipogonadismo congénito. Su incidencia es 1:750 aproximadamente. Lo causa una disomía del cromosoma X, que da lugar a un cariotipo 47,XXY. El síndrome de Klinefelter clásico se manifiesta por hipotrofia testicular bilateral, ginecomastia, signos de hipoandrogenismo moderado con concentraciones algo bajas de testosterona, esterilidad por azoospermia y concentraciones elevadas de gonadotropinas. El cuadro clínico es menos evidente en los mosaicismos (46,XY/47,XXY) y suele verse oligozoospermia. El síndrome de Klinefelter causa aproximadamente el 15% de los casos de azoospermia secretora. Algunos pacientes muestran espermatogénesis residual. El estudio cromosómico de estos espermatozoides (FISH) indica que un 5-10% pueden ser anormales, con aneuploidías gonosómicas y autosómicas60. La causa más frecuente de síndrome de Klinefelter es la falta de disyunción de las cromátides en la primera o la segunda división meiótica durante la gametogénesis61. Menos frecuentemente se pueden observar polisomías del tipo 48XXXY, que presentan cuadros clínicos análogos, aunque con mayor gravedad.
Alteraciones cromosómicas causantes de disfunción testicular
| Denominación | Cariotipo | Fenotipo | Hormonas |
| Síndrome de Klinefelter | 47,XXY | Ginecomastia, atrofia testicular, azoospermia, oligozoospermia (mosaicos) | FSH y LH altas, T normal o baja |
| 47,XXY/46,XY | |||
| 48,XXXY | |||
| Síndrome XYY | 47,XYY | Estatura alta, oligozoospermia | FSH alta, LH y T normal |
| Alteraciones estructurales | 45,XY,t(13;14)(p11;q11) | Oligozoospermia, azoospermia | FSH normal o alta, LH y T normal |
| 46,XY,inv(Y)(p11;q11) otras (Peschka 1999; Clementini 2005) | |||
| Deleciones Y | 46,del(Y)(q11) | Azoospermia, oligozoospermia | FSH normal o alta, LH y T normal |
| Síndrome de Down | 47,XY,+21 | Deficiencia mental, oligozoospermia | FSH y LH elevadas, T normal |
| Síndrome del varón XX | 46,XX, +SRY | Atrofia testicular, azoospermia | FSH y LH elevadas, T normal |
| Disgenesia gonadal mixta | 46,XY | Criptorquidia, cintillas gonadales, azoospermia | FSH y LH altas, T normal o baja |
| 46,XY/45,X0 |
FSH: folitropina; LH: lutropina; T: testosterona.
Los varones con oligozoospermia (< 10 millones/ml) tienen una frecuencia elevada de alteraciones estructurales autosómicas, como translocaciones e inversiones62. El porcentaje de anomalías es inversamente proporcional a la concentración espermática63. La trisomía del cromosoma 21 (síndrome de Down) se acompaña a menudo de esterilidad en el varón.
El cromosoma Y contiene genes específicos del sexo masculino que se expresan únicamente en el testículo o los tejidos precursores. Ése es el caso, por ejemplo, del gen SRY, que determina la diferenciación sexual, y del grupo de genes situados en la región AZF. El término AZF (azoospermia factor) fue propuesto al encontrar deleciones Yq en el estudio citogenético de algunos pacientes estériles con azoospermia idiopática64. Estas grandes deleciones incluían la región eucromática Yq11, por lo que se propuso que en esta banda se ubicaba un gen o un grupo de genes necesarios para el desarrollo normal del epitelio germinal. Con el desarrollo de métodos de genética molecular, se determinó que en muchos casos había deleciones submicroscópicas. En la actualidad, estas microdeleciones han identificado tres locus significativos, denominados AZFa, AZFb y AZFc65. Diversos genes situados en estos locus se expresan en los testículos, y su papel en el fallo espermatogénico es objeto de investigación66.
Otra alteración numérica relativamente frecuente de los cromosomas sexuales es el síndrome 47XYY. Aunque en muchos casos el desarrollo y la función testicular son normales, es posible observar hipotrofia testicular que afecta a la producción de testosterona y a la espermatogénesis. Estos varones tienen una talla media elevada y en ciertas revisiones clásicas se ha descrito que el cromosoma Y supernumerario induce un carácter agresivo.
Los pacientes con una constitución cromosómica 46,XX pueden manifestarse con fenotipo femenino, como intersexos o como varones azoospérmicos. En este caso hablamos de inversión sexual. En el 80% de los casos el mecanismo de aparición de esta anomalía es una translocación de la región terminal del cromosoma Y (Yp) que contiene el gen SRY (y que determina de diferenciación de la gónada masculina) al cromosoma X durante la meiosis.
La disgenesia gonadal mixta con cariotipo 45X0/46XY puede manifestarse con fenotipo masculino, aunque es más frecuente el fenotipo femenino. Hay criptorquidia habitualmente, micropene e hipospadias, y a menudo hay persistencia de rudimentos correspondientes a útero. Cuando el cariotipo es normal (el 95% de los casos), se ha utilizado la denominación de síndrome de Noonan, mientras que con cariotipo 45,X0 se lo llama síndrome de Turner masculino.