El síndrome de Cushing (SC) independiente de corticotropina (ACTH) secundario a hiperplasia suprarrenal macronodular fue descrito en 1964 por primera vez por Kirshner et al, y es una causa rara de SC endógeno. El SC endógeno se caracteriza por síntomas y signos clínicos derivados de la exposición crónica al exceso de glucocorticoides. Es una entidad poco frecuente con una incidencia de 4–6 casos por millón de habitantes/año1. En el 80–85% de los casos, es dependiente de ACTH, generalmente debido a un adenoma hipofisario secretor de ACTH. En el 15–20% restante, es independiente de ACTH, secundario a un tumor suprarrenal unilateral en la mayoría de los casos. La hiperplasia suprarrenal macronodular representa menos del 1% de las causas de SC endógeno2. Los síntomas y los signos clínicos derivados del hipercortisolismo suelen aparecer tras décadas de evolución. Típicamente, se produce un exceso de cortisol de forma aislada, aunque en ocasiones se pueden secretar mineralocorticoides y esteroides sexuales de forma asociada.
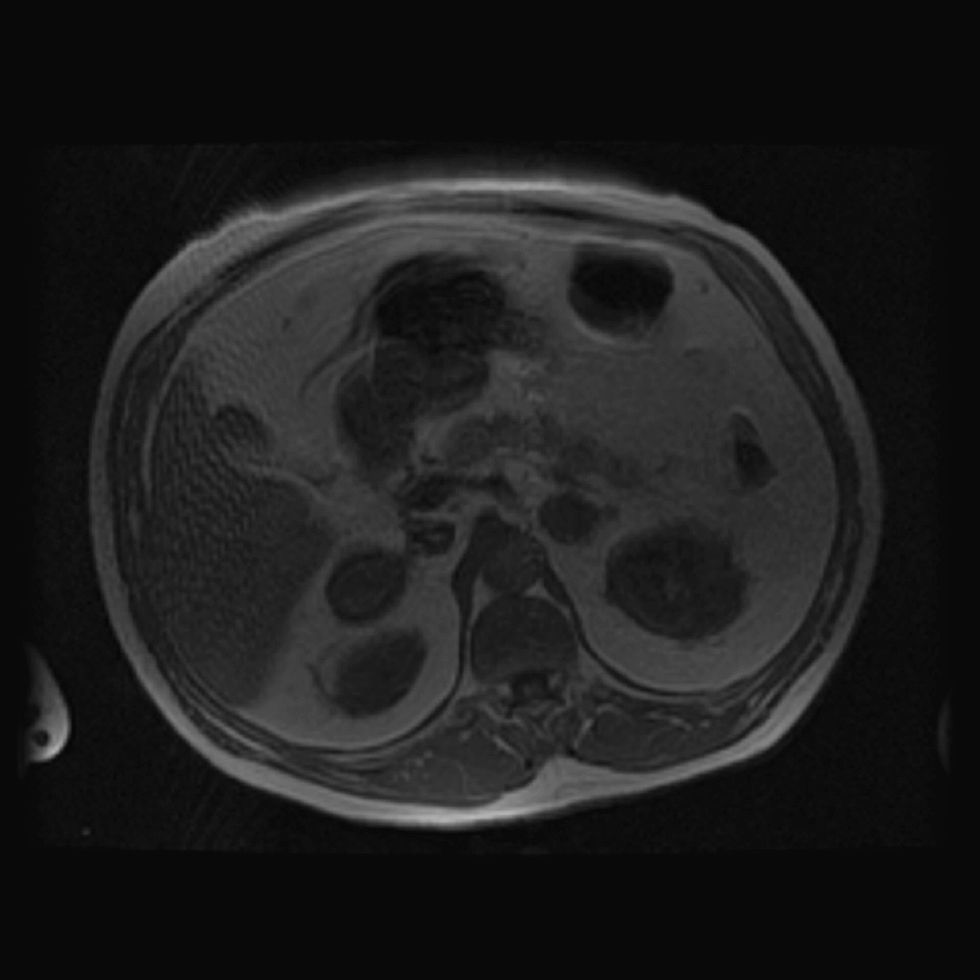
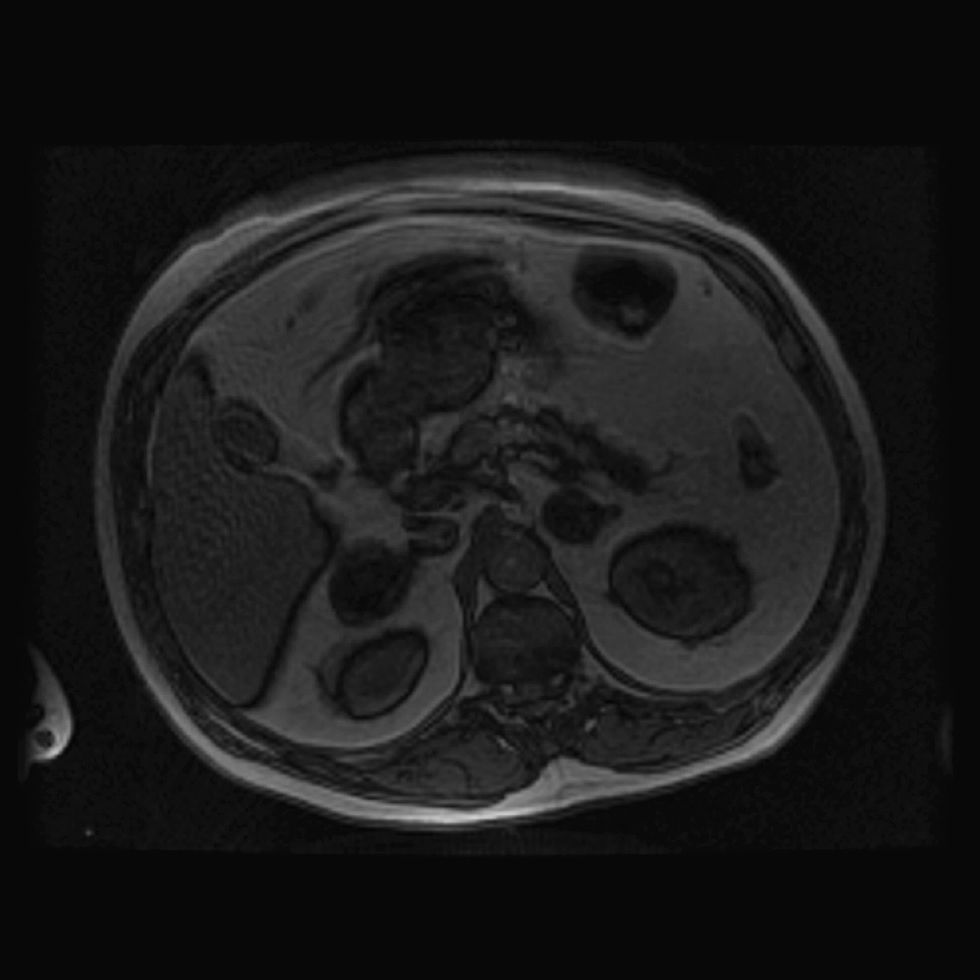
Presentamos el caso de un varón de 61 años con antecedentes personales de hipertensión arterial de difícil control con 3 fármacos, diabetes mellitus de 6 meses de evolución en tratamiento con 48 unidades de insulina (0,53U/kg/día), tabaquismo y enfermedad pulmonar obstructiva crónica. Acudió a la consulta para estudio de masas suprarrenales detectadas en una tomografía computarizada (TC) de forma casual. Refería ganancia ponderal no cuantificada, astenia grave y hematomas frecuentes ante mínimos traumatismos. En la exploración física destacaba: peso de 89kg; índice de masa corporal de 34,74kg/m2; perímetro de cintura de 111cm; presión arterial de 168/103mmHg; obesidad de predominio central sin otros estigmas de hipercortisolismo y edemas con fóvea en los miembros inferiores. Se inició el estudio solicitando catecolaminas, metanefrinas, ácido vanilmandélico en orina de 24h, así como la determinación de 17 hidroxiprogesterona y sulfato de dehidroepiandrosterona en el plasma, con cifras dentro de la normalidad, excepto por una mínima elevación en la excreción de noradrenalina (adrenalina de 5μg/24h [normal hasta 18], noradrenalina de 82μg/24h [normal hasta 80], metanefrina de 140μg/24h [normal hasta 341], normetanefrina de 433μg/24h [normal hasta 444], ácido vanilmandélico de 3,6mg/24h [2–9], 17 hidroxiprogesterona de 1,53ng/ml [0,23–4,28], dehidroepiandrosterona de 112,8μg/dl [normal hasta 337]). También se determinó el cortisol libre urinario y el cortisol plasmático tras 1mg de dexametasona, obteniéndose resultados elevados (cortisol libre urinario de 293,5μg/24h [20–90], cortisol plasmático tras 1mg de dexametasona de 24,5μg/dl). Para completar el estudio de hipercortisolismo, se solicitó en varias ocasiones ACTH plasmática (determinación por radioinmunoanálisis) con resultados de 7pg/ml, 8pg/ml y al menos 3 determinaciones con concentraciones inferiores a 5pg/ml. No se realizó test de estimulación con corticoliberina, dada la presencia de concentraciones de ACTH indetectables en varias determinaciones. Se completó el estudio de imagen con resonancia magnética (RM) que observó masas suprarrenales bilaterales lobuladas de 48mm en el lado izquierdo y de 45mm en el lado derecho, con señal en secuencias potenciadas en T2 isointensas con respecto al parénquima esplénico, siendo hipointensas en secuencias potenciadas en T1 (figs. 1 y 2). En la densitometría ósea, se observó una osteopenia moderada-grave a nivel de la columna lumbar y osteopenia leve en el cuello femoral. También se solicitó RM hipofisaria, observándose un posible nódulo de 3mm hipocaptante en el lado derecho, encontrándose el tallo hipofisario centrado, lo que se interpretó como un incidentaloma hipofisario no funcionante.
Se decidió realizar tratamiento quirúrgico con suprarrenalectomía bilateral que tuvo que ser abierta por la dificultad para obtener un neumoperitoneo aceptable. El resultado de la anatomía patológica fue el siguiente: glándula suprarrenal derecha de 78g y de 8,5×3×4cm, y glándula suprarrenal izquierda de 52g y de 7,5×3×2,5cm. La descripción microscópica fue de hiperplasia suprarrenal macronodular. A lo largo del seguimiento, el paciente presentó normalización de las cifras de glucemia y de presión arterial, sin precisar tratamiento. La concentración plasmática de ACTH a los cuatro meses de la cirugía fue de 39pg/ml. Quedó pendiente la realización de RM para valorar el posible incidentaloma hipofisario.
Las glándulas suprarrenales tienen forma de Y invertida, y en adultos sanos cada una pesa entre 4–5g. En el SC independiente de ACTH secundario a hiperplasia suprarrenal macronodular existe un considerable aumento del tamaño de las glándulas suprarrenales (entre 24–500g), que contienen múltiples nódulos mayores de 5mm, no pigmentados, separados por un estruma glandular hipertrófico, aunque en ocasiones también puede ser atrófico3. Esta entidad se presenta en pacientes con edades comprendidas entre los 50–60 años y no existe predominio por el sexo femenino, tal y como sucede en la mayoría de las causas de SC endógeno4. Se puede manifestar de forma muy infrecuente en los primeros años de vida en los pacientes con un síndrome de McCune–Albright5. La mayoría de las veces es esporádico, aunque se han documentado casos de formas familiares con una herencia autonómica dominante6.
El diagnóstico se basa en la demostración de hipercortisolismo y concentraciones indetectables de ACTH. La determinación de ACTH plasmática es esencial para saber la etiología del SC, con muy buena sensibilidad (99,89%) y especificidad (97%)7,8. Debe llevarse a cabo en plasma anticoagulado con ácido etilendiaminotetraacético, colocando la muestra inmediatamente en hielo después de la extracción y centrifugando en frío para evitar la degradación de la ACTH por endopeptidasas, lo cual puede inducir a errores diagnósticos. En el SC independiente de ACTH secundario a hiperplasia suprarrenal macronodular, las concentraciones plasmáticas de ACTH se encuentran suprimidas (<5pg/ml) y son inapropiadamente normales o altas en los casos de hiperplasia macronodular dependiente de ACTH (≥15pg/ml)9, aunque algunos autores consideran el intervalo entre 10–20pg/ml10. Con concentraciones de ACTH comprendidas entre 5–15pg/ml, se debe realizar un test de estimulación con corticoliberina para diferenciar aquellos casos de hiperplasia macronodular dependiente de ACTH en los que existen concentraciones bajas, pero detectables de ACTH, debido a que algunos nódulos adquieren la capacidad de secreción de cortisol de forma autónoma11.
En cuanto a las pruebas de imagen, tanto los resultados de la TC como los de la RM son variables. Las glándulas suprarrenales aparecen aumentadas de tamaño por la presencia de numerosos nódulos, que pueden ser mayores de 5cm, aunque el crecimiento también se puede producir de forma difusa. En la TC, los nódulos aparecen como hipointensos con un marcado aumento tras la administración del contraste. En la RM, las glándulas son isointensas respecto al parénquima esplénico e hipointensas respecto al hígado en secuencias en T1, y traduce la presencia de lípidos intracelulares12. La gammagrafía con 131-I-colesterol muestra una captación bilateral en ambas glándulas suprarrenales en la mayoría de los casos, pero no se realizó por no encontrarse disponible el isótopo.
Clásicamente, la producción de cortisol en el SC suprarrenal se había considerado autónoma. En el momento actual, existen evidencias que apuntan a que la estereidogénesis es regulada por otras hormonas distintas de la ACTH a través de la expresión de receptores aberrantes para el polipéptido inhibidor gástrico, la vasopresina, la serotonina, las catecolaminas y la hormona luteinizante2, cuya presencia no se investigó en nuestro caso puesto que se optó por el tratamiento quirúrgico.
La suprarrenalectomía bilateral es el tratamiento más aceptado para los pacientes con SC independiente de ACTH secundario a hiperplasia suprarrenal macronodular13. Sin embargo, en aquellos pacientes en los que la producción de cortisol sea moderada, se puede realizar una suprarrenalectomía unilateral de la glándula de mayor tamaño14. En nuestro caso, se optó por una suprarrenalectomía bilateral dado que las glándulas presentaban tamaños similares.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.