Se reseñan las características de 5 casos clínicos de encefalopatía de Hashimoto con una presentación clínica variable y pruebas morfológicas normales, en las que la tomografía computarizada de emisión monofotónica (SPECT) cerebral contribuyó decisivamente al diagnóstico, así como la evolución de las imágenes cerebrales mediante SPECT y su relación con la clínica y los parámetros inmunológicos en el caso de más larga evolución al que hemos asistido.
We present the clinical features of five cases of Hashimoto's encephalopathy, all of which showed heterogeneous presentation and normal results on morphological tests except for cerebral single photon emission computed tomography (SPECT), which was decisive in the diagnosis. In addition, we present changes in brain SPECT images and their connection with the clinical and immunological parameters in the patient with the longest-standing Hashimoto's disease that we have seen.
En la enfermedad tiroidea autoinmunitaria se describen diversas alteraciones neurológicas: demencia, psicosis, neuropatías periférica y una forma rara, pero grave, conocida como encefalopatía de Hashimoto (EH) descrita por primera vez en 1966 por Brain et al1. Desde entonces, el término encefalopatía de Hashimoto ha ido englobando un síndrome complejo de déficit neurológicos y particularmente neuropsicológicos en pacientes con antecedentes de tiroiditis de Hashimoto y/o enfermedad de Graves-Basedow, a pesar de concentraciones de hormonas tiroideas dentro de los límites normales. En la actualidad la EH se encuadra en un grupo de encefalopatías más amplio, conocidas como encefalopatías sensibles a glucocorticoides relacionadas con enfermedad tiroidea autoinmunitaria2,3. Los criterios diagnósticos que más consenso aúnan en la actualidad son: a) exclusión razonable de otras encefalopatías; b) elevación significativa de anticuerpos antitiroideos, no siendo la presencia de hipotiroidismo un requisito diagnóstico, y c) respuesta favorable a glucocorticoides o inmunosupresores4-7.
Clínicamente suelen presentarse de dos formas: una más aguda con presentación semejante a las vasculitis y focalidad neurológica y otra, insidiosa, con predominio de las alteraciones cognitivas y los trastornos de comportamiento asociados a cuadros epileptiformes.
Presentamos las características de 5 casos clínicos (tabla 1) con clínica variable y pruebas morfológicas normales en las que la tomografía computarizada de emisión monofotónica (SPECT) cerebral contribuyó decisivamente al diagnóstico, así como la evolución de las imágenes cerebrales mediante SPECT y su relación con la clínica y los parámetros inmunológicos en el caso de más larga evolución al que hemos asistido.
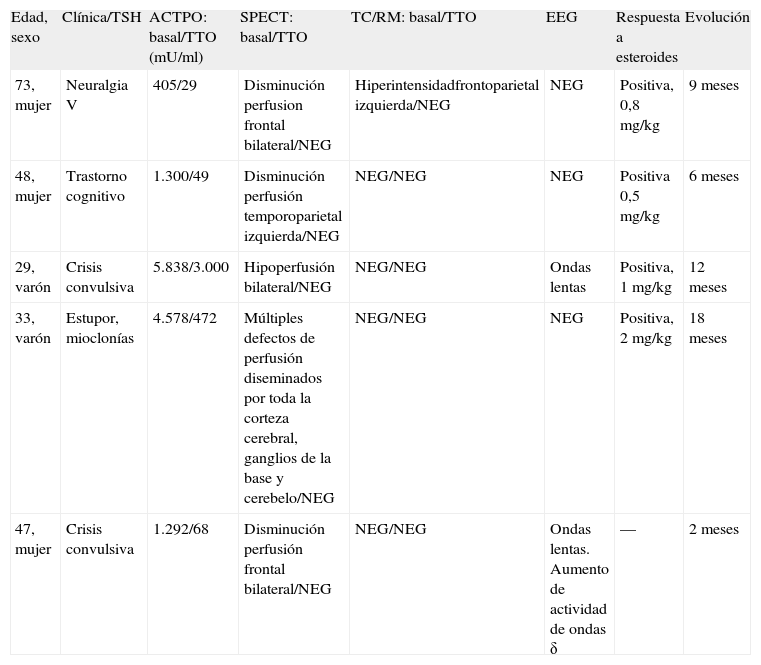
Datos de los 5 pacientes diagnosticados en nuestro centro en el periodo 1998-2008
| Edad, sexo | Clínica/TSH | ACTPO: basal/TTO (mU/ml) | SPECT: basal/TTO | TC/RM: basal/TTO | EEG | Respuesta a esteroides | Evolución |
| 73, mujer | Neuralgia V | 405/29 | Disminución perfusion frontal bilateral/NEG | Hiperintensidadfrontoparietal izquierda/NEG | NEG | Positiva, 0,8mg/kg | 9 meses |
| 48, mujer | Trastorno cognitivo | 1.300/49 | Disminución perfusión temporoparietal izquierda/NEG | NEG/NEG | NEG | Positiva 0,5mg/kg | 6 meses |
| 29, varón | Crisis convulsiva | 5.838/3.000 | Hipoperfusión bilateral/NEG | NEG/NEG | Ondas lentas | Positiva, 1mg/kg | 12 meses |
| 33, varón | Estupor, mioclonías | 4.578/472 | Múltiples defectos de perfusión diseminados por toda la corteza cerebral, ganglios de la base y cerebelo/NEG | NEG/NEG | NEG | Positiva, 2mg/kg | 18 meses |
| 47, mujer | Crisis convulsiva | 1.292/68 | Disminución perfusión frontal bilateral/NEG | NEG/NEG | Ondas lentas. Aumento de actividad de ondas δ | — | 2 meses |
ACTPO: anticuerpos antiperotidasa tiroidea; EEG: electroencefalograma; NEG: negativo; RM: resonancia magnética; SPECT: tomografía computarizada de emisión monofotónica; TC: tomografía computarizada; TSH: tirotropina; TTO: tratamiento.
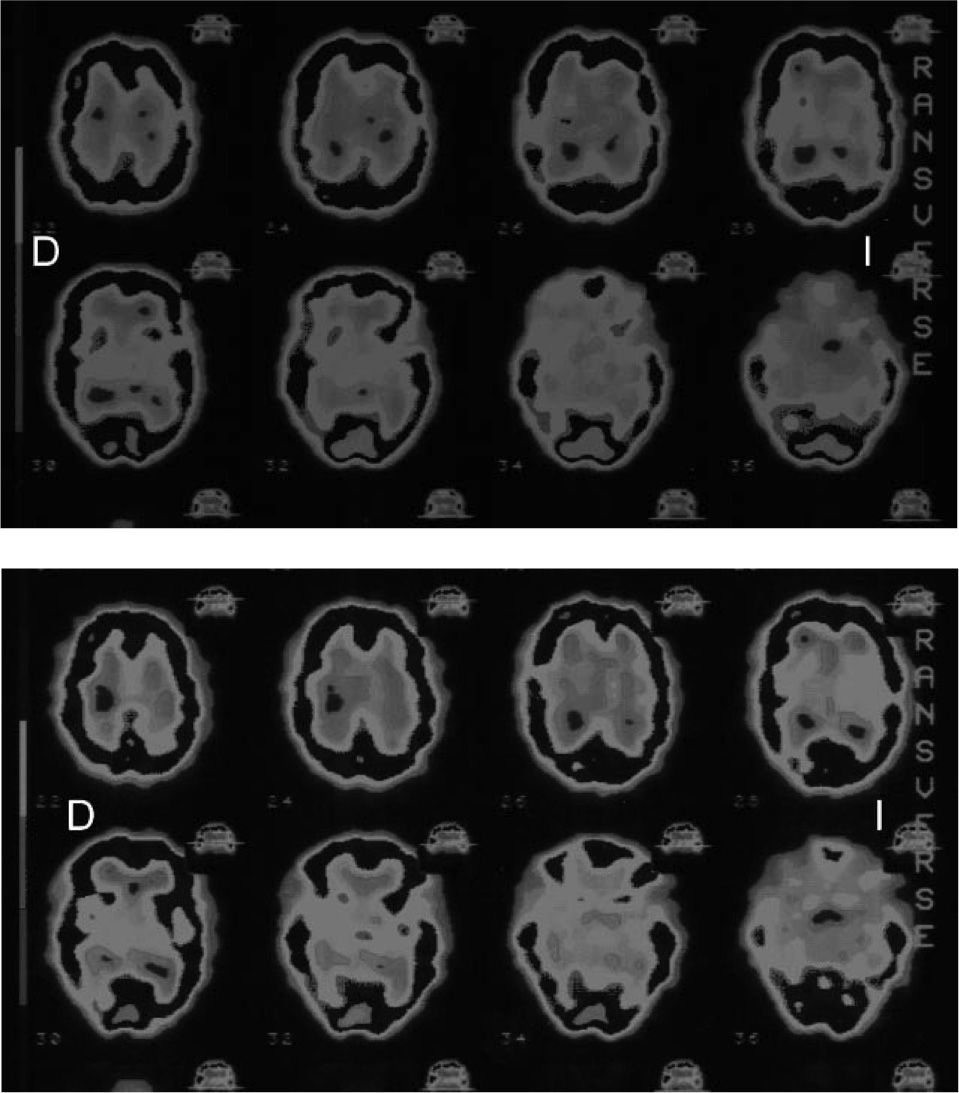
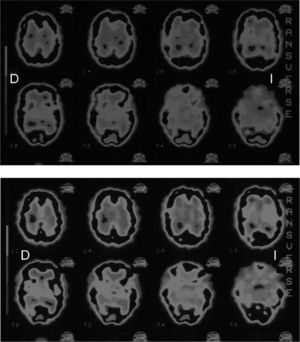
Varón de 32 años diagnosticado de hipotiroidismo primario autoinmunitaro 3 meses antes, clínica y analíticamente eutiroideo, que inicia clínica insidiosa de bradipsiquia, alteraciones cognitivas, temblor en las extremidades y parestesias migratorias en las manos y los pies, coincidiendo con elevación de títulos de anticuerpos anti-TPO (4.588 UI/ml; normal, < 60). Resonancia magnética (RM) con resultados normales y SPECT cerebral (25mCi de 99mTc-ECD) que mostró una distribución irregular del trazador con múltiples defectos de perfusión diseminados por toda la corteza cerebral, distribución irregular del trazador por ambos ganglios de la base, sin afección cerebelosa (fig. 1A). Con el diagnóstico de sospecha de EH, se inicia tratamiento con deflazacort a dosis bajas, con lo que mejora parcialmente la clínica y el resto de las pruebas practicadas resultan normales, VDRL, RPR e IgG negativas para sífilis, VIH y Borrelia, anticuerpos antinucleares, antimitocondriales, antimúsculo liso, anticardiolipinas y anticitoplasma del neutrófilo perinucleares (pANCA) o citoplásmicos (cANCA) negativos. LCR, EEG y nueva RM con y sin contraste, normales. Electromiograma y electroneurograma, normales. Se instaura tratamiento con 2mg/kg/día de prednisona. En los meses siguientes experimenta una lenta mejoría de la clínica inicial, pero se inicia debilidad muscular distal y atrofia muscular proximal secundaria al uso de glucocorticoides. Una nueva SPECT practicada a los 6 meses todavía muestra hipoactividad en la corteza cerebral parietal bilateral y temporal izquierda; con estructuras subcorticales y cerebelo sin hallazgos patológicos. Se inicia retirada de glucocorticoides de forma lenta, que se completa al año de su comienzo, sin que se objetive clínica. Se practica nueva reevaluación neuropsicológica, con resultados normales y RM y EEG normales. El estudio gammagráfico no muestra anomalías en esta ocasión y los títulos de anticuerpos antitiroideos están discretamente elevados (anti-TPO, 472 UI/ml; anti-Tg, 1.286 UI/ml). El paciente permanece eutiroideo y asintomático con tratamiento sustitutivo hasta el año siguiente, cuando refiere de nuevo, aunque de forma más leve, ansiedad, episodios de confusión mental y parestesias en extremidades inferiores, coincidiendo con nueva elevación de títulos de anticuerpos anti-TPO > 3.000 UI/ml y anticuerpos anti-Tg > 10.000 UI/ml). Otra SPECT confirma de nuevo hipoperfusión de corteza parietooccipital (fig. 1B).
DISCUSIÓNEn la patogenia se ha postulado un origen autoinmunitario, con depósitos de complejos antígeno-anticuerpo y edema perineuronal, anticuerpos que reaccionan de forma cruzada con antígenos neuronales (anticuerpos antiglutamatodecarboxilasa y alfa-enolasa), un posible efecto tóxico de la TRH en el sistema nervioso central o un origen vasculítico con infiltración linfocítica perivascular8.
En cualquier caso, el diagnóstico basado en pruebas morfológicas y funcionales está en controversia, pues se han descrito alteraciones inespecíficas en la RM en el 60% de los pacientes: atrofia discreta, lesiones subcorticales puntiformes, alteraciones de intensidad en la región temporal9,10.
Asimismo, también suelen ser anormales, incluso con mayor prevalencia (70-80%) que la RM, tanto el LCR como el EEG. El LCR suele ser hiperproteínico (75%) y con pleocitosis mononuclear. En ocasiones se han encontrado anticuerpos anti-TPO y anti-Tg elevados de significado incierto11 y el EEG (80%) suele mostrar un enlentecimiento de la actividad de fondo y brotes de actividad lenta intermitente difusa o focal12.
Con respecto a los estudios morfofuncionales, la tomografía por emisión de positrones (PET) no ha resultado de especial utilidad en su evaluación. Se ha descrito una alteración difusa secundaria a un hipometabolismo de la glucosa congruente con una afección cognitiva general en las fases más precoces de la enfermedad, aunque lo más habitual es la ausencia de alteraciones13 y no se correlacionan con los cambios neurológicos o electroencefalográficos de los pacientes12.
Más interesante ha resultado la valoración mediante SPECT. Esta técnica puede mostrar áreas de bajo flujo cerebral secundarias a un proceso vasculítico14 o a un edema perineuronal mediado por autoanticuerpos o complejos antígeno-anticuerpos15. En la revisión de Ferracci et al3, mediante SPECT se demostraron áreas focales de hipoperfusión contralaterales a la hemiparesia (3 de 21 casos) o varios grados de hipoperfusión (4 de 21 pacientes) frontal o parietal, aunque en 7 de 21 no hubo hallazgos; el resto, aunque con hipoperfusión focal o generalizada, no presentó correlación con la clínica. Sin embargo, este procedimiento, a diferencia de la PET, en la que hay captación y metabolismo activo del trazador, fluorodesoxiglucosa, utiliza isótopos químicamente inertes (99mTc) con fuerte carácter lipofílico (difusión pasiva), lo cual le permite unirse a los eritrocitos y una rápida difusión de la sangre al tejido cerebral, con lo que se evalúa tanto vascularización como permeabilidad de la membrana neuronal16.
Además, los resultados dependen del uso de diferentes microtrazadores químicos, fundamentalmente HMPAO (1-hexametil-propilamina-oxima) y ECD (dímero etilcisteinato), ya que éstos difieren en la capacidad de su señal en detectar la proporción flujo sanguíneo/retención de tejido cerebral, lo que justifica la mayor capacidad del 99Tc-ECD para detectar lesiones en esta enfermedad —como en nuestros casos, en los que se observó una correlación entre las áreas cerebrales afectadas y las alteraciones neurológicas de los pacientes— pues se ha documentado una mejor discriminación lesional tanto en encefalopatías como en ictus17,18. En cualquier caso, no se ha encontrado tampoco correlación con el EEG, lo que indica que las alteraciones de PET y SPECT son distintas19.
CONCLUSIONESEl diagnóstico de EH debe considerarse en los casos de encefalopatía de presentación subaguda, concentraciones elevadas de anticuerpos antitiroideos (incluso con función tiroidea normal) y ausencia de otro trastorno. La práctica de SPECT cerebral y la rápida respuesta a glucocorticoides son datos que respaldan el diagnóstico en esta entidad.