Actualmente, las opciones terapéuticas del bocio compresivo se limitan a la cirugía o a la administración de radioyodo. Clásicamente, la cirugía suele plantearse como primera opción, y se reserva el radioyodo para los pacientes de elevado riesgo quirúrgico. Comentamos el caso de una paciente de 81 años, con bocio multinodular (BMN) hiperfuncionante, extensión intratorácica y sintomatología compresiva, en quien la cirugía estaba contraindicada por enfermedades concomitantes. Revisamos las evidencias de eficacia de las alternativas de tratamiento del BMN compresivo y las posibles complicaciones secundarias.
Treatment options for large, compressive goiters are currently limited to surgery and radioiodine administration. Classically, the first-line option has been surgery, with radioiodine therapy being reserved as an alternative treatment in patients with high surgical risk. We describe the case of an 81-year-old woman with a large, compressive multinodular goiter and hyperthyroidism, substernal extension and associated co-morbidity, contraindicating surgery. We review the efficacy of different treatment options for compressive multinodular goiter, as well as the potential secondary complications.
El uso terapéutico del radioyodo 131I en las enfermedades tiroideas se ha limitado clásicamente al tratamiento del hipertiroidismo y el cáncer de tiroides. En pacientes tratados con 131I por cualquiera de estas 2 indicaciones, se observó una tendencia a la disminución de la glándula tiroidea tras la administración del radioisótopo. En 1988, Hedegüs et al1 demostraron que los pacientes con bocio multinodular no tóxico se beneficiaban del tratamiento con 131I al producirse una disminución del tamaño tiroideo. Estudios posteriores2,3 constataron este hallazgo y describieron reducciones del tamaño glandular de aproximadamente el 40-60% tras 1–2 años desde la administración de 131I, junto con cirugía y levotiroxina, como alternativa al tratamiento del bocio no tóxico.
A continuación comentamos el caso de una paciente de 81 años, con bocio multinodular (BMN) hiperfuncionante con extensión intratorácica y sintomatología compresiva, y contraindicación para la cirugía por enfermedades concomitantes. Se descartó malignidad de los nódulos sospechosos mediante punción-aspiración con aguja fina (PAAF) antes de la administración del 131I.
CASO CLÍNICOPaciente de 81 años afectada de bocio de larga evolución y por el que previamente no había consultado a ningún médico. Acudió a consultas de endocrinología por aumento progresivo de tamaño en los últimos meses, acompañado de sintomatología ocasional de tos, disfagia y disnea. No refería disfonía. La paciente había percibido pérdida ponderal de 5kg de peso en el último año. No aquejaba nerviosismo, aunque precisaba de ansiolíticos para conciliar el sueño desde hacía 3 años.
A la exploración física, no se objetivaron datos indicativos de alteración de la función tiroidea. Se palpaba bocio de grado III a expensas del lóbulo derecho, de consistencia aumentada y un nódulo de aproximadamente 2,5cm en el istmo, que se introducía en la fosa yugular. El lóbulo izquierdo era de tamaño y consistencia normal a la palpación. La circunferencia del cuello era de 37cm.
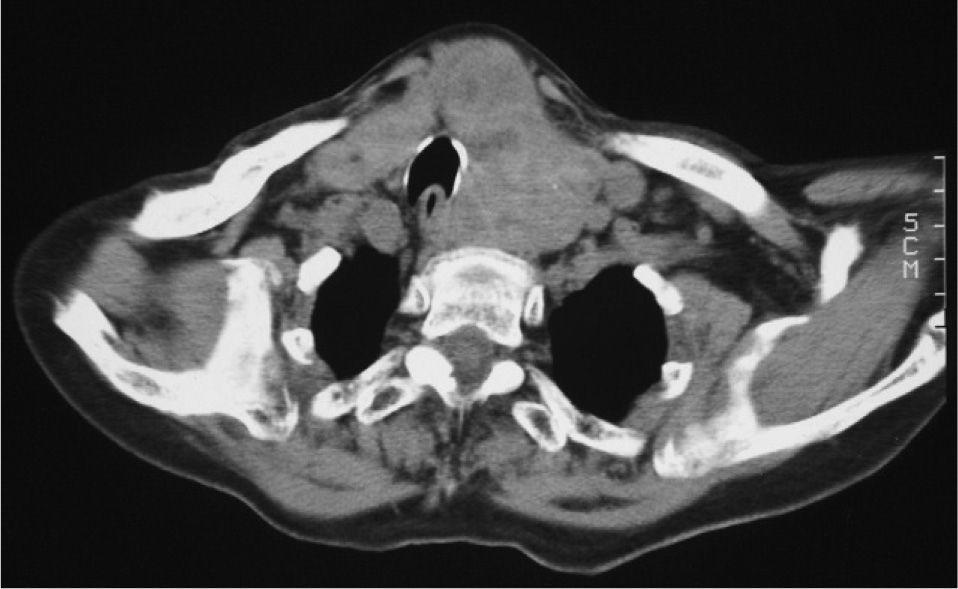
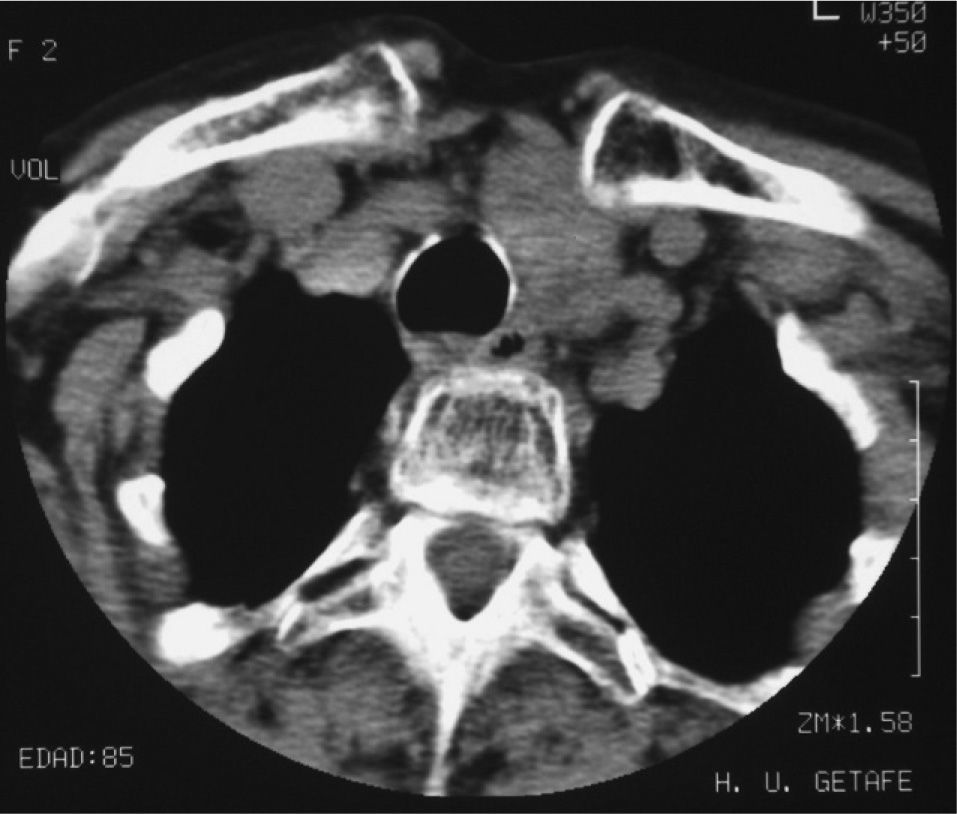
Se solicitaron pruebas de función tiroidea que evidenciaron hiperfunción subclínica con anticuerpos tiroideos negativos; TSH, 0,01 (normal, 0,3-5) μU/ml y T4l, 1,8 (normal, 0,8-2) ng/ml. La radiografía de tórax mostró desviación traqueal sin disminución de la luz. En la tomografía computarizada (TC) de cuello se evidenciaba gran bocio multinodular con compresión traqueal y disminución de la luz esofágica (fig. 1). La gammagrafía con 131I puso de manifiesto múltiples nódulos no captadores en lóbulo derecho, istmo y lóbulo izquierdo. Se inició tratamiento con antitiroideos a bajas dosis (metimazol, 5mg al día) con el objetivo de normalizar la función tiroidea. Ante el diagnóstico de BMN tóxico compresivo, y dada la avanzada edad y el riesgo quirúrgico (presentaba antecedentes de trombocitopenia y betatalasemia), se decidió tratamiento con 131I con el fin de controlar la función tiroidea, disminuir el tamaño tiroideo y mejorar la clínica compresiva. Tras mantener 1 año de tratamiento con metimazol 5mg/día, las pruebas de función tiroidea previas a la administración de 131I fueron normofuncionantes (TSH, 1,3; T4l, 1,8), y se suspendieron los antitiroideos la semana previa al tratamiento con 131I. Dos semanas después de la administración de 50mCi de 131I, la paciente acudió al departamento de urgencias por disfagia de 48h de evolución. Se realizó esofagograma, en que se objetivó estenosis esofágica por compresión extrínseca, probablemente secundaria a la inflamación tiroidea tras el 131I. Se inició tratamiento con glucocorticoides con mejoría progresiva de la disfagia. A los 2 años de la administración del 131I, el perímetro del cuello era de 33cm (había disminuido 4cm) y la TC de control mostró BMN con abundantes calcificaciones, que había disminuido de tamaño de forma espectacular, desapareciendo la compresión sobre estructuras adyacentes (fig. 2). La función se mantiene en eutiroidismo.
Clásicamente, las opciones terapéuticas del bocio se han limitado a la cirugía o bien, una vez descartada su etiología maligna, al tratamiento conservador mediante la administración de levotiroxina o radioyodo. Durante años se ha utilizado como primera opción de tratamiento conservador en el BMN normofuncionante la levotiroxina a dosis supresoras con el objetivo de estabilizar el crecimiento o incluso reducir el tamaño del bocio. Es útil en el tratamiento de bocios de discreto tamaño, pero apenas es eficaz en el caso de bocios de gran tamaño y larga evolución. En 2001, Wesche et al4 demostraron la superioridad del radioyodo frente a la levotiroxina en el tratamiento del bocio multinodular. El yodo radiactivo induce mayor porcentaje de respuestas y mayor disminución del tamaño del bocio.
Por otra parte, la reducción del tamaño tiroideo inducido por la levotiroxina no se mantiene tras la retirada de este tratamiento supresor, lo cual obliga a mantener el tratamiento de por vida.
Por tanto, la ineficacia de la levotiroxina en el tratamiento definitivo del bocio, asociada a los efectos óseos y cardiovasculares secundarios del hipertiroidismo subclínico mantenido a largo plazo, justifica su abandono como tratamiento del BMN en los últimos años5. Este hecho deja al radioyodo como única alternativa de tratamiento no quirúrgica en pacientes con BMN con tendencia al crecimiento o compresión de la tráquea, el esófago o el sistema venoso.
El tratamiento de elección en la mayoría de los pacientes es la cirugía. Es efectiva y consigue el control de la sintomatología de forma rápida y eficaz. Además, permite realizar examen histopatológico de la muestra, y descartar si hay focos de malignidad, más frecuentes en bocios de gran tamaño subesternales6. Por otra parte, deben considerarse las posibles complicaciones del acto quirúrgico, como lesión del nervio laríngeo recurrente y de las glándulas paratiroides. Las lesiones permanentes ocurren en menos de un 1% de los casos en manos expertas, aunque dicha incidencia puede aumentar en casos de grandes bocios7 y bocios reintervenidos. Asimismo, son más frecuentes las complicaciones respiratorias posquirúrgicas, y hasta un 5-10% de los pacientes requieren intubación por traqueomalacia8. La tasa de recurrencia del bocio tras la cirugía asciende hasta el 15- 40%, según el remanente tiroideo posquirúrgico, y es mínima tras la realización de tiroidectomía total5.
La necesidad de reintervención por recurrencia del bocio incrementa de 3 a 10 veces el riesgo de complicaciones quirúrgicas, como parálisis recurrencial e hipoparatiroidismo. Por eso, es recomendable realizar tiroidectomía total desde el inicio, salvo en los casos donde haya claro riesgo de dañar el nervio laríngeo recurrente o las paratiroides con la disección, en los que se optará por tiroidectomías subtotales5.
El tratamiento con 131I constituye una opción terapéutica eficaz y segura y, como se demuestra en el caso clínico presentado, puede conseguir una reducción del tamaño tiroideo de aproximadamente 40-50% al año de la administración2 de 131I. Su eficacia, sin embargo, disminuye según se incrementa al tamaño del bocio9, lo cual obliga a incrementar la dosis de 131I, con las posibles complicaciones dependientes de la dosis, como la tiroiditis tras yodo, el riesgo de cáncer y el hipotiroidismo.
La tiroiditis tras radioyodo puede exacerbar la sintomatología compresiva debido a un aumento del volumen tiroideo que, en algunos casos, como en el de nuestra paciente, puede hacer necesario el uso de corticoides o, incluso en situaciones más extremas, la intubación urgente. Este aumento transitorio del bocio suele ser máximo a los 7 días del tratamiento, aunque en el caso descrito fue más tardío (a las 2 semanas de la administración del radioisótopo). Sin embargo, hasta ahora ningún estudio ha demostrado, mediante control ecográfico, un incremento significativo del volumen tiroideo tras radioyodo10.
En cuanto al incremento de riesgo de cáncer inducido por 131I es controvertido. El estudio más largo siguió durante una media de 21 años a 35.593 pacientes que habían recibido radioyodo por hipertiroidismo, sin objetivar incremento en las muertes por cáncer en general. En ese estudio, sin embargo, se detectó un incremento en la mortalidad por cáncer de tiroides. Si el incremento está relacionado con la propia enfermedad tiroidea o exclusivamente con el efecto del radioyodo no está claro11. Otros estudios, basados en pacientes que han recibido repetidas dosis de radioyodo, presentan un incremento de riesgo de mortalidad por cáncer en general de 1,09. Sin embargo, este riesgo es mínimo en el subgrupo de pacientes mayores 65 años, entre los que se encuentra la mayoría de los pacientes con BMN compresivo11.
La aparición de hipotiroidismo tras radioyodo aparece en un 10-50% de los casos5,12, principalmente durante los primeros 2 años tras la aplicación de yodo. Diversas variables parecen afectar a la eficacia del radioyodo, así como a la aparición de hipotiroidismo. Entre ellas se encuentra la edad, el sexo, el tamaño tiroideo, la captación tiroidea y la administración previa de fármacos antitiroideos.
Los pacientes que reciben fármacos antitiroideos previamente al radioyodo, como es el caso descrito, parecen presentan menor riesgo de desarrollar hipotiroidismo posteriormente, pero también disminuye la tasa de eficacia del radioyodo. Aunque la sintomatología del paciente en casos de hiperfunción leve, como es nuestro caso, puede controlarse con bloqueadores beta hasta el inicio del efecto del radioyodo (4–8 semanas ), en pacientes de edad avanzada o con cardiopatía, es recomendable el uso previo de antitiroideos. El objetivo del uso de antitiroideos, cuyo efecto comienza a las 2–4 semanas, es deplecionar los almacenes de hormona tiroidea, reduciendo el riesgo de una posible crisis tirotóxica tras radioyodo. Estudios recientes indican que los antitiroideo de elección en este caso son metimazol o carbimazol, pues éstos parecen no alterar la eficacia del radioyodo, ni siquiera cuando se administran hasta 24h antes. Por el contrario, el pretratamiento con propiltiouracilo ha demostrado disminuir la eficacia del radioyodo, lo que obliga a incrementar la dosis del radioisótopo o bien suspender el tratamiento antitiroideo durante, al menos, 2 meses antes11.
Otro de los factores determinantes en la eficacia del radioyodo es la captación de yodo por el tejido tiroideo. Dicha captación es máxima en estado de hipotiroidismo y, por el contrario, disminuye cuando la TSH está suprimida. Por tanto, en las situaciones de hipotiroidismo o de TSH elevada la avidez del tejido tiroideo por el yodo es máxima, lo cual permite administrar dosis menores de radioyodo. Por este hecho fisiopatológico, y con el objetivo de disminuir las complicaciones dependientes de la dosis tras radioyodo, se ha propuesto la estimulación con TSH recombinante previamente al 131I. En un reciente estudio la administración de 0,3mg de TSH recombinante permitió disminuir en un 60% la dosis de radioyodo, obteniendo la misma eficacia en cuanto a reducción del tamaño tiroideo en comparación con otros estudios. Sin embargo, la administración previa de TSH recombinante se asoció a un aumento de tiroiditis y de hipotiroidismo tras radioyodo13.
En nuestra experiencia, la administración de yodo 131 en bocios de gran tamaño y con clínica compresiva es eficaz y segura, siempre y cuando se realice un estrecho seguimiento de los pacientes en la semana inmediatamente posterior a la administración, especialmente en los pacientes con evidencia radiológica de reducción de la vía aérea previa al radioyodo.
La elección final entre cirugía o yodo radiactivo debe basarse en la edad, las comorbilidades, las intervenciones quirúrgicas previas del tiroides y, finalmente, los deseos del paciente en particular.