Los tumores hipofisarios secretores de tirotropina (tirotropinomas) son menos del 1% de los adenomas hipofisarios y una causa rara de hipertiroidismo. La mayoría se diagnostica como macroadenoma, y los microadenomas son excepcionales. Debe hacerse el diagnóstico diferencial con la resistencia a las hormonas tiroideas. El tratamiento de elección es la adenomectomía transesfenoidal. Si fracasa, los análogos de somatostatina son una alternativa terapéutica. Presentamos a una paciente con un microadenoma productor de tirotropina en quien se practicó una adenomectomía transesfenoidal. Tras el fracaso de la cirugía, se inició tratamiento con un análogo de somatostatina. En la actualidad, después de 9 años, la paciente continúa el tratamiento y el hipertiroidismo y el crecimiento tumoral están controlados.
Thyrotropin secreting adenomas (TSH-omas) account for less than 1% of all pituitary adenomas and are a rare cause of hyperthyroidism. Most cases correspond to macroadenomas, microadenomas being exceptional. Differential diagnosis should be made with resistance to thyroid hormones. The first line treatment is transphenoidal surgery. When surgery is unsuccessful, somatostatin analogues are a therapeutic alternative. We report a patient with a TSH-secreting microadenoma. The microadenoma was resected through the transsphenoidal route. Because surgery was unsuccessful, medical therapy with somatostatin analogue was initiated. Currently, 9 years later, the patient continues to be under treatment with somatostatin analogue therapy, which has controlled the hyperthyroidism and tumoral growth. We describe successful long-term treatment of a TSH-oma with somatostatin analogue therapy when surgery is unsuccessful.
Los tumores hipofisarios secretores de tirotropina (TSH), también denominados tirotropinomas, son menos del 1% de los adenomas hipofisarios1,2 y son una causa rara de hipertiroidismo. Las manifestaciones clínicas, habitualmente moderadas o leves, son similares a las de otras formas más frecuentes de hipertiroidismo1. Se caracterizan por concentraciones plasmáticas aumentadas de hormonas tiroideas y TSH inapropiadamente normal o elevada. La mayoría se diagnostica como macroadenoma debido a la naturaleza agresiva de estos tumores y al retraso en el diagnóstico por atribuirse la clínica a otras causas más comunes de tirotoxicosis. Los microadenomas son menos del 10% de los casos3,4.
CASO CLÍNICOA continuación describimos un caso de un microadenoma hipofisario productor de TSH. Una paciente de 59 años fue remitida para estudio de anormalidad persistente en la determinación de hormonas tiroideas con TSH y T4 libre plasmáticas elevadas. La paciente había consultado 6 meses antes con su médico de familia por astenia, nerviosismo e insomnio.
La exploración física reveló un bocio de grado II, sobre todo izquierdo, y temblor fino distal. En el estudio analítico destacaban: TSH, 1,96 mUI/l (valor normal, 0,35-5); T4 libre, 2,51ng/ml (valor normal, 0,68-1,48); T3 libre, 2,1ng/ml (valor normal, 0,8-1,6); anticuerpos antitiroglobulina y antiperoxidasa, negativos; subunidad alfa, 1,1μg/l (valor normal, hasta 1,6 en la posmenopausia), y proteína transportadora de hormonas sexuales (SHBG), 48nmol/l (normal, 10–50). La relación subunidad alfa/TSH, calculada según la fórmula: [subunidad α (μg/l) / TSH (mU/l)]×10, fue 5,61, valor dentro de los límites de normalidad establecidos en pacientes con gonadotrofinas elevadas y TSH normal5. Las determinaciones plasmáticas de las demás hormonas hipofisarias fueron normales. No hubo respuesta de la TSH tras estimulación con 200μg de tiroliberina: TSH basal, 2,56 mUI/l; a los 30min, 2,62 mUI/l, y a los 60min, 2,44 mUI/l. La resonancia magnética mostró una formación nodular de 9mm en el lado derecho de la hipófisis, hipointensa en todas las secuencias y sin realce tras la administración de gadolinio (fig. 1). La ecografía tiroidea detectó aumento tiroideo bilateral, más acentuado en el lóbulo izquierdo, que presentaba 2 nódulos, de 11mm de diámetro en el tercio superior y de 36mm en el tercio inferior. En la gammagrafía tiroidea se objetivó un tiroides con aumento moderado de tamaño y captación, con nódulo frío en el polo inferior del lóbulo tiroideo izquierdo. La punción-aspiración con aguja fina del nódulo obtuvo material coloide.
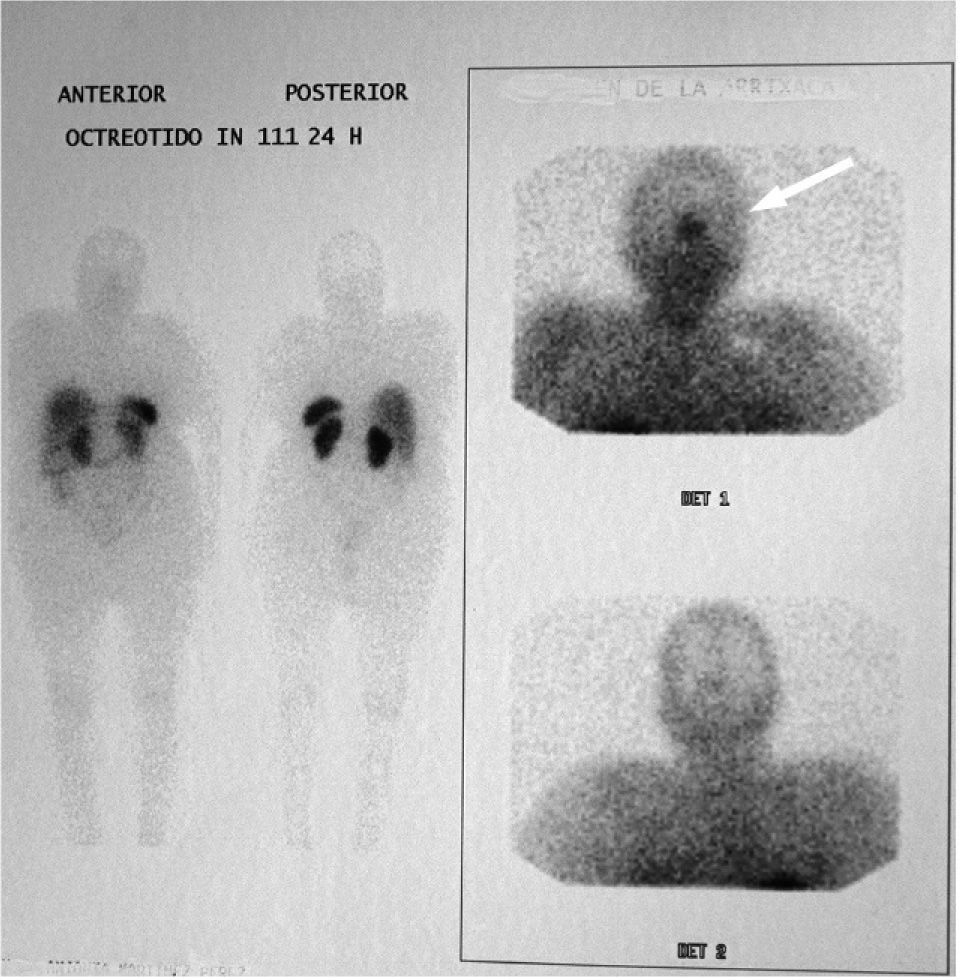
La paciente fue remitida a neurocirugía para realizar adenomectomía transesfenoidal. Durante el tiempo de espera quirúrgico se inició tratamiento con 5mg de metimazol al día, que normalizó la T4 libre y aumentó las concentraciones de TSH hasta 5,4 mUI/ml. Se realizó cirugía por vía transesfenoidal sin complicaciones, pero no se halló adenoma en el tejido resecado. Tras la cirugía, la paciente continuó con la misma sintomatología clínica y el estudio hormonal confirmó la persistencia del hipertiroidismo (TSH, 2,07 mUI/l; T4 libre, 2,1ng/ml; T3, 1,8ng/ml), sin más alteraciones de la función hipofisaria. La resonancia magnética hipofisaria fue compatible con silla turca vacía. Se realizó una gammagrafía con octreotida-111In, que mostró un depósito patológico del trazador a nivel de la silla turca (fig. 2). Ante estos resultados, se inició tratamiento con 20mg de octreotida lar cada 28 días, que normalizó la función tiroidea al mes (TSH, 1,07 mUI/l; T4 libre, 1,1ng/ml; T3 libre, 1,3ng/ml). La paciente ha sido revisada durante 9 años, en los que se ha mantenido clínica y analíticamente eutiroidea, con disminución de la dosis de octreotida a 10mg cada 4 semanas y buena tolerancia. En ese tiempo se han repetido tres estudios de resonancia magnética hipofisaria, y no se han observado cambios en la imagen. En el seguimiento ecográfico del bocio, se detectó un aumento progresivo del nódulo tiroideo izquierdo hasta llegar a 5cm, motivo por el que hace 1 año se realizó una tiroidectomía total; la anatomía patológica de la pieza extirpada informó de bocio multinodular con un adenoma folicular.
Tras la tiroidectomía, se inició tratamiento sustitutivo con 100μg/día de tiroxina y se mantuvo la octreotida. Al mes las concentraciones de TSH eran de 5,74 mUI/l y las de T4 libre, 0,89ng/ml, por lo que se decidió aumentar la tiroxina a 125μg/día. Dos meses después, las concentraciones de TSH eran de 0,92 mUI/l y las de T4 libre, 1,37ng/ml. En la actualidad la paciente sigue clínica y analíticamente controlada.
DISCUSIÓNLos tirotropinomas son los tumores menos frecuentes de la adenohipófisis. Las células tirotropas son menos del 5% de todas las células hipofisarias6, lo que puede justificar la baja incidencia de los tirotropinomas. Aproximadamente un tercio de ellos segregan otras hormonas, más frecuentemente hormona de crecimiento y prolactina. Clásicamente estos tumores eran excepcionales y en su mayoría se diagnosticaban como macroadenomas invasivos con clínica de afección de las estructuras vecinas a la silla turca. Sin embargo, en las últimas dos décadas, el uso generalizado de la TSH ultrasensible, la mejora de las técnicas de imagen y el mayor grado de sospecha de los clínicos han hecho que aumente el número de casos comunicados y el porcentaje de microadenomas. Sin embargo, los casos comunicados en la literatura española son muy escasos7,8.
Los tirotropinomas pueden ocurrir a cualquier edad, pero son más frecuentes en las edades medias de la vida. No tienen mayor prevalencia en mujeres, en contraste con la mayoría de las enfermedades tiroideas, y presentan una gran heterogeneidad clínica y bioquímica2.
Debe hacerse el diagnóstico diferencial con otro cuadro que cursa con secreción inadecuada de TSH, como es la resistencia a las hormonas tiroideas. El diagnóstico diferencial es más fácil cuando hay clínica de afección de estructuras vecinas a la silla turca y/o de hipersecreción de otras hormonas hipofisarias junto con alteraciones específicas en la resonancia. Sin embargo, en muchos microadenomas no aparece clínica neurológica ni de hipersecreción de otras hormonas.
La falta de respuesta tirotropínica a la estimulación con tiroliberina y la elevación de la subunidad α, de la relación subunidad α/TSH y de la SHBG en los tirotropinomas ayudan a diferenciar ambos procesos. Aunque todas estas pruebas tienen falsos negativos9-11. En nuestra paciente no había respuesta tirotropínica a la estimulación con tiroliberina, pero las cifras de subunidad α, α/TSH y SHBG eran normales.
Concentraciones de subunidad α normales, como ocurrió en nuestra paciente, se describen con mayor frecuencia en los microadenomas, guardando relación con el menor tamaño tumoral y la ausencia de hipersecreción múltiple12. En nuestro caso la resonancia magnética hipofisaria fue de gran utilidad para establecer el diagnóstico.
El tratamiento de elección de los tirotropinomas es la cirugía hipofisaria, previa normalización de la función tiroidea. Aunque en la actualidad se acepta el tratamiento prequirúrgico con análogos de somatostatina para el control del hipertiroidismo dependiente de TSH, también es adecuado el tratamiento con tionamidas y bloqueadores beta13. Hace 9 años el tratamiento prequirúrgico con análogos de somatostatina no estaba claramente establecido; por este motivo utilizamos tionamidas para el control prequirúrgico del hipertiroidismo durante 2 meses.
La cirugía transesfenoidal sólo resulta curativa en el 44% de los casos, probablemente debido al gran tamaño tumoral y a la naturaleza fibrosa de estos tumores5,14. El porcentaje de remisiones tras radioterapia es bajo12, por lo que los análogos de somatostatina son el tratamiento de elección ante el fracaso de la cirugía, pues se consigue la normalización de la función tiroidea en un 75-95% de los pacientes y reducción del tamaño tumoral hasta en el 50%2,4,15.
Se describe que dos tercios de los pacientes presentan bocio multinodular al diagnóstico, probablemente debido a la estimulación prolongada por TSH durante años. En nuestra paciente, pese a mantener concentraciones de hormonas tiroideas y TSH controladas con análogos de somatostatina, el crecimiento autónomo del bocio hizo necesaria la tiroidectomía tras 8 años de evolución. Tras la tiroidectomía se han mantenido las hormonas tiroideas en el límite alto de la normalidad para obtener el beneficio del feed-back negativo parcial sobre la TSH16,17.
Los resultados obtenidos en nuestra paciente, en tratamiento con análogos de somatostatina durante 9 años, con buen control hormonal y sin crecimiento tumoral, refuerzan el papel que estos fármacos tienen en el tratamiento de los tumores secretores de TSH no curados por cirugía.