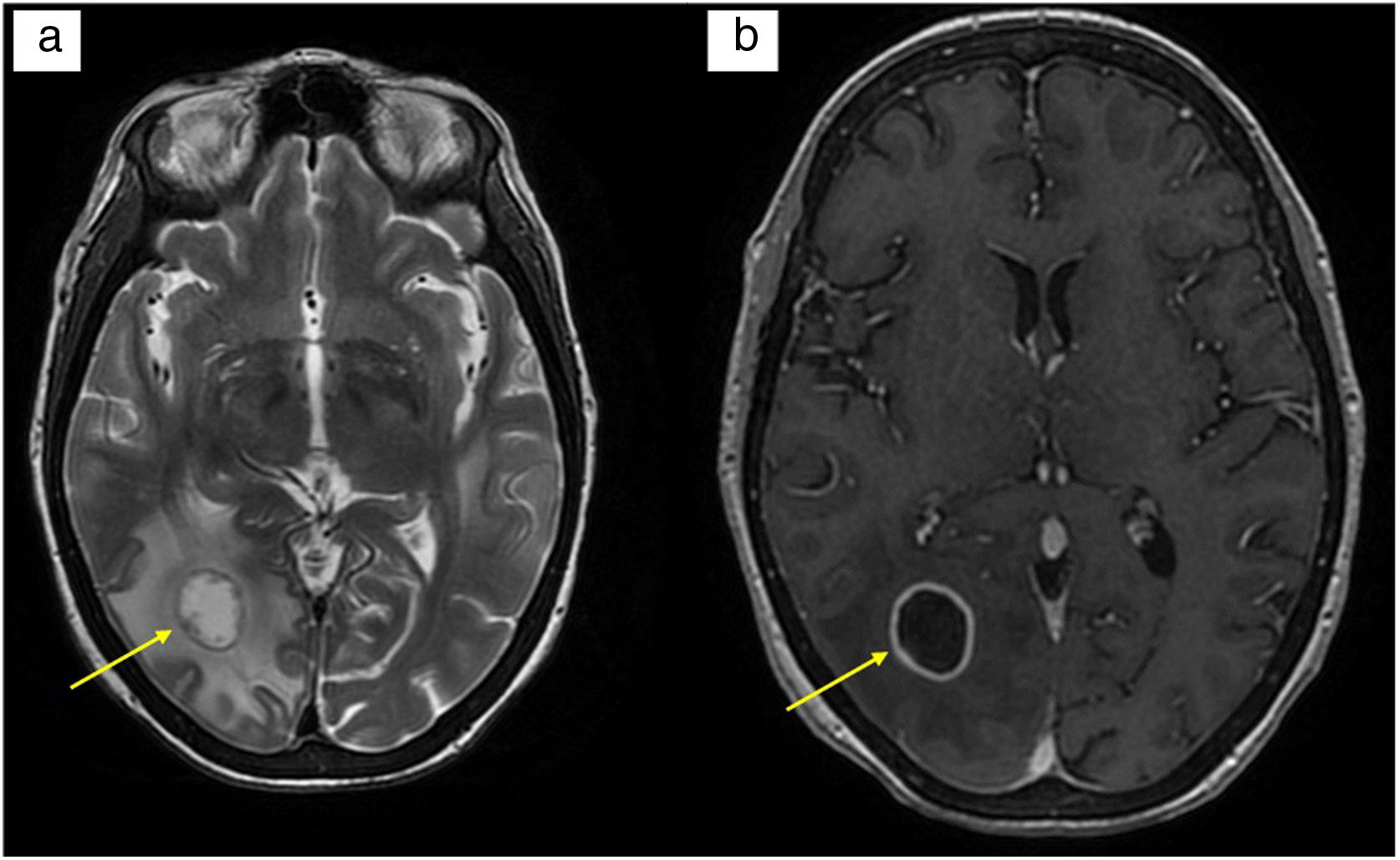
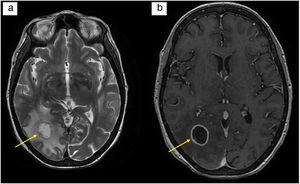
Reportamos el caso de una mujer de 56 años con hipertensión portal (HTP) secundaria a hidatidosis hepática, intervenida quirúrgicamente y síndrome de Budd-Chiari posquirúrgico. Se sometió a un trasplante hepático (TH), presentando disfunción primaria del injerto, y necesidad de retrasplante 3 días después. Su evolución en reanimación fue tórpida, con multitud de complicaciones: fracaso renal agudo con necesidad de tratamiento sustitutivo renal, neumotórax, encefalopatía urémica metabólica con repercusión neurológica (TAC normal), shock séptico, miopatía del enfermo crítico e hiperbilirrubinemia. Comenzó tratamiento con micofenolato, metilprednisolona, basiliximab, tacrólimus y ganciclovir (hasta conocer serología del receptor). Tras varios días en planta de hepatología, la paciente presentó clínica neurológica en forma de tetraparesia, desviación oculocefálica a la derecha y convulsiones. Se realizó un escáner cerebral donde se observó una hipodensidad parieto-occipital derecha sugestiva de isquemia aguda/subaguda, con sospecha de leucoencefalopatía posterior reversible asociada a tacrólimus. En la RM cerebral se vieron 3 lesiones intraaxiales de probable etiología infecciosa, la de mayor tamaño sugestiva de absceso fúngico (fig. 1). Se plantearon otras alternativas como absceso piógeno, neoplasia primaria o toxoplasmosis. Se inició tratamiento antifúngico y antibiótico empírico con meropenem, linezolid y anfotericina B liposomal.
a) RM cerebral en secuencia T2: lesión en sustancia blanca de lóbulo occipital derecho, de 1,7cm de diámetro, redondeada con apariencia en capas. Moderado edema vasogénico circundante; b) RM cerebral en secuencia T1 con contraste: tras la administración de contraste intravenoso, realce periférico anular homogéneo, liso y fino.
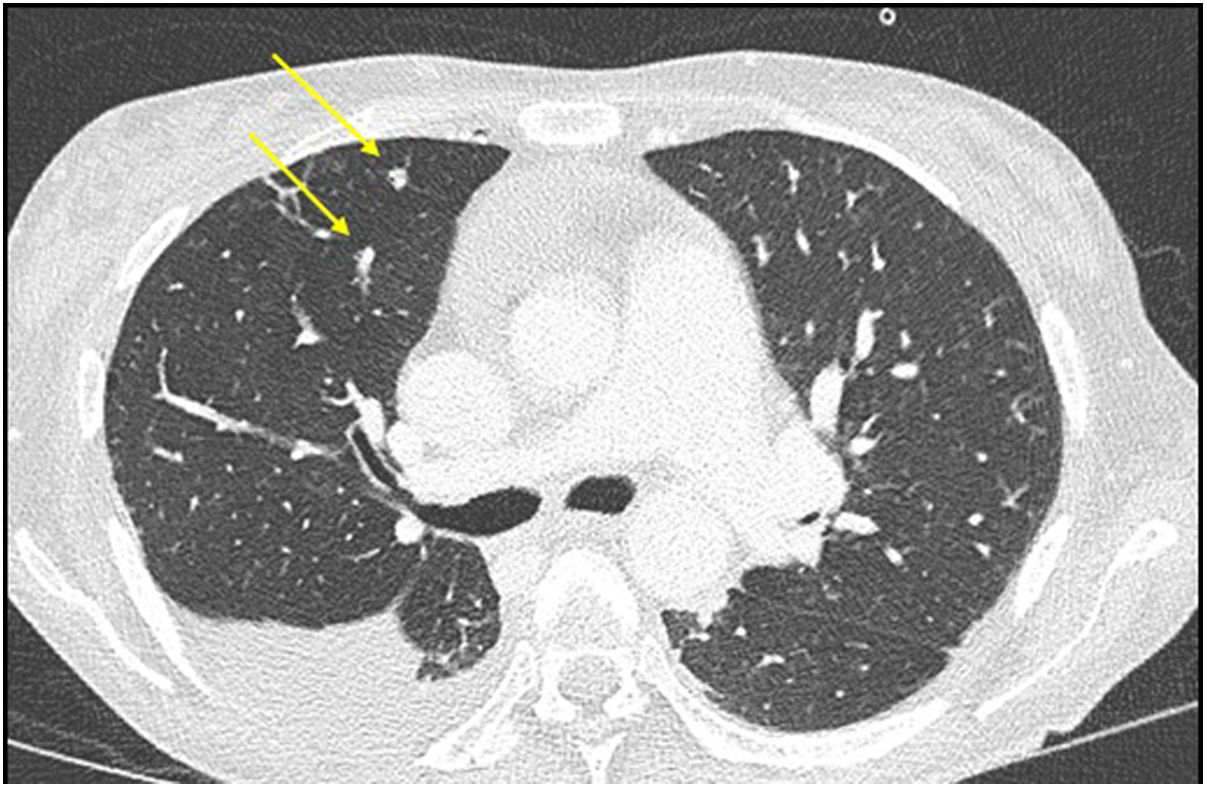
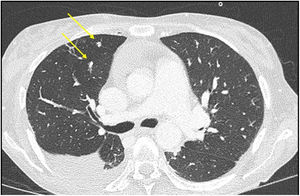
Se completó el estudio con un escáner de cuerpo completo, con hallazgos de colecciones hepáticas de gran tamaño y múltiples micronódulos pulmonares de probable origen infeccioso (fig. 2). Se realizó una ecografía cardíaca transesofágica que visualizó una masa lineal en la válvula aórtica compatible con vegetación endocardítica.
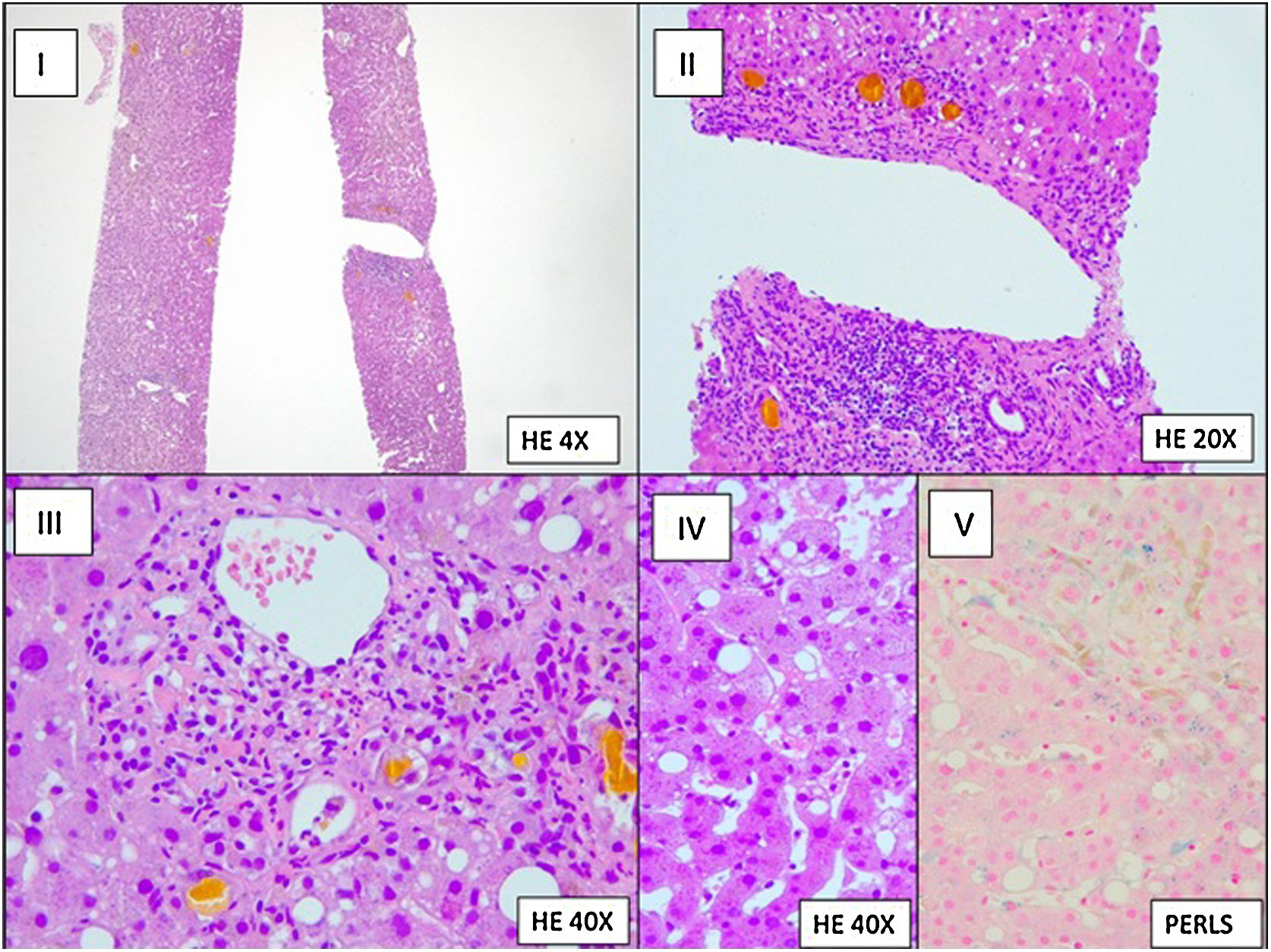
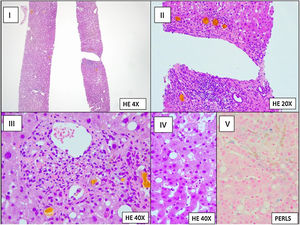
Se realizó lavado broncoalveolar (LBA) que evidenció estructuras fúngicas en examen directo y cultivo positivo para Aspergillus fumigatus (800UFC/ml). La determinación de galactomanano en LCR y LBA resultó positiva (índice 1.117 en LCR y >3.000 en LBA) y negativa en suero. La biopsia hepática informó de cambios histológicos secundarios a sepsis (fig. 3). La paciente fue diagnosticada de aspergilosis invasiva.
EvoluciónTras varios días de tratamiento hospitalario, se fue de alta con la unidad de hospitalización domiciliaria (UHD) con anfotericina 180mg/24h/durante 6 semanas y voriconazol 200mg/12h/durante 12 semanas, además del tratamiento inmunosupresor con micofenolato y tacrolimus. La paciente respondió adecuadamente al tratamiento y no presenta secuelas de la infección.
Comentario final/discusiónEl TH supone un estado de inmunosupresión que puede conllevar infecciones oportunistas. La infección por Aspergillus fumigatus es poco frecuente, pero es una importante causa de morbimortalidad (33-100%) en este contexto1. El caso clínico presentado trata de una infección por Aspergillus fumigatus en forma de aspergilosis invasiva en paciente trasplantada hepática. La presentación clínica suele ser entre la semana 2 y la semana 6 post-TH. El origen de la infección es nosocomial y se presenta normalmente en pacientes con factores de riesgo asociados2. Entre ellos destacan la insuficiencia renal con necesidad de diálisis o ultrafiltrado continuo, retrasplante (salvo el que se realiza en los primeros 7 días) o la disfunción inicial del injerto severa (GPT>2,000U/l y Quick<40%) que no se normalice al quinto día. Nuestra paciente precisó un retrasplante hepático y sufrió un fallo renal agudo postrasplante. El diagnóstico de sospecha es clínico y radiológico, y la confirmación requiere biomarcadores diagnósticos. Biomarcadores no invasivos incluyen el galactomanano o el beta-D-glucano en suero o el cultivo de esputo. En el TH el galactomanano acostumbra a ser negativo, es positivo en el paciente neutropénico. Una prueba invasiva sería broncoscopia con lavado broncoalveolar (LBA) o la biopsia pulmonar3. Los azoles, como el voriconazol o el isavuconazol, son uno de los tratamientos de primera línea. En casos graves se recomienda asociar equinocandina durante las 2 primeras semanas4. Es una complicación rara, pero muy grave, que debe descartarse ante la mínima sospecha por las repercusiones tanto en mortalidad como en morbilidad que puede llegar a ocasionar. Aunque hay controversia sobre la administración de tratamiento profiláctico universal5, sí que podría ser beneficiosa en pacientes con factores de riesgo mencionados anteriormente6.