Se ha estudiado el efecto de la pérdida de porinas y el efecto inóculo en la actividad comparativa del ertapenem (ERT) frente a las cepas de Klebsiella pneumoniae productoras de betalactamasas de espectro extendido (BLEE) o de betalactamasas de AmpC de codificación plasmídica (pACBL).
MétodosSistema de microdilución mediante la utilización de 2 inóculos diferentes.
ResultadosEl imipenem (IMP), la amikacina, el ERT y la cefepima fueron los antimicrobianos más activos en condiciones estándares. La pérdida de porinas afectó más al ERT que al IMP.
ConclusionesEl ERT muestra una buena actividad frente a las cepas productoras de betalactamasas de tipo BLEE y de tipo pACBL. Las cepas deficientes en porinas analizadas tienen una sensibilidad disminuida a betalactámicos. El efecto inóculo afectó más al IMP que al ERT.
The effect of porin loss and inoculum size on the comparative activity of ertapenem against either extended-spectrum beta lactamase-producing (ESBL) or plasmid-mediated AmpC beta lactamase-producing (pACBL) Klebsiella pneumoniae strains was evaluated.
MethodsMicrodilution using 2 different bacterial inocula.
ResultsImipenem, amikacin, ertapenem, and cefepime were the most active agents under standard conditions. Ertapenem was more highly affected by porin loss than imipenem.
ConclusionsErtapenem showed high activity against K. pneumoniae strains expressing ESBL, pACBL or both. Strains deficient in porins showed decreased susceptibility to beta lactams. The inoculum effect had a greater impact on imipenem than on ertapenem.
La producción de betalactamasas (BL) es el mecanismo de resistencia a antimicrobianos betalactámicos de mayor relevancia en bacterias gramnegativas. Las BL de espectro extendido (BLEE) de las familias TEM, SHV, OXA y, más recientemente, CTX-M han sido descritas en un gran número de países, incluida España1–3. También se han aislado en el país enterobacterias productoras de BL de tipo AmpC de codificación plasmídica (pACBL)4,5.
La expresión reducida de las proteínas de membrana externa es más frecuente en las cepas de Klebsiella pneumoniae productoras de BLEE que en las que no expresan estas BL6. La pérdida de porinas en una cepa que expresa una BLEE o que hiperproduce una BL de tipo AMPc puede provocar la aparición de resistencia a carbapenémicos7.
El ertapenem (ERT) es un carbapenémico activo frente a la mayoría de los microorganismos aislados de los pacientes no hospitalizados. Con la excepción de las metalobetalactamasas y otras carbapenemasas, el ERT es altamente resistente a la acción de las BL, incluidas las BLEE.
El propósito de este estudio fue analizar la actividad del ERT y compararla con la de otros betalactámicos y antimicrobianos de otras familias frente a las cepas de K. pneumoniae productoras de BLEE o de pACBL con ausencia de la expresión de porinas, así como analizar el efecto inóculo.
MétodosSe seleccionaron 50 cepas clínicas de K. pneumoniae en función de la producción de pACBL, la producción de BLEE y el patrón de expresión de proteínas de membrana externa (tabla 1). Algunas cepas se aislaron en muestras clínicas de esta Unidad y los doctores Jones, Jacoby, Bradford y Tzouvelekis suministraron amablemente las otras. La caracterización de las BL se realizó mediante métodos convencionales, incluidos isoelectroenfoque, determinación del perfil de sustratos, técnicas de reacción en cadena de la polimerasa y secuenciación8,9. El análisis de las porinas se realizó mediante electroforesis en gel de poliacrilamida con dodecilsulfato sódico (SDS-PAGE) de las proteínas de membrana externa, obtenidas tras digestión con lauril sarcosinato sódico (Sigma, España) de las membranas celulares extraídas por sonicación de las bacterias7. Se consideró que una cepa era deficiente en porinas cuando no expresaba OmpK35 ni OmpK36.
Cepas seleccionadas para este estudio
| pACBL−BLEE−POR− | pACBL− BLEE+ POR+ | pACBL− BLEE+ POR− | pACBL+ BLEE− POR+ | pACBL+ BLEE− POR− | pACBL+ BLEE+ POR+ | pACBL+ BLEE+ POR− |
| 2 cepas | 10 cepas | 12 cepas | 18 cepas | 1 cepa | 4 cepas | 3 cepas |
BLEE: betalactamasa de espectro extendido; pACBL: betalactamasa de tipo AmpC plásmidica; POR: expresión de porinas.
Se estudió la sensibilidad a los siguientes antimicrobianos mediante microdilución en caldo Mueller-Hinton siguiendo las directrices del CLSI (Clinical and Laboratory Standards Institute): cefoxitina (FOX), cefotaxima (CTX), ceftazidima, cefepima (FEP), imipenem (IMP), ERT, amoxicilina con ácido clavulánico (AMC), piperacilina con tazobactam (PTZ), amikacina (AK), gentamicina (GN), cotrimoxazol (SXT) y ciprofloxacino (CIP). Para la determinación de las categorías clínicas se utilizaron los puntos de corte del CLSI en función de los valores de la CMI (concentración mínima inhibitoria) obtenidos. No se modificaron las categorías clínicas de las cefalosporinas en las cepas productoras de BLEE. Para analizar el efecto inóculo, las pruebas de sensibilidad se realizaron utilizando inóculos estándares (105unidades formadoras de colonias [ufc]/ml) e inóculos elevados (106ufc/ml), como han descrito anteriormente Thomson y Molland10. Se utilizaron como cepas control Escherichia coli ATCC 25922, E. coli ATCC 35218, K. pneumoniae ATCC 700603 y Pseudomonas aeruginosa ATCC 27853.
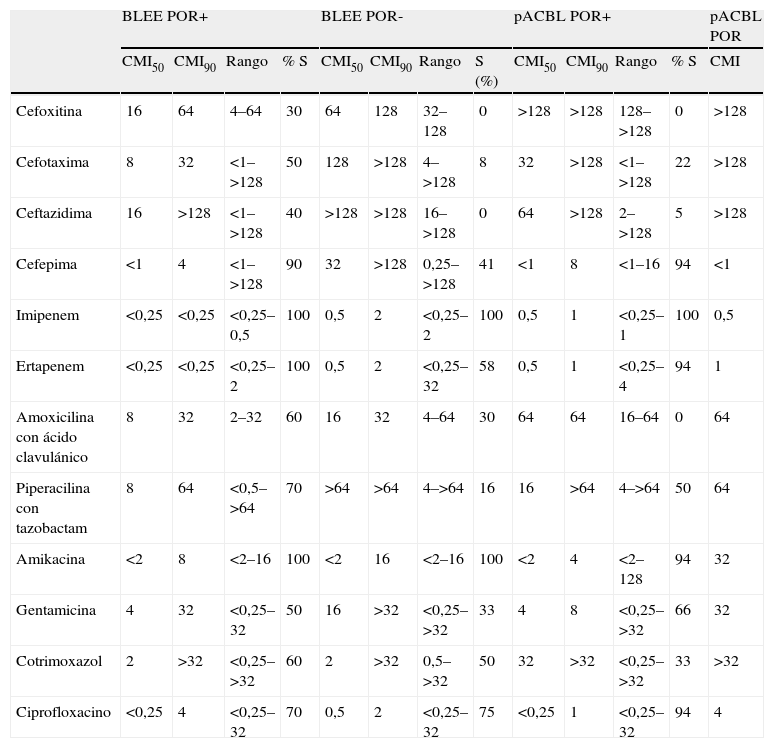
ResultadosLa CMI50, la CMI90, el rango y el porcentaje de las cepas sensibles se muestran en la tabla 2. Con el inóculo de 105ufc/ml, los antimicrobianos más activos fueron IMP y AK, seguidos por ERT, FEP y CIP. Se observó efecto inóculo con todas las cefalosporinas y las combinaciones de betalactámico con inhibidor de BL, con excepción de la FOX. Los antimicrobianos con los que se observó efecto inóculo con mayor frecuencia fueron FEP, CTX, PTZ, CIP y SXT. Los antimicrobianos menos afectados por el efecto inóculo fueron AMC, GN y AK.
CMI, rango (μg/ml) y porcentaje de cepas sensibles a los antimicrobianos evaluados en función del tipo de betalactamasa producida
| BLEE POR+ | BLEE POR- | pACBL POR+ | pACBL POR | ||||||||||
| CMI50 | CMI90 | Rango | % S | CMI50 | CMI90 | Rango | S (%) | CMI50 | CMI90 | Rango | % S | CMI | |
| Cefoxitina | 16 | 64 | 4–64 | 30 | 64 | 128 | 32–128 | 0 | >128 | >128 | 128–>128 | 0 | >128 |
| Cefotaxima | 8 | 32 | <1–>128 | 50 | 128 | >128 | 4–>128 | 8 | 32 | >128 | <1–>128 | 22 | >128 |
| Ceftazidima | 16 | >128 | <1–>128 | 40 | >128 | >128 | 16–>128 | 0 | 64 | >128 | 2–>128 | 5 | >128 |
| Cefepima | <1 | 4 | <1–>128 | 90 | 32 | >128 | 0,25–>128 | 41 | <1 | 8 | <1–16 | 94 | <1 |
| Imipenem | <0,25 | <0,25 | <0,25–0,5 | 100 | 0,5 | 2 | <0,25–2 | 100 | 0,5 | 1 | <0,25–1 | 100 | 0,5 |
| Ertapenem | <0,25 | <0,25 | <0,25–2 | 100 | 0,5 | 2 | <0,25–32 | 58 | 0,5 | 1 | <0,25–4 | 94 | 1 |
| Amoxicilina con ácido clavulánico | 8 | 32 | 2–32 | 60 | 16 | 32 | 4–64 | 30 | 64 | 64 | 16–64 | 0 | 64 |
| Piperacilina con tazobactam | 8 | 64 | <0,5–>64 | 70 | >64 | >64 | 4–>64 | 16 | 16 | >64 | 4–>64 | 50 | 64 |
| Amikacina | <2 | 8 | <2–16 | 100 | <2 | 16 | <2–16 | 100 | <2 | 4 | <2–128 | 94 | 32 |
| Gentamicina | 4 | 32 | <0,25–32 | 50 | 16 | >32 | <0,25–>32 | 33 | 4 | 8 | <0,25–>32 | 66 | 32 |
| Cotrimoxazol | 2 | >32 | <0,25–>32 | 60 | 2 | >32 | 0,5–>32 | 50 | 32 | >32 | <0,25–>32 | 33 | >32 |
| Ciprofloxacino | <0,25 | 4 | <0,25–32 | 70 | 0,5 | 2 | <0,25–32 | 75 | <0,25 | 1 | <0,25–32 | 94 | 4 |
Valores de CMI en μg/ml.
Sólo hay una cepa con el perfil pACBL+ y POR-. Se muestran los valores de CMI.
S: cepas sensibles; BLEE: betalactamasa de espectro extendido; CMI: concentración mínima inhibitoria; pACBL: betalactamasa de tipo AmpC plásmidica; POR: expresión de porinas.
Las cepas deficientes en porinas mostraron menor sensibilidad a betalactámicos, independientemente del tipo de BL expresada. El IMP, el ERT y el FEP fueron los betalactámicos más activos, con cerca del 100% de sensibilidad en las cepas que expresaban porinas, pero este porcentaje cayó al 88,9, el 50 y el 55,5%, respectivamente, en el caso de las cepas deficientes en porinas. En el caso de los antimicrobianos no betalactámicos, el efecto de la pérdida de porinas fue menos destacable (tabla 2).
Los antimicrobianos más activos frente a las cepas que expresaban porinas y que producían BLEE fueron ERT, IMP y AK (el 100% de cepas sensibles) y FEP (el 90% de sensibilidad). En el caso de las cepas productoras de BLEE y deficientes en porinas, el IMP y la AK seguían siendo los agentes más activos (el 100% de cepas sensibles), pero el porcentaje de cepas sensibles a ERT descendió a un 58,3%.
Frente a las cepas productoras de pACBL, el antimicrobiano más activo fue IMP, con un 96,2% de cepas sensibles, seguido por ERT, FEP, AK y CIP (el 94,4% de cepas sensibles, respectivamente). En estas cepas, el porcentaje de resistencia a FEP aumentó desde un 0% con un inóculo de 105ufc/ml hasta un 65,4% con el inóculo de 106ufc/ml. En estas cepas se observó efecto inóculo con los carbapenémicos. Este efecto afectó con mayor frecuencia al IMP, pero determinó menos cambios en la categoría clínica que en el caso del ERT, de modo que, con el inóculo de 105ufc/ml hubo un 80 y un 14% de cepas sensibles y resistentes a ERT, respectivamente; mientras que con el inóculo de 106ufc/ml esos valores fueron del 68 y del 30%. En el caso del IMP, un 96 y un 92% de las cepas eran sensibles con inóculos estándar y elevado, respectivamente, y el 4% eran resistentes con ambos inóculos. El efecto de la pérdida de porinas en estas cepas no pudo evaluarse debido al escaso número de cepas con estas características.
DiscusiónEn España la prevalencia de enterobacterias productoras de BLEE aisladas de muestras clínicas ha pasado de un 0,5% en el caso de E. coli y de un 2,7% en K. pneumoniae en el año 2000 a cifras de un 4% en el caso de E. coli y de un 5% en K. pneumoniae en el año 20062,3. De igual modo, cada vez hay más referencias sobre el aumento de enterobacterias productoras de BL de tipo pACBL aisladas en este medio5. Últimamente se han descrito aislamientos de cepas productoras simultáneamente de BL de tipo BLEE y de tipo AMPc11.
Las opciones terapéuticas en estos casos son realmente reducidas, puesto que la coexistencia de ambas BL inactiva a todas las cefalosporinas, incluidas las cefamicinas, y hacen inútil el efecto inhibidor del ácido clavulánico. Además, los microorganismos que expresan una BLEE o una pACBL suelen contener otros determinantes de resistencia en el plásmido en el que se encuentra el gen que codifica la BL o incluso en otros plásmidos. Muchas veces la única opción terapéutica disponible son los carbapenémicos, aunque es posible la aparición de resistencia a éstos en el caso de la producción de carbapenemasas, de BLEE o de pACBL en combinación con la pérdida de porinas o de mecanismos de expulsión activa de antimicrobianos.
En este trabajo se ha comparado la actividad del ERT con la de otros antimicrobianos frente a un grupo de cepas de K. pneumoniae que producen BL de tipo AmpC o de tipo BLEE y con alteraciones en la expresión de porinas. Igualmente se ha evaluado la aparición de efecto inóculo mediante la comparación de las CMI de estos antimicrobianos frente a 2 inóculos diferentes.
En consonancia con estudios previos de actividad de antimicrobianos frente a microorganismos multirresistentes, los fármacos más activos a inóculo estándar fueron los carbapenémicos, la AK y la FEP. Por el contrario, cuando se utilizó el inóculo de 106ufc/ml, las CMI de la FEP se incrementaron en el 89% de las cepas, al igual que se ha descrito en varios estudios10,12. El efecto inóculo también se observó en los carbapenémicos, pero sólo en el caso de las cepas productoras de pACBL, y es más frecuente con IMP que con ERT. Betriu et al12 han descrito también este hecho, y en su trabajo el porcentaje de cepas sensibles a IMP disminuye un 16% cuando se emplea el inóculo elevado. En este estudio, sin embargo, el efecto inóculo produjo más cambios de categoría clínica en el caso del ERT que en el del IMP y, así, con inóculo estándar hubo un 80 y un 14% de cepas sensibles y resistentes a ERT, respectivamente; mientras que con el inóculo de 106ufc/ml esos valores fueron del 68 y del 30%.
Como se ha comentado anteriormente, la alteración en la expresión de porinas produce resistencia a los antimicrobianos betalactámicos, incluidos los carbapenémicos, sobre todo si se asocia a la expresión de BL6,7. Martínez- Martínez et al7 describen 2 cepas de K. pneumoniae en las que la sensibilidad a IMP está disminuida debido a la pérdida de las 2 porinas principales junto con la producción de BLEE. Además, el grado de resistencia aumenta cuando se utiliza un alto inóculo de microorganismo. Un estudio similar es el de Bradford et al13, en el que describen 3 cepas de K. pneumoniae que expresan la pACBL ACT-1, en las que aparece resistencia a IMP debido a la pérdida de una porina principal. Posteriormente, Hernández-Allés et al6 estudian la relación entre las alteraciones en la expresión de las proteínas de membrana y la disminución de sensibilidad a antimicrobianos en mutantes deficientes en porinas, y encuentran que la pérdida de estas proteínas de membrana asociada a la producción de BL produce un incremento de la resistencia a betalactámicos. Kaczmarek et al14 estudian un aislamiento clínico de K. pneumoniae que presenta resistencia a IMP y al meropenem causada por la producción de la BL de tipo AMPc ACT-1 en combinación con una pérdida de porinas debida a una inserción en los genes OmpK35 y OmpK36 que produce su inactivación. Más recientemente, Elliott et al15 describen el desarrollo in vivo de resistencia a ERT en un paciente con una neumonía nosocomial producida por K. pneumoniae y tratada con ERT y AK. Un análisis de los aislamientos resistentes a ERT reveló que, además de la BLEE, que también estaba presente en el aislamiento sensible a ERT, aquéllas habían sufrido la pérdida de la porina OmpK36. Lee et al11 describen la aparición in vivo de resistencia a ERT en un aislamiento clínico de K. pneumoniae de una muestra de sangre. Esta bacteriemia se trató con flomoxef y durante el tratamiento se aislaron en 3 nuevas ocasiones este mismo microorganismo, el último de los cuales desarrolló resistencia a ERT. Los 3 primeros aislamientos producían las BLEE CTX-M-3 y SHV-5 y eran deficientes en la porina OmpK35, pero eran sensibles a flomoxef y ERT. El cuarto aislamiento se hizo resistente a estos 2 antimicrobianos debido a la adquisición del gen blaDHA−1 y a la pérdida de la porina OmpK36. Por último, Girlich et al analizan en primer lugar la actividad hidrolítica de las BL de tipo CTX-M (CTX-M-2, CTX-M-3, CTX-M-9 y CTX-M-15) frente a ERT, y ven que es muy débil y que, por tanto, el ERT es efectivo frente a enterobacterias productoras de BLEE de tipo CTX-M. En otro estudio, estos autores seleccionan mutantes con sensibilidad disminuida a ERT, y encuentran que la modificación en la expresión de porinas es la causa de esta disminución de sensibilidad16,17.
En este trabajo, los resultados obtenidos están en consonancia con los comentados anteriormente, de modo que, si casi todas las cepas que expresaban las porinas OmpK35 y OmpK36 eran sensibles a IMP, ERT y FEP, los porcentajes de sensibilidad a estos betalactámicos caían al 89, el 50 y el 55%, respectivamente, para las cepas deficientes en estas porinas.
En conclusión, el ERT ha resultado ser ligeramente menos activo que el IMP y la AK frente a los aislamientos de K. pneumoniae estudiados. El efecto inóculo afectó al IMP con mayor frecuencia que al ERT, pero sólo se detectó en cepas productoras de pACBL. Este efecto determinó un aumento en el porcentaje de cepas resistentes sólo en el caso de ERT. Las cepas deficientes en porinas analizadas tuvieron una sensibilidad disminuida a betalactámicos con respecto a las que sí la expresaban.
Este estudio se realizó bajo los auspicios de la Red Española de Investigación en Patología Infecciosa (REIPI RD06/0008), el Ministerio de Sanidad y Consumo, y el Instituto de Salud Carlos III–FEDER. Los laboratorios MSD España han financiado parcialmente este estudio.