Introducción
Durante los últimos años se aprecia un significativo incremento de la incidencia de infecciones fúngicas, incluidas las causadas por hongos filamentosos y, particularmente, por Aspergillus. Las infecciones ocasionadas por especies del género Aspergillus son diversas y revisten gravedad en pacientes inmunodeprimidos. A. fumigatus es la especie que causa la mayoría de las infecciones, especialmente en aspergilosis invasiva, aunque otras especies también se han descrito en estos procesos, como A. flavus, A. niger, A. terreus, A. nidulans y algunas más1,2. La aspergilosis invasiva se asocia con una elevada mortalidad debido al estado inmunitario de los pacientes, principalmente, y otros factores entre los que se considera la variable actividad de los antifúngicos frente a las especies de Aspergillus. En la actualidad se dispone de cuatro fármacos para el tratamiento: anfotericina B, itraconazol, voriconazol y caspofungina.
En este trabajo se evalúa la sensibilidad de un amplio número de especies de Aspergillus frente a anfotericina B, itraconazol y voriconazol, determinando la concentración inhibitoria mínima (CIM) mediante el sistema Sensititre YeastOne® (Diagnostic Systems, Inglaterra), un método admitido recientemente por la Food and Drug Administration (FDA) que presenta, en la mayoría de las especies de Aspergillus y para anfotericina B e itraconazol, un elevado grado de concordancia3-6 con el método de referencia de microdilución M38-A propuesto por el National Committee for Clinical Laboratory Standards (NCCLS)7. Este método colorimétrico se ha considerado como una buena alternativa al método de referencia por ser más asequible a los laboratorios de Microbiología, por su sencillez de realización y la facilidad de lectura de los resultados.
Métodos
Se estudió la sensibilidad a la anfotericina B, itraconazol y voriconazol de un total de 68 cepas del género Aspergillus, que incluye 20 especies: 10, A. fumigatus; 9, A. flavus; 8, A. niger; 5, A. tamarii; 5, A. versicolor; 4, A. terreus; 3, A. glaucus; 3, A. ochraceus; 3, A. oryzae; 2, A. candidus; 2, A. chevalieri; 2, A. rubrobrunneus; 2, A. sclerotiorum; 2, A. sydowii; 2, A. unguis; 2, A. ustus; 1, A. clavatus; 1, A. nidulans; 1, A. pseudofischeri, y 1, A. reptans. Estas cepas se aislaron de diversas muestras clínicas: 32 exudados óticos, 22 secreciones respiratorias, 7 exudados cutáneos, 4 de heridas, 2 uñas y 1 muestra de sangre, aunque muchas de ellas no se relacionaron con infección.
En todas las cepas se determinó la CIM utilizando el sistema de microdilución Sensititre YeastOne® 03 (Diagnostic Systems Ltd., Inglaterra) de acuerdo con las instrucciones del fabricante. El inóculo se preparó tras cultivo de las cepas en agar de Sabouraud durante 7 días a 30 °C. La superficie del agar fue inundada con 1 ml de solución salina estéril que contenía 0,05% de tween 80 y frotada suavemente con un escobillón para obtener una suspensión de conidios en 5 ml de agua destilada estéril. Esta suspensión fue filtrada a través de gasa estéril de cuatro dobleces para eliminar las hifas acompañantes, y diluida para ajustar la concentración del inóculo en un espectrofotómetro a 530 nm hasta obtener una transmitancia del 80-82%, equivalente a una concentración de 4 x 105 a 5 x 106 conidios/ml. A partir de esta suspensión se efectuó una dilución en caldo RPMI 1640 tamponado con MOPS a pH 7 hasta alcanzar un inóculo final de 0,4-5 x 104 conidios/ml. La inoculación de los pocillos de la placa Sensititre se efectuó con 100 ml de esta suspensión, y las placas se incubaron a 35 °C durante 48 y 72 h, antes de realizar la lectura definitiva. Todas las pruebas se realizaron por duplicado para evitar errores de técnica. Como control de calidad se incluyó en el estudio las cepas Candida albicans ATCC 68548 y C. krusei ATCC 6258 y A. flavus ATCC 204304, realizando en ellas las mismas determinaciones. Como CIM se consideró la concentración más baja que produjo ausencia del crecimiento en comparación con el crecimiento del pocillo control sin antifúngico, lo que se interpreta en este sistema por el cambio de color azul (ausencia de crecimiento) a rojo (crecimiento).
Resultados
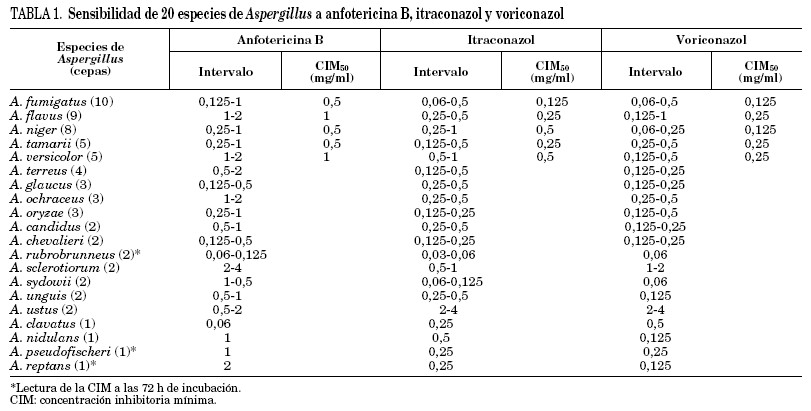
Todas las cepas de Aspergillus crecieron bien a las 48 h de incubación, menos una de A. rubrobrunneus, una de A. pseudofischeri y una de A. reptans que necesitaron prolongar la incubación hasta 72 h para realizar la lectura de resultados. Las CIM de las cepas control estuvieron dentro de los valores esperados. En la tabla 1 se reflejan los resultados del estudio de sensibilidad considerando el intervalo de CIM y la CIM50 frente a los tres antifúngicos ensayados de las especies con más de cinco cepas.
Para anfotericina B, un total de 10 cepas (14,7%) presentaron una CIM de 2 mg/l: 3 cepas de A. flavus, 2 de A. versicolor, una de A. terreus, una de A. ochraceus, una de A. sclerotiorum, una de A. ustus y una de A. reptans; la CIM fue de 4 mg/l para una cepa de A. sclerotiorum. Para itraconazol, 2 cepas de A. ustus tuvieron CIM de 2 mg/l y 4 mg/l. En el caso de voriconazol, una cepa de A. sclerotiorum y una de A. ustus presentaron CIM de 2 mg/l, y una de A. ustus tuvo una CIM de 4 mg/l.
Discusión
La sensibilidad disminuida o resistencia in vitro de algunas especies de Aspergillus se ha descrito recientemente, pero la amplitud de este problema aún es desconocida. Esta resistencia no se corresponde necesariamente con resistencia in vivo, pues hay que considerar diversas variables inherentes al paciente. No obstante, la concordancia entre los resultados in vitro y la respuesta en modelos animales demuestra que, para algunas especies de Aspergillus, los estudios de sensibilidad, a pesar de sus limitaciones, pueden tener relevancia clínica y ser un instrumento importante para proponer terapias alternativas8-10.
En el año 2002 se aprobó el método de microdilución propuesto por el NCCLS en el documento M38-A, que establece las condiciones óptimas para determinar la sensibilidad de Aspergillus y permite comparar resultados entre varios autores7. Los puntos de corte para predecir la resistencia in vivo no están, sin embargo, definidos todavía. Así, por ejemplo, para el itraconazol, en algunos estudios de correlación in vitro-in vivo se obtiene una adecuada respuesta terapéutica cuando la CIM < 1 mg/l11, pero en otros se clasifica como resistentes sólo a aquellas cepas con CIM ≥ 16 mg/l10. El método Sensititre YeastOne® ha sido evaluado por algunos autores para Aspergillus y encuentran una concordancia superior al 90% para anfotericina B e itraconazol3-6. La concordancia para este último mejora se interpreta como CIM el primer pocillo con completa inhibición del crecimiento (color azul) y si se aplaza la lectura hasta las 72 h, pues parece que los valores de CIM obtenidos a las 48 h son más bajos que los correspondientes al método del NCCLS4,5.
Considerando los resultados obtenidos en nuestro estudio, las especies de Aspergillus menos sensibles a la anfotericina B son: A. flavus, A. versicolor, A. terreus, A. ochraceus, A. sclerotiorum, A. ustus y A. reptans, algunas de ellas implicadas en aspergilosis diseminada. La sensibilidad de las cepas de A. fumigatus es bastante buena, hecho referido también en otros estudios1,5,6,12-16, aunque algunos han documentado en esta especie sensibilidad disminuida in vitro con CIM elevadas4,17-19. Sensibilidad disminuida a la anfotericina B también se ha descrito, al igual que nosotros, en A. flavus4,15-17,20,21, A. versicolor22, A. terreus2,4,16,17, A. nidulans4,21 y A. ustus4. En algunos estudios se ha demostrado resistencia en modelos animales con aspergilosis invasora por A. fumigatus23 y A. terreus24.
En el caso del itraconazol, en nuestro estudio se observa una buena actividad in vitro con CIM bajas frente a la mayoría de las especies de Aspergillus, al igual que han señalado otros autores4,5,13,15. Sin embargo, 2 cepas de A. ustus tuvieron una CIM ≥ 2 mg/l. Algunos estudios previos han comunicado disminución de la sensibilidad in vitro frente al itraconazol en A. fumigatus, A. flavus, A. niger, A. nidulans, A. versicolor y A. ustus, aunque no es un hecho frecuente4,15-20,22,25. Esta resistencia parece ser, en algunos casos, adquirida durante terapia prolongada con este antifúngico, aunque en otros no hay constancia de tratamiento previo, lo que sugiere que se trata de una resistencia primaria, fenómeno posible en especies de Aspergillus1,8,9,26. La resistencia también se ha confirmado en modelos animales10.
Las CIM obtenidas en nuestro estudio frente al voriconazol son, para todas las especies de Aspergillus, inferiores a las correspondientes a la anfotericina B y similares a las encontradas frente al itraconazol, al igual que ha sucedido en otros estudios1,3,13,14,25. Solamente se encuentra una CIM ≥ 2 mg/l en una cepa de A. sclerotiorum y 2 cepas de A. ustus. Las CIM elevadas frente al voriconazol son raras, aunque se han referido en A. fumigatus12,18,19,27, A. flavus12 y A. ustus18. Se ha demostrado que no existe resistencia cruzada entre el voriconazol y el itraconazol en A. fumigatus, lo que sugiere distintos mecanismos de resistencia19,28.
De nuestro estudio y de otros realizados con anterioridad, se deduce que los azoles itraconazol y voriconazol muestran, sin duda, mayor actividad in vitro que la anfotericina B para el conjunto de las especies de Aspergillus.