Introducción
Streptococcus pneumoniae es una de las causas más comunes de infección bacteriana invasiva en niños y de mayor morbimortalidad en todo el mundo, en especial en los países en desarrollo. Es el agente etiológico más frecuente en neumonía extrahospitalaria y una causa importante de meningitis, bacteriemia con o sin endocarditis, sinusitis y otitis media aguda1-4.
En Argentina los serotipos 14, 5, 1, 6A/6B, 7F, 9V, 19F, 19A, 16F y 23F constituyen los más frecuentes entre las cepas que circulan en la población de niños menores de 6 años3.
Si bien desde su introducción, la penicilina ha constituido el tratamiento empírico de elección para estas infecciones, su resistencia se ha diseminado rápidamente a través del mundo en la década de 1980, principalmente en Sudáfrica4, España5, Hungría6, Checoslovaquia7,8, Asia9, Estados Unidos10,11, Australia12 y otros países de Europa13-15. Argentina, que por esa época presentaba, según informes parciales, un 15% de aislamientos con sensibilidad disminuida a penicilina, comunicó hacia mediados de 1990 un incremento a más del 30%16.
Los datos de los que se disponen en Argentina, como los de otros países, indican que las infecciones por neumococos resistentes constituyen un problema creciente, que exige la implementación de medidas de control como la inmunización activa a grupos de riesgo en los que la vacuna tenga eficacia reconocida y sobre todo una racional utilización de los antibióticos4,17-19.
Este trabajo tuvo por finalidad establecer los serotipos predominantes de S. pneumoniae aislados de procesos invasivos en nuestra región y determinar el perfil de sensibilidad a distintos antimicrobianos para establecer pautas de tratamiento empírico en el Hospital de Pediatría de Misiones y evaluar la probable eficacia del uso de las vacunas conjugadas en esta población.
Métodos
El Hospital Provincial de Pediatría de Misiones (HPPM; Posadas, Argentina), actúa como centro de referencia en la región. Cuenta con 100 camas, y recibe derivaciones de otras localidades de Misiones, como también del norte de la provincia de Corrientes, y del sur de la República de Paraguay.
Se estudiaron cepas de S. pneumoniae aisladas de procesos invasivos de 101 pacientes pediátricos (> 1 mes y < 14 años) que fueron ingresados por diferentes procesos en el HPPM durante el período comprendido entre el 1 de junio de 1998 y el 30 de junio de 2001. La población fue clasificada en lactantes (< 2 años), preescolares (> 2-4 años) y escolares (> 5 años).
Las cepas estudiadas, consecutivas y no relacionadas, fueron aisladas de los siguientes materiales: líquido cefalorraquídeo (LCR), líquido pleural, hemocultivos, líquido ascítico y otros líquidos estériles. Las muestras se inocularon en placas de agar sangre de carnero al 5% (base Tripticasa Soja: Britania S.A., Buenos Aires, Argentina), agar chocolate (base Columbia, Britania), caldo tioglicolato (Britania) y caldo sangre de carnero al 5% (base caldo tripteína Soya, Britania). La incubación se efectuó en atmósfera de 5% de dióxido de carbono, a 35 °C durante 24-48 h. Se evaluaron las colonias con morfología característica, y se identificaron como neumococo por medio de la sensibilidad con el disco de optoquina (Britania) y la solubilidad en sales biliares (Merck, Darmastadt, Alemania)2,18.
Las pruebas de sensibilidad a los antimicrobianos se efectuaron por los métodos de difusión con discos y de macrodilución en caldo, siguiendo las pautas del National Committee for Clinical Laboratory Standards (NCCLS) 20.
Por método de difusión se ensayaron rifampicina (5 μg, oxacilina (1 μg), eritromicina (15 μg), cloranfenicol (30 μg), vancomicina (30 μg), trimetoprima-sulfametoxazol (1,25/ 23,75 μg), ofloxacino (5 μg) y tetraciclina (30 μg), utilizándose monodiscos de Lab. Britania, Buenos Aires, Argentina; y por el método de macrodilución, penicilina (Richet, Buenos Aires, Argentina) y cefotaxima (Argentia, laboratorios Bristol-Myers Squibb, Buenos Aires, Argentina).
El control de calidad de ambos métodos se realizó utilizando la cepa de referencia S. pneumoniae ATCC 4961920.
Las cepas se enviaron al Instituto Nacional de Enfermedades Infecciosas (INEI-ANLIS) Dr. Carlos G. Malbrán, para su confirmación de especie y determinación de serotipo y factor. El serotipo se determinó por la técnica de Quellung, utilizando antisueros específicos producidos por el Statens Seruminstitut (Copenhagen, Dinamarca).
La conservación de los microorganismos se realizó mediante suspensión en leche descremada al 10%, a 20 °C.
Se utilizó el programa Epi-info versión 6 para la recogida de los datos de cada paciente, así como para evaluar los resultados obtenidos por el laboratorio. Se consideró estadísticamente significativo un valor de p < 0,05.
Resultados
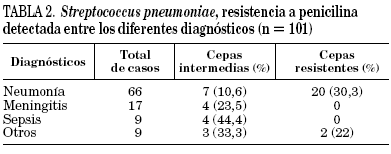
Las 101 cepas de S. pneumoniae fueron aisladas de: LCR (16,8%); líquido pleural (31,7%); hemocultivos (47,5%), y otras muestras (líquido ascítico, punción de hematoma, líquido pericárdico, punción de válvula hidrocefálico, 3,9%). Los diagnósticos correspondieron a: meningitis, 17 (16,8%); neumonía con o sin derrame, 66 (65,3%); sepsis, 9 (8,9%), y otros (artritis, pericarditis, peritonitis, fiebre de origen desconocido, hidrocefalia), 9 (8,9%). El 74% de los niños eran lactantes; el 17%, preescolares, y el 9%, escolares. El 62% de las neumonías, el 70% de las neumonías con derrame, el 70% de las meningitis y el 78% de las sepsis se diagnosticaron en niños menores de 2 años de edad.
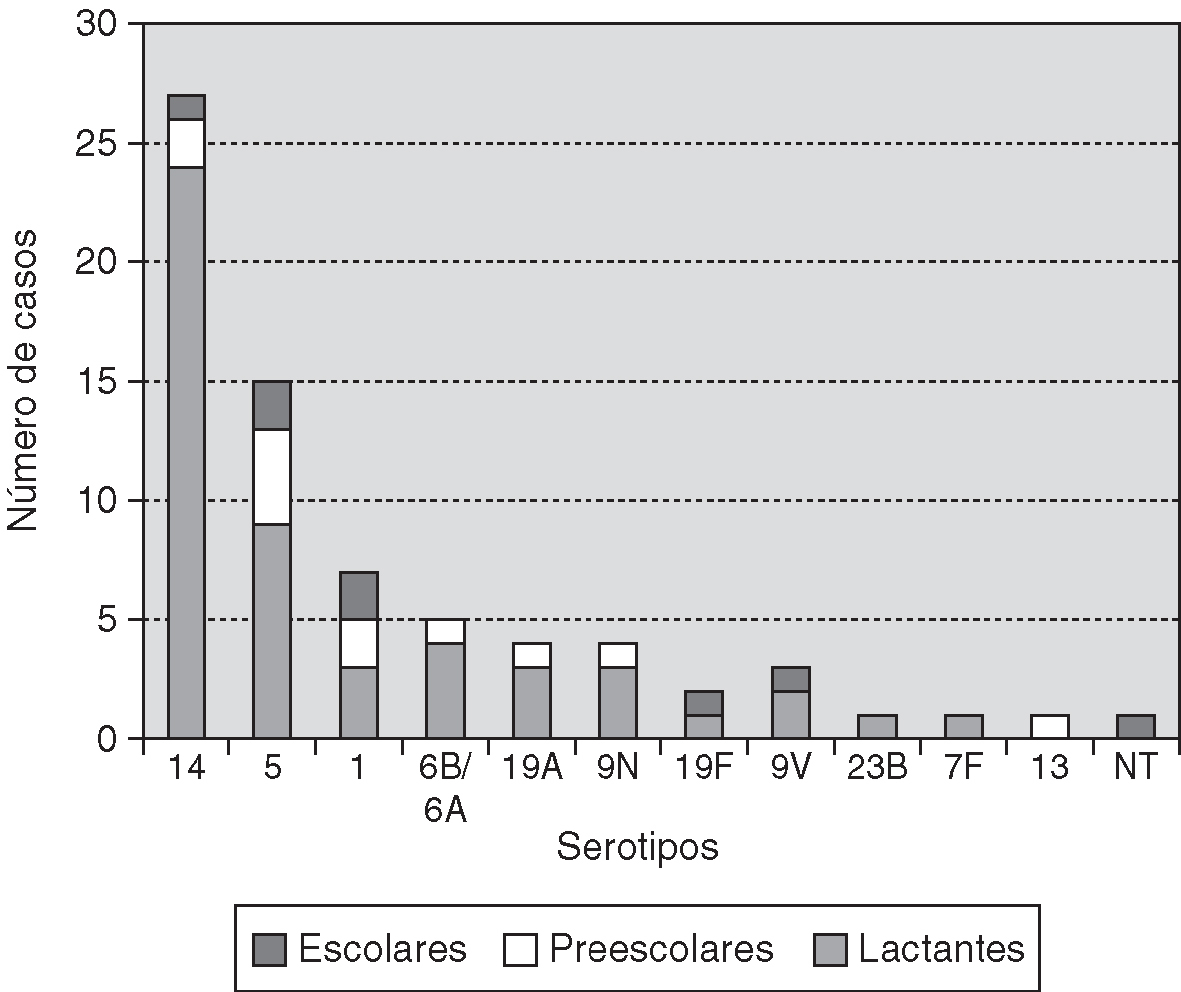
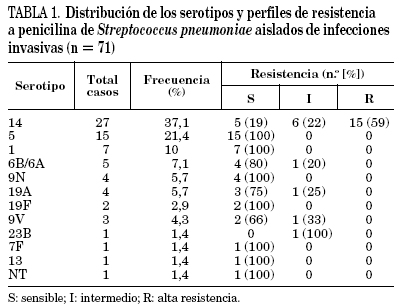
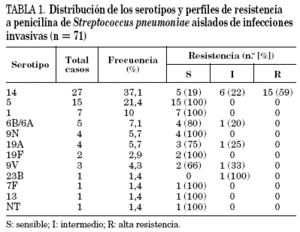
De los 101 aislamientos, se enviaron 71 para serotipificar, detectándose 12 serotipos diferentes. Una cepa resultó no tipificable. La frecuencia de los mismos y la distribución por grupos de edad se muestran en la figura 1. Para los propósitos de este estudio, los serotipos 6A y 6B se evaluaron juntos (6A/6B). El serotipo 14 fue el detectado con más frecuencia entre los lactantes, mientras que los serotipos 5, 14 y 1, sin diferencias significativas, fueron los prevalentes entre los niños mayores. No se observó asociación entre diagnósticos de meningitis o neumonía y serotipo aislado.
Figura 1. Distribución de serotipos de S. pneumoniae aislados de infecciones invasivas (n = 71) según grupos de edad.
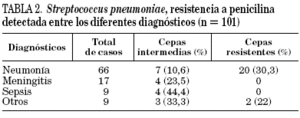
La resistencia a penicilina se detectó en el 39% de los 101 aislamientos, quedando circunscrita a cinco serotipos. El 84% de la misma correspondió al serotipo 14. Se detectaron niveles intermedios de resistencia en el 17,5% de los casos (18 cepas) y altos niveles en el 21,5% (22 cepas). Para ningún aislamiento la CIM a PEN fue superior a 4 μg/ml (tablas 1 y 2).
Se observó mayor resistencia en los aislamientos de niños menores de 2 años (42%, 32 niños) respecto a la de los otros grupos de edad (29%, 8 niños), sin detectarse diferencias significativas. La edad promedio de los pacientes con cepas resistentes a penicilina fue de 1,8 ± 0,3 años, y la de los niños con cepas sensibles a penicilina fue 2,6 ± 0,5 años. Del total de pacientes en los que se aisló S. pneumoniae resistente a penicilina, en el 67% el diagnóstico fue neumonía (27/40), mientras que en el 10% fue meningitis (4/40).
De los 71 aislamientos en los cuales se efectuó CIM a cefotaxima, 50 presentaron un valor igual o menor a 0,5 μg/ml; 18 cepas, 1 μg/ml, y 3 cepas, 2 μg/ml. No se detectaron valores de CIM superiores.
Entre las 10 cepas aisladas de cuadros meníngeos, ocho fueron sensibles y dos presentaron CIM a cefotaxima de 1 μg/ml. Éstas correspondieron al serotipo 14 y se aislaron de lactantes.
De los 61 aislamientos extrameníngeos, 58 fueron sensibles a cefotaxima y 3 cepas presentaron CIM de 2 μg/ml. Estas 3 cepas, clasificadas con resistencia intermedia, pertenecieron al serotipo 14 y se aislaron de pacientes lactantes con cuadros de neumonía.
No se aislaron cepas sensibles a penicilina que fueran resistentes a cefotaxima.
Sobre 101 cepas ensayadas, se observaron los siguientes perfiles de resistencia: eritromicina (6,8%); cloranfenicol, (11%); trimetoprima-sulfametoxazol (48%); tetraciclina (22%); no se detectó resistencia a vancomicina, rifampicina y ofloxacino.
El 48% de los neumococos tuvo resistencia al menos a uno de los antimicrobianos probados. Del total de las cepas resistentes a penicilina, el 51% lo fue a más de un antibiótico y el 33% de éstas fue multirresistente, comprometiendo a tres o más compuestos. Una cepa presentó resistencia a cinco antimicrobianos de los nueve estudiados (penicilina, cefotaxima, trimetoprima-sulfametoxazol, tetraciclina y cloranfenicol).
Entre las cepas no sensibles a penicilina, el patrón de resistencia combinada más frecuente fue penicilina, trimetoprima-sulfametoxazol (8 aislamientos, 20%) seguido de penicilina-cefotaxima-trimetoprima-sulfametoxazol (7%, 3 aislamientos con CIM a cefotaxima = 2 μg/ml) y penicilina-trimetoprima-sulfametoxazol,-CMP (2 aislamientos, 5%).
Discusión
Se han publicado numerosos estudios sobre la distribución de tipos capsulares de neumococos provenientes de procesos invasivos, que demuestran las variaciones en diferentes zonas geográficas. Los datos actualizados en Argentina pueden no reflejar la realidad de nuestra área, considerando la irregular distribución de la población en el país21-25. La provincia de Misiones se encuentra ubicada en el extremo nordeste de la república, con una extensión de 29.801 km2 y 961.000 habitantes, y no presenta centros de gran densidad poblacional.
El serotipo 14, con una frecuencia del 38% en este trabajo, es el de mayor predominio en nuestro país y, salvo algunas diferencias regionales, también en Brasil y Uruguay3,24,26. Este serotipo está ampliamente distribuido en el mundo entero, siendo (con algunas excepciones como España o Pakistán) uno de los más prevalentes. Los tipos 1 y 5, que casi no se aíslan en Estados Unidos y España, ocupan el segundo y tercer lugar entre los niños de Argentina, al igual que en este estudio, seguidos en orden de importancia por los serotipos 6A/6B.3,5,10,11.
Ningún aislamiento correspondió al serotipo 23F. Éste, usualmente asociado con resistencia a penicilina, es frecuente en países como México o Colombia, pero es infrecuente entre los niños de Argentina y el cono sur de América Latina3,16,26.
En este trabajo y en coincidencia con autores argentinos observamos diferencias significativas entre los tipos capsulares detectados en los lactantes y los niños mayores3. En concordancia con investigadores brasileños24 y argentinos3, entre los lactantes predominó el serotipo 14. Sin embargo, en los niños mayores no se detectaron variaciones significativas entre los serotipos 5, 14 y 1.
Según esta información epidemiológica, la vacuna heptavalente disponible en el mercado tendría una cobertura teórica frente al 60% de los serotipos causantes de enfermedad invasiva en niños menores de 2 años de edad en nuestro medio.
Entre 1993 y 1998 varios grupos de trabajo latinoamericanos han publicado datos sobre la variación de los niveles de resistencia a penicilina en cepas de neumococos causantes de enfermedad invasora en población pediátrica26,27. En 1998 la resistencia global a este antimicrobiano alcanza un 34,2%, que oscila entre el 22,3% en Brasil al 49,4% en México. En este período, se publicó en Argentina un incremento del 22 al 45%21.
Los perfiles detectados en este estudio resultan similares a los de otros autores del país21,27 y extranjeros6,12,26. La resistencia de bajo nivel (categoría clínica de intermedio) a cefotaxima cercana al 4% entre los cuadro extrameníngeos es inferior a la publicada para toda la Argentina21. En nuestro hospital, la incidencia de este perfil entre aislamientos de pacientes con diagnóstico meningitis, y al igual que en otros centros pediátricos nacionales27, sigue siendo baja. Se ha observado una marcada asociación entre resistencia a penicilina y a cefalosporinas de tercera generación en todo el mundo28,29. Nuestros hallazgos refrendan esos resultados. No se ha observado ninguna cepa con resistencia, en sentido estricto, a cefotaxima.
Las primeras cepas de neumococo con resistencia múltiple se encontraron en la población pediátrica. Desde entonces, se ha observado que éstas son más comunes en niños que en adultos. La razón de esta asociación no está clara, pero probablemente refleje el amplio uso de antibióticos16,17.
En cuanto a los antimicrobianos no betalactámicos, los niveles de resistencia a eritromicina, trimetoprima-sulfametoxazol y rifampicina resultaron similares a los comunicados para el país, siendo nuestros hallazgos mayores para cloranfenicol y tetraciclina21.
Si bien se han informado aislamientos resistentes a fluoroquinolonas30, no se han detectado cepas resistentes a ofloxacino en este trabajo.
Al igual que lo observado por Culasso et al27 del Hospital de Niños de Córdoba (Argentina)27, el patrón de resistencia combinada más frecuente encontrado entre las cepas no sensibles a penicilina en este estudio, fue penicilina-trimetoprima-sulfametoxazol (20%), seguido de penicilina-trimetoprima-sulfametoxazol-cefotaxima (7%), si bien ninguna de las 3 cepas presentó resistencia estricta a cefotaxima.
Con este estudio se ponen en evidencia los perfiles de resistencia de nuestra zona, llevando la necesidad de adecuar los esquemas terapéuticos a la realidad local, que mediante el uso racional de los antibióticos permitirá frenar el aumento alarmante de cepas resistentes a diversos fármacos.
Además de la falta de recursos en los hospitales que impide la toma de hemocultivos en todos los pacientes que llegan con síntomas de neumonía o meningitis, los problemas en el aislamiento, cultivo e identificación de S. pneumoniae contribuyen a la falta de información y a la poca recuperación de esta bacteria. El empleo indiscriminado de antimicrobianos y la falta de un control de calidad estricto en los medios de cultivo favorecen aún más una recuperación pobre y, por lo tanto, un estudio muy limitado de la sensibilidad antimicrobiana. Los pocos fármacos para tratar el creciente número de cepas multirresistentes, la frecuencia de infecciones respiratorias y meningitis causadas por los neumococos en niños, sanos, la presencia y gravedad de estas infecciones en recién nacidos, adultos y pacientes inmunodeprimidos, así como el aumento en la prevalencia de esta bacteria, hace que el desarrollo de una vacuna efectiva sea una prioridad.
Agradecimientos
Este estudio se ha realizado con la colaboración del personal del laboratorio de bacteriología del Hospital Provincial de Pediatría de Misiones: Bqco. Marcelo Salvi, Ramón Castillo, Elida Horodeski, Gustavo Maciel, Delia Villalba y de la División Bacteriología clínica del INEI ANLIS Dr. Carlos G. Malbran: Elsa Chávez y Cristina Correa. Agradecemos a la Prof. Mary M. Kuhlmann su asesoramiento en la traducción al inglés.