Los constantes flujos migratorios han favorecido la presencia de personas con la enfermedad de Chagas en regiones clásicamente consideradas como no endémicas, como Estados Unidos, Europa, Asia y Oceanía. Este hecho ha obligado tanto a las autoridades sanitarias como a los profesionales a tener que actualizarse para poder dar respuesta a tal demanda asistencial. Los últimos años han supuesto un gran avance tanto en el campo del diagnóstico como del tratamiento de la enfermedad de Chagas, una de las enfermedades tropicales más olvidadas. Ensayos clínicos recientes están arrojando nuevas evidencias que hacen que el manejo de estos pacientes sea un desafío constante para los profesionales involucrados. Novedosas herramientas diagnósticas y esquemas terapéuticos hacen que veamos el futuro de la enfermedad de Chagas con optimismo.
The constant migration flows have favored the presence of people with Chagas disease in regions traditionally regarded as non-endemic, such as North America, Europe, Asia and Oceania. This has forced both health authorities and professionals to be updated in order to respond to such a demand for assistance. Recent years have led to significant progress in the field of diagnosis and treatment of Chagas disease, one of the most neglected tropical diseases. Recent clinical trials are providing new evidence that makes the management of these patients, a constant challenge for the professionals involved. Innovative diagnostic tools and therapeutic regimens, allow us to face the future of Chagas disease with optimism.
Más de 100 años después de su descubrimiento, la enfermedad de Chagas continúa siendo un reto para los profesionales de la salud.
Los avances tecnológicos y los cambios sociodemográficos han supuesto un revulsivo sin precedentes tanto para la visibilidad de la enfermedad como para la generación de conocimiento sobre una de las enfermedades más olvidadas.
Causada por el protozoo Trypanosoma cruzi, la enfermedad de Chagas implica a numerosos reservorios animales (domésticos y selváticos). La enfermedad se transmite principalmente a través de un insecto vector (más de 150 especies de triatominos están implicadas), de madres a hijos, a través de transfusión de hemoderivados y de trasplante de tejidos no controlados y por ingesta de alimentos contaminados (zumos de frutas principalmente). Si a estos factores relativos a la biodiversidad de la enfermedad se le añaden los últimos flujos migratorios, las rutas comerciales de los actuales países emergentes y la modernización de los métodos de transporte, es fácil entender la dificultad en controlar esta enfermedad y el efecto de la globalización en su distribución.
Cambios en la epidemiología de la enfermedad. ¿Países endémicos y no endémicos?Desde su establecimiento como antropozoonosis hace más de 8.000 años en el continente americano hasta la fecha actual, se han sucedido diversos eventos que finalmente han acabado de modelar el panorama actual de la enfermedad de Chagas tanto a nivel clínico como su presencia fuera del continente latinoamericano1. Inicialmente la enfermedad se consideraba circunscrita a la América continental, afectando a una población en la que, al igual que otras enfermedades tropicales desatendidas, se cebaba con los más desfavorecidos, encontrando en las áreas rurales su mayor prevalencia. Con el progresivo desarrollo económico y las mejoras paulatinas de las condiciones de vida, las personas afectadas por la enfermedad de Chagas han experimentado una mayor esperanza de vida, un mejor acceso a los sistemas de salud y una coexistencia con otras enfermedades crónicas y estados de inmunosupresión (virus de la inmunodeficiencia humana [VIH], tratamientos citostáticos, etc.)2. Estos factores acabarán modulando la expresividad clínica de la enfermedad.
Finalmente, en las últimas décadas los flujos migratorios han favorecido la presencia de pacientes con enfermedad de Chagas en todos los continentes, excepto en África, aunque posiblemente sea cuestión de tiempo ser testigo de la primera notificación en esta región.
Según las últimas estimaciones realizadas por la OMS, basadas en datos del 2010, casi 6 millones de personas están infectadas por T.cruzi en los 21 países de América Latina, de los cuales dos terceras partes son países pertenecientes al Cono Sur3. Los países con más casos estimados en valores absolutos serían Argentina, Brasil y México, seguido de Bolivia. Si tenemos en cuenta las vías de transmisión, Bolivia, Argentina y Paraguay (en concreto una amplia región conocida como el Gran Chaco) liderarían los países con mayor número de casos adquiridos por transmisión vectorial; en cambio, Argentina, México y Colombia serían los países con mayor número de casos estimados debidos a transmisión vertical.
De manera global, el 13% de toda la población latinoamericana está en condiciones de riesgo de adquirir la enfermedad de Chagas.
Si se comparan estas cifras con las estimaciones realizadas por la OMS en base a los datos de 2005, se observa una importante reducción de los casos estimados: de 8 a 6 millones de personas infectadas4. Al margen de las posibles diferencias metodológicas entre los 2 informes, destaca la notable reducción observada en ese periodo de 5años. Sería difícil identificar un único motivo que explicase esa reducción; la mejora de las condiciones de vida, un mejor acceso a los sistemas de salud y la implementación de programas de control vectorial y de seguridad transfusional han contribuido sin duda alguna a evitar nuevas infecciones.
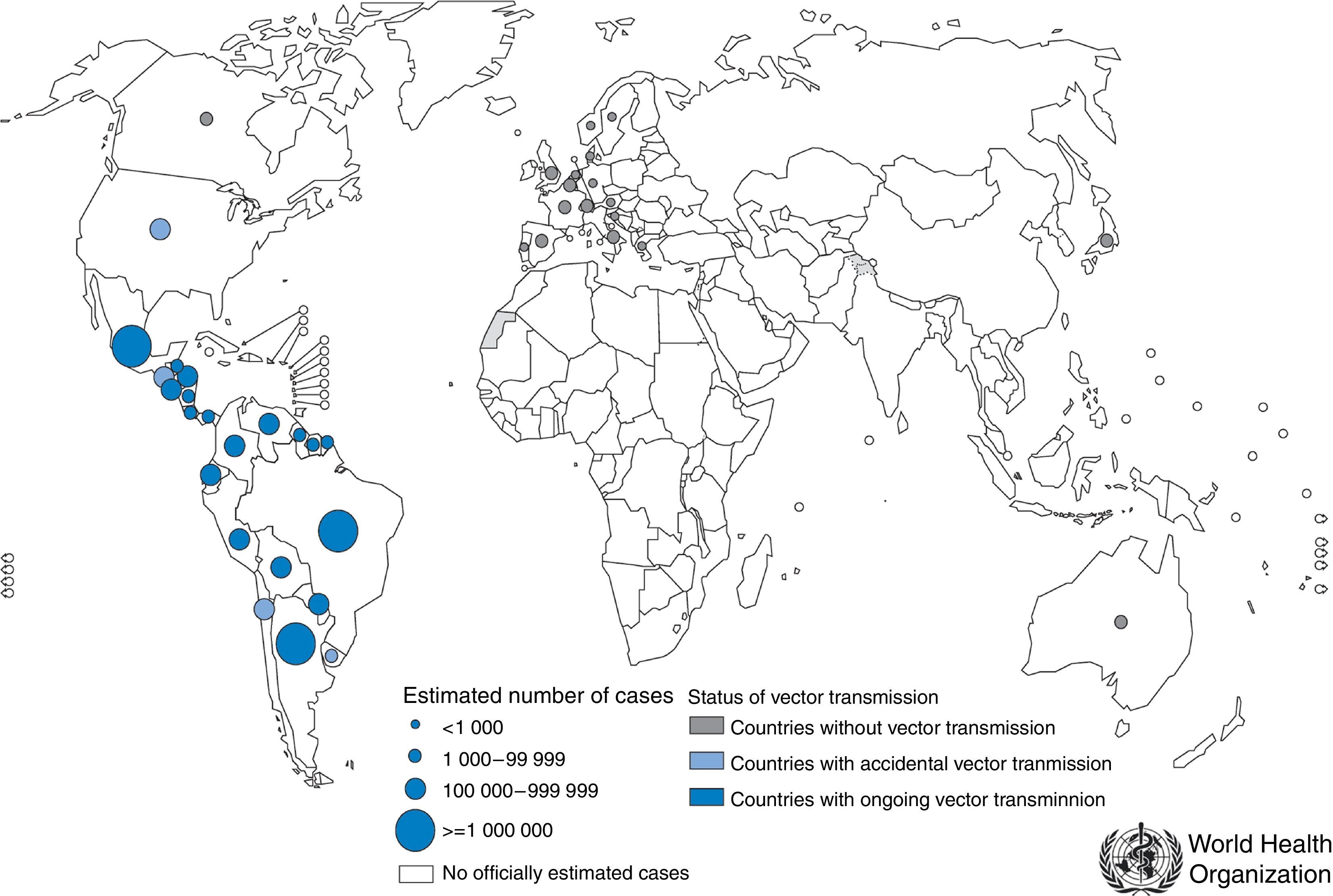
De manera concomitante, uno de los hechos más destacables de los últimos años es la presencia de pacientes infectados por T.cruzi en países clásicamente considerados como no endémicos, y por tanto el riesgo añadido de transmisión en estas regiones, independientemente de la presencia del vector transmisor. Europa y Estados Unidos son las zonas con mayor número de casos estimados, aunque también se han documentado casos en Asia y en Oceanía5-8 (fig. 1).
Distribución de la enfermedad de Chagas.
Fuente: imagen obtenida de: http://gamapserver.who.int/mapLibrary/app/searchResults.aspx.
A pesar de contar con la presencia de personas infectadas en diferentes regiones del planeta, los esfuerzos por parte de gobiernos y agencias de salud pública son heterogéneos y en muchas ocasiones insuficientes para prevenir nuevos casos en estas áreas. Posiblemente España sea uno de los países donde exista un mejor escenario en cuanto a estrategias de prevención. Las donaciones de sangre y tejidos son sometidas a un cribado regulado por un decreto ley; en cambio, los programas de prevención de la transmisión vertical recaen sobre regulaciones regionales, garantizando un adecuado manejo de los casos en el territorio, como es el caso de Cataluña, Comunidad Valenciana y Galicia, o sobre iniciativas locales de centros hospitalarios9.
De manera paralela a los flujos migratorios de las personas afectadas por la enfermedad de Chagas, los vectores susceptibles de transmitir la enfermedad también se han distribuido por todo el mundo aprovechando las cada vez más frecuentes rutas comerciales, sobre todo marítimas10.
Ante esta situación en que existen regiones donde se pueden dar nuevos casos de enfermedad de Chagas sin intervención vectorial (transmisión vertical, transfusional, por trasplante), cabe preguntarse hasta cuándo debemos seguir hablando de regiones endémicas y no endémicas.
ClínicaLa enfermedad de Chagas se divide en fase aguda y fase crónica. Se considera fase aguda desde la infección hasta que la parasitemia detectada microscópicamente es negativa. La clínica se inicia entre 7 y 10días tras la infección por T.cruzi, y consiste normalmente en síntomas leves e inespecíficos que se asemejan a un cuadro gripal (fiebre, malestar general, hepatoesplenomegalia11. En la mayor parte de los casos la fase aguda pasa desapercibida. En contadas ocasiones pueden aparecer lesiones cutáneas que indican el lugar de la inoculación, tales como nódulos cutáneos, conocidos como chagoma de inoculación, o un edema bipalpebral unilateral con conjuntivitis, que se denomina signo de Romaña. La muerte en la fase aguda es extremadamente rara y ocurre principalmente por miocarditis o meningoencefalitis, siendo más frecuente en pacientes inmunodeprimidos o en etapas tempranas de la vida. En la transmisión vertical la clínica no difiere de la que se observa si la infección se produce por vía vectorial; sin embargo, en los casos de transmisión oral, que normalmente ocurren en forma de brote, se han descrito cifras algo superiores de complicaciones agudas graves12.
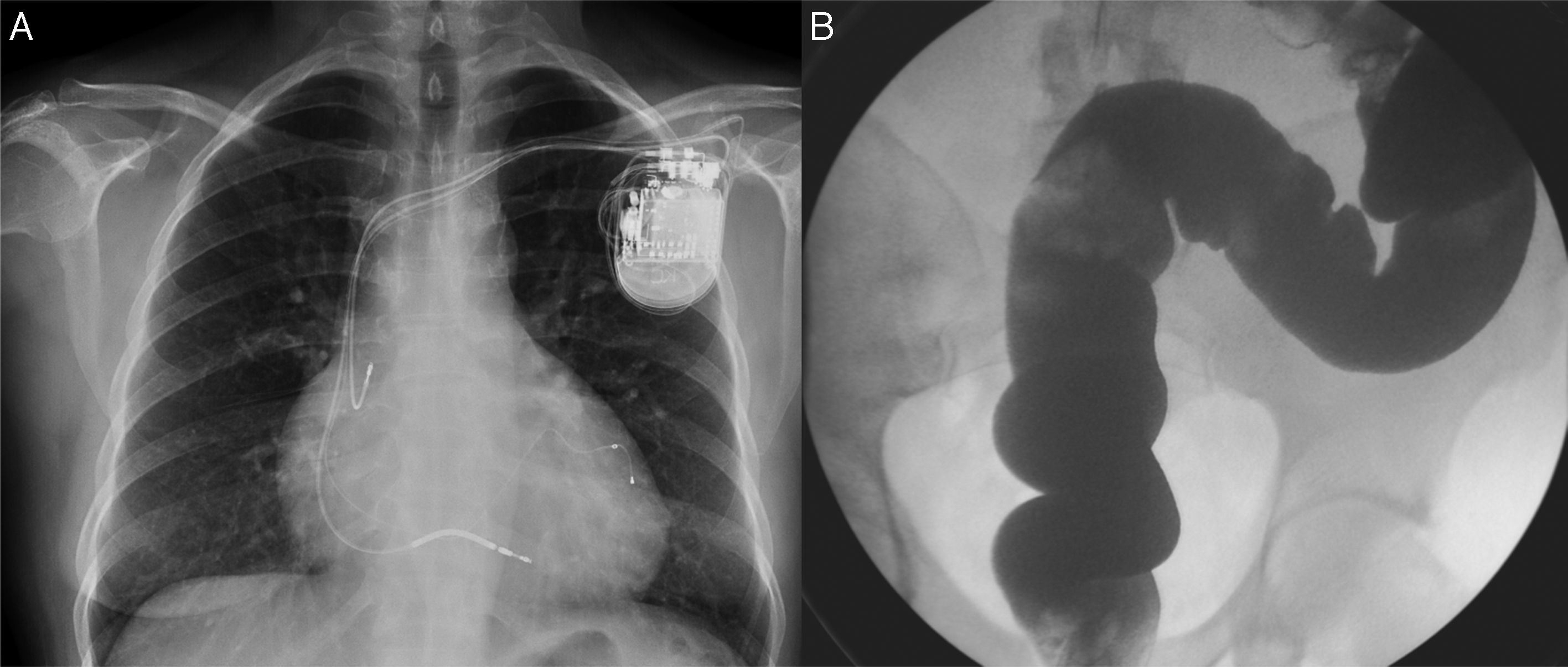
La fase crónica se inicia cuando la parasitemia detectada microscópicamente es negativa y las pruebas serológicas son positivas, lo que ocurre aproximadamente 1-2meses después de la infección. Durante la fase crónica la mayor parte de los pacientes están asintomáticos, lo que se conoce como forma indeterminada. Sin embargo, un porcentaje variable de pacientes desarrollan complicaciones décadas después de la infección, predominantemente con afectación cardíaca, digestiva o mixta5 (fig. 2).
Las manifestaciones clínicas de la enfermedad van a estar condicionadas por varios aspectos, pero posiblemente la variabilidad genética del parásito va a ser uno de los principales moduladores de la expresión clínica13. Se calcula que alrededor del 40 al 60% de los pacientes con enfermedad de Chagas desarrollarán cardiopatía chagásica14. En los países endémicos se ha descrito mayor porcentaje de cardiopatía que en países no endémicos con inmigrantes de zonas endémicas. Numerosos factores pueden intervenir en este hecho (edad de los pacientes, reinfecciones, variabilidad de los países de origen de los pacientes, etc.).
La patogenia de la cardiopatía todavía no está bien esclarecida. Una respuesta inmunológica descontrolada y el constante daño directo del parásito producen un daño microvascular, en los miocardiocitos y en el tejido nervioso que terminan causando trastornos del ritmo, zonas de fibrosis y dilataciones cardíacas.
El principal hallazgo de la cardiopatía chagásica son los trastornos electrocardiográficos tales como hemibloqueo anterior o posterior, bloqueo de rama derecha, bloqueo de rama izquierda, extrasístoles ventriculares, bloqueos auriculoventriculares, alteraciones del ST, presencia de ondas Q anómalas, bradicardia, bajo voltaje del QRS, arritmias auriculares. Otras alteraciones eléctricas, aunque menos frecuentes, son mucho más graves, entre ellas las taquicardias ventriculares (sostenidas y no sostenidas), la fibrilación auricular y la muerte súbita de origen cardíaco.
Por otro lado, la enfermedad de Chagas puede producir una miocardiopatía dilatada que desencadenará una insuficiencia cardíaca progresiva. El tratamiento de la miocardiopatía dilatada es similar al de otras cardiopatías, y consiste por un lado en el tratamiento de la insuficiencia cardíaca y, por otro, en evitar las arritmias ventriculares malignas mediante fármacos antiarrítmicos y desfibriladores implantables15. Habitualmente, cuando los pacientes presentan una miocardiopatía dilatada las alteraciones electrocardiográficas están establecidas, por lo que el electrocardiograma es una buena herramienta de cribado de cardiopatía chagásica16. Las principales alteraciones ecocardiográficas que se encuentran en los pacientes con cardiopatía chagásica son una fracción de eyección deprimida, alteraciones segmentarias de la contractilidad miocárdica y aumento del diámetro telediastólico del ventrículo izquierdo. Un hallazgo muy sugestivo de cardiopatía chagásica en el ecocardiograma es la presencia de aneurismas apicales.
La mortalidad asociada a la cardiopatía chagásica es de aproximadamente el 3,9% al año, pero depende de la severidad de la cardiopatía. Por regla general, la mortalidad de la miocardiopatía dilatada de origen chagásico es mayor que la de la miocardiopatía dilatada de otra etiología17.
A nivel gastrointestinal, la enfermedad de Chagas puede afectar a cualquier parte del tubo digestivo, siendo las localizaciones más afectadas el colon y el esófago. La frecuencia con la que produce afectación digestiva varía entre el 5 y el 35%, y al igual que la afectación cardíaca, la proporción observada en países no endémicos es menor que en los países de origen5.
La patogenia detrás de la afectación digestiva es una pérdida del sistema nervioso entérico (tanto del sistema excitatorio como del inhibitorio), lo que da lugar a trastornos motores y dilataciones localizadas.
La disfagia es el principal síntoma de la afectación esofágica y suele aparecer cuando existe una dilatación esofágica evidente18. Estructuralmente la dilatación esofágica de origen chagásico es similar a la acalasia idiopática, pero a diferencia de esta, la presión del esfínter esofágico inferior no se encuentra alterada19. La exploración más utilizada para valorar la afectación esofágica es el tránsito esofagogástrico. Otras exploraciones, como la manometría esofágica, se utilizan en casos dudosos o con fines de investigación.
Los pacientes con afectación colónica por la enfermedad de Chagas presentan estreñimiento progresivo, y en el estudio baritado se observa dilatación colónica o megacolon. Tanto el recto como el sigma están afectados en la mayor parte de los pacientes con afectación colónica. La afectación de áreas colónicas más proximales es infrecuente20.
Otra complicación asociada con la enfermedad de Chagas es el aumento del riesgo de padecer eventos tromboembólicos que ocurre principalmente por la formación de trombos en los pacientes con miocardiopatía dilatada, aneurismas o fibrilación auricular. En algunas ocasiones el ictus es la primera manifestación de la enfermedad de Chagas, por lo que siempre se tiene que descartar la enfermedad de Chagas en un paciente de zona endémica que padezca un accidente cerebrovascular21.
DiagnósticoEl diagnóstico de la enfermedad de Chagas depende en gran medida de la fase de la enfermedad en que se encuentre el paciente. En la fase aguda de la enfermedad, en la forma congénita y en la reactivación durante la fase crónica (fundamentalmente en situaciones de inmunosupresión), la parasitemia es elevada, por lo que el diagnóstico se basa en la detección del parásito por métodos directos en sangre periférica y, de manera excepcional, en otros fluidos corporales como el líquido cefalorraquídeo22. La microscopia directa de sangre periférica en fresco permite visualizar al tripomastigote en movimiento. También se pueden realizar diferentes tinciones (Giemsa) sobre extensión periférica o gota gruesa de sangre periférica. La sensibilidad se puede incrementar mediante técnicas de concentración, como son el microhematocrito o el método de Strout. Otras técnicas cada vez más en desuso incluyen el hemocultivo y el xenodiagnóstico, técnicas que están solo disponibles en laboratorios especializados y que se emplean para investigación23.
En la fase crónica de la enfermedad la parasitemia disminuye drásticamente, por lo que el diagnóstico se basa en la detección de anticuerpos IgG anti-T.cruzi (diagnóstico serológico), ya que los métodos parasitológicos directos suelen ser negativos en un 30 a 60% de los pacientes. Las técnicas serológicas utilizan como antígenos tanto el parásito completo o extractos purificados (pruebas convencionales), como antígenos recombinantes o péptidos sintéticos (pruebas no convencionales). Las técnicas más empleadas son la inmunofluorescencia indirecta (IFI), la hemoaglutinación indirecta (HAI) y el enzimoinmunoanálisis (ELISA), siendo esta última la que alcanza valores más óptimos de sensibilidad y especificidad24. Sin embargo, dado que ninguna de las pruebas alcanza un 100% de sensibilidad y especificidad, la OMS define el diagnóstico de enfermedad de Chagas en su fase crónica mediante la positividad de 2 pruebas serológicas realizadas por métodos diferentes22. En caso de discordancia, se deberá realizar una tercera prueba para confirmar o descartar la infección, como puede ser la técnica de Western blot. Estas discordancias pueden deberse a reacciones cruzadas con otros protozoos hemoflagelados, como Leishmania spp. o Trypanosoma rangeli25. Se han desarrollado algunos test de diagnóstico rápido basados en técnicas inmunocromatográficas que pueden ser de utilidad en áreas con difícil acceso al sistema sanitario o en situaciones de cribado masivo26.
En las últimas décadas, la detección de ADN de T.cruzi en sangre periférica mediante la reacción en cadena de la polimerasa (PCR) se ha utilizado cada vez más. Las dianas más utilizadas son la región variable del ADN del minicírculo del kinetoplasto, secuencias repetidas en el ADN satélite o genes del ARN ribosomal27. En la fase aguda de la enfermedad o en la reactivación durante la fase crónica ha resultado ser de gran utilidad, ya que tiene una sensibilidad mayor que las técnicas parasitológicas clásicas28. El papel de la PCR en la fase crónica de la enfermedad de Chagas está más discutido, ya que resulta positiva en el 40-70% de los pacientes dependiendo de los estudios, con una gran variabilidad dependiendo de diferentes factores: el grado de parasitemia del paciente, el volumen y procesado de la muestra, la diana de la técnica, las características de la población en la que se realiza. Por otro lado, un resultado negativo no excluye la infección29. La PCR está siendo cada vez más utilizada para monitorizar la eficacia del tratamiento y para la evaluación de nuevos tratamientos en ensayos clínicos, ya que la positividad de la técnica tras la finalización del tratamiento indicaría un fracaso terapéutico30-32.
Tratamiento actual y futuro escenario terapéuticoEl tratamiento etiológico de la enfermedad de Chagas se sigue basando en 2 medicamentos desarrollados hace más de 40años: el benznidazol y el nifurtimox33.
Las tasas de respuesta terapéutica están en función sobre todo de la fase de la enfermedad y de la zona geográfica. En la fase aguda de la enfermedad ambos medicamentos presentan una aceptable tasa de curación, entre el 65 y el 80% de los pacientes, llegando a tasas por encima del 95% en casos de transmisión congénita tratados de manera precoz34,35.
En los casos de infección crónica se consiguen tasas de curación entre el 15 y el 40%, aunque con un grado de evidencia mucho menor36.
Además de esas pobres tasas de curación, una de las principales limitaciones que presentan estos medicamentos es la importante tasa de efectos adversos que experimentan los pacientes. La gravedad de estos lleva a la retirada permanente del tratamiento en el 6 al 40% de los pacientes que reciben nifurtimox y en el 7 al 30% de los que recibieron benznidazol. En base a su relativo mejor perfil tóxico y experiencia acumulada, el benznidazol se considera el estándar de tratamiento actual36.
El espectro de toxicidad del benznidazol es muy variado. En función de sus manifestaciones clínicas se podrían clasificar en reacciones de hipersensibilidad, digestivas, neurológicas y de carácter general37.
Las reacciones de hipersensibilidad como la dermatitis, el prurito, las linfadenopatías, el edema, la fiebre y, en algunos casos, la anafilaxia son las más frecuentes (alrededor del 50% de los pacientes las van a padecer); suelen aparecer entre los 7 y 20días de tratamiento y son las que motivan la gran mayoría de retiradas del tratamiento.
Las manifestaciones digestivas comprenden principalmente náuseas, vómitos y epigastralgia, y pueden llegar a aparecer en hasta el 20% de los pacientes.
Los síntomas de carácter general son también frecuentes: aparecen en el 30% de los casos, y los más habituales son cefalea, somnolencia y dolores musculares, que no suelen condicionar la suspensión del tratamiento.
Los eventos adversos dentro de la esfera neurológica se manifiestan principalmente en forma de parestesias y disgeusia. A pesar de no conocerse bien la etiopatogenia de esta toxicidad, se asume que es por un efecto acumulativo de dosis y, por tanto, suelen aparecer durante el segundo mes de tratamiento.
El objetivo del tratamiento, al igual que en otras infecciones, es la eliminación del parásito y la resolución de los síntomas. Precisamente una de las grandes dificultades es evaluar la curación de los pacientes tratados. El único criterio aceptado es la negativización de las serologías. En pacientes afectos de la enfermedad de Chagas en su fase crónica, el tiempo necesario hasta la negativización puede ser de hasta 20años, haciendo muy complicado el seguimiento de los pacientes y dificultando la evaluación de nuevos fármacos en ensayos clínicos22.
A pesar de las tasas de curación tan discretas en fase crónica y del perfil tóxico de los medicamentos, las recomendaciones actuales abogan por ofrecer tratamiento a todos los pacientes en fase crónica38. Esta recomendación se basa fundamentalmente en la mejor evolución clínica a largo plazo observada en los pacientes tratados con benznidazol tras un seguimiento promedio de unos 10años y en la prevención de la miocardiopatía chagásica39. Sin embargo, un estudio recientemente publicado arroja nuevas dudas sobre el beneficio clínico de tratar a los pacientes. El ensayo clínico BENEFIT, primer ensayo aleatorizado, doble ciego que compara benznidazol contra placebo para el tratamiento de los pacientes afectados con miocardiopatía chagásica no ha demostrado diferencias significativas en cuanto al beneficio clínico entre los 2 grupos durante los 5años de seguimiento de los pacientes32. Por otro lado, se ha observado que los pacientes que fueron tratados con benznidazol presentaron una importante reducción de la carga parasitaria en sangre periférica.
Por tanto, a pesar del beneficio demostrado en reducir la carga parasitaria, teniendo en cuenta el posible poco impacto sobre la progresión de la enfermedad en pacientes con miocardiopatía instaurada, se hace urgente la búsqueda de nuevos compuestos o nuevas estrategias que aporten un mejor pronóstico a estos pacientes.
Dentro de los compuestos que se están evaluando actualmente, los que han presentado una mejor actividad en el modelo in vivo e in vitro son los inhibidores de la síntesis del ergosterol. Este grupo de medicamentos, utilizados ampliamente en la práctica clínica habitual como antifúngicos, actúan interfiriendo en la síntesis de la membrana del protozoo. De este grupo, el posaconazol es el medicamento que ha logrado un mayor desarrollo como antiparasitario y una mejor evidencia de su actividad. Tras haber demostrado una excelente actividad en el modelo murino y una excelente tolerancia en el ser humano, se evaluó en un ensayo clínico, comparando su eficacia con benznidazol, en pacientes con enfermedad de Chagas en fase crónica, independientemente de su forma clínica. Después de 2meses de tratamiento y con 2 esquemas terapéuticos diferentes (800mg/día y 200mg/día) y tras 10meses de seguimiento, se obtuvo una tasa de fracaso terapéutico medida mediante la detección de ADN parasitario en sangre periférica de más del 80%, muy por encima de la obtenida con benznidazol31. A pesar de estos resultados, durante el periodo de tratamiento prácticamente todos los pacientes mostraron una supresión mantenida de la carga parasitaria, lo que sí evidencia que efectivamente el posaconazol presenta actividad anti-tripanosoma pero no es capaz de erradicar el parásito.
Nuevos ensayos clínicos se han llevado a cabo con compuestos de esta familia, como el pro-ravuconazol, con resultados similares40.
Durante los próximos meses saldrán a la luz los resultados de nuevos ensayos clínicos que ya han acabado su periodo de seguimiento, como es el caso del estudio TRAENA, donde se compara benznidazol versus placebo de manera aleatorizada y doblemente ciega en pacientes con enfermedad de Chagas en su fase crónica41.
Del resto de compuestos que están en fase de desarrollo y que están siendo evaluados como tripanocidas, hay un derivado nitroheterocíclico, el fexinidazol, que se está valorando casi al mismo tiempo contra la tripanosomiasis africana como contra la enfermedad de Chagas. Lamentablemente, la inclusión de pacientes en este último estudio se ha interrumpido por problemas de seguridad42.
Ante este panorama terapéutico, las futuras líneas de investigación se encaminan hacia estrategias de combinaciones de fármacos, hacia reformulaciones de las antiguas moléculas y hacia la optimización de los actuales regímenes de benznidazol. El estudio STOP CHAGAS (ClinicalTrials.gov Identifier: NCT01377480) pretende evaluar la combinación de posaconazol con benznidazol frente a los 2 medicamentos por separado y a placebo en un ensayo clínico aleatorizado y doble ciego en pacientes en fase crónica de la enfermedad de Chagas sin evidencia de afectación cardíaca.
Si bien la evidencia actual parece demostrar que el benznidazol no tiene el beneficio deseado en la evolución clínica de la enfermedad de Chagas en los pacientes con afectación cardíaca, sí sabemos que el tratamiento en mujeres en edad fértil tiene un gran impacto en la transmisión vertical de la infección, ya que reduce de manera drástica el riesgo de infección congénita43.
Con independencia de estos resultados, hay motivos sobrados para afrontar el futuro próximo del tratamiento contra la enfermedad de Chagas con optimismo. Las iniciativas para buscar nuevos compuestos se han incrementado en los últimos años, así como el diseño y la ejecución de nuevos ensayos clínicos. Lo que también parece claro es que durante los próximos años el benznidazol seguirá siendo la primera opción terapéutica. Tendremos que acabar de definir cuáles van a ser los pacientes que más se beneficien de este tratamiento.
Situaciones especialesEnfermedad de Chagas e inmunosupresiónLa reactivación de la enfermedad de Chagas durante la fase crónica (definida por la detección de tripomastigotes en sangre periférica o en otros fluidos corporales) puede ocurrir en situaciones de inmunosupresión. Esta situación suele cursar con una elevada parasitemia y con cuadros clínicos graves, como son la afectación del sistema nervioso central (en forma de meningoencefalitis o absceso cerebral) o miocarditis, y con menor frecuencia lesiones cutáneas (paniculitis y nódulos subcutáneos), peritonitis o cervicitis44. Estos cuadros graves se han descrito fundamentalmente en los pacientes con infección por el virus de la inmunodeficiencia humana (VIH) y en los receptores de trasplante, tanto hematológico como de órgano sólido45.
En países endémicos para la enfermedad de Chagas la tasa de coinfección con el VIH es del 1,3 al 7,1%, dependiendo de los diferentes estudios46,47. La reactivación de la enfermedad de Chagas en pacientes con infección por el VIH es considerada una condición definitoria de SIDA en algunos países (como Brasil), y el riesgo de reactivación se incrementa de una manera significativa cuando el recuento de linfocitos CD4+ es inferior a 200células/mm3. Estudios realizados en zonas endémicas estiman que el riesgo de reactivación en pacientes que no reciben tratamiento antirretroviral es del 15 al 20%46,48. La reactivación de la enfermedad de Chagas también se ha descrito ampliamente en receptores de trasplante de órganos, fundamentalmente de corazón y riñón49,50. Debido al envejecimiento de la población, un mejor acceso al sistema sanitario y el empleo de nuevos tratamientos, los pacientes con enfermedad de Chagas presentan con más frecuencia otras situaciones que condicionan inmunosupresión, como las enfermedades neoplásicas y enfermedades autoinmunes o reumatológicas que requieren tratamiento inmunosupresor, como son la artritis reumatoide o el lupus eritematoso sistémico51.
Los recientes flujos migratorios de países endémicos para enfermedad de Chagas hacia nuestro país ha hecho que se observen cada vez más casos de coinfección VIH-Chagas, o que pacientes con enfermedad de Chagas entren en programas de trasplante, lo que ha llevado a los profesionales implicados a crear protocolos de actuación en estos casos52,53.
Enfermedad de Chagas y embarazoLa mayor parte de las embarazadas con enfermedad de Chagas se encuentran en la fase crónica de la enfermedad y suelen estar asintomáticas, pero pueden presentar mayor riesgo de parto pretérmino, bajo peso al nacer o muerte fetal. La tasa de transmisión vertical de la enfermedad de Chagas es del 1 al 12%, dependiendo de los estudios54. La transmisión vertical es el principal mecanismo de contagio en los países no endémicos, lo que ha llevado a algunas comunidades autónomas de España (Cataluña, Comunidad Valenciana y Galicia) a implementar programas de prevención de transmisión vertical en las mujeres embarazadas procedentes de áreas endémicas. Dado que el embarazo es una contraindicación para el tratamiento antiparasitario (benznidazol o nifurtimox) debido al posible efecto teratogénico, el cribado en los recién nacidos de madres con enfermedad de Chagas y su tratamiento temprano es la mejor estrategia55. Por otra parte, es fundamental el cribado de la infección en las mujeres en edad fértil procedentes de áreas endémicas, ya que el tratamiento antiparasitario disminuye el riesgo de transmisión vertical en posteriores embarazos43.
FinanciaciónEste estudio no ha tenido ninguna fuente de financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.