Introducción
La hidatidosis humana es una zoonosis parasitaria causada por el estadio larvario del cestodo Echinococcus granulosus (familia Taeniidae). La enfermedad tiene una distribución mundial, con elevadas prevalencias en los países del área mediterránea, norte y este de África, China, Suramérica y Australia1,2. En España la incidencia de la hidatidosis humana tiende a disminuir, desde una tasa de 2,52 casos/100.000 habitantes en 1985 hasta una tasa de 1,01/100.000 habitantes en 19963, último año en el que la hidatidosis se consideró una enfermedad de declaración obligatoria. Esta tendencia se debe principalmente a la implantación y mantenimiento de programas de control de la enfermedad4. Actualmente Aragón, Castilla y León, La Rioja y Navarra son las Comunidades Autónomas que presentan mayores incidencias, con tasas comprendidas entre 1,62-4 casos/100.000 habitantes3-5. En nuestro entorno, la enfermedad se transmite a través de un ciclo doméstico mantenido entre perros (hospedador definitivo) y ungulados domésticos (principalmente ovinos y vacunos) como hospedadores intermediarios. El hombre adquiere la infección tras ingerir de forma accidental alimentos o agua contaminados con los huevos del parásito. Una vez en el intestino, el huevo eclosiona y libera el embrión hexacanto u oncosfera, que atraviesa la lámina propia y es transportada por los vasos sanguíneos hasta alcanzar diversos órganos o tejidos. Tras establecerse en ellos, la oncosfera da origen al estadio larvario, también denominado metacestodo o quiste hidatídico, que se desarrolla como una vesícula unilocular rellena de líquido. En el hombre el hígado es el órgano más frecuentemente afectado (52-73%), seguido de los pulmones6 (10-40%). Habitualmente la infección permanece asintomática durante años, hasta que la aparición de complicaciones (rotura del quiste, infección, compresión mecánica de órganos adyacentes) desencadena la sintomatología de la enfermedad, que puede variar en función del órgano afectado, el número y tamaño de los quistes y el tipo de complicaciones que afecten a los mismos.
Actualmente, el diagnóstico de la hidatidosis humana está basado en la combinación de métodos de tratamiento de imagen (ecografía, tomografía computarizada, resonancia magnética, rayos X) y ensayos inmunodiagnósticos (principalmente análisis inmunoenzimático [ELISA] e immunoblotting), estos últimos habitualmente utilizados como técnicas de confirmación de los casos sospechosos7.
La eficacia de las técnicas empleadas en el serodiagnóstico de la enfermedad es en gran medida dependiente de una serie de factores como el origen, pureza y calidad del extracto antigénico utilizado8,9, el panel de sueros seleccionado (sueros de pacientes confirmados o no quirúrgicamente, subclase de las inmunoglobulinas)9,10, el órgano afectado y el número de quistes11. El líquido hidatídico es la principal fuente antigénica empleada tanto para el inmunodiagnóstico primario como para el seguimiento de pacientes después de tratamiento quirúrgico o farmacológico12. Sin embargo, este extracto ha evidenciado problemas tanto en la estandarización de su uso como en su falta de sensibilidad y especificidad13,14. Así, un elevado porcentaje de pacientes con hidatidosis confirmadas clínica o quirúrgicamente muestran serología negativa (falsos negativos), mientras que problemas de reactividad cruzada son frecuentemente hallados con sueros de pacientes infectados con otros helmintos, principalmente E. multilocularis y Taenia solium15,16. Para paliar estos inconvenientes, en los últimos años se ha realizado un considerable esfuerzo con el fin de identificar nuevos componentes altamente inmunogénicos derivados de otros estadios de desarrollo del parásito. Así, los extractos somáticos y los productos de excreción-secreción de protoescólex y adultos han sido caracterizados y ensayados, evaluándose su potencial en el serodiagnóstico de la hidatidosis humana.
La utilización de técnicas de biología molecular ha permitido también disponer de una considerable gama de proteínas recombinantes y péptidos sintéticos cuyo uso, de forma individual o conjunta, ha supuesto una considerable mejora en las prestaciones diagnósticas de las técnicas disponibles17. Sin embargo, a pesar de todos estos avances no existe actualmente una técnica estandarizada que aúne elevadas sensibilidad y especificidad diagnósticas18.
Antígenos del líquido hidatídico (LH)
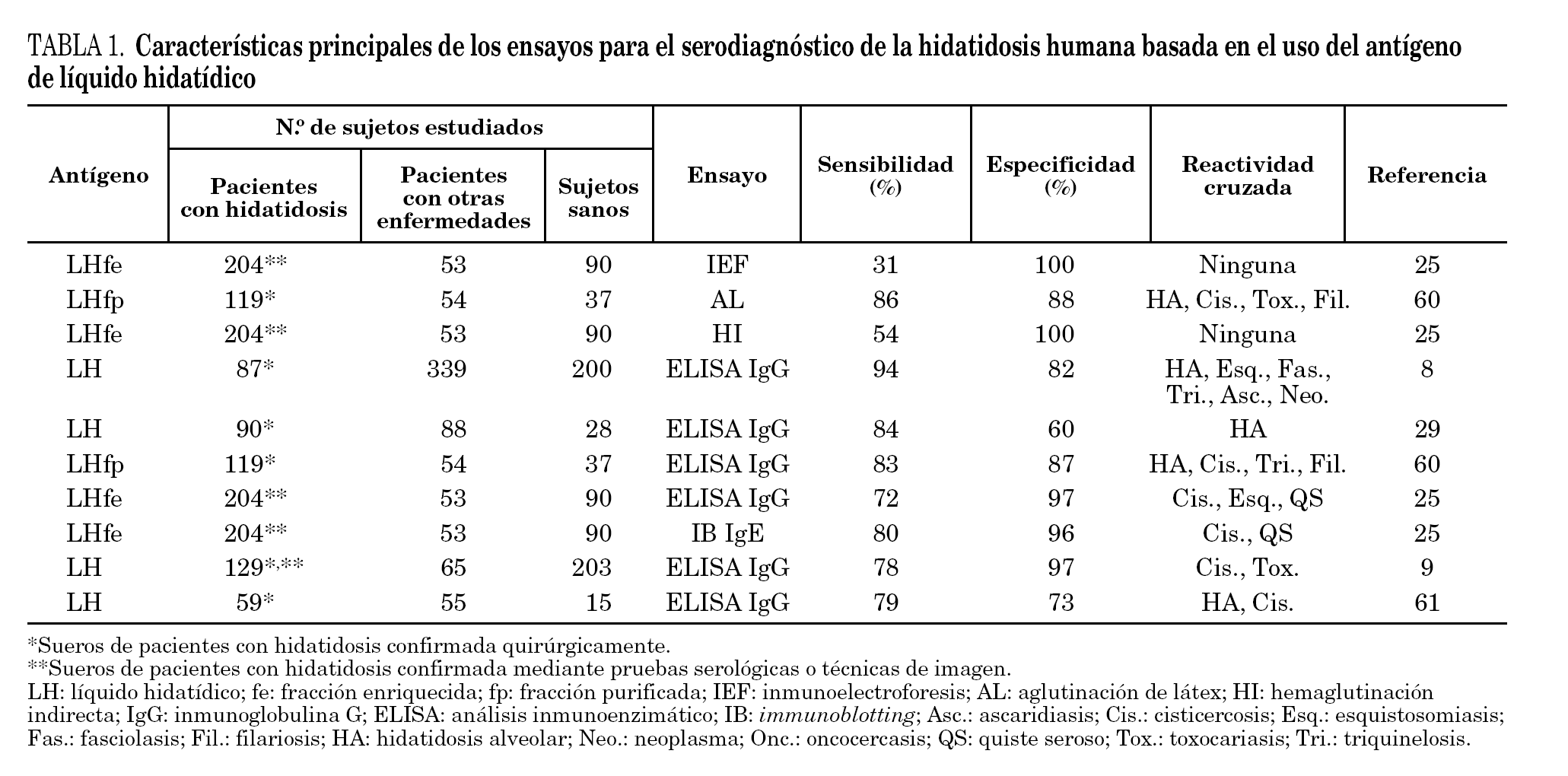
El LH esta constituido por una compleja mezcla de glucoproteínas y lipoproteínas, hidratos de carbono y sales minerales. Algunos de sus componentes provienen del hospedador (principalmente albúmina e inmunoglobulinas), mientras que el resto son producto de la actividad metabólica del metacestodo. Históricamente, el LH es la fuente de antígenos más importante para el inmunodiagnóstico de la hidatidosis humana. Con fines clínicos, el LH bruto posee una sensibilidad en torno al 85-95%, aunque su especificidad está frecuentemente limitada por problemas de reactividad cruzada con sueros de pacientes infectados con otros cestodos, nematodos y trematodos7,15,16, especialmente con E. multilocularis y T. solium. Sin embargo, es necesario tener en cuenta que en España la hidatidosis alveolar no es una enfermedad autóctona, mientras que la prevalencia de la cisticercosis es baja19. Por estos motivos el serodiagnóstico basado en el uso de LH bruto presenta menos inconvenientes que en otras regiones del mundo donde estas enfermedades son endémicas. Otro factor que hay que considerar es el tipo de órgano afectado, puesto que la localización del quiste puede ser una importante causa de falsos negativos. Así, entre el 10-20% de los pacientes con quistes hepáticos y aproximadamente el 40% de los pacientes con quistes pulmonares no presentan niveles significativos de anticuerpos (IgG) específicos11,20.
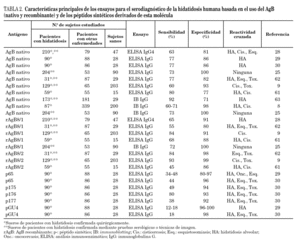
Del mismo modo, quistes alojados en riñón, bazo, cerebro o hueso inducen una baja o nula respuesta de anticuerpos contra el parásito20. Por todos los motivos expuestos, actualmente el LH bruto está especialmente recomendado en estudios seroepidemiológicos21, mientras que el diagnóstico individual se basa en el uso de fracciones purificadas como las lipoproteínas antígeno B y antígeno 5. El rendimiento del LH en el inmunodiagnóstico de la hidatidosis humana se especifica en la tabla 1.
Antígeno B (AgB)
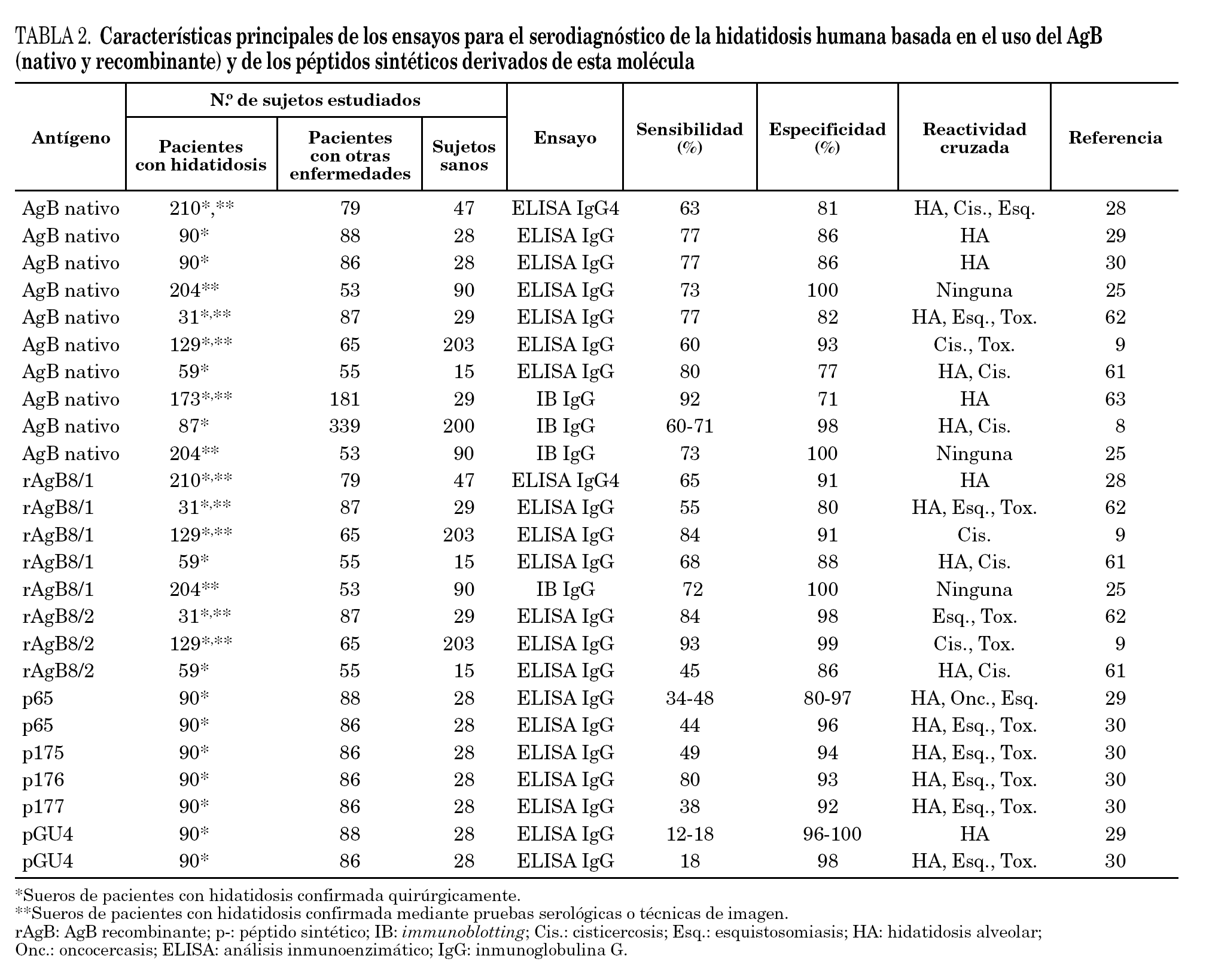
El AgB22 es una proteína polimérica de 120-160 kDa que en condiciones reductoras se disocia en subunidades de 8/12, 16 y 20/24 kDa. Este hecho sugiere que su arquitectura está constituida por agregados multiméricos de la subunidad de 8 kDa23. El papel que desempeña el AgB en la fisiología del parásito no está plenamente establecido, pero hay evidencias que demuestran su participación en la evasión de la respuesta inmunitaria del hospedador16,24. La identificación mediante immunoblotting de la subunidad de 8/12 kDa es actualmente considerada el método de mayor especificidad para el diagnóstico de la enfermedad25. Sin embargo, el 18% de los sueros de pacientes con hidatidosis no presentan niveles detectables de anticuerpos específicos, mientras que el 39% de los sueros de pacientes con hidatidosis alveolar muestran reactividad cruzada con la subunidad de 8/12 kDa26. Por otra parte, el seguimiento de los niveles de IgE específica contra el AgB ha demostrado ser una importante herramienta para determinar la evolución de la infección en pacientes después de tratamiento quirúrgico o farmacológico12.
Recientes estudios moleculares han demostrado que el AgB está codificado por una familia multigénica de expresión variable constituida por al menos 5 isoformas, denominadas EgAgB1 a EgAgB527. Hasta el momento sólo EgAgB1 y EgAgB2 han sido clonados y usados con fines inmunodiagnósticos. De ellos, EgAgB2 ha mostrado la mejor eficacia diagnóstica, sensiblemente superior a la del AgB nativo9. Es de destacar que la subclase IgG4 es predominante en la respuesta mostrada por sueros de pacientes con hidatidosis frente al AgB tanto nativo como recombinante, sugiriendo que ésta puede ser la subclase de elección en ensayos serológicos9,28.
Con el fin de determinar con más precisión los epitopos del AgB involucrados en fenómenos de inmunogenicidad, otros estudios han tenido por objeto la evaluación diagnóstica de péptidos sintéticos que incorporan estas secuencias29,30. Sin embargo, hasta el momento actual tan sólo el péptido p176 ha revelado características diagnósticas relevantes30. En estos trabajos se ha demostrado también que la combinación de antígenos con secuencias bien definidas, incluyendo péptidos sintéticos, puede mejorar la especificidad del inmunoensayo al reducir el número de falsos negativos29. El rendimiento del AgB (nativo y recombinante) y de los péptidos sintéticos derivados de esta molécula en el inmunodiagnóstico de la hidatidosis humana se especifican en la tabla 2.
Antígeno 5 (Ag5)
El Ag531 es una proteína termolábil constituida por dos componentes de 57 y 67 kDa32 que en condiciones reductoras se disocian en subunidades de 38 y 22-24 kDa23. La función de esta molécula en la biología del parásito es casi completamente desconocida, aunque su elevada concentración en el LH sugiere un papel destacado en el desarrollo del metacestodo. Recientemente se ha demostrado que la subunidad de 38 kDa está íntimamente relacionada con serina-proteasas de la familia de la tripsina, mientras que la subunidad de 22 kDa parece estar implicada en fenómenos de adhesión a la matriz extracelular33. Al igual que en el caso del AgB, también se han detectado diferentes isoformas del Ag5, por lo que esta molécula parece estar codificada por una familia multigénica de expresión variable34.
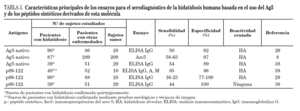
El Ag5 ha sido ampliamente utilizado en el serodiagnóstico de la hidatidosis humana, principalmente mediante la detección del arco 5 en inmunoelectroforesis. Sin embargo, entre el 10-40% de los sueros de pacientes con hidatidosis quirúrgicamente confirmadas no presentan niveles detectables de anticuerpos específicos contra este antígeno en ELISA35. Además, el Ag5 ha demostrado diversos grados de reactividad cruzada con sueros de pacientes infectados con otros helmintos. Este problema es en parte debido a la presencia del hapteno fosforilcolina en la subunidad de 38 kDa23,36. La fosforilcolina es un componente estructural compartido por múltiples especies, tanto procariotas como eucariotas, que además presenta propiedades inmunorreguladoras en nematodos37. Estudios recientes mediante ELISA han revelado que el Ag5 posee una sensibilidad y especificidad diagnóstica del 50-54 y 89-92%, respectivamente29,38. Estos resultados demuestran que el Ag5 es menos útil que el AgB en el serodiagnóstico de la hidatidosis humana.
Aunque la secuencia completa del Ag5 ha sido clonada recientemente33, la proteína recombinante no ha sido aún evaluada en ensayos inmunodiagnósticos. Sin embargo, un péptido sintético derivado de este antígeno (péptido 89-122) ha sido empleado en diversos estudios, con resultados variables en función del grupo de sueros ensayado29,38,39. El rendimiento del Ag5 nativo y de los péptidos sintéticos derivados de esta molécula en el inmunodiagnóstico de la hidatidosis humana se especifican en la tabla 3.
La estandarización del serodiagnóstico de la hidatidosis humana también ha sido mejorada mediante la producción y uso de anticuerpos monoclonales, principalmente dirigidos contra el AgB y el Ag5 (revisado por Siles-Lucas y Gottstein40).
Antígenos somáticos de protoescólex y adultos
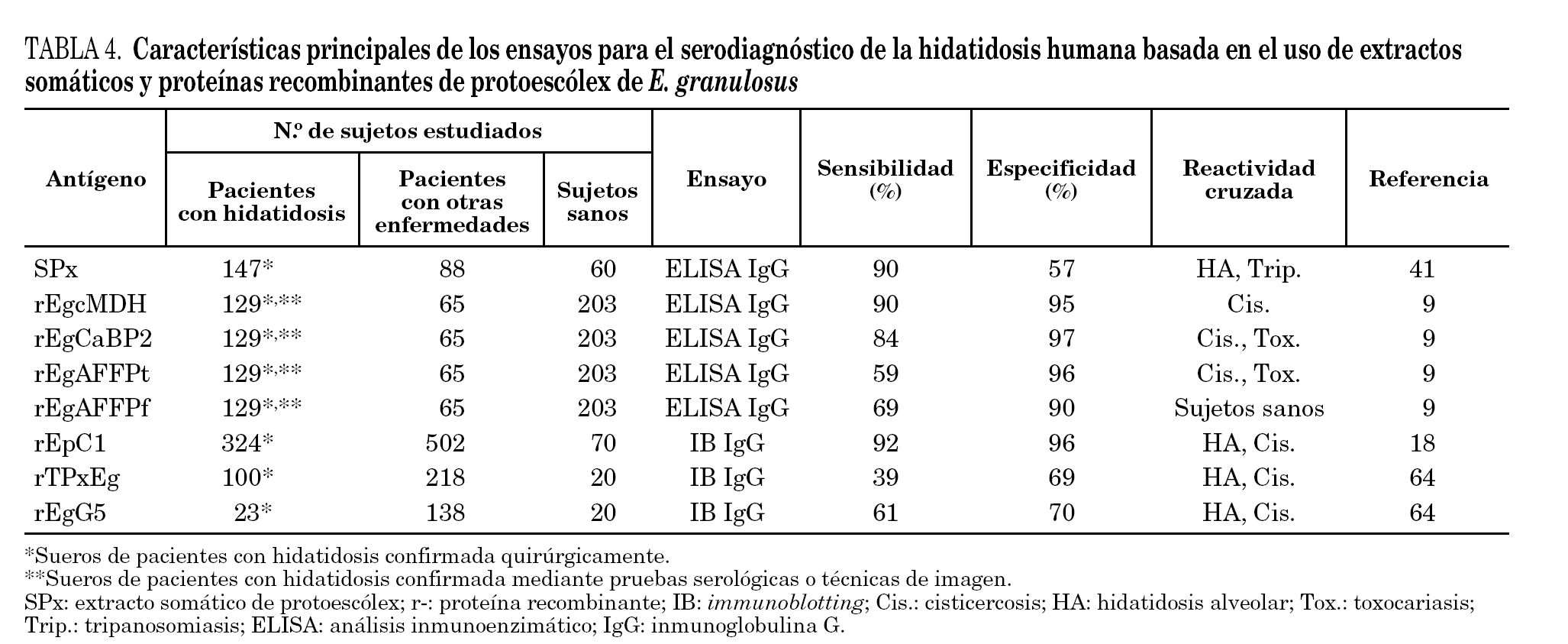
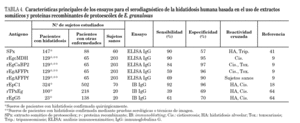
En los últimos años la búsqueda de nuevos componentes con relevancia en el serodiagnóstico de la hidatidosis humana ha conllevado la obtención y uso de extractos derivados de otras fuentes antigénicas, como protoescólex y adultos. Aunque los extractos somáticos brutos han evidenciado pobres especificidades en ELISA41, varias proteínas recombinantes han mostrado un elevado potencial diagnóstico, especialmente rEpC118 y rEgcMDH9. rEpC1 (sensibilidad: 92%; especificidad: 96%) es una secuencia parcial obtenida a partir de una biblioteca de cADN de protoescólex de E. granulosus que codifica un polipéptido de 8,4 kDa, mientras que rEgcMDH (sensibilidad: 90%; especificidad: 95%) es una isoforma de la enzima malatodeshidrogenasa aislada en el citosol del parásito adulto. Ambos antígenos recombinantes fueron evaluados utilizando un gran número de sueros humanos, por lo que pueden ser considerados como serios candidatos a antígenos estándar para el serodiagnóstico de la enfermedad. El rendimiento de los extractos somáticos y proteínas recombinantes de protoescólex de E. granulosus en el inmunodiagnóstico de la hidatidosis humana se especifican en la tabla 4.
Productos de excreción-secreción de protoescólex y adultos
Los productos de excreción-secreción (PES) de protoescólex y adultos de E. granulosus han sido previamente utilizados como fuentes antigénicas en el inmunodiagnóstico de la equinococosis canina42. Sin embargo, poco se conoce sobre estos extractos y su utilidad en el serodiagnóstico de la hidatidosis humana.
Recientemente nuestro laboratorio ha llevado a cabo la caracterización bioquímica de PES de protoescólex, identificándose 20 componentes proteicos en SDS-PAGE43,44. De ellos, los polipéptidos de 89 y 74 kDa fueron identificados únicamente por sueros de pacientes con hidatidosis. La ausencia de reactividad cruzada frente a los sueros ensayados de pacientes con otras parasitosis y enfermedades permite proponer dichos componentes como antígenos estándar para el serodiagnóstico de la hidatidosis humana.
Seguimiento de pacientes con hidatidosis después de tratamiento
Dependiendo de la estructura y las características individuales del quiste, actualmente existen tres opciones terapéuticas para el tratamiento de la hidatidosis humana: cirugía, técnica de drenaje PAIR (punción, aspiración, instilación, reaspiración) y quimioterapia con compuestos benzimidazólicos como el albendazol y el mebendazol7. Teniendo en cuenta que el riesgo de recurrencia es del 3-16% para las técnicas de resección y drenaje45, y que la acción del albendazol/mebendazol es más parasitostática que parasiticida, la diferenciación entre pacientes con enfermedad activa o progresiva e individuos curados es un aspecto clave para la evaluación del éxito o fracaso de la terapia empleada. Inicialmente, el seguimiento clínico de pacientes con hidatidosis ha sido basado en la detección de isotipos y subclases de anticuerpos específicos contra antígenos de E. granulosus. Así, estudios previos en pacientes con estados avanzados de la enfermedad han puesto de manifiesto una marcada producción de anticuerpos IgG, especialmente de las subclases IgG1 e IgG446,47. Posteriormente, Riganò et al48 observaron que pacientes con una respuesta favorable al tratamiento con albendazol presentaban niveles de IgG4 significativamente inferiores a los de aquéllos con escasa o nula respuesta al tratamiento, mientras que la subclase IgG1 mostraba la tendencia contraria. A su vez Shambesh et al49 propusieron que la elevada respuesta de IgG1 es una característica propia de la fase asintomática de la infección, produciéndose un cambio de síntesis de IgG1 a síntesis de IgG4 cuando la enfermedad se torna sintomática. Finalmente, Daeki et al50 mostraron que la elevada respuesta de IgG4 estaba ligada a estadios de desarrollo y crecimiento del quiste hidatídico, mientras que las subclases IgG1, IgG2 e IgG3 estaban asociadas a procesos de degeneración/calcificación del quiste. Todos estos datos aportan una creciente evidencia de la correlación entre el nivel de IgG4 específica y la progresión de la enfermedad. De forma similar otros estudios han descrito también correlaciones positivas entre el nivel de IgE y el estado de desarrollo de la infección12,51-53. Sin embargo, el descenso de los niveles de IgE específica es lento, y anticuerpos de este isotipo son aún detectables después de un año tras la eliminación del quiste54. Aunque IgA e IgM también presentan respuestas elevadas en pacientes con hidatidosis activa, su persistencia, incluso durante períodos de 3 años o más, hace que estos isotipos no sean de utilidad para el seguimiento del curso de la infección55,56.
Recientemente se han desarrollado nuevas estrategias con el fin de mejorar la prognosis de la enfermedad tras tratamiento quirúrgico o farmacológico, basadas en observaciones que demuestran que la activación de linfocitos Th1/Th2 tiene un papel destacado en la evolución de la infección. En la mayoría de las parasitosis una elevada respuesta Th2 es indicativa de susceptibilidad a la enfermedad, mientras que una respuesta Th1 está asociada con el desarrollo de mecanismos de inmunoprotección24. Una de las características más destacadas de la hidatidosis humana es la coexistencia de respuestas Th1/Th2. Así, la eliminación/inactivación del quiste hidatídico tras cirugía o tratamiento farmacológico produce una caída drástica de la respuesta Th2, mientras que la respuesta Th1 adquiere entonces especial predominancia57. Las poblaciones de linfocitos Th1 y Th2 mantienen un equilibrio que está estrictamente regulado mediante la producción de citocinas específicas. Así, elevados niveles de interferón gamma (IFN-ϒ) asociados con escasa producción de interleucina 10 (IL-10) y ausencia de IL-4 han sido hallados en pacientes con hidatidosis que mostraban una evolución favorable al tratamiento con albendazol y mebendazol (respuesta Th1). Por el contrario, altos niveles de IL-4 e IL-10 asociados con escasa o nula producción de IFN-ϒhan sido detectados en pacientes refractarios al tratamiento farmacológico58 (respuesta Th2). Estos datos demuestran que la determinación de los niveles de citocinas específicas, particularmente IL-4, es un buen indicador de la evolución de la infección tras tratamiento quirúrgico o farmacológico.
Estudios similares59 han puesto de manifiesto que pacientes hidatídicos con serología negativa no presentan niveles significativos de IL-5, citocina que sin embargo es abundantemente expresada en pacientes seropositivos. Esta interesante observación indica claramente que IL-5 tiene una importancia vital en la regulación de la expresión de inmunoglobulinas, y su determinación puede mejorar considerablemente la sensibilidad del serodiagnóstico de la enfermedad al reducir el número de falsos negativos.
Conclusiones
El principal problema del serodiagnóstico de la hidatidosis humana es la falta de antígenos de elevada especificidad y sensibilidad cuyo proceso de obtención sea fácilmente estandarizable. El líquido hidatídico bruto y especialmente las fracciones purificadas del AgB y el Ag5 han constituido durante décadas las principales fracciones antigénicas utilizadas con fines diagnósticos. Sin embargo, dos nuevos campos de investigación han centrado los más destacados avances en el inmunodiagnóstico de la enfermedad en los últimos años. En primer lugar, la obtención y uso de secuencias recombinantes, que han demostrado características diagnósticas superiores a las de sus proteínas nativas homólogas y además permiten la estandarización de la fuente antigénica. En segundo lugar, la irrupción de nuevos antígenos procedentes de extractos antigénicos de otros estadios de desarrollo de E. granulosus, como protoescólex y adultos. A pesar del innegable progreso realizado, hay que recordar que actualmente no existe una técnica de diagnóstico estandarizada que aúne elevada sensibilidad y especificidad, por lo que la identificación y caracterización de nuevos antígenos y la estandarización de técnicas y extractos antigénicos sigue siendo una de las tareas prioritarias con el fin de mejorar el inmunodiagnóstico de la hidatidosis humana.
Correspondencia:
Dr. D. Carmena.
MRC Clinical Sciences Centre. Membrane Transport Biology Group.
Faculty of Medicine. Imperial College. Hammersmith Hospital Campus.
Du Cane Road. London W12 0NN. UK.
Correo electrónico: d.carmena@imperial.ac.uk
Manuscrito recibido el 16-11-2005; aceptado el 5-6-2006.