Descripción clínica y epidemiológica de un brote en una unidad de cuidados intensivos (UCI) causado por Enterobacter cloacae complex multirresistente productor de una β-lactamasa de espectro extendido (BLEE) tipo CTX-M-9.
MétodosSe realizó un estudio retrospectivo de las características clínicas y epidemiológicas del brote causado por E.cloacae complex. La identificación y estudio de sensibilidad de las cepas fueron realizados mediante el sistema semiautomático BD Phoenix™, y la caracterización de la BLEE, por PCR y secuenciación. La tipificación molecular se realizó mediante electroforesis en gel de campo pulsado (PFGE).
ResultadosDurante febrero de 2014, 6 pacientes (50% mujeres; media de edad: 61,5años; rango de edad: 44-76años) ingresados en la UCI del Complejo Hospitalario de Pontevedra (CHOP) presentaron aislamientos de E.cloacae complex resistente a cefalosporinas de amplio espectro. Tres pacientes desarrollaron infección; uno presentó bacteriemia primaria y shock séptico, y 2 neumonía asociada a ventilación mecánica. En los 3 casos restantes los aislamientos de E.cloacae complex se consideraron colonización. El análisis fenotípico y genotípico reveló que todos los aislados presentaban el mismo perfil por PFGE y que portaban la misma BLEE del tipo CTX-M-9. El brote se controló mediante la mejora de las medidas universales y el aislamiento de contacto de los pacientes infectados y/o colonizados.
ConclusiónSe describe desde un punto de vista clínico y epidemiológico un brote de E.cloacae complex portador de CTX-M-9 en una UCI.
Clinical and epidemiological description of an outbreak in an intensive care unit (ICU) caused by a strain of multidrug-resistant Enterobacter cloacae complex carrying a CTX-M-9-type extended-spectrum β-lactamase (ESBL).
MethodsA retrospective study of the clinical and epidemiological features of the outbreak caused by E.cloacae complex was performed. Identifying and studying the sensitivity of the strains were performed using the semi-automated system BD Phoenix™, and the characterisation of ESBL using PCR and sequencing. Molecular typing was performed by pulsed-field gel electrophoresis (PFGE).
ResultsDuring February 2014, 6 patients (50% women; mean age: 61.5years; age range: 44-76years) admitted to the ICU of the Hospital of Pontevedra (CHOP) presented resistant E.cloacae complex isolates to extended-spectrum cephalosporins. Three patients developed infection; one had primary bacteraemia and septic shock, and 2 with ventilator-associated pneumonia. In the remaining three cases E.cloacae complex isolates were considered as colonisation. Phenotypic and genotypic analysis revealed that all isolates had the same PFGE profile and carried the same CTX-M-9 ESBL. The outbreak was controlled by improving universal precautions and contact isolation of patients infected and/or colonized.
ConclusionThe clinical and epidemiological features of an outbreak in an ICU caused by E.cloacae complex carrying CTX-M-9 are described.
Enterobacter cloacae es un microorganismo ubicuo en la naturaleza que forma parte de la flora intestinal en humanos, y en los últimos años se ha convertido en un importante patógeno asociado a infecciones de origen nosocomial, principalmente bacteriemia, infección respiratoria, del tracto urinario y abdominal. La colonización de distintos dispositivos de uso hospitalario, favorecida por su capacidad de formar biopelículas, constituye un factor de especial relevancia en su relación con brotes, sobre todo en unidades de cuidados intensivos (UCI) neonatales1.
La resistencia natural de este microorganismo debido a la presencia de AmpC cromosómica, así como la capacidad de adquirir β-lactamasas de espectro extendido (BLEEs) plasmídicas, constituye un problema añadido en el manejo terapéutico. La producción de BLEE en E.cloacae es menos prevalente que en Escherichia coli y Klebsiella pneumoniae, así como su asociación a brotes2. Las enzimas del tipo CTX-M, actualmente predominantes en E.coli y K.pneumoniae, también han sido descritas en E.cloacae3. En concreto, CTX-M-9 se encuentra entre las BLEEs más frecuentes en España, con CTX-M-14, CTX-M-15 y SHV-124.
En este estudio se analizan las características clínicas y epidemiológicas de un brote causado por una cepa de E.cloacae complex multirresistente portadora de una BLEE tipo CTX-M-9 en una UCI de adultos del Complejo Hospitalario de Pontevedra (CHOP) durante febrero de 2014.
Material y métodosCaracterísticas del hospitalEl CHOP es un hospital universitario de tercer nivel, de 621 camas, localizado en Pontevedra, España, y da cobertura sanitaria a una población de 225.739 habitantes. La UCI consta de 10 camas para pacientes críticos adultos, a excepción de los pacientes de cirugía, que son atendidos en otra unidad.
Definición y período de estudioSe estudiaron todos los aislamientos clínicos de E.cloacae complex registrados en la UCI durante el mes de febrero de 2014. Previamente a la detección del caso índice objeto de este estudio, se habían aislado de forma esporádica y en distintas unidades hospitalarias cepas de E.cloacae complex con un patrón de resistencia similar (39 casos en pacientes hospitalizados durante los 4años previos al brote, 2010-2013), pero no se llevó a cabo el estudio genotípico del mecanismo de resistencia por no constituir ningún brote. El caso índice del brote fue una mujer de 70años ingresada en la UCI del CHOP que sufrió un shock séptico por E.cloacae complex multirresistente aislado en un hemocultivo tras 28días de ingreso, falleciendo a las 24h del inicio del cuadro séptico. Durante los 17días siguientes se produjeron 5 casos de infección y/o colonización por E.cloacae complex con el mismo perfil de resistencia en pacientes de la misma unidad. Los datos clínicos fueron obtenidos a partir de la base de datos clínicos del hospital (IANUS), que es común a todos los hospitales pertenecientes al Servicio Gallego de Salud (SERGAS).
Medidas de control de la infecciónUna vez detectado el caso índice, el Servicio de Medicina Preventiva realizó una evaluación inicial, tras la cual se adoptaron medidas de aislamiento de contacto y se tomaron muestras periódicas semanales a todos los pacientes con aislamientos clínicos de E.cloacae complex multirresistente hasta el alta hospitalaria, el traslado de unidad o su negativización. En total se recogieron 22 muestras de control correspondientes a exudados faríngeos y rectales que se cultivaron en placas de MacConkey, detectándose 2 portadores rectales de E.cloacae complex multirresistente. No se realizó estudio de portadores al resto de los pacientes de la UCI ni al personal sanitario, ni se realizaron estudios microbiológicos de muestras ambientales por no considerarse necesarias al detectarse deficiencias en las medidas universales que fueron convenientemente resueltas según el protocolo de actuación de nuestro centro5. De forma adicional, se realizó una campaña de refuerzo sobre las medidas de higiene estándar, que incluyó el lavado adecuado de manos entre el personal sanitario relacionado con la UCI, lo que contribuyó de forma eficaz al control del brote. El final del brote se determinó a partir del momento en que se detectó el último paciente infectado/colonizado por E.cloacae complex multirresistente. El estado de infección o colonización fue determinado según los criterios modificados del CDC/NHSN6.
Estudio microbiológicoMuestras clínicasLas muestras clínicas de los pacientes implicados en el brote corresponden a una muestra de sangre, 4 broncoaspirados (BAS) y un lavado broncoalveolar (BAL). Dos de los BAS se recogieron a través del tubo endotraqueal empleado en ventilación mecánica invasiva; los otros 2 BAS y el BAL se recogieron mediante fibrobroncoscopio con intervalos de 7 y 9días entre ellos, ya que los pacientes se encontraban en el momento de toma de la muestra con ventilación no invasiva.
Cepas bacterianas y determinación de sensibilidad a antibióticosLas muestras clínicas en las que se aisló E.cloacae complex se procesaron según los métodos convencionales. La identificación y el estudio de sensibilidad de las cepas fueron realizados mediante el sistema semiautomático BD Phoenix™ (Becton Dickinson, Biosciences), empleando paneles NMIC/ID-86 para microorganismos gramnegativos. Los criterios de interpretación de sensibilidad utilizados fueron EUCAST7.
Estudio fenotípico para la detección de β-lactamasas de espectro extendido y carbapenemasasTodas las cepas de E.cloacae complex aisladas en pacientes de la UCI durante el período de estudio presentaron CMI≥2mg/l para cefepima y activación del pocillo de detección de BLEE en el sistema semiautomático BD Phoenix™, por lo que se comprobó la presencia de BLEE mediante E-test con cefepima y cefepima/ácido clavulánico (bioMérieux, Marcy-l’Étoile, Francia) y técnica de doble inhibición con discos de cefepima y amoxicilina/ácido clavulánico. Se estudió la producción de carbapenemasas en aquellos aislamientos con una CMI≥0,5mg/l para ertapenem mediante el test de Hodge modificado con disco de ertapenem más cloxacilina (600μg) (cepa E.coli ATCC 25922) y el método colorimétrico CarbaNP8. La inhibición de la actividad carbapenemasa se estudió comparando los halos de inhibición de los discos de ertapenem, ertapenem con EDTA (10μl de una solución 0,5M), ertapenem con ácido fenilborónico (400μg) y ertapenem con cloxacilina (600μg)9.
Caracterización molecular de β-lactamasas de espectro extendido y carbapenemasasSe estudió la presencia de genes codificantes de BLEE (blaSHV, blaCTX-M y blaTEM) y de carbapenemasas (blaOXA-48, blaKPC, blaVIM, blaIMP, y blaNDM) mediante amplificación de ADN por PCR con iniciadores específicos y posterior secuenciación10,11.
Epidemiología molecularLa relación genética entre los aislados de E.cloacae complex incluidos en el estudio se determinó mediante pulsed-field gel electrophoresis (PFGE) tras digestión del ADN total con la enzima de restricción XbaI.
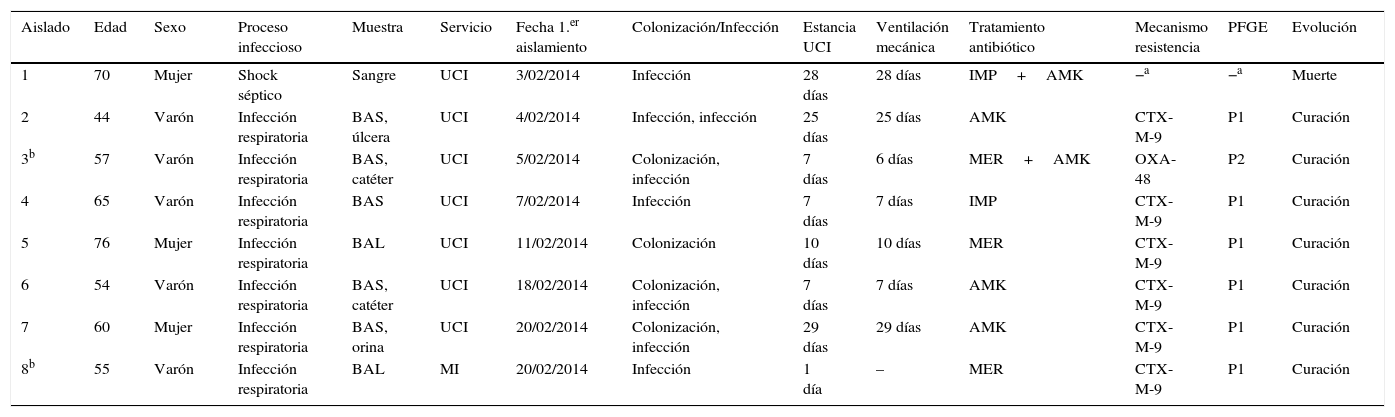
ResultadosCaracterísticas clínicas, tratamiento y evoluciónDurante el mes de febrero de 2014 se detectaron en la UCI del CHOP 6 pacientes (50% mujeres; media de edad: 61,5años; rango de edad: 44-76años) infectados y/o colonizados por E.cloacae complex con un patrón de multirresistencia similar, incluida resistencia a cefepima, que no constituía parte de la epidemiología previa del hospital. El período medio de estancia en la UCI de estos pacientes antes del aislamiento de E.cloacae complex fue de 17,7días (rango: 7-29días). Las características clínicas de estos pacientes se detallan en la tabla 1.
Características clínicas de los pacientes con aislamientos de Enterobacter cloacae complex incluidos en este estudio
| Aislado | Edad | Sexo | Proceso infeccioso | Muestra | Servicio | Fecha 1.er aislamiento | Colonización/Infección | Estancia UCI | Ventilación mecánica | Tratamiento antibiótico | Mecanismo resistencia | PFGE | Evolución |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 70 | Mujer | Shock séptico | Sangre | UCI | 3/02/2014 | Infección | 28 días | 28 días | IMP+AMK | −a | −a | Muerte |
| 2 | 44 | Varón | Infección respiratoria | BAS, úlcera | UCI | 4/02/2014 | Infección, infección | 25 días | 25 días | AMK | CTX-M-9 | P1 | Curación |
| 3b | 57 | Varón | Infección respiratoria | BAS, catéter | UCI | 5/02/2014 | Colonización, infección | 7 días | 6 días | MER+AMK | OXA-48 | P2 | Curación |
| 4 | 65 | Varón | Infección respiratoria | BAS | UCI | 7/02/2014 | Infección | 7 días | 7 días | IMP | CTX-M-9 | P1 | Curación |
| 5 | 76 | Mujer | Infección respiratoria | BAL | UCI | 11/02/2014 | Colonización | 10 días | 10 días | MER | CTX-M-9 | P1 | Curación |
| 6 | 54 | Varón | Infección respiratoria | BAS, catéter | UCI | 18/02/2014 | Colonización, infección | 7 días | 7 días | AMK | CTX-M-9 | P1 | Curación |
| 7 | 60 | Mujer | Infección respiratoria | BAS, orina | UCI | 20/02/2014 | Colonización, infección | 29 días | 29 días | AMK | CTX-M-9 | P1 | Curación |
| 8b | 55 | Varón | Infección respiratoria | BAL | MI | 20/02/2014 | Infección | 1 día | – | MER | CTX-M-9 | P1 | Curación |
AMK, amikacina; BAL, lavado broncoalveolar; BAS, broncoaspirado; IMP, imipenem; MER, meropenem; MI, Medicina Interna; UCI, Unidad de Cuidados Intensivos.
El primero de los pacientes, considerado el caso índice, ingresó en la UCI con un cuadro de encefalitis herpética e insuficiencia respiratoria, por lo que recibió ventilación mecánica continua invasiva durante todo el período que permaneció hospitalizado. A los 28días del ingreso presentó bacteriemia primaria por E.cloacae complex y shock séptico con evolución fatal. No tenía antecedentes de procesos infecciosos previos, viajes, ni asistencia sanitaria en otro hospital. En los 5 casos restantes los aislamientos de E.cloacae complex procedieron de muestras respiratorias, 4 broncoaspirados (BAS) y un lavado broncoalveolar (BAL), de los cuales 2 se diagnosticaron como neumonía asociada a ventilación mecánica (PNU2) y 3 como colonización, según criterios del CDC/NHSN6. El tiempo medio de ventilación mecánica fue de 17,7días (rango: 7-29días). Además, 3 de los 6 pacientes implicados en el brote también presentaron infección de orina, de úlcera sacra y de catéter venoso central. Todos los pacientes presentaban comorbilidades y diversas patologías de base, que incluían sondaje permanente, obesidad, hipotiroidismo, hepatopatía alcohólica, esplenectomía, enfermedad pulmonar obstructiva crónica (EPOC), hipertensión arterial y diabetes mellitus tipo2. En 2 de los 6 pacientes se mantuvo el estado de portador hasta el alta hospitalaria. Tres pacientes fueron tratados con amikacina y 2 pacientes con un carbapenem, con éxito terapéutico en todos ellos. En el caso índice se inició una terapia combinada con imipenem y amikacina, pero la rápida evolución impidió comprobar su eficacia (tabla 1). La mortalidad asociada al brote fue del 16,67% (1/6).
Durante el período de estudio se detectaron otros 2 aislamientos de E.cloacae complex resistentes a cefepima. Uno de ellos, con el mismo perfil de resistencia y perfil de PFGE que los detectados en la UCI, se aisló en un BAL de un paciente ingresado en el servicio de Medicina Interna, aunque no se pudo establecer una relación epidemiológica clara con el brote. El otro aislamiento se produjo en un paciente de la UCI con un perfil de resistencia diferente al resto (sensibilidad a aminoglucósidos, fluoroquinolonas y cotrimoxazol). Este último paciente también presentó infección de catéter venoso central (tabla 1).
Medidas de control de la infecciónLa UCI del CHOP durante el mes de febrero de 2014 tuvo una ocupación media del 103,6%, lo que motivó la existencia de pacientes ectópicos, y en este período se produjeron 23 ingresos (16 ingresos externos y 7 traslados internos) con una incidencia de E.cloacae complex productor de BLEE del 26,09%. Durante el período de estudio se produjo un cambio de personal, lo que pudo contribuir a un menor rigor en las medidas de higiene habituales en la unidad. Tras las precauciones adoptadas, que incluyeron medidas de aislamiento de contacto, mejoras en la higiene de manos mediante el uso de solución alcohólica antes y después de la atención a cada paciente, y refuerzo de las precauciones estándar, se consiguió detener el brote en 3 semanas.
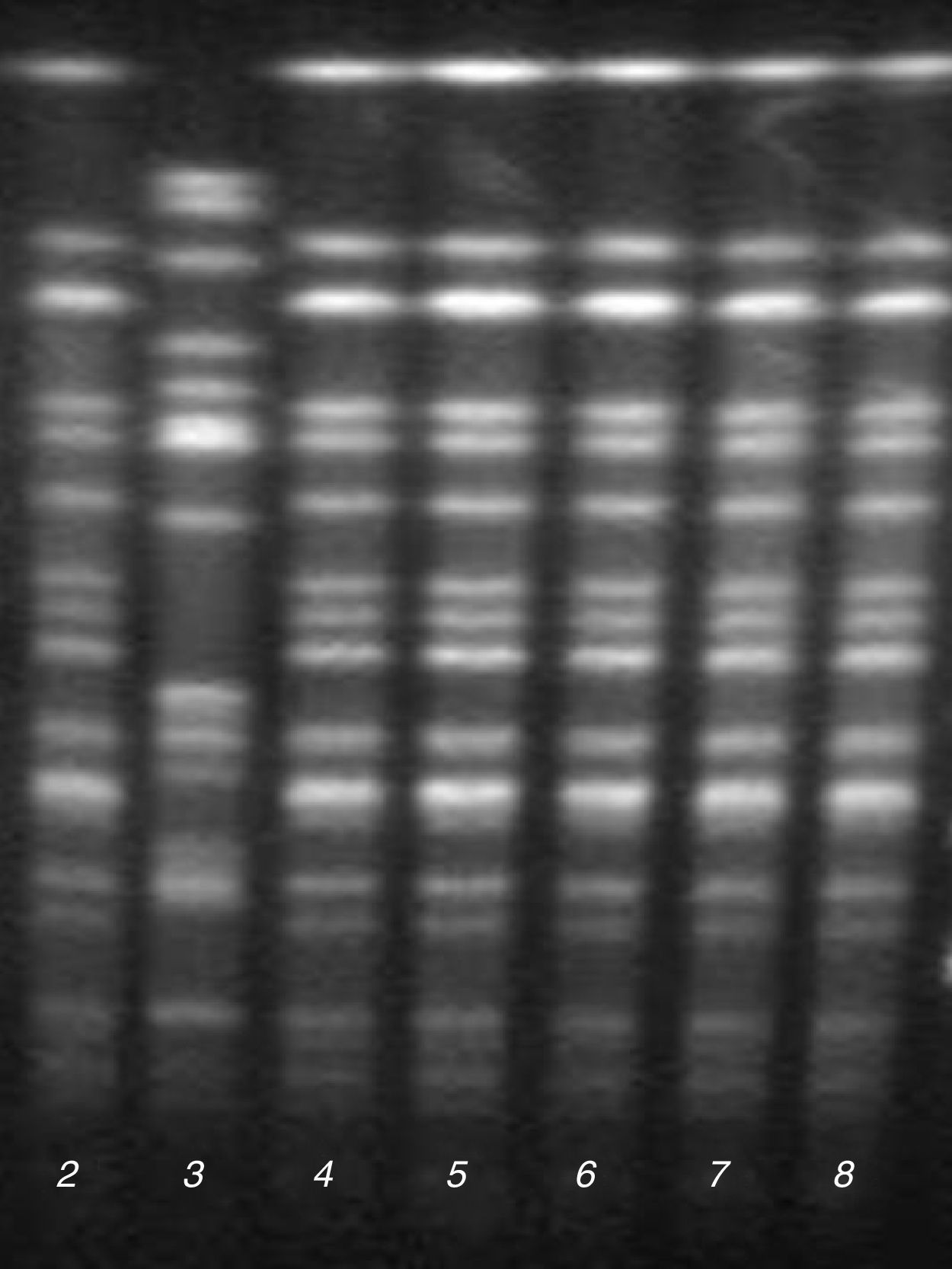
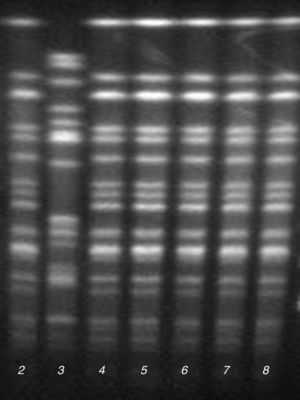
Epidemiología molecularEl análisis de los resultados de PFGE mostró la presencia de un pulsotipo predominante (P1) en 5 de los aislamientos de la UCI y el de Medicina Interna, que presentaron un mismo perfil de antibiograma (fig. 1). El otro aislamiento de la UCI con el mismo perfil de antibiograma correspondiente al caso índice no pudo ser analizado por falta de viabilidad de la cepa, aunque mostró el mismo fenotipo bioquímico y de sensibilidad antibiótica que los aislados del pulsotipo P1.
La cepa restante de la UCI con un perfil diferente de antibiograma pertenecía a un pulsotipo diferente (P2).
Determinación de sensibilidad a antibióticos y caracterización de mecanismos de resistenciaEl estudio de sensibilidad a antibióticos mostró que todos los aislados de E.cloacae complex del pulsotipo P1 eran resistentes a ampicilina, piperacilina, amoxicilina/ácido clavulánico, cefotaxima, gentamicina, tobramicina, ciprofloxacino, levofloxacino y cotrimoxazol, y sensibles a amikacina, imipenem, meropenem y colistina. Además presentaron sensibilidad intermedia a ceftazidima y cefepima, y sensibilidad variable a piperacilina/tazobactam, aztreonam y ertapenem; la CMI de piperacilina/tazobactam varió entre 8/4mg/l (sensible) y >16/4 mg/l (resistente), la CMI de aztreonam varió entre 4mg/l (sensibilidad intermedia) y 8mg/l (resistente), y la CMI de ertapenem varió entre 0,5mg/l (sensible) y 1mg/l (sensibilidad intermedia). El estudio fenotípico y genotípico de estos aislamientos demostró la presencia de una BLEE tipo CTX-M-9 y la ausencia de carbapenemasas.
La cepa del pulsotipo P2, a diferencia del pulsotipo predominante P1, se mostró sensible a aminoglucósidos, fluoroquinolonas y cotrimoxazol, pero fue positiva para el test de Hodge y el CarbaNP, demostrándose la presencia del gen blaOXA-48 mediante PCR.
DiscusiónE.cloacae constituye un patógeno asociado a la infección hospitalaria de especial importancia, dada su capacidad de desarrollar resistencia en el curso de los tratamientos. Los últimos datos publicados en España de prevalencia de resistencias en E.cloacae comprenden un período de 12años (1989-2000), mostrando un 0,4% de BLEEs12. A raíz de este brote, se llevó a cabo en nuestra área sanitaria un estudio retrospectivo de la epidemiología local de E.cloacae complex con sensibilidad intermedia o resistente a cefepima (CMI≥2mg/l). En el período comprendido entre el 1 de enero y el 30 de septiembre de 2014 (que incluye el brote de la UCI, objeto de este estudio) se produjeron 120 aislamientos de E.cloacae complex en toda el área sanitaria, de los cuales 67 (55,83%) fueron de origen hospitalario o estaban relacionados con cuidados sanitarios, mientras que 53 (44,17%) se produjeron en pacientes de la comunidad. De todos los aislamientos, 17 presentaban CMI≥2mg/l para cefepima, pudiendo ser debido a hiperproducción de AmpC cromosómica y/o presencia de BLEE, lo que supone un 14,17%. De todos estos aislamientos, un 22,39% (15/67) eran de origen hospitalario o asociados a cuidados sanitarios, mientras que solamente un 3,77% (2/53) fueron de origen comunitario. Entre los años 2010 y 2013, el porcentaje medio de aislamientos de E.cloacae complex con este perfil de resistencia fue del 10,53%, siendo la incidencia de infecciones de origen hospitalario del 16,66%.
Las BLEEs tipo TEM y tipo CTX-M son las más frecuentemente asociadas a E.cloacae. El tipo CTX-M-9 en E.cloacae ya había sido descrito previamente en Polonia13, Asia14, España15-20, Reino Unido21,22, Corea23-27, Estados Unidos28, Túnez29, Francia30, Holanda31, Alemania32, Taiwán33, China34,35 y Brasil36, siendo una de las más frecuentes junto con la CTX-M-15 y la CTX-M-3. Podemos ver que en España es donde más casos se han registrado de E.cloacae portador de CTX-M-9.
A pesar del predominio de CTX-M-9 en E.cloacae, solo se ha descrito un brote por este tipo de BLEE en una UCI cardiotorácica en el Hospital de Bellvitge (Barcelona) en el año 200519. Se han descrito otros brotes causados por E.cloacae productor de BLEE tipo CTX-M distintos a CTX-M-9, afectando en todos ellos a población infantil: 2 brotes por CTX-M-15 en una unidad de cirugía pediátrica en un hospital infantil finlandés37 y en una UCI neonatal en España3, y un brote por CTX-M-3 en un área de pediatría en un hospital de Japón38 (tabla 2). En nuestro caso, se describe el primer brote de E.cloacae complex portador de CTX-M-9 en una unidad de críticos no quirúrgica, estando asociado en la mayoría de los casos a infección o colonización respiratoria.
Revisión de los brotes descritos por Enterobacter cloacae productor de BLEE tipo CTX-M
| Publicación | Autor | Año publicación | Lugar del brote | País | Año aislamiento | Tipo BLEE |
|---|---|---|---|---|---|---|
| 1 | Pasanen37 | 2014 | Cirugía pediátrica | Finlandia | 2007-2008 | CTX-M-15 |
| 2 | Oteo3 | 2013 | UCI neonatal | España | 2010-2011 | CTX-M-15 |
| 3 | Manzur19 | 2007 | UCI cardiotorácica | España | 2005 | CTX-M-9 |
| 4 | Moriguchi38 | 2007 | Área pediátrica | Japón | 2002-2003 | CTX-M-3 |
Los carbapenems constituyen una opción terapéutica de primera línea de las infecciones causadas por E.cloacae, tanto en aquellas cepas hiperproductoras de AmpC (en las que la cefepima podría ser una alternativa) como en las que presentan BLEE39. Sin embargo, la aparición de resistencias a carbapenems por diferentes mecanismos, como metalo-β-lactamasas (MBL) o enzimas OXA-4840 (igual que la detectada en el período de estudio), amenaza el papel terapéutico de las mismas en dichas infecciones. Hay que señalar que la producción de carbapenemasas es poco frecuente en E.cloacae, aunque hay una creciente preocupación por su aparición y su rápida diseminación1,41. En el caso de nuestro brote, amikacina fue el tratamiento de elección en la mayor parte de los casos, y en segundo lugar los carbapenems.
En resumen, en este estudio se describe un brote causado por E.cloacae complex multirresistente portador de una BLEE de tipo CTX-M-9 en una UCI de adultos no relacionada con cirugía, a diferencia del brote previamente publicado19. Por otro lado, la presencia de una cepa no relacionada con el brote y productora de OXA-48 constituye un reflejo de la actual situación de diseminación de mecanismos de resistencia entre especies, que están cambiando de forma creciente la epidemiología en Enterobacteriaceae.
El abordaje de este brote se realizó desde 2 aspectos: la mejora de las medidas higiénicas estándar y el tratamiento antibiótico dirigido. Sin embargo, la evidencia del incremento en la prevalencia de cepas de E.cloacae complex multirresistentes apoya la necesidad de controlar su presencia y tomar las medidas de vigilancia epidemiológica adecuadas para evitar su diseminación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.