Estudios recientes confirman un aumento de la incidencia de infección aguda por el virus de la hepatitisC (HAC) en hombres que tienen sexo con hombres (HSH) infectados o no por el VIH. El tratamiento temprano con interferón-alfa, solo o asociado a ribavirina, reduce significativamente el riesgo de evolución a la cronicidad.
MétodosEstudio retrospectivo que incluye todos los pacientes VIH diagnosticados de HAC en nuestro centro desde junio del 2003 a marzo del 2013, definida la HAC por la seroconversión de anticuerpos contra el VHC y la detección de ARN-VHC sérico.
ResultadosSe diagnosticaron 93 episodios de HAC en 89 pacientes. Excepto en 3 casos todos eran HSH con antecedentes de prácticas sexuales de riesgo. Treinta y 7 (40%) pacientes presentaban otra enfermedad de transmisión sexual asociada. El 29% (27) presentaron algún síntoma sugestivo de HAC. El genotipo 4 del VHC fue el más frecuente (41%), seguido del genotipo1. En 70 casos se inició tratamiento con interferón-alfa y ribavirina ajustada a peso. En la actualidad 46 han finalizado el tratamiento y el seguimiento, alcanzando 26 de ellos (56,5%) una respuesta viral sostenida.
ConclusionesLa incidencia de HAC en los pacientes VIH HSH de nuestro centro ha aumentado de forma exponencial en los últimos años, siendo la transmisión sexual la vía principal de infección. El tratamiento precoz con interferón-alfa y ribavirina consigue una respuesta moderada en estos pacientes.
Recent studies suggest an increased incidence of acute infection with hepatitisC virus (AHC) in men who have sex with men (MSM) co-infected with HIV. Early treatment with interferon-alpha, alone or in combination with ribavirin, significantly reduces the risk of chronic evolution.
MethodsThis retrospective study includes all HIV patients with AHC in our centre from 2003 to March 2013. AHC was defined by seroconversion of HCV antibodies and detection of serum HCV RNA.
Results93 episodes of AHC were diagnosed in 89 patients. All but three were MSM with a history of unprotected sex. Thirty-seven (40%) patients had other associated sexually transmitted disease. The 29% (27) had any symptoms suggestive of AHC. HCV genotype 4 was the most common (41%), followed by genotype1. Seventy patients started treatment with interferon-alfa and weight-adjusted ribavirin. Currently 46 have completed treatment and follow-up, reaching 26 of them (56.5%) sustained viral response.
ConclusionsThe incidence of AHC in HIV MSM patients from our centre has increased exponentially in recent years; sexual transmission remains the main route of infection. Early treatment with interferon-alpha and ribavirin achieved a moderate response in these patients.
La principal vía de contagio del virus de la hepatitisC (VHC) es el contacto con sangre contaminada después de una transfusión o al compartir agujas en los pacientes que consumen drogas por vía intravenosa. El riesgo de transmisión por vía sexual es muy bajo, pero parece ser mayor en pacientes coinfectados con el VIH-11.
En los últimos 8años, un número creciente de casos de hepatitis aguda por el VHC (HAC) han sido reportados en grandes centros urbanos de Europa2-4, Estados Unidos5-7 y Australia8. Además, estudios longitudinales de cohortes han confirmado un aumento en la incidencia de VHC entre los pacientes hombres que mantienen relaciones sexuales con hombres (HSH)9,10. Recientemente, un análisis filogenético de las cepas del VHC, demostró la aparición de casos agrupados conforme a la transmisión dentro de una red social y sexual de pacientes HSH VIH que se extiende a nivel nacional e internacional dentro de determinados círculos sociales-sexuales10. El aumento de la incidencia de la HAC en este colectivo se ha atribuido a varios factores: la existencia de una mayor carga viral del VHC en sangre y semen de los pacientes con VIH11-13, ciertas prácticas sexuales en las que hay un mayor riesgo de daño de la mucosa, la presencia de enfermedades de transmisión sexual (ETS) que pueden presentarse con ulceración de la mucosa como la sífilis o el linfogranuloma venéreo14, un mayor número de parejas sexuales15 y el uso de drogas recreativas como el gamma-hidroxi-butirato (GHB)16. Sin embargo, existen casos descritos de HAC entre los HSH que niegan todos los factores de riesgo mencionados anteriormente. En este artículo se describe la experiencia en HAC en pacientes VIH positivos acumulada en una década en nuestro centro, poniendo especial énfasis en el alarmante aumento de su incidencia en los últimos 2 años.
MétodosPacientesSe incluyeron de manera retrospectiva todos los pacientes VIH que fueron diagnosticados consecutivamente de HAC entre junio de 2003 y marzo de 2013 en el Servicio de Infecciones del Hospital Clínico de Barcelona.
A los pacientes seguidos en esta unidad se les realiza un seguimiento rutinario de la infección crónica por el VIH cada 6meses que consta de una evaluación clínica además de un estudio analítico completo que incluye las enzimas hepáticas aspartato aminotransferasa (AST) y alanina aminotransferasa (ALT). Los anticuerpos anti-VHC se solicitan en el momento del diagnóstico de la infección por el VIH y posteriormente se actualizan cada 2años, o antes si el médico lo cree conveniente en caso de que existan factores de riesgo para contraer una infección por el VHC. Todos los pacientes que tuvieron un aumento inexplicable del valor de las enzimas hepáticas (>1,5 veces el límite superior de la normalidad) durante el control rutinario de la infección por el VIH y todos los pacientes con signos clínicos de hepatitis aguda (artralgias, ictericia, fatiga intensa, orina colúrica o heces acólicas) fueron examinados con la intención de descartar una HAC.
El diagnóstico de la HAC se realizó en base a la documentación de la seroconversión del anti-VHC (ELISA 3.ª generación: Advia Centaur HCV, Siemens Healthcare Diagnostics Inc. Tarrytown, NY 10591-5097 EE.UU.), presencia de un ARN-VHC positivo tras un ensayo de transcripción mediada (Versant ARN-VHC ensayo cualitativo, TMA), límite de detección de 615UI/ml, Siemens Healthcare Diagnostics Inc. Tarrytown, NY 10591 hasta 5097 EE.UU.) y una cuantificación de ARN-VHC por Versant 3,0 Ensayo (bDNA), límite de detección de 5UI/ml (Siemens Healthcare Diagnostics Inc. Tarrytown, NY EE.UU. 10591 a 5097).
También se registraron los datos sobre el comportamiento sexual y otros factores de riesgo clásicos para el contagio del VHC.
Evaluaciones virológicasEl genotipo del VHC se determinó por RT-PCR/RFLP17.
Para estimar la fecha del contagio del VHC y confirmar la existencia de una HAC, en varios pacientes se estudió la existencia de anticuerpos anti-VHC y ARN-VHC en una muestra de plasma almacenada en el laboratorio de microbiología obtenida durante los 12meses previos al diagnóstico.
SeguimientoTras el diagnóstico de HAC, los pacientes fueron visitados cada 2 o 3semanas para su control clínico, evaluar la evolución de la inflamación hepática (el valor de las transaminasas) y la caída del ARN-VHC. A los pacientes que no aclararon espontáneamente el ARN-VHC a las 16-20semanas después de la fecha estimada del contagio del VHC se les ofreció iniciar tratamiento con interferón pegilado (PegIFN) alfa-2b (1,5mg/kg/semana) o PegIFN alfa-2a (180μg/semana) más ribavirina (RBV) (800-1.200mg/día ajustado por peso corporal) durante 24semanas. La curación, definida como respuesta viral sostenida (RVS), se determinó a las 24semanas después de finalizar el tratamiento.
El tratamiento antirretroviral para el VIH que llevaban los pacientes se mantuvo durante el tratamiento para el VHC. Los pacientes fueron visitados cada 2 semanas durante el primer mes y cada 4 semanas hasta el final del período de tratamiento, y luego cada 3 meses en el período de seguimiento.
Análisis estadísticoSe llevó a cabo un análisis descriptivo de las variables basales, incluyendo las medidas de tendencia central y de dispersión. Se utilizó un análisis de regresión logística univariante para confirmar la importancia de los factores pronósticos de RVS. Los factores que mostraran asociación en el análisis univariante (p<0,1) se considerarían como candidatos para ser incluidos en el análisis de regresión logística multivariante. El nivel de significación estadística se definió como un valor de p-valor bilateral <0,05. Los datos fueron analizados por STATA (StataCorp. 2005 Stata Statistical Software: Release 9,2 College Station, TX. Stata Corporation).
ResultadosCaracterísticas basales de los pacientes incluidosLas características basales de los pacientes se describen en la tabla 1.
Características basales de los pacientes
| Todos (n=93), media (DE) | |
|---|---|
| Edad, años | 38 (7) |
| Peso, kg | 71 (11,2) |
| Tiempo entre el VIH y diagnóstico VHC, años | 6,2 (5) |
| CD4 basales (células/ml) y % | 569 (256,23) - 27,29 (8,70) |
| VIH-CV basal (cop/ml) | 10748 (32873) |
| Clasificación CDC | |
| A | 70 (75,26) |
| B | 9 (9,6) |
| C | 14 (15,05) |
| Tratamiento antirretroviral, n (%) | 71 (76) |
| Síntomas VHC | 27 (29) |
| ARN-VHC más elevado pretratamiento, UI/ml | 2665146 (4250435) |
| AST más elevada, IU/ml | 342,26 (359,13) |
| ALT más elevada, IU/ml | 379,81 (296,16) |
| VHC genotipo (n = 84) | |
| 1 | 38 (40) |
| 2 | 1 (1) |
| 3 | 3 (3) |
| 4 | 39 (41) |
| 1 y 4 | 1 (1) |
| No tipable | 2(2) |
| Otras ETS | 37 (40) |
| Tiempo entre contagio-diagnóstico, meses | 3 (1,28) |
| Tiempo entre diagnóstico-tratamiento, meses | 2,6 (1,3) |
| Tratamiento con Peg-IFN (n = 67) | |
| PegIFNα 2a | 39 (41) |
| PegIFNα 2b | 28 (30) |
ALT: alanina aminotransferasa; AST: aspartato aminotransferasa; CDC: Centers for Disease Control and Prevention; ETS: enfermedades de trasmisión sexual;
PegIFN: interferón pegilado; RVS: respuesta viral sostenida; VHC: virus hepatitisC; VIH: virus de la inmunodeficiencia humana.
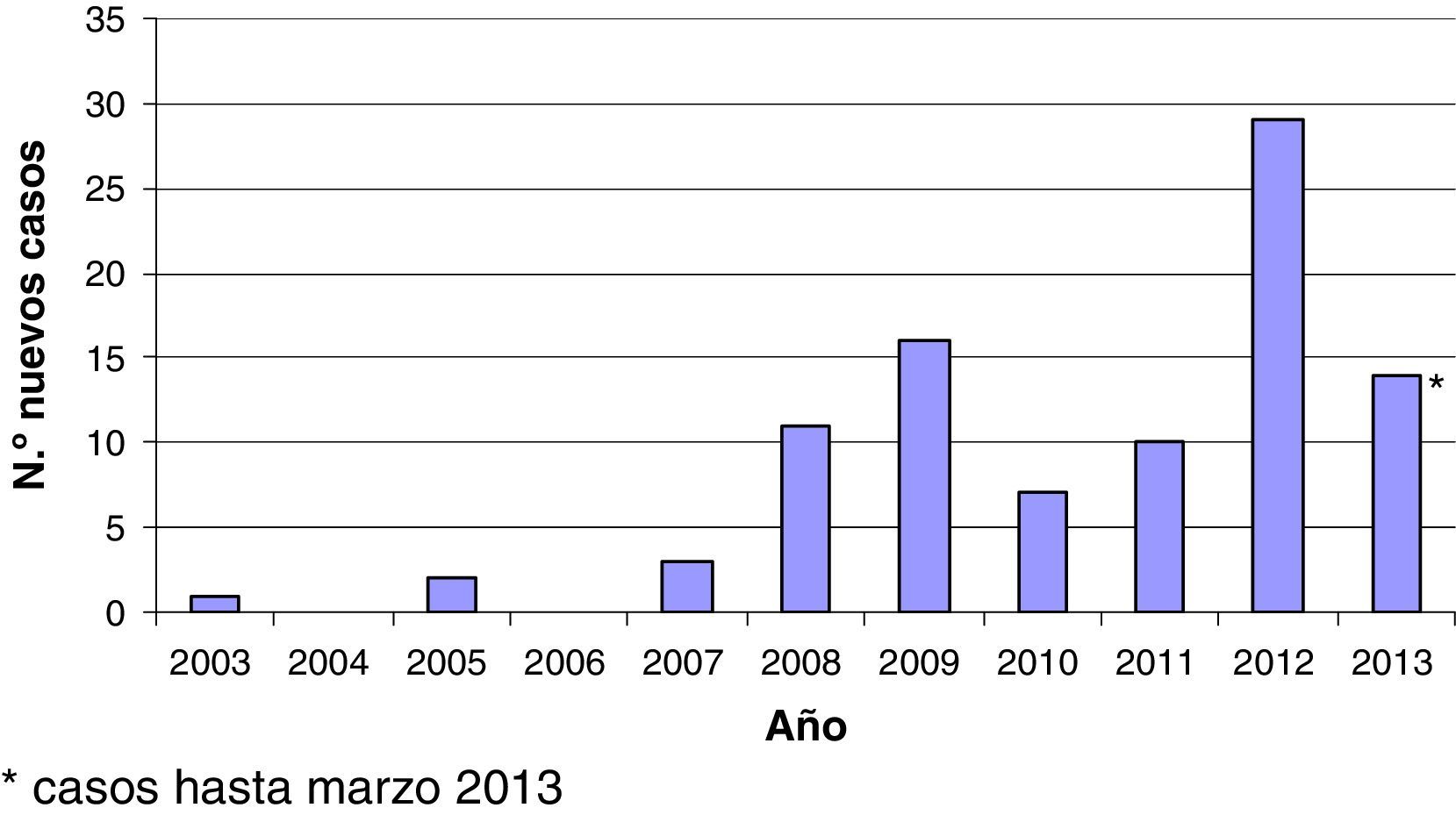
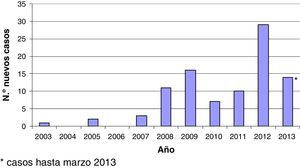
El estudio recoge 93 episodios de HAC que corresponden a 89 pacientes VIH positivos que fueron diagnosticados consecutivamente de HAC entre junio de 2003 y marzo de 2013 (fig. 1). Entre 2003 y 2006 solo 3 pacientes fueron diagnosticados, desde 2006 a 2011 se diagnosticó una media de un caso nuevo/mes, y en los últimos meses destaca un aumento claro de la incidencia de diagnósticos de HAC en nuestro medio. Excepto 3 casos, todos los pacientes eran hombres con prácticas sexuales de riesgo (es decir, sexo sin protección con otros hombres). Un varón toxicómano activo presentó una infección aguda por el VHC recogiendo como único factor de riesgo para el contagio el consumo de heroína intravenosa. Las 2 pacientes de sexo femenino incluidas en nuestra serie contrajeron la infección por VHC por contacto heterosexual una y por una posible transmisión nosocomial la otra. La media de edad fue de 38años (desviación estándar [DE]: 7). El tiempo medio de evolución desde el diagnóstico del VIH hasta el diagnóstico de la infección aguda por el VHC fue de 6,2 (DE: 5) años. En 5 casos, la HAC y el diagnóstico del VIH fueron concomitantes. En estos casos el único factor de riesgo para el contagio que existió en los 6 meses previos al diagnóstico fueron las relaciones sexuales sin protección. Setenta y un pacientes estaban tomando terapia antirretroviral combinada antes del diagnóstico de HAC. Todos ellos, excepto 2, tenían una carga viral indetectable en sangre y un recuento de células CD4>200células/μl (mediana: 511células/μl). Catorce pacientes pertenecían a la categoríaC en la clasificación de los CDC para la infección por el VIH. La mayoría de los pacientes incluidos estaban inmunizados contra la hepatitisA y B (84 y 85%, respectivamente). Treinta y siete pacientes presentaron de forma concomitante a la HAC otra enfermedad de transmisión sexual: sífilis aislada en 17 pacientes; sífilis más uretritis por gonococo y Chlamydia en 3; sífilis más linfogranuloma venéreo 3 pacientes; 3 uretritis por gonococo y Chlamydia; 5 con linfogranuloma venéreo; 5 pacientes con diagnostico reciente de VIH, y una balanitis herpética.
Características de la hepatitis aguda CVeintisiete pacientes (29%) presentaron síntomas asociados con el episodio de HAC que permitieron sospechar dicho diagnóstico: astenia en 8 pacientes, mal estado general y coluria en 15 pacientes, molestias digestivas/dolor en hipocondrio derecho, náuseas, en 5 pacientes, fiebre en 4, y 3, ictericia. En los 66 pacientes restantes, la HAC cursó de modo asintomático y el diagnóstico de sospecha se basó en la elevación de transaminasas en la analítica de control de la infección por VIH. En la mayoría de los pacientes se objetivó la seroconversión de anticuerpos anti-VHC, ya que disponíamos de controles seriados analíticos para poder realizar el diagnóstico de la infección aguda por el VHC. En solo 4 casos fue necesario solicitar al laboratorio de microbiología una determinación en un suero congelado (6meses previos) de anticuerpos contra el VHC y ARN-VHC. La determinación de ambos fue negativa en los 4 pacientes, confirmando el diagnóstico de sospecha de HAC. El tiempo medio entre la exposición de riesgo conocida o sospechada y el diagnóstico de la infección aguda por el VHC fue de 3 meses (DE: 1,28meses). El valor plasmático medio de la AST fue de 342 (DE: 359) UI/l y la ALT era de 517 (404-777) UI/l al diagnóstico. El genotipo del VHC se identificó en 84 pacientes: genotipo1 en 38 pacientes (45%), genotipo2 en un paciente, genotipo3 en 3 pacientes (3,6%), genotipo4 en 39 (46%), un paciente infectado por 2 genotipos (1 y 4) y 2 no tipables. El valor medio basal del ARN-VHC en plasma fue de 2665146 (SD 4250435) UI/ml.
ResultadoLa infección aguda por el VHC se resolvió espontáneamente en 4 pacientes dentro de las 12 semanas después del diagnóstico.
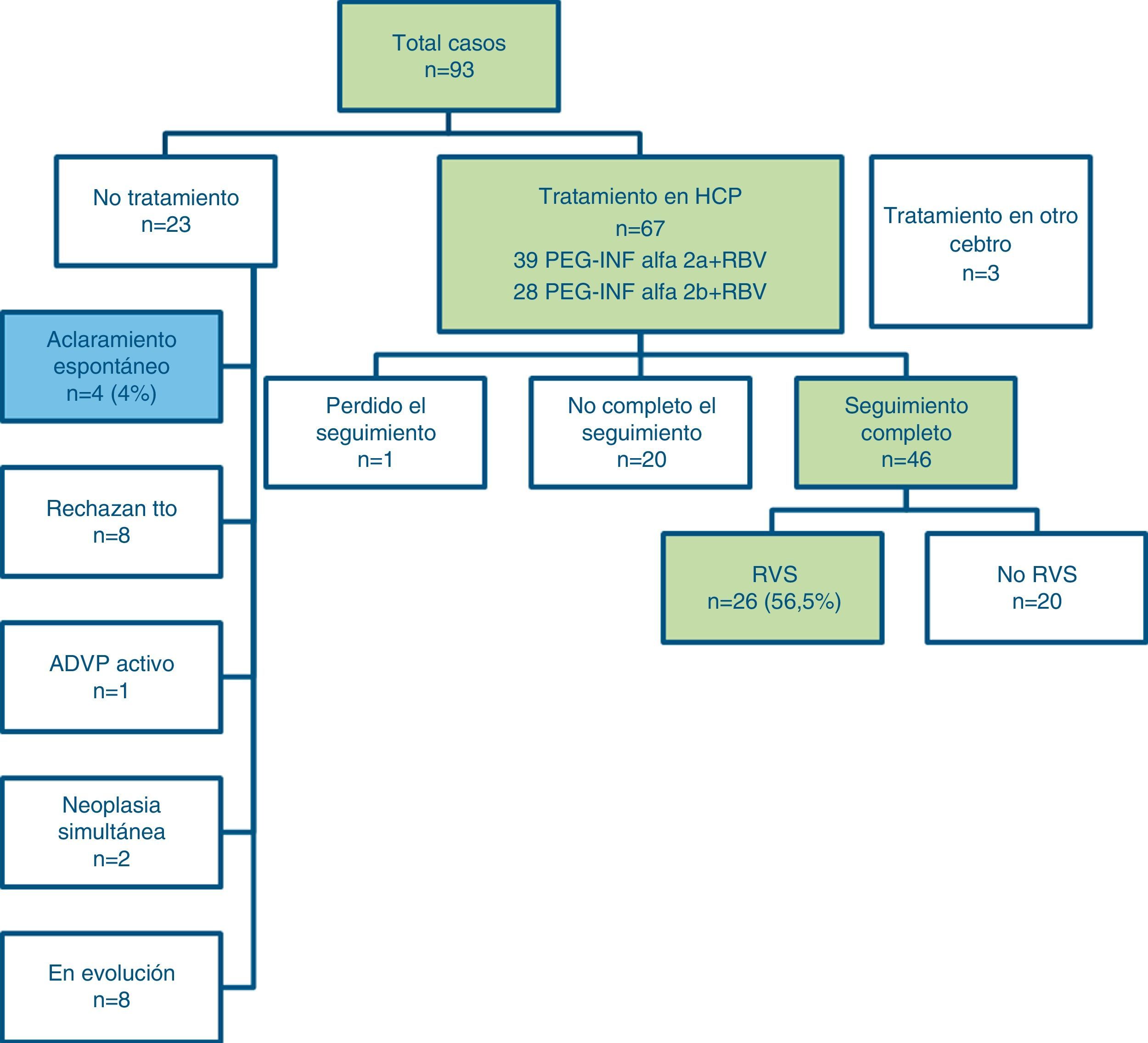
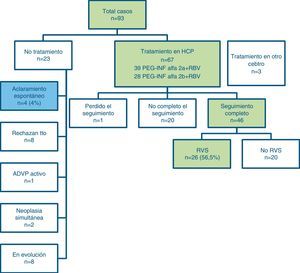
El tratamiento para el VHC se inició entre las 12 y las 24 semanas tras el diagnóstico de la hepatitis en 70 casos, 3 de ellos en un centro hospitalario distinto del nuestro por decisión del paciente en relación a cambio de domicilio. Dos pacientes tenían un tumor maligno (adenocarcinoma rectal) que requirió tratamiento quirúrgico prioritario; 8 pacientes rechazaron la terapia; no se consideró oportuno tratar la HAC en el paciente con consumo activo de drogas por vía intravenosa. No se ha completado la evaluación en 8 casos por estar pendientes de la evolución analítica para decidir iniciar el tratamiento (fig. 2).
Terapia antiviralEficaciaLa media de tiempo entre el diagnóstico de la infección aguda por el VHC y el inicio de un tratamiento específico fue de 2,6 (DE: 1,3) meses.
De los 67 pacientes tratados en nuestro centro hasta marzo del 2013, 39 han recibido PegIFN alfa-2a y 28 han recibido PegIFN alfa-2b, combinando en ambos casos con RBV (dosis ajustada a peso). Los resultados de los primeros 46 pacientes que han completado el tratamiento y seguimiento a las 24 semanas postratamiento se presentan en la figura 2. El tratamiento está en curso en los otros pacientes, excepto un paciente que se perdió durante el seguimiento. En nuestra cohorte, 26 pacientes (56.5%) presentaron una RVS al tratamiento.
Dieciocho pacientes fueron no respondedores (es decir, el ARN del VHC fue detectable durante y después del tratamiento) y 2 pacientes presentaron recidiva viral 3-6 meses después de la finalización del tratamiento. Ambos pacientes presentaron RVS al retratamiento durante 6meses más. No se pudo determinar si estos 2 casos fueron recaídas tardías o posibles reinfecciones. El estudio del genotipo viral mostró la misma infección por el genotipo1a en el primer paciente e igual infección viral doble por genotipos1 y 4 en el segundo. Veintiún pacientes, de los 46 que iniciaron el tratamiento y finalizaron el periodo de seguimiento, presentaron una respuesta viral rápida (RVR) (ARN-VHC inferior al límite de cuantificación, 5UI/ml). De ellos, 20 obtuvieron una RVS.
El único paciente que no lo consiguió presentaba un valor de ARN-VHC muy bajo pero detectable en las semanas 4 y 12. El valor predictivo positivo (VPP) de RVS en los pacientes que alcanzaron RVR fue del 95,2%.
Treinta y tres pacientes mostraron una respuesta virológica precoz (RVP), definida como un descenso ≥2log del ARN del VHC desde el inicio hasta la semana 12. Entre estos pacientes, 6 no alcanzaron la RVS (VPP 75%). Cuatro de estos pacientes tenían una carga viral muy baja (valor de ARN-VHC <5UI/ml). Ninguno de los pacientes que no alcanzaron RVP obtuvo RVS, por lo que el valor predictivo negativo (VPN) de no alcanzar RVP fue del 100%.
Centrándonos en el subgrupo de pacientes que alcanzaron RVP completa (RVPc), definida como ARN indetectable por una técnica cualitativa en la semana 12, todos excepto 2 de los pacientes alcanzaron la RVS (VPP: 91,6%). Solo uno de los pacientes que no consiguió la RVPc alcanzó la RVS, por lo que el VPN de no alcanzar RVPc fue del 94,4%.
En el análisis univariado, solo los valores de RVR (p<0,0002) se asociaron significativamente con una mayor probabilidad de RVS. El análisis multivariado no se pudo realizar porque era la única variable que cumplió los criterios de inclusión.
Efectos adversosUn paciente presentó una anemia hemolítica grave que provocó la hospitalización y la retirada de RBV. El paciente completó 24semanas de PegIFN sin lograr respuesta viral. En 2 casos se redujo transitoriamente la dosis de ribavirina por anemia; en otros 3 pacientes se redujo la dosis de PegIFN, durante 2-3semanas, por neutropenia. En ningún caso fue necesario el uso de factores de crecimiento.
En 8 pacientes se suspendió el tratamiento por falta de respuesta viral en la semana 12 (disminución de ARN-VHC inferior a 2log10).
Doce pacientes presentaron síntomas depresivos durante el tratamiento, y a 7 de ellos se le prescribió tratamiento con citalopram entre las semanas 4 y 24 de tratamiento. A otros 2 se les pautó mirtazapina por dificultad para conciliar el sueño. Como era de esperar, las células CD4+ se redujeron ligeramente (un 30% en valor absoluto) durante el tratamiento de la HAC. No se observaron cambios en la carga viral de VIH durante el seguimiento de los pacientes.
DiscusiónAl igual que lo ocurrido en varias ciudades de Europa, América del Norte y Australia, hemos podido observar un brote de hepatitisC aguda entre los pacientes seropositivos que practican sexo desprotegido con varones en España. A pesar de la alta prevalencia de la hepatitisC crónica en los países mediterráneos, hasta el momento son pocos los datos reportados de brotes de HAC en la comunidad de HSH VIH positivo en esta área18-21. Excluyendo los 2 pacientes de sexo femenino, todos excepto uno de los pacientes incluidos en nuestra serie con HAC tenían como factor de riesgo para contraer la infección las prácticas sexuales de riesgo. La curva de incidencia de la HAC en nuestro centro muestra un progresivo incremento a lo largo de los últimos 5 años con un claro aumento de la incidencia en los últimos meses. Valoramos que existe un porcentaje elevado de pacientes que presentaron de forma concomitante otra enfermedad de transmisión sexual, en muchos casos ulcerativa, que aumentaría el riesgo para el contagio del VHC. Además, existen otros factores virales propios que podrían propiciar un mayor riesgo de transmisión; en este sentido, existen datos en la literatura que describen un cambio en la virulencia de la hepatitisC en los últimos años22. Similar a lo reportado en otros estudios1-4,23,24, se ha observado una mayor frecuencia inesperada para nuestra área geográfica del genotipo4. Este hallazgo puede atribuirse a la existencia de entornos concretos cerrados donde los pacientes podrían entrar en contacto con la misma cepa viral.
La ictericia es un signo clínico característico de la población monoinfecta por el VHC, pero estuvo presente en solo un pequeño porcentaje de nuestros pacientes VIH. Esta baja prevalencia también se ha descrito en otros artículos23. En la mayoría de los casos el diagnóstico de HAC se realizó durante la visita rutinaria de control de seguimiento de los pacientes con VIH, y se sospechó al valorar una elevación de las transaminasas en la analítica. A tenor de los datos presentados y revisando la literatura reciente, consideramos que el VHC se ha convertido en los últimos años en una enfermedad de transmisión sexual en pacientes HSH VIH positivos1,23-25, mientras que su prevalencia como una infección aguda en la población HSH VIH negativos sigue siendo baja26,27. La HAC puede presentarse como un co-infección acompañando el diagnóstico del VIH, sífilis, gonorrea, o linfogranuloma venéreo. En nuestra cohorte, en más de un tercio de los pacientes esta fue la forma de presentación. Por lo tanto, creemos que debe solicitarse una serología VHC dentro del estudio general en cualquier paciente examinado para una ETS. La tasa de aclaramiento viral espontáneo en la presente serie fue muy baja. Diferentes estudios4,23,24,28-31 publicados muestran un amplio abanico en cuanto a la tasa de resolución espontánea de la HAC, entre el 4 y el 27%. Se conoce que el VIH, la falta de síntomas y el sexo masculino son factores que están asociados con un mayor riesgo de progresión a cronicidad32,33.
Existen datos muy interesantes en la literatura sobre la relación entre ciertos polimorfismos genéticos y la eliminación espontánea y la RVS al tratamiento del VHC34,35. Recientemente, 2 estudios han descrito que el polimorfismo de la IL28B homocigotoC/C se relaciona con mayor tasa de RVS al tratamiento con interferón pegilado y ribavirina en el paciente VIH positivo con infección crónica por el VHC36,37. Sin embargo, los mismos autores no hallaron esta relación en el caso de la HAC37. Desafortunadamente, no podemos ofrecer información sobre esta posible relación en nuestro caso. Esta técnica se ha incorporado en la práctica clínica diaria de nuestro servicio recientemente, y en el momento de análisis de los datos reportados aquí no disponíamos de suficiente número de pacientes testados.
Pensamos que posiblemente algunos pacientes en nuestro hospital pueden haber contraído una HAC y podrían haber aclarado espontáneamente la viremia, pero que no se llegó a hacer el diagnóstico por presentar pocos síntomas y porque en sus controles analíticos no se detectó alteración importante del perfil hepático. Por otro lado, estamos convencidos de que el brote descrito de HAC en nuestro centro es únicamente la punta del iceberg y que muchos pacientes estarán contrayendo una infección por el VHC, y dado que no presentan síntomas y tampoco siguen controles analíticos rutinarios, pasarán sin ser diagnosticados durante meses o años, y en el futuro serán identificados como portadores de una hepatopatía crónica por el VHC.
Los datos sobre la eficacia de la terapia anti-VHC en pacientes VIH seropositivos con HAC son limitados y se basan en los resultados de estudios pequeños38,39. La monoterapia con interferón ha demostrado una pobre tasa de RVS (0-10%)2-4,40. Algunos autores41 no encontraron ninguna ventaja de la adición de ribavirina al PegIFN, pero otros8,28 obtuvieron mayores tasas de RVS con el tratamiento combinado. La duración óptima del tratamiento no está bien establecida, y la conferencia de consenso NEAT, en base a los resultados de diferentes estudios, propone un curso de 24 semanas de terapia y aboga por alargar la duración del tratamiento para los pacientes con respuesta inicial lenta (sin RVR pero con RVP)42.
En nuestro hospital hemos utilizado la terapia combinada con PegIFN más RBV durante 24 semanas. Se obtuvo una tasa moderada de RVS, cercana al 55%, similar a lo reportado en un estudio de cohortes de pacientes de VIH en Estados Unidos23, pero inferior a la obtenida por otros autores8,29,41. Muy recientemente43 se han comunicado los resultados de un estudio piloto donde se evalúa la posibilidad de realizar un tratamiento más corto, de 12 semanas, con terapia triple con interferón pegilado+RBV asociado a un inhibidor de la proteasa, el telaprevir, obteniendo una RVS del 85%, muy superior a la obtenida con la biterapia actual.
La infección por el VHC curada no deja inmunidad. Existe un elevado riesgo de reinfección en pacientes HSH VIH positivo que ha sido bien documentado33,34 y que hemos podido corroborarlo en 5 pacientes en nuestra serie. Estos datos refuerzan la necesidad de realizar campañas de promoción de la salud y prevención de ETS en esta población. Debido al pequeño número de pacientes incluidos en los estudios publicados, la identificación de factores predictivos de respuesta es muy difícil. Ciertos factores han sido asociados con RVS: ALT basal elevada y valor de CD425, HAC sintomática44 y descenso rápido del ARN-VHC8,41,45. En nuestro estudio, ninguna de las variables basales se relacionó con la RVS; solo la RVR se correlacionó positivamente con la RVS.
La cinética viral parece clave en la identificación de los pacientes VIH positivos con HAC que presentarán una buena respuesta. Si el VHC es negativo en la semana 4, la posibilidad de eliminar el virus es muy alta; en nuestra cohorte, el VPP fue del 95,2%, similar a los valores reportados en otros estudios41,44,46. A la inversa, no conseguir la RVP en la semana 12 es un indicador fiable de la falta de respuesta a la terapia y puede ser utilizado como marcador de interrupción del tratamiento.
En este estudio, como en otros artículos publicados previamente8,29, no se evidenció una relación clara entre la respuesta al tratamiento y el intervalo de tiempo entre el diagnóstico de la hepatitis aguda y el inicio del tratamiento: la terapia del VHC no fue más efectiva cuando se inició en las primeras 12 semanas después del diagnóstico de la HAC o cuando se comenzó más tarde (entre las 12 y 24 semanas).
Unas de las limitaciones principales de este estudio es que solo se dispone del resultado de RVS en 46 de los 89 pacientes, pero son los datos de seguimiento que tenemos hasta la fecha de análisis de este estudio.
En conclusión, se ha detectado un importante aumento en la incidencia de HAC en pacientes VIH en nuestro centro en los últimos 5años. La mayoría presentan como vía de contagio la sexual, y en el 40% la infección por el VHC se asociaba a otra ETS. El tratamiento de la infección por el VHC en pacientes co-infectados con PegIFN más RBV durante 24 semanas obtuvo una moderada tasa de RVS en nuestra cohorte de 89 pacientes. Se requieren esfuerzos de prevención con el fin de reducir el número de nuevas infecciones. La revisión regular en esta población ayudará a diagnosticar infecciones agudas por VHC. Por último, parece esencial evaluar nuevas estrategias de tratamiento del VHC en pacientes coinfectados para mejorar la RVS y evitar la progresión a la cronicidad.Conflicto de intereses
Maria Martínez-Rebollar es beneficiaria de la ayuda Sara Borrell CD13/00123 del Instituto de Salud Carlos III, Ministerio de Economía y Competitividad, Gobierno de España. El resto de autores no declaran ningún conflicto de intereses.