Se describe la investigación de un brote por Listeria monocytogenes en una Unidad de Neonatos.
MétodosSe realizó una encuesta epidemiológica, recogida de muestras ambientales y estudio de epidemiología molecular.
ResultadosSe trata de un brote nosocomial de infección por L. monocytogenes, confirmado por epidemiología molecular, en una Unidad de Neonatos que afectó a tres niños. La cadena de transmisión no pudo ser confirmada, pero se sospecha una transmisión cruzada vehiculizada por las manos del personal.
ConclusiónLa estricta adherencia a las medidas de prevención estándar es necesaria para evitar estos brotes nosocomiales.
Description of an outbreak of Listeria monocytogenes in a neonatal intensive care unit.
MethodsA questionnaire, environmental investigation and molecular study were performed.
ResultsWe identified a nosocomial outbreak of L. monocytogenes, confirmed by the genetic study, in a neonatal intensive care unit. Three infants were affected. Although the transmission mechanism could not be elucidated, cross-infection was strongly suggested.
ConclusionAdherence to universal hygiene standards is necessary to avoid nosocomial outbreaks.
Listeria monocytogenes es una bacteria gram positiva de forma bacilar. Por lo general, se manifiesta en los recién nacidos y adultos como meningoencefalitis, septicemia o ambas y en las mujeres embarazadas por corioamnionitis que puede producir el aborto. Se transmite habitualmente por ingestión de alimentos contaminados. En las infecciones neonatales se puede transmitir de la madre al feto en el útero o durante el paso por el conducto del parto infectado. El periodo de incubación va de 3 a 70 días1. También, aunque no es frecuente, en la literatura se han descrito brotes de infección nosocomial por contaminación cruzada2–9.
A continuación, se describe el estudio epidemiológico de un brote nosocomial de infección por L. monocytogenes en una Unidad de Neonatos.
Pacientes y métodosNotificaciónEn junio de 2010, se notificó al Servicio de Epidemiologia de la Agencia de Salud Pública de Barcelona dos casos de infección por L. monocytogenes en recién nacidos, uno de ellos con antecedentes de listeriosis materna y el otro sin antecedentes de infección materna que habían ingresado en una Unidad de Neonatos. Posteriormente, se identifica un tercer caso en otro recién nacido sin antecedentes de listeriosis materna, que también había ingresado en la Unidad de Neonatos y había coincidido con los casos previos.
Resumen de casos:
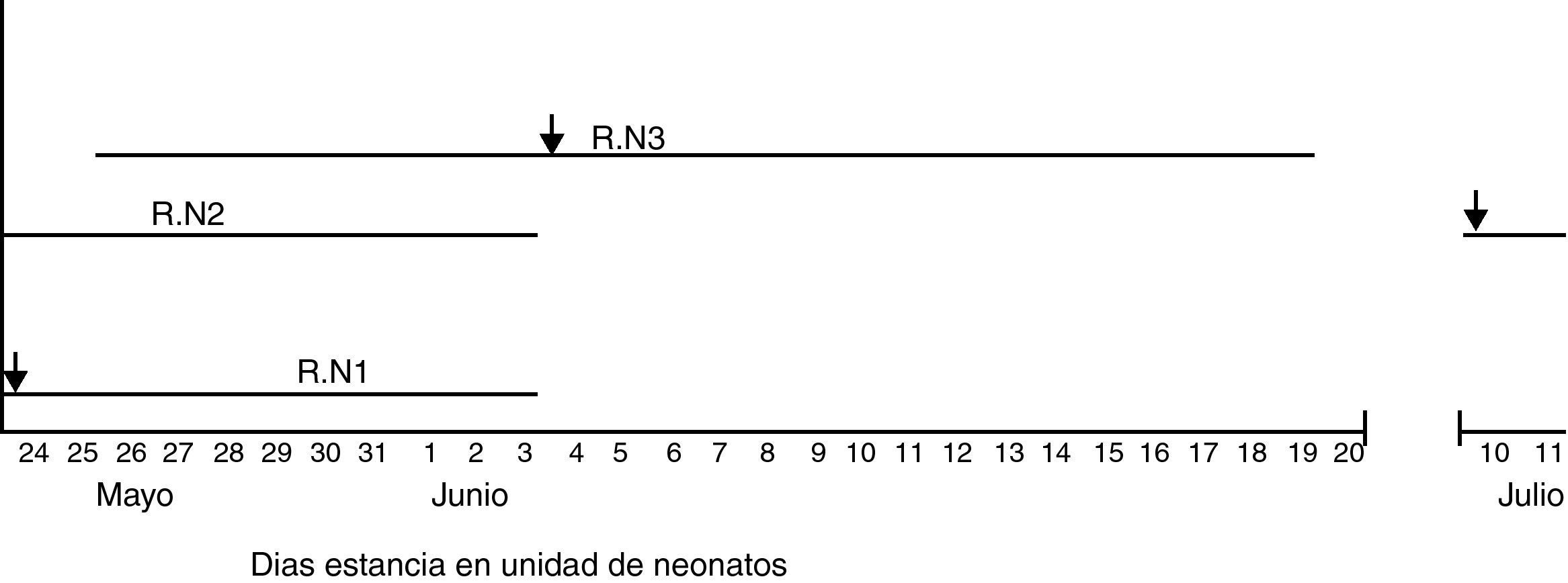
Recién nacido 1: niño nacido el 24/05/2010 de 35 semanas, ingresa en la Unidad de Neonatos el mismo día (fig. 1). Parto por cesárea por sospecha de corioanmionitis materna, posteriormente se aísla L. monocytogenes en los cultivos de placenta. Nace con depresión respiratoria y bradicardia que precisó reanimación e intubación. Se aísla L. monocytogenes en los cultivos periféricos, siendo negativos el hemocultivo y el cultivo de líquido cefalorraquídeo (LCR). La bioquímica del LCR no presentó alteración.
Recibió tratamiento con ampicilina y gentamicina endovenosas durante 8 días.
Recién nacido 2: niña nacida el 24/05/2010. Ingresa a la Unidad de Neonatos, área de cuidados intermedios, el mismo día por prematuridad leve. Fue alta el 31/05/2010. Durante este primer ingreso no se habían realizado cultivos. Reingresa el 10/07/2010 por meningitis por L. monocytogenes, confirmada por cultivo positivo del LCR. Se trató inicialmente con ampicilina y cefotaxima, hasta conocerse el resultado de los cultivos, momento en que se siguió con ampicilina endovenosa hasta un total de 3 semanas.
Recién nacido 3: niña nacida el 26/05/2010. Ingresa en la Unidad de Neonatos el mismo día por prematuridad, en el área de cuidados intermedios. El 4/06/2010, al noveno día de vida, presenta deterioro del estado general con hiporreactividad. Posteriormente, en un hemocultivo se aísla L. monocytogenes. Recibe tratamiento inicial con teicoplanina y amikacina según protocolo de sospecha de infección nosocomial, pero al confirmarse el crecimiento de L. monocytogenes se cambia a ampicilina y gentamicina, que recibe durante 10 días.
Todos los recién nacidos evolucionaron adecuadamente. No hubo ningún éxitus y en el seguimiento hasta la fecha no se han encontrado secuelas neurológicas.
Características de la Unidad de NeonatologíaLa Unidad de Neonatología ocupa un área aproximada de 220 m2, de los cuales un 30% aproximadamente se destina a cuidados intensivos (UCI) y un 60% a cuidados intermedios-prealta, sin separación arquitectónica entre ambos. Por sus recursos asistenciales se clasifica como unidad de nivel IIIb10. Tiene capacidad para 4-5 pacientes de UCI y 15-18 pacientes de cuidados intermedios. Los pacientes son atendidos por un total de 3 enfermeras por turno, con ayuda adicional de una auxiliar si la carga asistencial lo requiere. Las enfermeras atienden indistintamente a niños de UCI y de cuidados intermedios. Se reciben un total de 250 ingresos al año, de los cuales un 10% aproximadamente son prematuros de muy bajo peso (<1-500g).
Investigación epidemiológicaSe definió como caso perteneciente al brote aquellos recién nacidos diagnosticados de listeriosis por microbiología que estuvieron en la Unidad de Neotanos entre el 24/05/2009 y el 03/06/2010 (periodo que duró el ingreso del caso 1).
Se realizó búsqueda activa de casos, que consistió en revisión de historias clínicas en busca de signos y síntomas sugestivos de listeriosis y de cultivos del laboratorio de microbiología de los 6 meses previos a la aparición del primer caso y posteriormente, se continuó haciendo vigilancia microbiológica y clínica hasta pasado dos periodos de incubación.
En cada caso se hizo una encuesta epidemiológica destinada a valorar posibles exposiciones de riesgo en la unidad. En la encuesta se recogió información sobre: procedimientos para la alimentación, la leche de lactancia utilizada, uso de biberones, tetinas y jeringas para alimentación; tratamientos recibidos; procedimientos y productos utilizados para la higiene; procedimiento para el uso del cambiador de pañales; procedimientos para la cura del ombligo, otros procedimientos médicos realizados ej.- intubación, aspiración de secreciones e identificación del personal sanitario a cargo de cada paciente. Se procedió a la recogida de muestras ambientales de las superficies de preparación de los alimentos, superficies del cambiador de pañales, mostrador de enfermería y teclados de ordenador, incubadoras, cunas, estantes y mesitas próximas al paciente. Se hizo estudio molecular de las cepas aisladas.
Métodos de laboratorioEn la unidad solo se toman habitualmente muestras de cultivo de los niños con síntomas clínicos o cuando hay sospecha de enfermedad materna. Se remitieron al laboratorio muestras de placenta (cara materna y cara fetal) y periféricos del neonato (ótico, faríngeo, rectal) recogidas en escobillones con medio (Amies, DELTALAB, Rubi, España), hemocultivos pediátricos (botellas Bact/Alert PF, Biomérieux SA, Francia) y muestras de LCR en tubos estériles. Se procedió a la siembra en placas de agar sangre de cordero 5%, agar chocolate PVX (Biomérieux SA, Francia). Para muestras de placenta, rectales periféricas y líquido cefalorraquídeo (LCR) se añadió una siembra en placa de agar McConkey (Biomérieux SA, Francia). Las muestras de placenta y LCR se sembraron también en tubos de tioglicolato (Biomérieux SA, Francia). Se incubaron en estufa de CO2 al 5%, según periodo establecido (48 horas para las placas y en el caso del caldo de cultivo, 5 días para el líquido cefalorraquídeo y 72 horas para las muestras de placenta) realizándose su lectura correspondiente, cada 24 horas. En aquellos casos donde el tioglicolato se positivizó se realizaron resiembras en placa.
En todos aquellos cultivos que se observó crecimiento de colonias beta hemolíticas se procedió a realizar una prueba de la catalasa y una tinción de gram. Una vez confirmada la presencia de bacilos gram positivos catalasa positivos se realizó la identificación mediante el sistema automatizado Vitek 2, usando la tarjeta de identificación GP para gram positivos (Biomérieux SA, Francia) con el correspondiente antibiograma por el método de disco-difusión (Bio-disc, Biomérieux SA, Francia) en placas de agar Mueller-Hilton sangre (Biomérieux SA, Francia) con suspensión al 0,5 McFarland. Todas las cepas aisladas se almacenaron en tubos de congelación (vibakstore mixed, Nirco, Barcelona, España) para posterior estudio molecular.
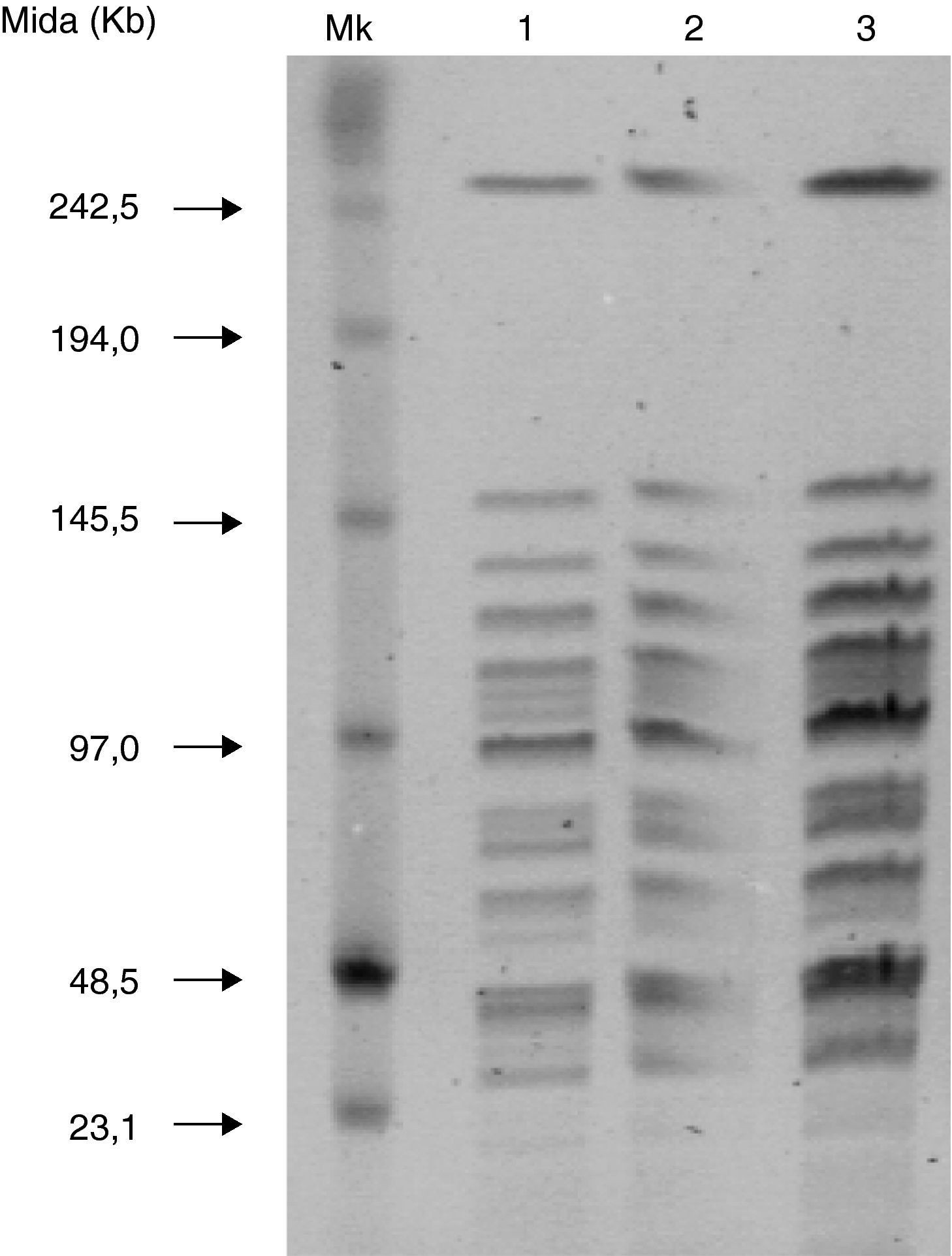
Electroforesis en campo pulsante (PFGE): el proceso de preparación de los insertos y lisis celular se ha realizado según el protocolo descrito anteriormente por Lukinmaa et al.11, añadiendo mutanolisina al tampón de lisis (35U/ml, Sigma, St. Louis, MO, EE. UU.). Para la digestión del ADN se han utilizado 30 U de SmaI (Roche Diagnostics, Indianápolis, IN, EE. UU.), incubando a 37°C durante 18h según las instrucciones del fabricante. La separación de los fragmentos de restricción se ha realizado mediante el sistema CHEF DRIII (Bio-Rad Laboratories, Hercules, CA, EE. UU.) en geles de agarosa al 1% (SeaKem ME agarose, Lonza, ME, EE. UU.) durante 30 horas a un voltaje de 6V/cm con pulsos de 4-8 segundos durante 10 horas y 10-15 segundos durante 20 horas. Los patrones PFGE se han analizado y comparado utilizando el programa InfoQuest FP, versión 4.5 (Bio-Rad Laboratories, Hercules, CA, EE. UU.) mediante el algoritmo unweighted pair group-matching algorithm (UPGMA) y el coeficiente de correlación Dice. Los patrones se han considerado iguales o distintos según los criterios descritos por Tenover et al.12.
ResultadosSe revisaron las historias clínicas de 17 pacientes que habían coincidido con el caso y los resultados de los cultivos microbiológicos siguiendo los criterios explicados en el apartado «investigación epidemiológica». No se identificaron más casos que los ya conocidos, así pues, el brote afecto a tres recién nacidos, siendo el caso índice el recién nacido diagnosticado de listeriosis por transmisión vertical. La tasa de ataque fue del 12%.
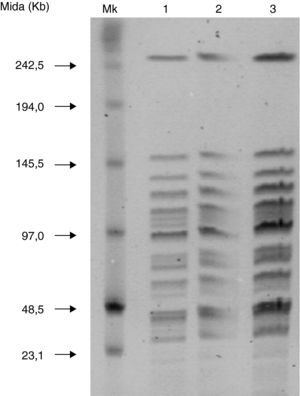
El estudio de las cepas de los recién nacidos 1, 2 y 3 presentó el mismo patrón de campo pulsado (PFGE) obtenido por restricción (fig. 2).
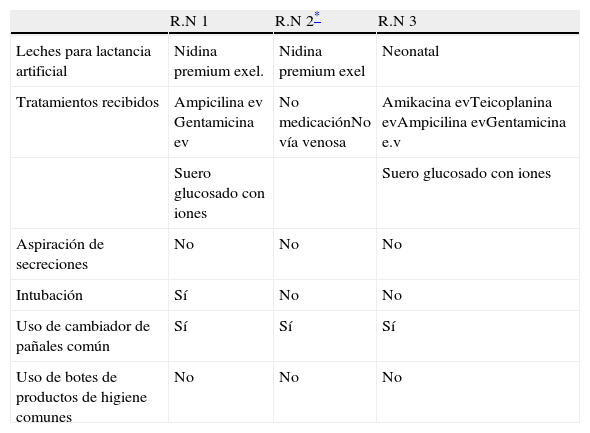
Respecto a los resultados de la investigación epidemiológica, destacar que se trata de una unidad con 12 incubadoras dado que el caso índice coincidió con los otros dos casos, no es probable que hayan compartido una misma incubadora. Cuatro personas del personal sanitario coincidieron en el cuidado de los tres casos. Se revisó la administración de tratamientos endovenosos y la leche utilizada para la alimentación, no se encontraron coincidencias (tabla 1). Para el baño se utiliza una botella de jabón individual que cada madre aporta y no se comparten. El cambiador para los pañales es una superficie compartida para todos que utilizan los padres y el personal sanitario, no se puede garantizar que se limpie con desinfectante después de cada uso. La cura del ombligo se hace dentro de la incubadora de cada recién nacido. En ninguno de los casos se hizo aspiración de secreciones. El centro cuenta con protocolo para la higiene de manos y limpieza de superficies. De las 39 muestras de superficies todas fueron negativas para L. monocytogenes.
Exposiciones de riesgo de los recién nacidos
| R.N 1 | R.N 2* | R.N 3 | |
| Leches para lactancia artificial | Nidina premium exel. | Nidina premium exel | Neonatal |
| Tratamientos recibidos | Ampicilina ev Gentamicina ev | No medicaciónNo vía venosa | Amikacina evTeicoplanina evAmpicilina evGentamicina e.v |
| Suero glucosado con iones | Suero glucosado con iones | ||
| Aspiración de secreciones | No | No | No |
| Intubación | Sí | No | No |
| Uso de cambiador de pañales común | Sí | Sí | Sí |
| Uso de botes de productos de higiene comunes | No | No | No |
ev: administración endovenosa; R.N: recién nacido.
Aunque la infección nosocomial cruzada por L. monocytogenes ha sido descrita con anterioridad es muy poco común. En el brote que se describe, un caso de listeria por transmisión vertical fue el caso índice que generó dos casos secundarios en recién nacidos que coincidieron con él en la Unidad de Neonatos. Uno de los casos inició síntomas a los 9 días del ingreso en la Unidad de Neonatos y por tanto de la posible exposición, sin embargo, el otro caso reingresa por meningitis a las 7 semanas del primer ingreso en la Unidad de Neonatos. La epidemiología molecular confirmó que las tres cepas estaban relacionadas. En este brote en el que uno de los casos está prácticamente al límite del periodo de incubación, la epidemiología molecular confirma su relación con el brote.
Los métodos moleculares de tipificación epidemiológica tales como ribotipado o PFGE presentan un poder discriminativo superior al serotipado, método clásicamente utilizado en los estudios epidemiológicos de L. monocytogenes11. Otros métodos desarrollados para el tipaje de L. monocytogenes incluyen el Multilocus sequence typing (MLST) y Multiple-locus variable-number tandem-repeat analysis (MLVA)13,14. Estos métodos permiten analizar la genética, epidemiología y ecología asociada a L. monocytogenes15,16.
El PFGE, en general, se considera la técnica más discriminativa, permitiendo la detección y control de los brotes de listeriosis humana, aun cuando se extienden en el espacio o en el tiempo17–20. El uso del PFGE es a menudo crucial para relacionar distintos casos de listeriosis y poder establecer así el origen de la infección20–22. Estos brotes, en su mayoría, se encuentran ligados a alimentos listos para su consumo, destacando distintos tipos de carnes y embutidos17–21, leche y derivados lácticos20–23.
A pesar de que sabemos que la transmisión se produjo en la Unidad de Neonatos, la cadena de transmisión no pudo ser identificada. La revisión de los brotes descritos pone de evidencia la dificultad de trazar la cadena de transmisión, solo en uno de los brotes3 se identificó L. monocytogenes por cultivo en un dispensador multidosis de aceite mineral utilizado para el baño de los neonatos. En otros se expone la sospecha de las manos del personal2, o la posible contaminación del equipo de resucitación7 como parte de la cadena de transmisión.
En nuestro caso como en otros casos de transmisión cruzada, las manos del personal pudieron jugar un papel en la transmisión ya que en los tres casos parte de los cuidados estuvieron a cargo del mismo personal sanitario. Como hipótesis alternativa también nos planteamos que, teniendo en cuenta que las personas infectadas excretan el microoganismo en las heces, un punto que pudo haber intervenido en la transmisión es en uso del cambiador. El cambiador se usaba tanto por el personal sanitario como por los padres, no se pudo garantizar que fuera adecuadamente desinfectado después de cada uso.
Como limitaciones de la investigación epidemiológica cabe citar que las muestras de superficies se tomaron tres semanas después del inicio de síntomas del primer caso, lo que hace descender las posibilidades de detectar posibles contaminaciones de superficies.
En resumen, hay que tener en cuenta el largo periodo de incubación de la L. monocytogenes y tener presente que en un brote pueden haber casos secundarios transcurridas semanas tras la exposición. La adherencia estricta a las normas de precaución estándar es necesaria para evitar brotes de transmisión nosocomial.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.