El tratamiento de la hepatitis crónica C (HCC) se basa en la combinación de peginterferón alfa 2a o 2b y ribavirina que consiguen una respuesta virológica persistente (RVP) en más del 50% de los casos. Esta RVP es superior en los pacientes infectados por los genotipos 2 y 3, pero los casos infectados por el genotipo 1, la RVP es inferior al 50%, lo que hace necesario el desarrollo de nuevos tratamientos.
A partir de los conocimientos del ciclo replicativo del virus de la hepatitis C (VHC) y de la caracterización de los enzimas virales se han definido dianas terapéuticas que inhiben los enzimas del VHC. En esta revisión se analizan los dos primeros inhibidores de la proteasa NS3/NS4 aprobados para el tratamiento de la HCC, boceprevir y telaprevir. Ambos consiguen incrementar la tasa de RVP, tanto en pacientes naïves como en pacientes previamente tratados con la ventaja de que en ocasiones es posible acortar el tratamiento. Sin embargo, estos fármacos se asocian a nuevos efectos adversos como eritema cutáneo e incremento de la anemia.
The current treatment of Chronic Hepatitis C (CHC) is based on the combination of peginterferon alpha 2a or 2b and ribavirin. This treatment achieves Sustained Virological Response (SVR) rates in more than 50% of the patients. The SVR rates are higher in genotype 2 and 3 patients than in genotype 1, which account for more than 50%. For this reason, the development of new drugs is needed.
The knowledge of Hepatitis C Virus (HCV) replication cycle and the characterisation of the viral enzymes allow targets to be defined with the ability to inhibit HCV enzymes. The present overview analyses the first two NS3/NS4 protease inhibitors approved for the treatment of CHC, boceprevir and telaprevir. Both increase rates of SVR in naïve and in previously treated patients with the advantage that in some cases therapy can be shortened. However, these drugs have new side effects such as a rash and an increase in the rate of anaemia.
La hepatitis C es una enfermedad relativamente frecuente. Se ha calculado que un 3% de la población mundial está infectada por el virus de la hepatitis C (VHC). La infección por VHC puede manifestarse de varias formas, desde una hepatitis aguda a una hepatitis crónica o una cirrosis hepática. La mayoría de los pacientes con hepatitis crónica C están asintomáticos durante años pero a pesar de ello, pueden desarrollar una enfermedad hepática lentamente progresiva evolucionando a formas más graves como son la cirrosis hepática y el hepatocarcinoma. En nuestro medio, el VHC es la causa más frecuente de cirrosis hepática de etiología viral y la indicación principal es el trasplante hepático1,2.
El VHC es miembro de la familia de los Flaviviridae. Se clasifica mayoritariamente en seis genotipos (del 1 al 6) que tienen una distribución mundial determinada, están relacionados con el tipo de transmisión de la infección y con una posibilidad de respuesta al tratamiento diferente2,3. Además, los genotipos se clasifican en subgenotipos o subtipos (a, b, c, d, etc.). Esta detallada clasificación se debe a la elevada variabilidad que acumula el virus en su genoma. En realidad, la elevada tasa de mutaciones que presenta el virus durante su replicación (10−3 a 10−5 errores/nucleótido copiado) y el elevado número de partículas virales que se generan (1012 partículas/día) hacen que la población viral sea muy diversa en un mismo paciente. Por este motivo se considera que el VHC circula como una población de genomas virales diferentes pero íntimamente relacionada, definida como quasispecies4.
El genoma viral del VHC es de cadena sencilla y positiva de ARN, tiene una longitud de 9,6-kb y contiene una única pauta de lectura abierta. La única proteína que se codifica es una poliproteína de 3.010 aminoácidos. Los extremos 5′ y 3′ contienen regiones no traducidas importantes para la replicación viral. En el caso del extremo 5′ contiene señales de localización ribosomal5 y el extremo 3′ contiene una secuencia altamente conservada con la señal de terminación de la transcripción6. La región cercana al extremo 5′ contiene la información genética para la codificación de las proteínas estructurales, que son el Core (C) y las proteínas de la envuelta 1 y 2 (E1 y E2); el resto del genoma codifica para las proteínas no estructurales (NS). La proteína NS1 o p7 forma canales de iones y la NS2 es una proteína transmembrana con actividad proteolítica y capacidad de ensamblaje del Core, NS5A y NS3. La proteína NS3 tiene actividad proteasa y ARN helicasa; en cambio, NS4A es un cofactor de NS3, y NS4B facilita la oligomerización del genoma viral. La proteína NS5A tiene actividad de unión al ARN y está relacionada con la resistencia al interferón. Finalmente, la proteína NS5B es una ARN polimerasa dependiente del ARN7.
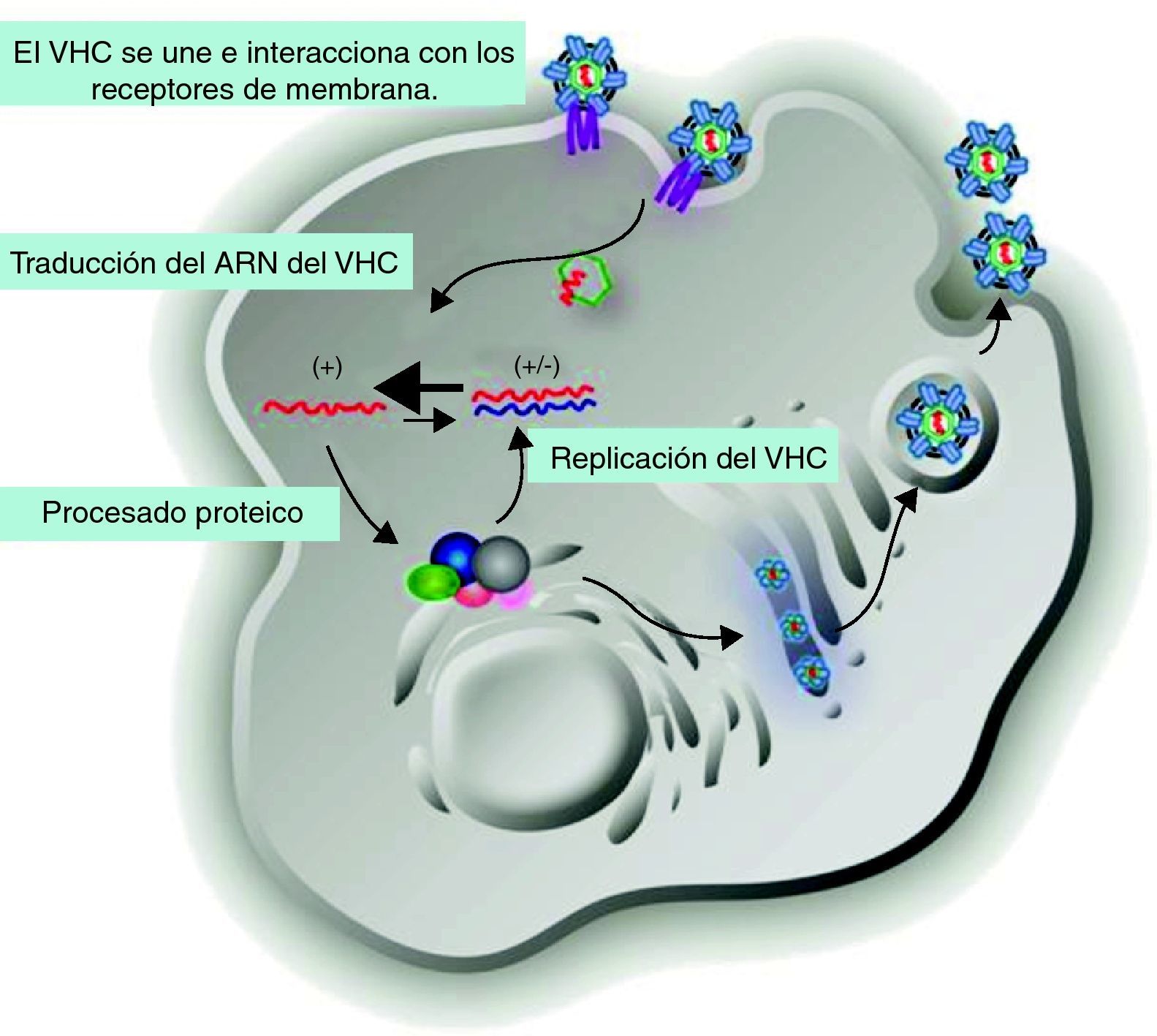
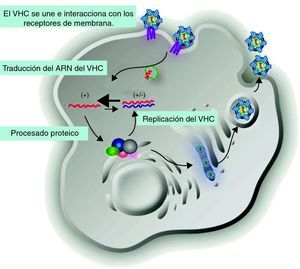
Los viriones del VHC están compuestos por una envuelta exterior constituida por lípidos de origen celular y proteínas virales de la envoltura E1 y E2. En su interior se localiza la cápside, formada por las proteínas Core (C) y más internamente el genoma de ARN del VHC. El ciclo replicativo del VHC está representado en la figura 1, la replicación viral tiene lugar en el citoplasma del hepatocito, aunque también puede ocurrir en las células mononucleares periféricas. Inicialmente, el virus circula en sangre y se une e interacciona con receptores de membrana del hepatocito (CD81, receptor de LDL, SR-BI, DC-SIGN, claudina-1 y ocludina)8. Posteriormente, el virus es endocitado y liberado en el citoplasma celular, donde elimina la envuelta exterior y la cápside. El ARN del VHC se traduce directamente dando lugar a una única poliproteína (NH2-C-E1-E2-NS1-NS2-NS3-NS4A-NS4B-NS5A-NS5B-COOH). Seguidamente, las peptidasas del retículo endoplasmático del huésped proteolizan el extremo 5′, dando lugar a las tres proteínas estructurales (C, E1 y E2) y a NS19. Finalmente, las proteínas no estructurales son escindidas por la acción de las proteasas virales que actúan unidas, NS2 con NS3 y NS3 con NS4A10. La proteolisis de la poliproteína da lugar a NS5B que inicia y completa la síntesis de la cadena negativa de ARN, a partir de esta se completa la síntesis de una nueva cadena positiva que constituirá los nuevos viriones.
Desde hace años, el tratamiento de la hepatitis crónica C ha sido la combinación de peginterferón alfa 2a o 2b y ribavirina que es eficaz en más del 50% de los pacientes tratados11. Este tratamiento comporta efectos adversos considerables y un elevado coste. Además, la eficacia del tratamiento es diferente dependiendo del genotipo del VHC: los pacientes infectados por el genotipo 1 consiguen una respuesta más baja, en general, inferior al 50% de la observada en los pacientes infectados por los genotipo 2 y 312,13. En nuestro medio más del 70% de los pacientes están infectados por genotipo 12 y cada vez existe una proporción más elevada de pacientes previamente tratados con peginterferón y ribavirina que han presentado una respuesta transitoria con recaída posterior o ausencia de respuesta.
Es evidente que se necesitan nuevos tratamientos para incrementar la respuesta en los pacientes naïve y conseguir tasas más elevadas de éxito en los pacientes no respondedores o con respuesta transitoria. El conocimiento del ciclo replicativo del VHC ha permitido identificar dianas terapéuticas de gran utilidad para el desarrollo de nuevos fármacos. Una de las dianas farmacológicas en fase más avanzada es la región de la proteasa NS3/4. En el momento actual existen múltiples fármacos en fase de investigación clínica (ensayos en fase III; II y I) que inhiben la proteasa NS3/4. Dos de estos fármacos, boceprevir y telaprevir, han sido aprobados por la Food and Drug Administration (FDA) y la Agencia Europea del Medicamento y están disponibles para el tratamiento de la hepatitis C, tanto para pacientes naïve como pacientes que han sufrido recaída o aquellos que no han respondido a un tratamiento previo.
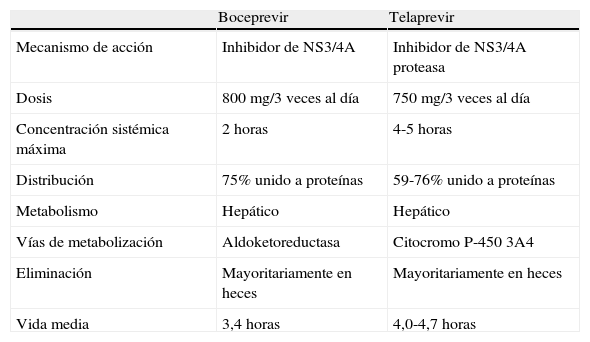
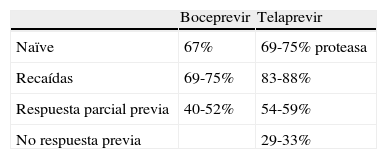
BoceprevirBoceprevir es el primer inhibidor de las proteasas aprobado por la Agencia Europea del Medicamento para el tratamiento de la hepatitis C. Debe administrarse conjuntamente con peginterferón y ribavirina y solo es eficaz para pacientes infectados por genotipo 1. Las características del boceprevir se muestran en la tabla 1, que ha sido evaluado en dos estudios de fase III: uno que incluía pacientes naïve y otro con pacientes que sufrieron fracaso previo al interferón. El estudio denominado Serine Protease inhibitor Therapy (SPriNT) incluyó 1.097 pacientes naïve infectados por genotipo 1, de los cuales 159 fueron de raza negra14. Los pacientes fueron aleatorizados a recibir peginterferón alfa 2b y ribavirina durante 48 semanas (brazo estándar) o tratamiento triple con boceprevir, peginterferón alfa 2b y ribavirina durante 44 semanas o tratamiento triple de duración variable guiado según la respuesta terapéutica. En los dos brazos que se incluyó boceprevir, todos los pacientes recibieron 4 semanas de peginterferón y ribavirina, esta fase de inducción denominada en inglés como la fase de lead-in tiene como objetivo valorar la sensibilidad al interferón. Tras estas 4 semanas se añadió el tratamiento con boceprevir. Los resultados del estudio demostraron una RVP en el 67% de los sujetos de raza no negra y en el 42% de los sujetos de raza negra en los brazos con boceprevir mientras que en el brazo control con peginterferón y ribavirina solo respondieron el 40% de los pacientes de raza no negra y el 23% de los pacientes de raza negra (p=0,004 y p=0,044). En el brazo de tratamiento guiado por la respuesta, la duración del tratamiento fue de 28 o 48 semanas. Aproximadamente, el 50% recibieron tratamiento durante 28 semanas. La respuesta en este brazo fue similar a la observada con 48 semanas de tratamiento triple. Un 25% de los pacientes tuvieron que interrumpir el tratamiento en la semana 24 por falta de respuesta o efectos adversos. Los factores predictivos de RVP fueron la ausencia de fibrosis avanzada, y una caída de más de un logaritmo en los niveles de ARN del VHC en la semana 4 de tratamiento con peginterferón y ribavirina.
Características principales de boceprevir y telaprevir
| Boceprevir | Telaprevir | |
| Mecanismo de acción | Inhibidor de NS3/4A | Inhibidor de NS3/4A proteasa |
| Dosis | 800mg/3 veces al día | 750mg/3 veces al día |
| Concentración sistémica máxima | 2 horas | 4-5 horas |
| Distribución | 75% unido a proteínas | 59-76% unido a proteínas |
| Metabolismo | Hepático | Hepático |
| Vías de metabolización | Aldoketoreductasa | Citocromo P-450 3A4 |
| Eliminación | Mayoritariamente en heces | Mayoritariamente en heces |
| Vida media | 3,4 horas | 4,0-4,7 horas |
El segundo estudio denominado RESPOND (Retreatment with HCV Serine Protease Inhibitor Boceprevir and Peginteron/Rebetol) incluyó a 403 pacientes con hepatitis crónica C infectados por genitipo 1 y previamente tratados con peginterferón y ribavirina15. En este estudio los pacientes fueron aleatorizados (1:2:2) a recibir tratamiento estándar con peginterferón alfa 2b y ribavirina durante 48 semanas (brazo control), o cuatro semanas de peginterferón alfa 2b y ribavirina (fase lead-in) seguido de 44 semanas de tratamiento triple (boceprevir, peginterferón alfa 2b y ribavirina) o cuatro semanas de peginterferón y ribavirina (fase lead-in), seguido de 32 semanas de tratamiento triple (boceprevir, peginterferón alfa 2b y ribavirina). En este último brazo de tratamiento guiado por la respuesta, aquellos pacientes con ARN del VHC detectable a la semana 8 recibieron 12 semanas más de peginterferón y ribavirina, después de la semana 32. La RVP fue superior en los brazos con boceprevir, 59% en el brazo guiado por la respuesta y 66% en el brazo de 48 semanas, mientras que solo del 21% en el brazo control (p<0001). Este estudio incluyó dos poblaciones diferentes de pacientes, recaedores y pacientes con respuesta parcial al interferón definido por una caída en los niveles de ARN del VHC durante el tratamiento previo con peginterferón y ribavirina. La respuesta fue superior entre los recaedores tratados con boceprevir (69-75%) que entre los pacientes con respuesta parcial (40-52%) (tabla 2). Fue interesante observar que el 25% de los pacientes con una respuesta pobre al peginterferón, definida como una caída de menos de un logaritmo en los niveles de ARN del VHC durante las primeras cuatro semanas de tratamiento, solo presentaron una tasa de RVP del 34% al tratamiento triple comparado con el 79% en los pacientes con una buena respuesta inicial al interferón.
Además, en los pacientes con ARN del VHC indetectable en la semana 8, la RVP fue del 86% tras 32 semanas de tratamiento triple y 88% tras 44 semanas de tratamiento triple. Nuevamente, el efecto adverso más importante fue la anemia y un 40% de los pacientes tratados con boceprevir recibieron eritropoyetina.
Los factores predictivos basales asociados a respuesta favorable al tratamiento fueron la administración de boceprevir, ser recaedor, niveles bajos de viremia y la ausencia de cirrosis. Cuando a estos factores de respuesta se añadió la respuesta a la semana 4 definida por la caída superior a un logaritmo de ARN del VHC, este último factor fue más importante que el tipo de respuesta al tratamiento previo.
En el futuro, un análisis más exhaustivo de estos estudios facilitará nuevos datos importantes asociados a la respuesta al tratamiento que ayudarán a mejorar el tratamiento de la hepatitis C.
TelaprevirTelaprevir es un inhibidor de la NS3/4A proteasa, también aprobado para el tratamiento de pacientes con hepatitis crónica C naïves o previamente tratados con interferón y ribavirina infectados por el genotipo 1. Debe administrarse en combinación con peginterferón y ribavirina y las características del telaprevir se muestran en la tabla 1.
Los estudios en fase III con telaprevir han incluido pacientes naïve y previamente tratados. El estudio en pacientes naïve, denominado ADVANCE, incluyó 1.088 pacientes naïve infectados por genotipo 116. Los pacientes fueron asignados a recibir telaprevir con peginterferón alfa 2a y ribavirina durante 12 semanas (grupo T12PR) seguido de peginterferón y ribavirina durante 12 semanas si el ARN del VHC era indetectable a la semana 4 y 12; o durante 36 semanas si el ARN del VHC se detectaba en algún momento. Otro grupo de pacientes recibieron telaprevir con peginterferón alfa 2a y ribavirina durante 8 semanas (T8PR) seguido de 36 semanas de peginterferón y ribavirina. Finalmente el tercer grupo, considerado el control, recibió peginterferón alfa 2a y ribavirina. La tasa de RVP en los grupos de telaprevir durante 8 o 12 semanas, acompañado de terapia estándar durante 24 o 48 semanas, fue del 69 y 75%, respectivamente comparado con el 44% del grupo control (p<0,001). El 58% de los pacientes tratados presentaron efectos adversos, un 10% en los grupos T12PR y T8PR y un 7% de los pacientes en el grupo control (tabla 2). El estudio demostró que el tratamiento triple con telaprevir aumentaba la respuesta virológica persistente y permitía reducir la duración del tratamiento a 24 semanas en una proporción considerable de pacientes.
En otro estudio que incluyó 161 pacientes infectados por genotipo 1 analizó la eficacia del telaprevir, tanto en combinación con peginterferon alfa 2a o peginterferón alfa 2b y ribavirina durante 12 semanas, seguido de 12 o 36 semanas de peginterferón y ribavirina. En este estudio, telaprevir se administró la misma dosis de telaprevir diaria cada 8 horas o cada 12 horas. La tasa de RVP fue de entre el 81 y el 85%, sin observarse diferencias en relación al tipo de peginterferón o la administración de telaprevir cada 8 o 12 horas sugiriendo que el fármaco podía administrarse con ambos tipos de interferón o cada 12 horas. Sin embargo, la pauta recomendada para telaprevir es cada 8 horas17.
En pacientes infectados por genotipo 1 previamente tratados con peginterferón y ribavirina, se ha realizado un estudio multicéntrico de fase III denominado REALIZE para evaluar la eficacia del telaprevir asociado a peginterferón y ribavirina18. En él se incluyeron un total de 663 que fueron asignados a recibir tratamiento con telaprevir durante 12 semanas combinado con peginterferón alfa 2a y ribavirina durante 48 semanas, o 4 semanas de peginterferón alfa 2a y ribavirina (con fase lead-in) seguido de 12 semanas de telaprevir combinado con peginterferón y ribavirina durante un total de 48 semanas o tratamiento estándar con peginterferón alfa 2a y ribavirina. Las tasas de RVP fueron superiores en los grupos tratados con telaprevir en comparación con el tratamiento estándar. Entre los pacientes con recaída previa, las tasas de RVP fueron del 83 y 88%, respectivamente para T12PR48 sin o con lead in y del 24% para peginterferón y ribavirina. En el grupo de pacientes con una respuesta previa parcial, las tasas de RVP fueron del 59, 54 y 15%, respectivamente y en el grupo de no respondedores del 29, 33 y 5%, respectivamente (p<0,001). Los efectos adversos más importantes asociados a telaprevir fueron prurito, exantema, anemia, náuseas, vómitos y molestias anales. El eritema cutáneo obligó a interrumpir el tratamiento en el 4% de los pacientes. Se han reportado reacciones cutáneas graves del tipo de síndrome de Stevens Johnson y suponen la limitación más importante del telaprevir. Tanto boceprevir como telaprevir han sido clasificados como fármacos de categoría B en relación al embarazo, es decir, sin evidencia de riesgo en humanos. Sin embargo, debido a que deben administrarse siempre en combinación con peginterferón y ribavirina, están contraindicados durante el embarazo y en varones cuyas mujeres están embarazadas.
Un aspecto nuevo de estos fármacos son las interacciones con otros fármacos. Boceprevir se metaboliza primariamente por una aldoketoreductasa y también, aunque con menor importancia, también a través del citocromo P-450 3A4/5 (CYP3A4/5)19. Su administración simultánea con inductores potentes de CYP3A4 podría reducir las concentraciones séricas de boceprevir y la combinación con fármacos que inhiben CYP3A4 pueden incrementar las concentraciones de boceprevir. Un ejemplo de ello es que la coadministración de boceprevir y midazolam aumenta considerablemente la concentración de midazolam a niveles perjudiciales, por lo que se desaconseja su administración concomitante.
Telaprevir se metaboliza a través del CYP3A4, aunque también es un inhibidor de la glicoproteína-P20. La administración simultánea con inductores potentes de CYP3A4 puede disminuir las concentraciones séricas de telaprevir; en cambio, fármacos que inhiban el CYP3A4 o la glicoproteína-P pueden aumentar las concentraciones de telaprevir. Algunos fármacos como alfuzosin, rifampicina, derivados de la ergotamina, estatinas, midazolam, y triazolam están contraindicados con telaprevir. Recientemente se ha observado que telaprevir aumenta de forma considerable los niveles séricos de ciclosporina y tacrolimus en sujetos sanos. Ello hace que para su utilización en pacientes trasplantados hepáticos con recidiva de la infección por VHC sean necesarios nuevos estudios que evalúen las interacciones entre estos fármacos21.
Finalmente, en España boceprevir va a comercializarse con el nombre de Victrelis y en forma de tabletas de 200mg; mientras que telaprevir lo hará con el nombre de Incivo y en forma de tabletas de 750mg. La dosis recomendada de boceprevir es de 800mg cada 8 horas y se aconseja tomarlo con una comida ligera, ya que así se mejora su absorción. Boceprevir debe administrase siempre con peginterferón y ribavirina. Su administración debe interrumpirse en todos los pacientes que presentan niveles de ARN del VHC superiores a 100UI en la semana 12 de tratamiento o ARN del VHC detectable a la semana 24, ya que en estas situaciones raramente se consigue una RVP y de esta manera, se evita el desarrollo de resistencia a boceprevir.
Telaprevir debe administrase a dosis de 750mg cada 8 horas durante 12 semanas y siempre asociado a peginterferón y ribavirina. Se recomienda tomarlo con una comida rica en grasas para mejorar su absorción. Todos los pacientes con niveles de ARN del VHC superiores a 1.000IU/mL a la semana 4 y 12 deben interrumpir el tratamiento.
En resumen, boceprevir y telaprevir añadidos al tratamiento estándar con peginterferón y ribavirina aumentan las tasas de RVP en pacientes infectados por genotipo 1, tanto naïves como previamente tratados, las diferencias básicas entre ambos se presentan en la tabla 1. En aproximadamente el 50% de los pacientes naïve puede reducirse la duración del tratamiento a 24-28 semanas, mientras que en pacientes previamente tratados, especialmente en no respondedores, es aconsejable mantener las 48 semanas de tratamiento. En un futuro inmediato, nuevos datos de estos estudios nos ayudaran a optimizar el manejo de estos fármacos para conseguir un aumento de las tasas de curación, disminuir los efectos adversos e individualizar el tratamiento.
Conflicto de interesesMaria Buti: Editorial Board de Merk i Janssen.