Analizar y comparar la capacidad de la procalcitonina (PCT), proteína C reactiva (PCR) y leucocitos para diferenciar la bacteriemia verdadera de los hemocultivos (HC) contaminados en los pacientes atendidos en el servicio de urgencias (SU) por un episodio de infección.
MétodosEstudio observacional, retrospectivo y analítico de todos los HC con crecimiento positivo extraídos en un SU en los pacientes adultos (≥18 años) durante los años 2016 y 2017. Se realizó seguimiento durante 30 días y se calculó el poder y rendimiento pronóstico de bacteriemia verdadera.
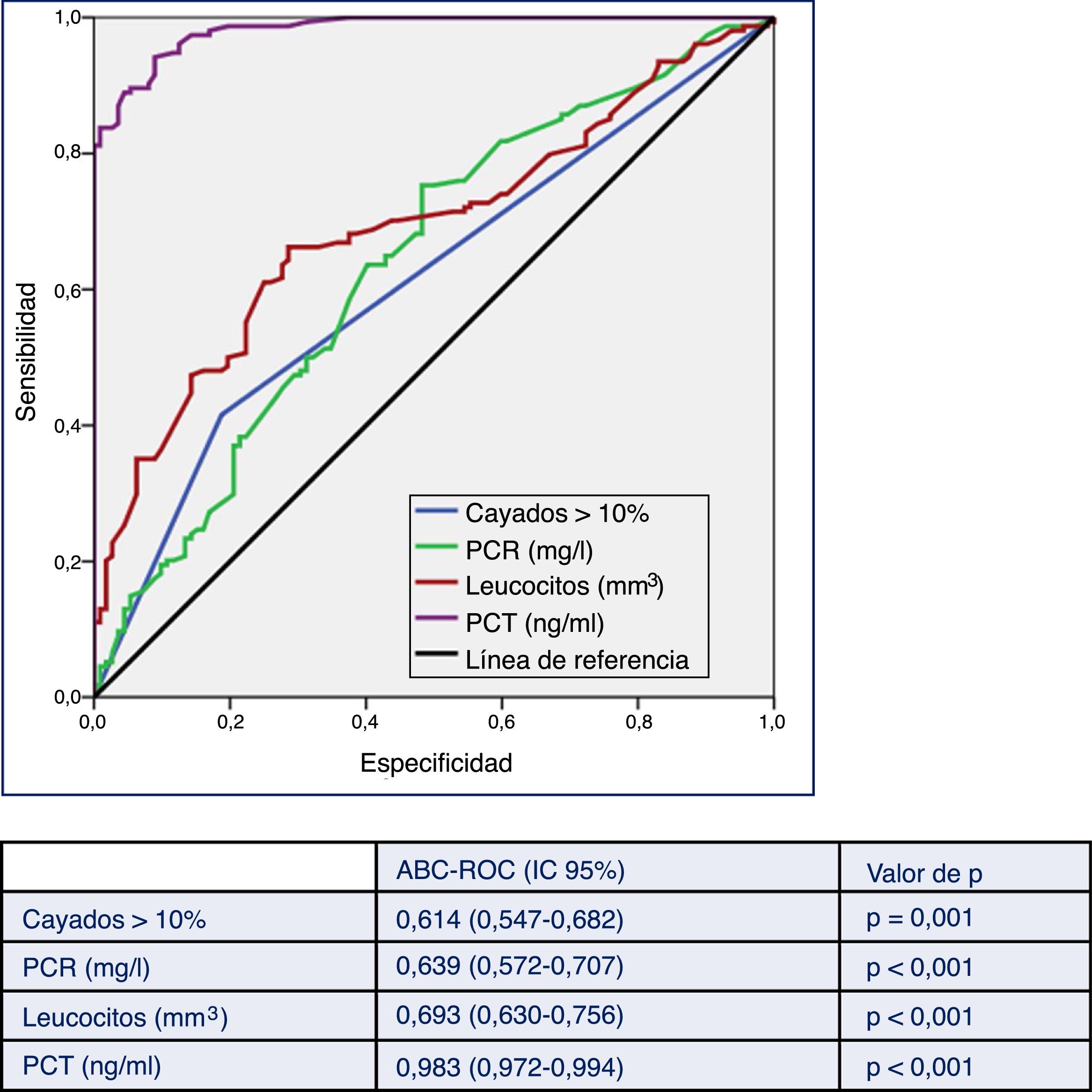
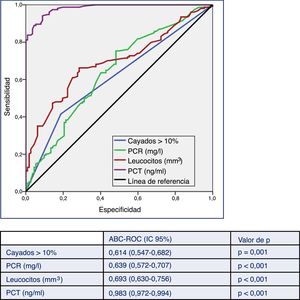
ResultadosSe incluyeron 266 casos de HC con crecimiento positivo. De ellos se consideraron como bacteriemias verdaderas 154 (57,9%) y como HC contaminantes 112 (42,1%). Para la predicción de bacteriemia verdadera la PCT obtiene un área bajo la curva Receiver Operating Characteristic (ABC-ROC) de 0,983 (IC 95%: 0,972-0,994; p<0,001) y con un punto de corte de PCT≥0,43ng/ml se consigue una sensibilidad del 94%, una especificidad del 91%, un valor predictivo positivo de 94% y un valor predictivo negativo de 92%. El ABC-ROC obtenida para la PCR fue de 0,639 (IC 95%: 0,572-0,707; p<0,001), para el recuento de leucocitos de 0,693 (IC 95%: 0,630-0,756; p<0,001) y para las formas inmaduras (>10% cayados) de 0,614 (IC 95%: 0,547-0,682; p=0,001). Los valores medios al comparar la PCT en las bacteriemias verdaderas y los HC contaminados fueron de 3,44ng/ml (DE 6,30) frente a 0,16ng/ml (DE 0,18), p<0,001.
ConclusionesEn los HC con crecimiento positivo extraídos en el SU la PCT consigue el mejor rendimiento pronóstico de bacteriemia verdadera diferenciándola de los HC contaminados, mayor que la PCR y los leucocitos.
To analyse and compare the ability of procalcitonin (PCT), C-reactive protein (CRP) and leukocytes to differentiate true bacteraemia from contaminated blood cultures in patients seen in the emergency department (ED) for an episode of infectious disease.
MethodsObservational, retrospective and descriptive analytical study of all blood cultures with positive growth extracted in an ED in adult patients (≥18 years) during 2016 and 2017. The follow-up was carried out over a 30-day period to calculate the predictive power and the prognostic performance for true bacteraemia.
ResultsA total of 266 blood cultures with positive growth were included in the study. Out of these, 154 (57.9%) were considered true bacteraemia and 112 (42.1%) were considered to be contaminated blood cultures. The area under the Receiver Operating Characteristic curve (AUC-ROC) for PCT to predict true bacteraemia was 0.983 (95% CI: 0.972-0.994; P<0.001) and, considering a cut-off value of≥0.43 ng/ml, PCT achieved 94% sensitivity, 91% specificity, positive predictive value of 94%, and negative predictive value of 92%. The AUC-ROC obtained for CRP was 0.639 (95% CI: 0.572-0.707, P<.001), for leukocytes of 0.693 (95% CI: 0.630-0.756, P<.001) and for immature leukocytes (>10% bands) of 0.614 (95% CI: 0.547-0.682, P<.001). The mean values for PCT were 3.44 (SD 6.30) ng/ml in true bacteraemia vs. 0.16 (SD 0.18) ng/ml in contaminated blood cultures (P<.001).
ConclusionsIn blood cultures with positive growth extracted in an ED, PCT achieves the best prognostic performance of true bacteraemia vs. contaminated blood cultures, better than CRP and leukocytes.
El 14,3% de los pacientes que se atienden en los servicios de urgencias hospitalarios (SUH) se diagnostican finalmente de un proceso infeccioso. En su valoración se toman muestras para estudios microbiológicos en el 43% de estos, donde predomina la extracción de hemocultivos (HC) que se lleva a cabo en el 14,6% de los pacientes con infección del SUH1.
A pesar de las nuevas técnicas de detección rápida2, los HC siguen siendo la técnica principal para el diagnóstico etiológico de bacteriemia, aportan información sobre la sensibilidad del microorganismo aislado y favorecen la optimización del tratamiento antimicrobiano2–4. La rentabilidad diagnóstica es muy variable (2-20%)3, mientras que los considerados «HC contaminantes» (idealmente<3%)2,3 pueden alcanzar tasas del 30-50%5–7. Este hecho constituye un verdadero problema, ya que suele conllevar un incremento de las pruebas diagnósticas, estancia hospitalaria, de los costes y la administración de tratamientos antibióticos innecesarios2,8. En la actualidad la incidencia de bacteriemia comunitaria ha aumentado hasta 1-2/1.000 atenciones en los SUH3. La etiología se debe a bacterias grampositivas en un 30-35%, gramnegativas en un 65-70% y anaerobios alrededor del 1%3,5,6. Esta proporción puede cambiar en función de las tasas de HC contaminantes a favor de las grampositivas (Sthapylococcus coagulasa-negativo [ECN], Bacillus spp., Streptococcus viridans, Micrococcus spp., Propionibacterium spp., Corynebacterium spp. y otros bacilos grampositivos). En relación con las bacteriemias verdaderas (BV), en cuanto al foco, la infección del tracto urinario con el 45-55% y el foco respiratorio (10-25%) son los más frecuentes. Las bacterias aisladas con mayor frecuencia son Escherichia coli, Sthapylococcus aureus y Streptococcus pneumoniae3.
La mortalidad cruda a los 30 días de los pacientes con HC positivos en el SUH se ha cifrado entre 10-25%3, en relación con la gravedad de la situación clínica (existencia de sepsis-shock séptico), el foco primario, la consideración de BV y las características de los pacientes (edad, comorbilidad, etc.)3,9,10.
Por todo ello es muy importante la sospecha y la detección de la bacteriemia, ya que esta tiene un significado diagnóstico, pronóstico y obliga a cambiar algunas de las decisiones más importantes (alta-ingreso, extraer HC, administrar el antimicrobiano adecuado y precoz, etc.)11–14. Pero también sería relevante poder disponer de herramientas objetivas, como los biomarcadores, que pudieran predecir en el SUH tanto la existencia de bacteriemia como que esta tendrá relevancia clínica (BV)15,16. Así, este objetivo secundario supondría un valor añadido a la confirmación de bacteriemia, ya que la existencia de HC contaminados puede suponer un obstáculo para el diagnóstico real clínico-microbiológico y para el mismo manejo diagnóstico-terapéutico de estos hallazgos. Y de esta forma, el clínico podría tomar con seguridad las decisiones urgentes al predecir que ante una hipotética positividad de los HC esta se relacionará con la contaminación en la técnica de obtención de los mismos15,16.
El objetivo de este estudio fue analizar y comparar la capacidad de la procalcitonina (PCT), proteína C reactiva (PCR) y recuento de leucocitos para diferenciar la BV de los HC contaminados en los pacientes atendidos en el SUH por un episodio de infección.
Material y métodosDiseño y sitio del estudioEstudio observacional, retrospectivo y analítico de las características microbiológicas de todos los HC con crecimiento positivo extraídos en el SUH de los pacientes adultos (≥18 años). Se realizó seguimiento de los pacientes durante 30 días. Se realizó en un hospital universitario de tercer nivel de 786 camas perteneciente al Servicio de Salud de Castilla La Mancha.
Periodos del estudio y población incluidaDesde enero de 2016 a diciembre de 2017 se incluyeron de forma consecutiva todos aquellos HC de pacientes diagnosticados clínicamente de un proceso infeccioso en el SUH en los que también se obtuvieron muestras de analítica para realizar hemograma, bioquímica y biomarcadores (PCT y PCR). Se excluyeron los pacientes de pediatría y obstetricia-ginecología. La indicación de la solicitud de HC se llevó a cabo según el criterio del médico responsable. El estudio ha seguido todos los protocolos y normas de nuestro centro e internacionales (Declaración de Helsinki) para la utilización de los datos de los pacientes que se codificaron para asegurar la confidencialidad de los mismos, no requiriéndose la aprobación del Comité Ético de Investigación Clínica por el carácter descriptivo del mismo. Se revisó la historia clínica informatizada y de atención primaria cuando se requirió.
Definiciones, técnicas y métodos establecidos para las muestrasLa extracción de los HC se realizó por la técnica estándar por venopunción percutánea. En cada paciente se realizaron 2 extracciones separadas entre sí 20minutos. Por cada una de ellas se inocularon 2 botellas (correspondientes al medio aerobio y anaerobio: BD BACTEC®), respectivamente. Los HC se transportaron manualmente al servicio de microbiología para su procesamiento inmediato con el sistema automático de lectura Bactec/Alert® (BioMérieux, Durham, NC, EE. UU.). El tiempo de incubación de los HC fue de 5-7 días, excepto en los casos de sospecha de endocarditis, brucelosis o a petición del médico responsable donde se prolongó hasta 30 días. Se definió como bacteriemia verdadera el aislamiento de bacterias habitualmente patógenas en uno o los 2 HC con un cuadro clínico compatible. Y como HC contaminado ante el aislamiento en una sola botella de HC de ECN, Bacillus spp., Streptococcus viridans, Micrococcus spp., Propionibacterium spp., Corynebacterium spp., Bacillus spp. y otros bacilos grampositivos cuando se interpretó la ausencia de significado clínico en estos casos (confirmado según la historia y/o el criterio del médico responsable y/o microbiología). En otros casos, al existir 2 HC positivos y una significación clínica atribuida a ellos (especialmente en inmunodeprimidos o en portadores de catéteres vasculares o tras pruebas invasivas) sí se consideró BV y se trató con antibióticos.
Para los biomarcadores se adoptaron como valores de referencia los de nuestro laboratorio. Para la PCR: 0-8mg/l. Método de determinación: inmunoanálisis enzimático cuantitativo (Slides VITROS CRP®) con una sensibilidad de 1mg/l. Para la PCT se utilizaron como valores de referencia:<0,5ng/ml. Método: inmunoanálisis cuantitativo de electroquimioluminiscencia ELECSYS (BRAHMS PCT®) con una sensibilidad de 0,02ng/ml.
Variables recogidasSe registraron sociodemográficas (edad, sexo, institucionalización), la toma de antibióticos en las 72horas previas y/o los 3 meses anteriores, el ingreso en los 3 meses previos y la existencia de comorbilidades (enfermedad tumoral sólida u oncohematológica, hepatopatía, nefropatía, diabetes, enfermedad cardiaca crónica o cerebrovascular, enfermedad pulmonar obstructiva crónica, arterial periférica o del tejido conectivo e infección por el virus de la inmunodeficiencia humana [VIH]). Se calculó el índice de Charlson17 ponderado por la edad (y dicotomizado≥3 puntos) y la situación funcional (índice de Barthel18 y dicotomizado≤60). Se registraron datos clínicos y de gravedad: temperatura en grados, alteración de la consciencia definida con<15 puntos en la escala del coma de Glasgow, presión arterial sistólica (PAS), criterios de sepsis, sepsis grave o shock séptico y las variables que los definen según la conferencia de expertos de sepsis de 200119, definición de sepsis según un qSOFA≥2 y las variables que la constituyen según la tercera conferencia de consenso de sepsis (SEPSIS-3)20. Se incluyeron variables de evolución y destino: días de clínica previa, destino inicial de los pacientes, días de estancia hospitalaria, reconsulta en el SUH y mortalidad hospitalaria y a 30 días. En relación con las analíticas se registraron el recuento de leucocitos (así como la existencia de leucocitosis>12.000/mm3, leucopenia<4.000/mm3 o cayados>10%), concentración de PCR en mg/l (y dicotomizado≥9mg/l) y la de PCT en ng/ml (y dicotomizado para≥0,5ng/ml, para ≥1ng/ml y para el punto de corte obtenido con mejor rendimiento).
Análisis estadísticoPara la asociación entre la confirmación de BV y las variables independientes se utilizaron medias y sus desviaciones estándar para las cuantitativas y porcentajes para las cualitativas. Se utilizaron las pruebas de Chi al cuadrado o exacta de Fisher, la «t» de Student y la U de Mann-Whitney, según fueran aplicables, para investigar la relación entre la existencia de BV frente a HC contaminados y las variables independientes (y aquellas que se dicotomizaron). Se consideró significativo un valor de p<0,05, los contrastes fueron bilaterales. Se realizó un análisis descriptivo (números absolutos y porcentajes) de ambos grupos (BV vs. HC contaminados) en relación con el tipo de patógeno encontrado globalmente y diferenciado según fuera el aislamiento de bacterias grampositivas, gramnegativas o anaerobias, así como en función del foco o diagnóstico clínico realizado en el SUH.
La eficacia y capacidad de la PCT, PCR, recuento de leucocitos y porcentaje de cayados para diferenciar la BV de los HC contaminados se estudió mediante el análisis de las curvas Receiver Operating Characteristic (ROC) con el intervalo de confianza (IC) del 95% del área bajo la curva (ABC) de la curva ROC y se comparó frente al valor neutro (0,5). Los errores estándar de las ABC se calcularon por métodos no paramétricos. Se determinaron los puntos de corte (PC) en los valores de PCR y PCT con mayor capacidad diagnóstica, que maximizaba la diferencia entre la tasa de verdaderos positivos y falsos positivos mediante el índice de Youden. Se halló la sensibilidad, la especificidad, el valor predictivo positivo (VPP) y el valor predictivo negativo (VPN), el coeficiente de probabilidad positivo (CP+) y negativo (CP–) para cada resultado estudiado, así como sus IC 95% por métodos binomiales exactos y por el de Taylor para los CP. El análisis estadístico se realizó con el paquete IBM-SPSS® Statistics 22 para Windows.
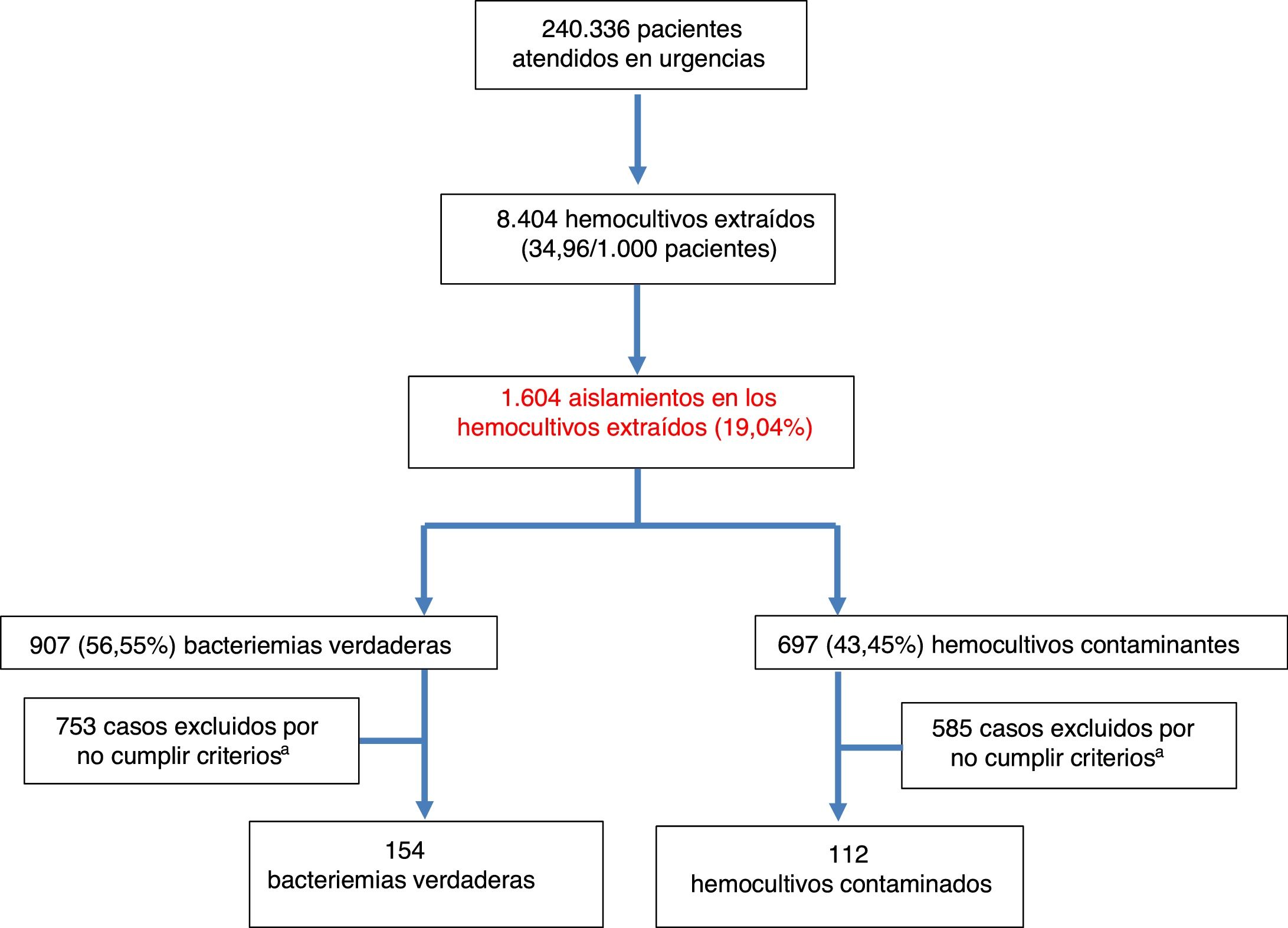
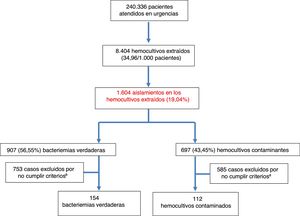
ResultadosDurante el periodo de estudio se atendieron en el SUH a 240.336 pacientes. Se realizaron 8.404HC, lo que supone 34,96HC por cada 1.000 pacientes atendidos en el SUH. La edad media de los pacientes en los que se obtuvieron HC fue de 63 (19) años con un rango entre 18 y 99 años. De estos, 4.828 eran varones (57,44%) y 3.576 (42,56%) mujeres. De ellos, se registraron aislamientos en 1.604 (19,08%). De estos HC positivos se consideraron como BV 907 (56,55%) (7 de ellas polimicrobianas) y como HC contaminantes 697 (43,45%). Por lo tanto, la rentabilidad diagnóstica ([n.° bacteriemias verdaderas/n.° de HC realizados]×100) fue del 10,79% y la tasa de contaminación ([n.° de HC contaminantes/n.° de HC realizados]×100) del 8,29%. Así, la incidencia de BV fue de 3,77/1.000 pacientes atendidos en el SUH. De las BV 23 (2,53%) fueron dadas de alta directamente desde el SUH («bacteriemias ocultas»). El diagrama de flujo de inclusión de episodios se muestra en la figura 1. De estos 1.604HC positivos finalmente solo se incluyeron por oportunidad en el estudio a los 266 casos (16,58%) con crecimiento positivo en los que se disponía de PCT y PCR extraídas en el SUH. De ellos se consideraron como bacteriemias verdaderas 154 (57,9%) y como HC contaminantes 112 (42,1%).
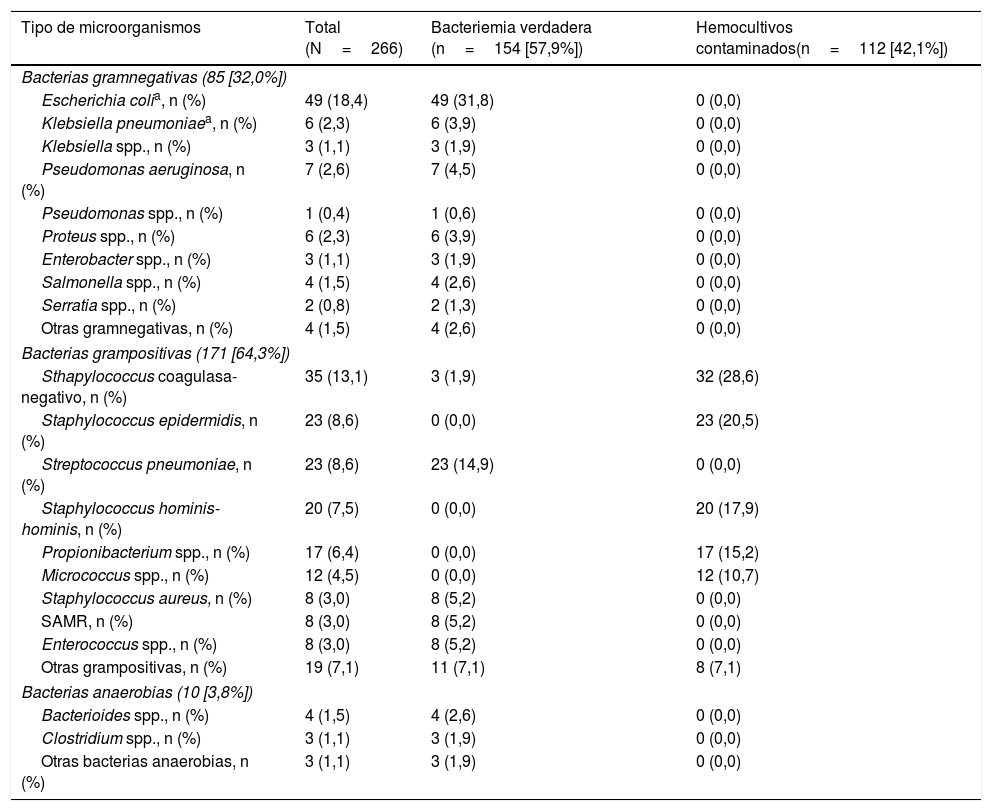
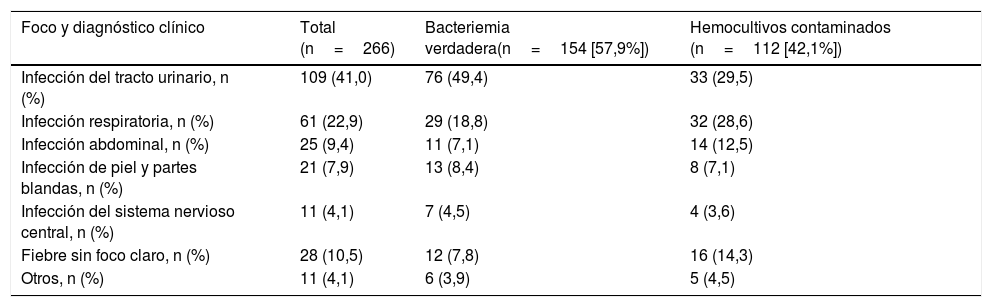
La etiología agrupada y por microorganismos de las BV se expone en la tabla 1. Los aislamientos más frecuentes fueron Escherichia coli con/sin betalactamasas de espectro extendido (BLEE) en 346 ocasiones (38,14%), Staphylococcus aureus sensible/resistente a meticilina con en 73 (8,04%) y Streptococcus pneumoniae en 34 (3,74%). Por su parte, Escherichia coli en 12 ocasiones (52%) también fue el patógeno más frecuente de las bacteriemias ocultas. En relación con los HC contaminados las bacterias más frecuentes fueron: 1) ECN: 318 (21,07%); 2) Staphylococcus epidermidis: 126 (7,85%); 3) Staphylococcus hominis-hominis 116 (7,23%); 4) Propionibacterium spp. 57 (3,55%); y 5) Micrococcus spp. 32 (3,52%). El foco u origen clínico de presunción en el SUH de las bacteriemias verdaderas y de los HC contaminados se muestra en la tabla 2. Por otro lado, en la tabla 3 se señalan los diagnósticos finales en los casos de HC contaminados tras el alta directa desde el SUH o desde la hospitalización.
Características microbiológicas de la muestra global en función del tipo de aislamiento (bacteriemia verdadera frente a hemocultivos contaminados)
| Tipo de microorganismos | Total (N=266) | Bacteriemia verdadera (n=154 [57,9%]) | Hemocultivos contaminados(n=112 [42,1%]) |
|---|---|---|---|
| Bacterias gramnegativas (85 [32,0%]) | |||
| Escherichia colia, n (%) | 49 (18,4) | 49 (31,8) | 0 (0,0) |
| Klebsiella pneumoniaea, n (%) | 6 (2,3) | 6 (3,9) | 0 (0,0) |
| Klebsiella spp., n (%) | 3 (1,1) | 3 (1,9) | 0 (0,0) |
| Pseudomonas aeruginosa, n (%) | 7 (2,6) | 7 (4,5) | 0 (0,0) |
| Pseudomonas spp., n (%) | 1 (0,4) | 1 (0,6) | 0 (0,0) |
| Proteus spp., n (%) | 6 (2,3) | 6 (3,9) | 0 (0,0) |
| Enterobacter spp., n (%) | 3 (1,1) | 3 (1,9) | 0 (0,0) |
| Salmonella spp., n (%) | 4 (1,5) | 4 (2,6) | 0 (0,0) |
| Serratia spp., n (%) | 2 (0,8) | 2 (1,3) | 0 (0,0) |
| Otras gramnegativas, n (%) | 4 (1,5) | 4 (2,6) | 0 (0,0) |
| Bacterias grampositivas (171 [64,3%]) | |||
| Sthapylococcus coagulasa-negativo, n (%) | 35 (13,1) | 3 (1,9) | 32 (28,6) |
| Staphylococcus epidermidis, n (%) | 23 (8,6) | 0 (0,0) | 23 (20,5) |
| Streptococcus pneumoniae, n (%) | 23 (8,6) | 23 (14,9) | 0 (0,0) |
| Staphylococcus hominis-hominis, n (%) | 20 (7,5) | 0 (0,0) | 20 (17,9) |
| Propionibacterium spp., n (%) | 17 (6,4) | 0 (0,0) | 17 (15,2) |
| Micrococcus spp., n (%) | 12 (4,5) | 0 (0,0) | 12 (10,7) |
| Staphylococcus aureus, n (%) | 8 (3,0) | 8 (5,2) | 0 (0,0) |
| SAMR, n (%) | 8 (3,0) | 8 (5,2) | 0 (0,0) |
| Enterococcus spp., n (%) | 8 (3,0) | 8 (5,2) | 0 (0,0) |
| Otras grampositivas, n (%) | 19 (7,1) | 11 (7,1) | 8 (7,1) |
| Bacterias anaerobias (10 [3,8%]) | |||
| Bacterioides spp., n (%) | 4 (1,5) | 4 (2,6) | 0 (0,0) |
| Clostridium spp., n (%) | 3 (1,1) | 3 (1,9) | 0 (0,0) |
| Otras bacterias anaerobias, n (%) | 3 (1,1) | 3 (1,9) | 0 (0,0) |
SAMR: Staphylococcus aureus meticilín resistente
Otras gramnegativas (4): Citrobacter freundii+Haemophilus influenzae+Providencia stuartii+Morganella morganii.
Otras grampositivas (11 bacteriemias verdaderas): Listeria monocytogenes, Streptococcus agalactiae, Streptococcus mitis.
Otros grampositivos (8 contaminantes): Streptococcus grupo viridans, Staphylococcus hominis, Staphylococcus capitis, Staphylococcus capitis-capitis, Corynebacterium spp.
Foco/diagnóstico clínico de presunción en el servicio de urgencias de la muestra global en función del tipo de aislamiento (bacteriemia verdadera frente a hemocultivos contaminados)
| Foco y diagnóstico clínico | Total (n=266) | Bacteriemia verdadera(n=154 [57,9%]) | Hemocultivos contaminados (n=112 [42,1%]) |
|---|---|---|---|
| Infección del tracto urinario, n (%) | 109 (41,0) | 76 (49,4) | 33 (29,5) |
| Infección respiratoria, n (%) | 61 (22,9) | 29 (18,8) | 32 (28,6) |
| Infección abdominal, n (%) | 25 (9,4) | 11 (7,1) | 14 (12,5) |
| Infección de piel y partes blandas, n (%) | 21 (7,9) | 13 (8,4) | 8 (7,1) |
| Infección del sistema nervioso central, n (%) | 11 (4,1) | 7 (4,5) | 4 (3,6) |
| Fiebre sin foco claro, n (%) | 28 (10,5) | 12 (7,8) | 16 (14,3) |
| Otros, n (%) | 11 (4,1) | 6 (3,9) | 5 (4,5) |
Otros focos: ginecológico, endocarditis, dispositivos externos.
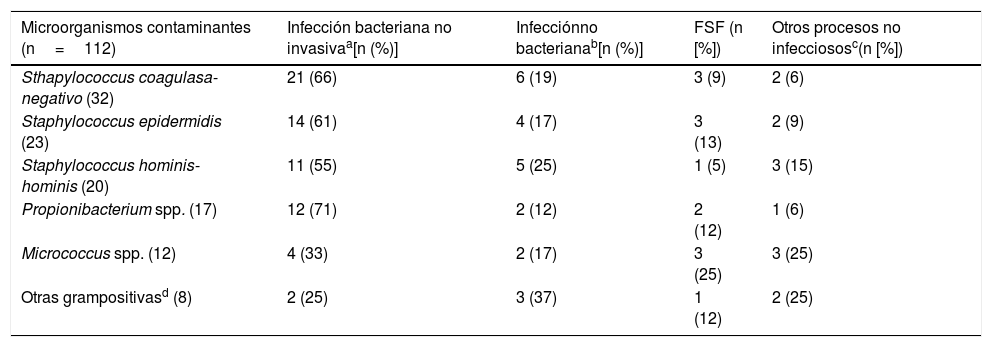
Foco/diagnóstico clínico final tras el alta desde el servicio de urgencias o desde la hospitalización de los casos de hemocultivos contaminados
| Microorganismos contaminantes (n=112) | Infección bacteriana no invasivaa[n (%)] | Infecciónno bacterianab[n (%)] | FSF (n [%]) | Otros procesos no infecciososc(n [%]) |
|---|---|---|---|---|
| Sthapylococcus coagulasa-negativo (32) | 21 (66) | 6 (19) | 3 (9) | 2 (6) |
| Staphylococcus epidermidis (23) | 14 (61) | 4 (17) | 3 (13) | 2 (9) |
| Staphylococcus hominis-hominis (20) | 11 (55) | 5 (25) | 1 (5) | 3 (15) |
| Propionibacterium spp. (17) | 12 (71) | 2 (12) | 2 (12) | 1 (6) |
| Micrococcus spp. (12) | 4 (33) | 2 (17) | 3 (25) | 3 (25) |
| Otras grampositivasd (8) | 2 (25) | 3 (37) | 1 (12) | 2 (25) |
FSF: fiebre sin foco claro o definido.
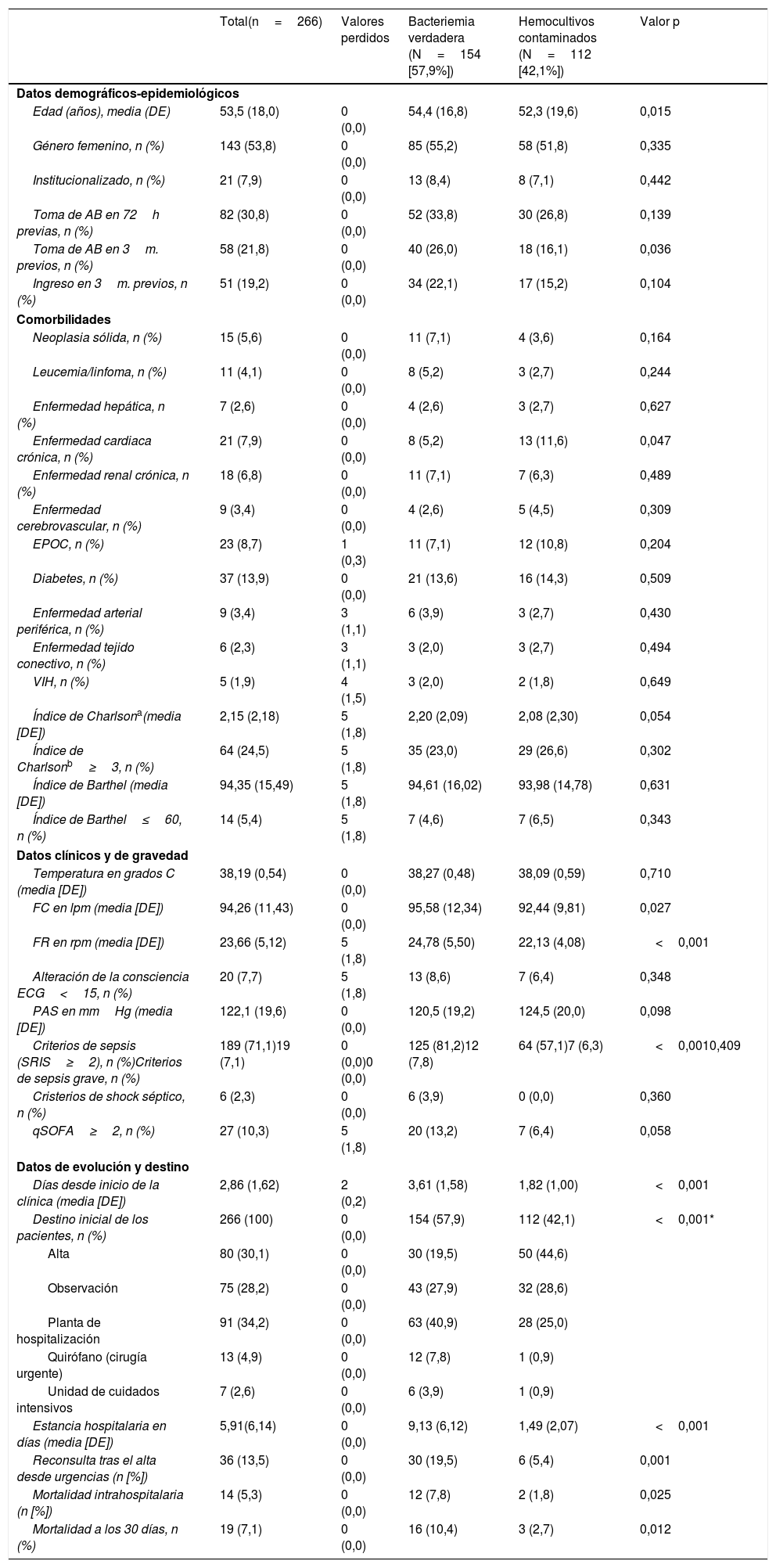
En la tabla 4 se muestran las características sociodemográficas, epidemiológicas, las comorbilidades (y el índice de Charlson) funcionales (y el índice de Barthel), clínicas, de gravedad, de evolución de los pacientes y destino. Al comparar los pacientes con BV y con HC solo se encontraron diferencias significativas en la edad (54,4 [16,8] frente a 52,3 [19,6] años, p=0,015) y en la existencia de cardiopatía crónica (mayor en las BV, p=0,015). En relación con los datos de presentación clínica solo la frecuencia cardiaca (95,98 [12,34] frente a 92,44 [9,81] lpm, p=0,027), la frecuencia respiratoria (24,78 [5,50] frente a 22,13 [4,08] rpm, p<0,001) y los criterios clásicos de sepsis (SRIS≥2) (81,2% frente a 57,1%, p<0,001) fueron superiores en los casos de BV. Por otro lado, también tuvieron diferencias significativas, con p<0,001 a favor de las BV los días de clínica previa (3,61 [1,58] frente a 1,82 [1,0] días) y el porcentaje de casos ingresados en planta, UCI o los remitidos a quirófano. La mortalidad cruda de los pacientes que ingresaron con BV a los 30 días fue del 10,4% (16 fallecidos) superior (p=0,012) a la de los casos de HC contaminados del 3% (3 casos).
Características clinicoepidemiológicas, de evolución y destino de la muestra global y estudio univariable en función del tipo de aislamiento (bacteriemia verdadera frente a hemocultivos contaminados)
| Total(n=266) | Valores perdidos | Bacteriemia verdadera (N=154 [57,9%]) | Hemocultivos contaminados (N=112 [42,1%]) | Valor p | |
|---|---|---|---|---|---|
| Datos demográficos-epidemiológicos | |||||
| Edad (años), media (DE) | 53,5 (18,0) | 0 (0,0) | 54,4 (16,8) | 52,3 (19,6) | 0,015 |
| Género femenino, n (%) | 143 (53,8) | 0 (0,0) | 85 (55,2) | 58 (51,8) | 0,335 |
| Institucionalizado, n (%) | 21 (7,9) | 0 (0,0) | 13 (8,4) | 8 (7,1) | 0,442 |
| Toma de AB en 72h previas, n (%) | 82 (30,8) | 0 (0,0) | 52 (33,8) | 30 (26,8) | 0,139 |
| Toma de AB en 3m. previos, n (%) | 58 (21,8) | 0 (0,0) | 40 (26,0) | 18 (16,1) | 0,036 |
| Ingreso en 3m. previos, n (%) | 51 (19,2) | 0 (0,0) | 34 (22,1) | 17 (15,2) | 0,104 |
| Comorbilidades | |||||
| Neoplasia sólida, n (%) | 15 (5,6) | 0 (0,0) | 11 (7,1) | 4 (3,6) | 0,164 |
| Leucemia/linfoma, n (%) | 11 (4,1) | 0 (0,0) | 8 (5,2) | 3 (2,7) | 0,244 |
| Enfermedad hepática, n (%) | 7 (2,6) | 0 (0,0) | 4 (2,6) | 3 (2,7) | 0,627 |
| Enfermedad cardiaca crónica, n (%) | 21 (7,9) | 0 (0,0) | 8 (5,2) | 13 (11,6) | 0,047 |
| Enfermedad renal crónica, n (%) | 18 (6,8) | 0 (0,0) | 11 (7,1) | 7 (6,3) | 0,489 |
| Enfermedad cerebrovascular, n (%) | 9 (3,4) | 0 (0,0) | 4 (2,6) | 5 (4,5) | 0,309 |
| EPOC, n (%) | 23 (8,7) | 1 (0,3) | 11 (7,1) | 12 (10,8) | 0,204 |
| Diabetes, n (%) | 37 (13,9) | 0 (0,0) | 21 (13,6) | 16 (14,3) | 0,509 |
| Enfermedad arterial periférica, n (%) | 9 (3,4) | 3 (1,1) | 6 (3,9) | 3 (2,7) | 0,430 |
| Enfermedad tejido conectivo, n (%) | 6 (2,3) | 3 (1,1) | 3 (2,0) | 3 (2,7) | 0,494 |
| VIH, n (%) | 5 (1,9) | 4 (1,5) | 3 (2,0) | 2 (1,8) | 0,649 |
| Índice de Charlsona(media [DE]) | 2,15 (2,18) | 5 (1,8) | 2,20 (2,09) | 2,08 (2,30) | 0,054 |
| Índice de Charlsonb≥3, n (%) | 64 (24,5) | 5 (1,8) | 35 (23,0) | 29 (26,6) | 0,302 |
| Índice de Barthel (media [DE]) | 94,35 (15,49) | 5 (1,8) | 94,61 (16,02) | 93,98 (14,78) | 0,631 |
| Índice de Barthel≤60, n (%) | 14 (5,4) | 5 (1,8) | 7 (4,6) | 7 (6,5) | 0,343 |
| Datos clínicos y de gravedad | |||||
| Temperatura en grados C (media [DE]) | 38,19 (0,54) | 0 (0,0) | 38,27 (0,48) | 38,09 (0,59) | 0,710 |
| FC en lpm (media [DE]) | 94,26 (11,43) | 0 (0,0) | 95,58 (12,34) | 92,44 (9,81) | 0,027 |
| FR en rpm (media [DE]) | 23,66 (5,12) | 5 (1,8) | 24,78 (5,50) | 22,13 (4,08) | <0,001 |
| Alteración de la consciencia ECG<15, n (%) | 20 (7,7) | 5 (1,8) | 13 (8,6) | 7 (6,4) | 0,348 |
| PAS en mmHg (media [DE]) | 122,1 (19,6) | 0 (0,0) | 120,5 (19,2) | 124,5 (20,0) | 0,098 |
| Criterios de sepsis (SRIS≥2), n (%)Criterios de sepsis grave, n (%) | 189 (71,1)19 (7,1) | 0 (0,0)0 (0,0) | 125 (81,2)12 (7,8) | 64 (57,1)7 (6,3) | <0,0010,409 |
| Cristerios de shock séptico, n (%) | 6 (2,3) | 0 (0,0) | 6 (3,9) | 0 (0,0) | 0,360 |
| qSOFA≥2, n (%) | 27 (10,3) | 5 (1,8) | 20 (13,2) | 7 (6,4) | 0,058 |
| Datos de evolución y destino | |||||
| Días desde inicio de la clínica (media [DE]) | 2,86 (1,62) | 2 (0,2) | 3,61 (1,58) | 1,82 (1,00) | <0,001 |
| Destino inicial de los pacientes, n (%) | 266 (100) | 0 (0,0) | 154 (57,9) | 112 (42,1) | <0,001* |
| Alta | 80 (30,1) | 0 (0,0) | 30 (19,5) | 50 (44,6) | |
| Observación | 75 (28,2) | 0 (0,0) | 43 (27,9) | 32 (28,6) | |
| Planta de hospitalización | 91 (34,2) | 0 (0,0) | 63 (40,9) | 28 (25,0) | |
| Quirófano (cirugía urgente) | 13 (4,9) | 0 (0,0) | 12 (7,8) | 1 (0,9) | |
| Unidad de cuidados intensivos | 7 (2,6) | 0 (0,0) | 6 (3,9) | 1 (0,9) | |
| Estancia hospitalaria en días (media [DE]) | 5,91(6,14) | 0 (0,0) | 9,13 (6,12) | 1,49 (2,07) | <0,001 |
| Reconsulta tras el alta desde urgencias (n [%]) | 36 (13,5) | 0 (0,0) | 30 (19,5) | 6 (5,4) | 0,001 |
| Mortalidad intrahospitalaria (n [%]) | 14 (5,3) | 0 (0,0) | 12 (7,8) | 2 (1,8) | 0,025 |
| Mortalidad a los 30 días, n (%) | 19 (7,1) | 0 (0,0) | 16 (10,4) | 3 (2,7) | 0,012 |
AB: antibióticos; C: centígrados; DE: desviación estándar; EPOC: Enfermedad pulmonar obstructiva crónica; FC: frecuencia cardiaca; FR: frecuencia respiratoria; h: horas; lpm: latidos por minuto; m: meses; n: número; rpm: respiraciones por minuto; VIH: virus de la inmunodeficiencia humana.
Criterios de sepsis (SRIS≥2) según conferencia de Consenso de 2001 (Levy et al.19), criterios de sepsis (qSOFA≥2) según la tercera conferencia de consenso (Sepsis-3) (Singer et al.20), p<0,05 (comparación 2×2de los grupos).
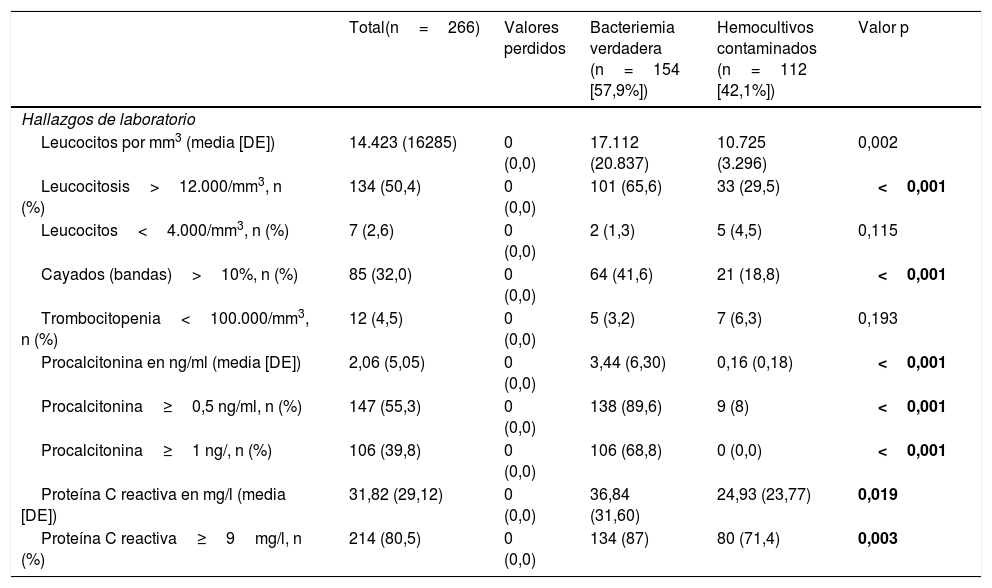
En relación con la comparación de los valores analíticos (tabla 5) se encontraron diferencias significativas en el recuento absoluto de leucocitos (17.112 [20.837] vs. 10.725 [3.296] por mm3, p=0,002) y ante la existencia de una leucocitosis>12.000/mm3 (65,6% vs. 29,5, p<0,001) y una proporción>10% de cayados (41,6% vs. 18,8, p<0,001). Para la PCR existieron diferencias con mayores concentraciones medias en las BV (36,84 [31,60] vs. 24,93mg/l [23,77], p=0,019) y con el PC≥9mg/l (87% vs. 71,4%, p=0,003). Por último, para la PCT se obtuvieron las mayores diferencias entre concentraciones (3,44 [6,30] vs. 0,16ng/ml [0,18], p<0,001) y también tanto con el PC≥0,5ng/ml (89,6% vs. 8%, p=0,003), como con PC≥1ng/ml (68,8% vs. 0,0%, p<0,001).
Características analíticas de la muestra global y estudio univariable en función del tipo de aislamiento (bacteriemia verdadera frente a hemocultivos contaminados)
| Total(n=266) | Valores perdidos | Bacteriemia verdadera (n=154 [57,9%]) | Hemocultivos contaminados (n=112 [42,1%]) | Valor p | |
|---|---|---|---|---|---|
| Hallazgos de laboratorio | |||||
| Leucocitos por mm3 (media [DE]) | 14.423 (16285) | 0 (0,0) | 17.112 (20.837) | 10.725 (3.296) | 0,002 |
| Leucocitosis>12.000/mm3, n (%) | 134 (50,4) | 0 (0,0) | 101 (65,6) | 33 (29,5) | <0,001 |
| Leucocitos<4.000/mm3, n (%) | 7 (2,6) | 0 (0,0) | 2 (1,3) | 5 (4,5) | 0,115 |
| Cayados (bandas)>10%, n (%) | 85 (32,0) | 0 (0,0) | 64 (41,6) | 21 (18,8) | <0,001 |
| Trombocitopenia<100.000/mm3, n (%) | 12 (4,5) | 0 (0,0) | 5 (3,2) | 7 (6,3) | 0,193 |
| Procalcitonina en ng/ml (media [DE]) | 2,06 (5,05) | 0 (0,0) | 3,44 (6,30) | 0,16 (0,18) | <0,001 |
| Procalcitonina≥0,5 ng/ml, n (%) | 147 (55,3) | 0 (0,0) | 138 (89,6) | 9 (8) | <0,001 |
| Procalcitonina≥1 ng/, n (%) | 106 (39,8) | 0 (0,0) | 106 (68,8) | 0 (0,0) | <0,001 |
| Proteína C reactiva en mg/l (media [DE]) | 31,82 (29,12) | 0 (0,0) | 36,84 (31,60) | 24,93 (23,77) | 0,019 |
| Proteína C reactiva≥9mg/l, n (%) | 214 (80,5) | 0 (0,0) | 134 (87) | 80 (71,4) | 0,003 |
DE: desviación estándar; n: número.
Los datos (valores de p) en negrita son aquellos en los que hay diferencias estadísticamente significativas con p < 0,05.
Al comparar específicamente los valores obtenidos con el único patógeno encontrado en los 2 grupos (Staphylococcus coagulasa-negativa: 3BV vs. 32HC contaminados) los resultados son muy parecidos a los generales. Para el recuento absoluto de leucocitos (14.423 [16.285] vs. 10.456 [4.356] por mm3, p=0,064), proporción>10% de cayados (25% vs. 33%, p<0,603), para la PCR (6,00 [3,00] vs. 27,32mg/l [24,93], p=0,019 y para la PCT también se obtuvieron las mayores diferencias entre concentraciones (1,10 [0,33] vs. 0,26ng/ml [0,21], p<0,001. En 3 casos de BV hubo crecimiento en 2 pares de HC y correspondieron a 2 infecciones del sistema nervioso central relacionadas con sistemas de derivación ventricular, y uno asociado a infección de un catéter central. Los diagnósticos finales de los 32 casos definidos como HC contaminados se muestran en la tabla 3.
En la figura 2 se describen los valores del ABC-ROC de la PCT, la PCR, el recuento de leucocitos y las formas inmaduras (cayados) para predecir la existencia de BV frente a HC contaminados. Aunque el ABC-ROC obtenida para la PCR de 0,639 (IC 95%: 0,572-0,707, p<0,001), para el recuento de leucocitos de 0,693 (IC 95%: 0,630-0,756, p<0,001) y para las formas inmaduras (>10% cayados) de 0,614 (IC 95%: 0,547-0,682, p=0,001) son significativas, la PCT muestra una capacidad muy superior a estas, con un ABC-ROC de 0,983 (IC 95%: 0,972-0,994, p<0,001). Esta diferencia es evidente al comprobar que los valores superiores de los IC 95% de las ABC-ROC de la PCR, leucocitos y formas jóvenes (0,707; 0,756 y 0,682, respectivamente) son claramente menores al valor inferior del IC 95% de la PCT (0,972).
Capacidad predictiva de bacteriemia verdadera de los biomarcadores en pacientes atendidos en el servicio de urgencias por infección.
ABC-ROC: área bajo la curva (Receiver Operating Characteristic); IC: intervalo de confianza; PCT: procalcitonina (ng/ml); PCR: proteína C reactiva (mg/l).
Valor de p: indica el riesgo de error tipo i en el contraste de la hipótesis nula de que el ABC-ROC es igual a 0,5.
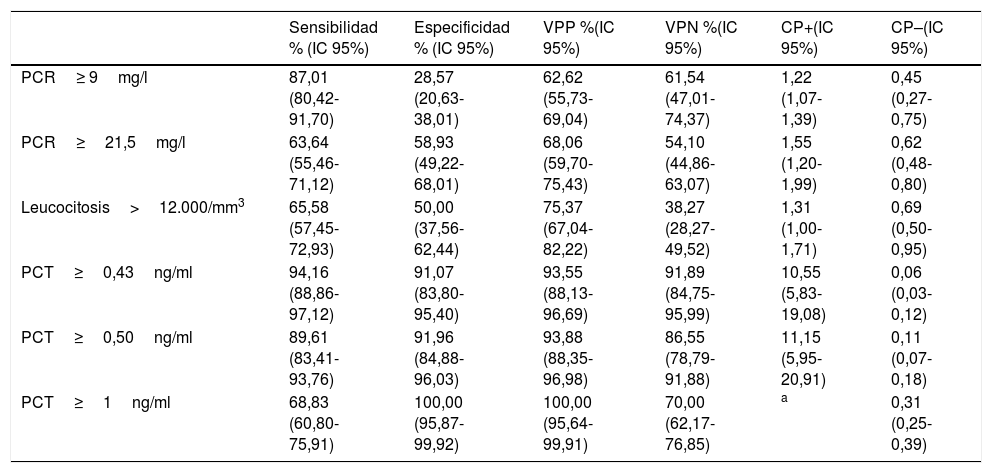
El PC de PCT que consigue el mejor rendimiento pronóstico es≥0,43ng/ml, con el que se consigue una sensibilidad del 94,16% (IC 95%: 88,86-97,12), una especificidad del 91,07% (IC 95%: 83,80-95,40), un VPP de 93,55% (IC 95%: 88,13-96,69), un VPN de 91,89% (IC 95%: 84,75-95,99), un CP+ de 10,55 (IC 95%: 5,83-19,08) y un CP– de 0,06 (IC 95%: 0,03-0,12). Todos los valores de los rendimientos diagnósticos de BV de los distintos PC de PCT, PCR y leucocitos se muestran en la tabla 6.
Puntos de corte y rendimiento para la predicción de bacteriemia verdadera en los hemocultivos extraídos en urgencias con aislamiento positivo
| Sensibilidad % (IC 95%) | Especificidad % (IC 95%) | VPP %(IC 95%) | VPN %(IC 95%) | CP+(IC 95%) | CP–(IC 95%) | |
|---|---|---|---|---|---|---|
| PCR≥ 9mg/l | 87,01 (80,42-91,70) | 28,57 (20,63-38,01) | 62,62 (55,73-69,04) | 61,54 (47,01-74,37) | 1,22 (1,07-1,39) | 0,45 (0,27-0,75) |
| PCR≥21,5mg/l | 63,64 (55,46-71,12) | 58,93 (49,22-68,01) | 68,06 (59,70-75,43) | 54,10 (44,86-63,07) | 1,55 (1,20-1,99) | 0,62 (0,48-0,80) |
| Leucocitosis>12.000/mm3 | 65,58 (57,45-72,93) | 50,00 (37,56-62,44) | 75,37 (67,04-82,22) | 38,27 (28,27-49,52) | 1,31 (1,00-1,71) | 0,69 (0,50-0,95) |
| PCT≥0,43ng/ml | 94,16 (88,86-97,12) | 91,07 (83,80-95,40) | 93,55 (88,13-96,69) | 91,89 (84,75-95,99) | 10,55 (5,83-19,08) | 0,06 (0,03-0,12) |
| PCT≥0,50ng/ml | 89,61 (83,41-93,76) | 91,96 (84,88-96,03) | 93,88 (88,35-96,98) | 86,55 (78,79-91,88) | 11,15 (5,95-20,91) | 0,11 (0,07-0,18) |
| PCT≥1ng/ml | 68,83 (60,80-75,91) | 100,00 (95,87-99,92) | 100,00 (95,64-99,91) | 70,00 (62,17-76,85) | a | 0,31 (0,25-0,39) |
CP+: cociente de probabilidad positivo; CP–: cociente de probabilidad negativo; IC: intervalo de confianza; PCR: proteína C reactiva; PCT: procalcitonina; VPN: valor predictivo negativo; VPP: valor predictivo positivo.
Se han utilizado los puntos de corte con mayor rendimiento diagnóstico encontrados, así como otros puntos de corte elegidos por los autores (valores definidos por el laboratorio como normales o significativos) para poder realizar comparativas con otros estudios.
En los últimos años distintas revisiones han propuesto distintos criterios, entre ellos los biomarcadores, para optimizar las indicaciones de obtención de los HC en los SUH, y así mejorar su eficacia (aumentando el número de positivos), efectividad (disminuyendo los contaminados) y su eficiencia (costes y procesamiento, mejora de la adecuación del tratamiento antibiótico, decisión de alta o ingreso)11–13. En este escenario, teniendo en cuenta que en los SUH se obtienen la gran mayoría de HC que se envían al servicio de microbiología para su procesamiento, no debemos olvidar la importancia diagnóstica, pronóstica y terapéutica que tiene la sospecha y confirmación de la bacteriemia3,11,12,21. En este sentido, los biomarcadores y muy especialmente la PCT han demostrado su gran capacidad para predecir la existencia de bacteriemia, e incluso cuándo indicar la necesidad de obtener HC en los pacientes en el SUH11,12. Pero pocos estudios15,16 se han diseñado para analizar la capacidad de estos para diferenciar entre los HC positivos, las BV de los HC contaminados.
Los resultados del estudio confirman que el número de HC extraídos en nuestro SUH (34,96 HC/1.000 atendidos) es superior a la mayoría de estudios en adultos, que varían entre 5-20HC/1.000 atendidos3,5,14,15,21, pero inferior a los publicados en urgencias de pediatría7. Por otro lado, la rentabilidad diagnóstica del 10,79% es similar a la conseguida en la mayoría de estudios comparados (2-20%)3,6,7,21, pero la tasa de contaminación de 8,29% es muy superior a la referida por estos mismos trabajos (1-3%)3,6,7,21, ya que de todos nuestros aislamientos solo el 56,55% se consideraron BV y el 43,45% HC contaminados. Este hecho constituye un verdadero problema de calidad y seguridad para el paciente, ya que estos hallazgos conllevan un incremento de las pruebas complementarias y pueden ser un obstáculo para el diagnóstico, aumentar la estancia hospitalaria, los costes y la administración de tratamientos antibióticos innecesarios2,8,22. Al hilo de esta situación, el interés de conocer en aquellos casos donde las manifestaciones clínicas sean sutiles o indeterminadas (por ejemplo en los ancianos, neutropénicos o algunos de los tratados previamente con antibióticos) o de confirmar la sospecha clínica de contaminación de los HC es evidente, y puede mejorar la estrategia diagnóstico-terapéutica a seguir con el paciente.
En relación directa con la capacidad de la PCT de poder predecir la existencia de BV y diferenciar esta de los aislamientos en HC contaminados, nuestros resultados confirman el excelente rendimiento que se obtiene con los PC de PCT≥0,5ng/ml (y 0,43), como ya habían apuntado algunos autores como Jeong et al.15, muy superior al conseguido por la PCR y/o el recuento leucocitario. Las diferencias en las concentraciones medias de PCT en nuestro estudio al comparar los casos de BV con HC contaminados (3,44 [6,30] vs. 0,16 [0,18] ng/ml, p<0,001) fueron similares a las publicadas por Jeong et al.15, con 3,2ng/ml en BV y 0,3ng/ml en los casos de grampositivos considerados contaminantes (p<0,0001). Del mismo modo, el ABC-ROC de la PCT de 0,86 (IC 95%: 0,83-0,89) encontrada por estos autores es muy superior, como en nuestro caso, a la de la PCR. Todo ello coincide con lo publicado anteriormente por Schuetz et al.23, con un ABC-ROC de 0,98, aunque en este caso con una muestra pequeña (n=40) y con la restricción de definir HC contaminado cuando el aislamiento fue solo de ECN. Más recientemente Watanabe et al.24 encuentran diferencias significativas sobre 133HC positivos entre Escherichia coli y HC con aislamiento de Staphylococcus epidermidis y Staphylococcus lugdunensis, considerados contaminantes en los que la PCT registró en todos un valor<0,5ng/ml. Con una muestra parecida (88 casos de BV frente a 49HC contaminados) Oksuz et al.16 también confirmaron estos hallazgos con el mismo PC (<0,5ng/ml) obteniendo una sensibilidad de 68%, especificidad de 66% y un VPN del 94%, con un ABC-ROC también de 0,86 para distinguir BV de HC contaminados. Por todo lo dicho, ante la existencia de concentraciones de PCT≥0,5ng/ml (o/y 0,43ng/ml) en el SUH, estaría indicado obtener HC por la mayor probabilidad de que resulten positivos, y además cuando exista aislamiento se deberá asumir que se tratará de una BV descartando la posible contaminación de los HC con una especificidad mayor del 91%. Y por otro lado, estos datos refuerzan algunas recomendaciones existentes12,25 para la extracción de HC en los SUH cuando la PCT sea>0,5ng/ml al poseer un VPN>91% para descartar contaminación. De forma que si la PCT tiene un valor de 0,1-0,43ng/ml habrá que considerar la situación clínica (criterios de sepsis) para valorar la indicación o no de extraer HC11,12,25. En nuestro estudio, si elevamos el PC a 1ng/ml de PCT, conseguimos una especificidad y un VPP del 100%, reduciendo la sensibilidad al 68%, pero Jeong et al.15 prefieren utilizar un PC de 0,99ng/ml para conseguir una especificidad del 98% (muy parecida a la nuestra) con el que predicen la existencia de BV.
La mortalidad cruda del grupo de bacteriemias fue del 10,4% a los 30 días de la extracción de los HC en el SUH, en los rangos de lo publicado por otros autores (10-25%)3,9,10 y significativamente superior al grupo de pacientes con HC contaminados del 2,7% (p<0,001).
El presente estudio tiene distintas limitaciones, como son su carácter retrospectivo y unicéntrico con una tasa muy alta de HC contaminados, aunque los resultados representan el fiel reflejo de la epidemiología y realidad clínica en nuestro SUH, pero no se pueden extrapolar y carecen de validez externa. Por otro lado, el hecho de incluir por oportunidad solo los casos en los que también se obtuvieron los biomarcadores (266 de los 1.604, el 16,58%) podría haber condicionado un sesgo de selección al no contemplar las características de los no incluidos (algo más del 80%). Otra posible limitación, no controlable por el carácter retrospectivo del estudio, que habría podido originar algún sesgo o déficit de información, sería el hecho de no haber podido tener en cuenta en todos los casos el efecto de la toma previa de antibióticos25, ya que estos podrían haber mitigado o modificado las manifestaciones clínicas en algunos pacientes con HC contaminados, o incluso podría existir algún caso, no detectado, con concentraciones elevadas de PCT y HC negativos que realmente sí procedieran de una infección bacteriana, e incluso con criterios de sepsis12,25.
Con los resultados de nuestro estudio creemos que la PCT puede ayudar a predecir la existencia de BV en el SUH y así evitar posibles efectos colaterales y adversos (como la realización de pruebas diagnósticas y la administración de tratamientos antibióticos innecesarios, reconsultas en urgencias, estancias hospitalarias prolongadas, de los costes, etc.)2,8,26,27. En un futuro próximo sería necesario promover un estudio multicéntrico con los mismos objetivos para validar los resultados.
Como conclusión de nuestro estudio podemos decir que en los HC con crecimiento positivo extraídos en el SU la PCT consigue el mejor rendimiento pronóstico de BV diferenciándola de los HC contaminados, mayor que la PCR y los leucocitos.
Conflicto de interesesAJJ ha participado en reuniones científicas organizadas por Roche, Thermo Scientific Biomarkers, B.R.A.H.M.S. AG y Biomerieux.
Los autores declaran la ausencia de conflicto de intereses en relación con el presente artículo.
Ningún autor ha recibido compensación económica por participar en este trabajo.