Los enterococos son causantes de infecciones graves, como endocarditis y bacteriemias. Durante las últimas décadas, las infecciones enterocócicas han ganado importancia debido al aumento del número de casos. El conocimiento de los factores predisponentes al aislamiento de Enterococcus faecalis o Enterococcus faecium puede ser útil para mejorar el tratamiento empírico de las bacteriemias.
MétodosEstudio retrospectivo de los pacientes hospitalizados diagnosticados de bacteriemia enterocócica (enero 2000–diciembre 2006). Se analizaron datos demográficos, clínicos, microbiológicos, exposición antibiótica, tratamientos y pronóstico. Para identificar los factores predisponentes al aislamiento de E. faecalis o E. faecium se llevó a cabo un análisis comparativo univariado y después un análisis multivariado.
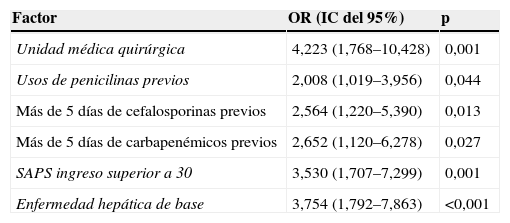
ResultadosSe estudiaron 228 episodios de bacteriemia: 168 de E. faecalis y 60 de E. faecium. Todos los aislamientos de E. faecalis fueron sensibles a ampicilina, aunque sólo el 25% lo fue en el grupo de E. faecium. Hubo un caso de resistencia a vancomicina. Las variables que se asociaron independientemente a la adquisición de bacteriemia por E. faecium cuando se compararon con las bacteriemias producidas por E. faecalis fueron el ingreso en una unidad quirúrgica (OR: 4,223; p=0,001), más de 5 días de tratamiento previo con cefalosporinas o carbapenémicos (OR: 2,564; p=0,013 y OR: 2,652; p=0,027, respectivamente), la administración previa de penicilinas (OR: 2,008; p=0,044), Simplified Acute Physiology Score superior a 30 al ingreso (OR: 3,530; p=0,001) y enfermedad hepática de base (OR: 3,754; p<0,001).
ConclusionesDebido al diferente patrón de resistencia de ambas especies enterocócicas, es esencial el conocimiento de los factores predisponentes a la adquisición de bacteriemia por una u otra especie a fin de establecer un tratamiento empírico antibiótico adecuado.
Enterococci are responsible for severe infections, such as endocarditis and bacteremia. During recent decades, enterococcal infections have grown in importance because of the increasing number of cases. Knowledge of the factors predisposing to acquisition of infection by E. faecalis or E. faecium may be useful to improve the empirical treatment.
MethodsRetrospective study of patients diagnosed with enterococcal bacteremia and hospitalized over a 7-year period (January 2000–December 2006), analyzing demographic data, clinical and microbiological characteristics, antibiotic exposure, treatment, and outcome. To identify the predisposing factors for isolation of E. faecalis or E. faecium in a clinical specimen, we performed univariate comparisons between the 2 groups, and subsequently, multivariate logistic regression analysis.
ResultsA total of 228 episodes of bacteremia were recorded, 168 caused by E. faecalis and 60 by E. faecium. All E. faecalis isolates were susceptible to ampicillin, but only 25% of E. faecium were ampicillin-susceptible. There was only 1 vancomycin-resistant isolate. The variables independently associated with acquisition of E. faecium bacteriemia were surgical ward admission (odds ratio [OR], 4.223; P=.001), >5 days of previous treatment with cephalosporins (OR, 2.564; P=.013), >5 days of carbapenems (OR, 2.652; P=.027), previous administration of penicillins (OR, 2.008; P=0.044), SAPS score >30 at admission (OR, 3.530; P=0.001), and hepatobiliary disease as a comorbid condition (OR, 3.754; P<0.001),
ConclusionBecause of the differing susceptibility patterns of the enterococcal species studied, it is essential to know the factors predisposing to acquisition of infection by one or the other species to initiate adequate empirical treatment.
Los enterococos son microorganismos comensales del tracto digestivo que ocasionalmente, y sobre todo en pacientes inmunodeprimidos u hospitalizados durante largos períodos de tiempo, pueden comportarse como microorganismos patógenos1,2. Actualmente, en EE. UU. los aislamientos del género Enterococcus son la cuarta causa más frecuente de infección nosocomial y la tercera causa de bacteriemia, y suponen un 10,2% del total de las bacteriemias3. Estas cifras son algo menores en Europa, donde las bacteriemias por enterococos suponen un 7,2% del total3, y en España, donde representan aproximadamente el 5–6%4,5.
En general, las bacteriemias enterocócicas ocurren en pacientes con hospitalización prolongada, enfermedades de base graves, pacientes a los que se les realiza manipulación instrumental y pacientes con presión antibiótica previa4. Las 2 especies principales causantes de infección enterocócica son Enterococcus faecalis y Enterococcus faecium. Históricamente, las infecciones por E. faecalis representaban el 80–90%, mientras que las infecciones por E. faecium representaban el 5–10% del total; sin embargo, actualmente la proporción de aislamientos de E. faecium ha aumentado respecto a E. faecalis y se sitúa en torno del 22,2%6.
Además de la resistencia intrínseca frente a diferentes clases de antibióticos, los enterococos son capaces de adquirir altos niveles de resistencia antibiótica mediante transferencia genética horizontal7. La E. faecium tiende a acumular resistencia a ampicilina y a vancomicina más frecuentemente que E. faecalis8. En cambio, la resistencia a ampicilina se ha descrito poco en E. faecalis y cuando se origina es generalmente por la producción de betalactamasas9. La resistencia de E. faecium frente a ampicilina y a carbapenémicos se debe principalmente a la producción de una proteína de unión a penicilina (PBP), la PBP5, que por mutaciones presenta baja afinidad a ampicilina10,11. La prevalencia actual de resistencia a ampicilina por parte de E. faecium es del 97,5% en Europa y del 98,7% en EE. UU12. Además, la resistencia adquirida a ampicilina es un gran marcador fenotípico de infección nosocomial en Europa y la experiencia americana ha demostrado que frecuentemente predice aumentos en los porcentajes de resistencia a vancomicina en años venideros7,13.
Durante las últimas 2 décadas, los datos epidemiológicos han revelado que la emergencia de la especie de E. faecium como patógeno nosocomial está relacionada con la expansión de una subpoblación genéticamente diferente, en concreto el complejo clonal 17, diseminado en países de todos los continentes y que parece estar especialmente adaptado al medio hospitalario a través de procesos de diversificación genética14–17.
Debido a que la diferente sensibilidad a los antimicrobianos entre estas 2 especies de enterococos puede tener un impacto a la hora de establecer un tratamiento empírico y sobre el tratamiento del paciente, se ha realizado un estudio comparativo de las características clínicas y microbiológicas y de pronóstico de las bacteriemias por E. faecalis frente a E. faecium. Asimismo, se determinaron los factores que independientemente se asociaron a la adquisición de bacteriemia por E. faecium.
Métodos- 1.
Diseño. Estudio retrospectivo observacional de cohortes realizado entre el 1 de enero de 2000 y el 31 de diciembre de 2006. Se incluyeron todos los primeros episodios de bacteriemia por E. faecalis o E. faecium de todos los pacientes mayores de 18 años de los que se disponía de datos de hospitalización.
- 2.
Descripción de la institución. El estudio se realizó en el ámbito del Hospital del Mar (Barcelona). Se trata de un centro hospitalario universitario de tercer nivel que cuenta con 450 camas, 18 de éstas están dedicadas a la unidad de cuidados intensivos (UCI). Dispone de servicios médicos, incluídos Oncología y Hematología, servicios quirúrgicos así como la UCI antes mencionada. El Hospital es centro de referencia para un área de 318.000 habitantes.
- 3.
Descripción de los casos. Para el diagnóstico de la bacteriemia se siguieron globalmente las recomendaciones de la Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica (SEIMC) en su última edición18.
Factores analizados. En cada episodio de bacteriemia se recogió la siguiente información: datos demográficos (edad y sexo), características clínicas (ingreso previo y estancia previa en la UCI), unidad de hospitalización (médica, quirúrgica o UCI), y gravedad al ingreso, se consideró la puntuación del Simplified Acute Physiology Score (SAPS) II19. Para el cálculo de este predictor, los valores de las variables no disponibles se consideraron como normales; comorbilidad (diabetes, enfermedad hepática, insuficiencia renal, malignidad, etc.); uso previo de antibióticos; otros tratamientos previos (uso de inmunosupresores [incluyendo corticoides], quimioterapia, administración de nutrición parenteral total [NPT] y hemodiálisis); tratamiento empírico adecuado en función de la información obtenida respecto al perfil de sensibilidad del enterococo aislado (se consideró tratamiento antibiótico empírico correcto cuando al menos uno de los antibióticos incluidos en la pauta inicial presentó actividad in vitro frente a este microorganismo); estancia hospitalaria, y mortalidad bruta.
Se recogieron los siguientes datos microbiológicos:
- a)
Origen de la bacteriemia, se consideraron 3 posibilidades: 1) nosocomial: cuando ésta no estaba presente en el momento del ingreso hospitalario y se adquirió después de 48h de estancia en el hospital; 2) asociada a asistencia sanitaria extrahospitalaria: se utilizaron los criterios de Friedman20 (se efectuó un estudio sobre las características clínicas y microbiológicas de este tipo de bacteriemias), y 3) adquirida en la UCI: los mismos criterios de tiempo que la bacteriemia nosocomial, pero en la UCI.
- b)
Clasificación de la bacteriemia: se definió como bacteriemia polimicrobiana cuando se obtuvo aislamiento de 2 o más patógenos en la misma toma de hemocultivo.
- c)
Foco de la bacteriemia: para establecer la fuente de infección se consideraron criterios clínicos y microbiológicos. Los criterios clínicos incluyeron los síntomas y los signos que indicaban el posible foco de infección. Desde el punto de vista microbiológico, se tuvo en cuenta el aislamiento del mismo microorganismo en cualquier localización anatómica dentro de las 48h del episodio de bacteriemia. Se consideró bacteriemia primaria cuando los datos clínicos y las exploraciones complementarias no pusieron de manifiesto la existencia de ningún foco infeccioso. Cuando se pudo demostrar el foco de la infección, se consideró bacteriemia secundaria. Según el foco, las bacteriemias se clasificaron como procedentes de catéter, orina, herida quirúrgica, sistema respiratorio, abdominal, piel y partes blandas, endocarditis y foco desconocido.
- 4.
Análisis microbiológico. La metodología empleada para la extracción de los hemocultivos, así como la identificación de los microorganismos y sus sensibilidades se realizaron por métodos estándares, según la rutina del laboratorio de microbiología del centro. La sistemática para la extracción de los hemocultivos dependió del criterio del clínico responsable, aunque la práctica general consiste en extraer 2 pares de frascos (aerobios y anaerobios) por paciente. Para el estudio de la sensibilidad a distintos grupos de antibióticos se siguieron las recomendaciones (método y valores) del Clinical Laboratory Standards Institute21.
- 5.
Tratamiento estadístico. Se estudió la evolución de las distintas especies de enterococos durante el período de estudio.
Se realizó un análisis descriptivo de las características clínicas y microbiológicas de las bacteriemias por enterococo en los 2 grupos de pacientes mediante el cálculo de medias±desviaciones estándar para las variables cuantitativas continuas y medianas para variables cuantitativas ordinales. Como prueba estadística se utilizó la t de Student para las variables con distribución normal o la U de Mann-Whitney para las variables no paramétricas. Para las variables dicotómicas, se calcularon las proporciones a través de las tablas de contingencia y a nivel estadístico se utilizó el test de χ2 y el test exacto de Fischer. Se consideró un valor de p<0.05 como estadísticamente significativo.
Finalmente, se realizó un análisis de regresión logística en el que la variable dependiente fue la adquisición de bacteriemia por E. faecium frente a E. faecalis, incluyendo como variables independientes las que obtuvieron significación estadística en el análisis bivariante. El análisis estadístico se llevó a cabo mediante la aplicación estadística SPSS, versión 13.0 para Windows.
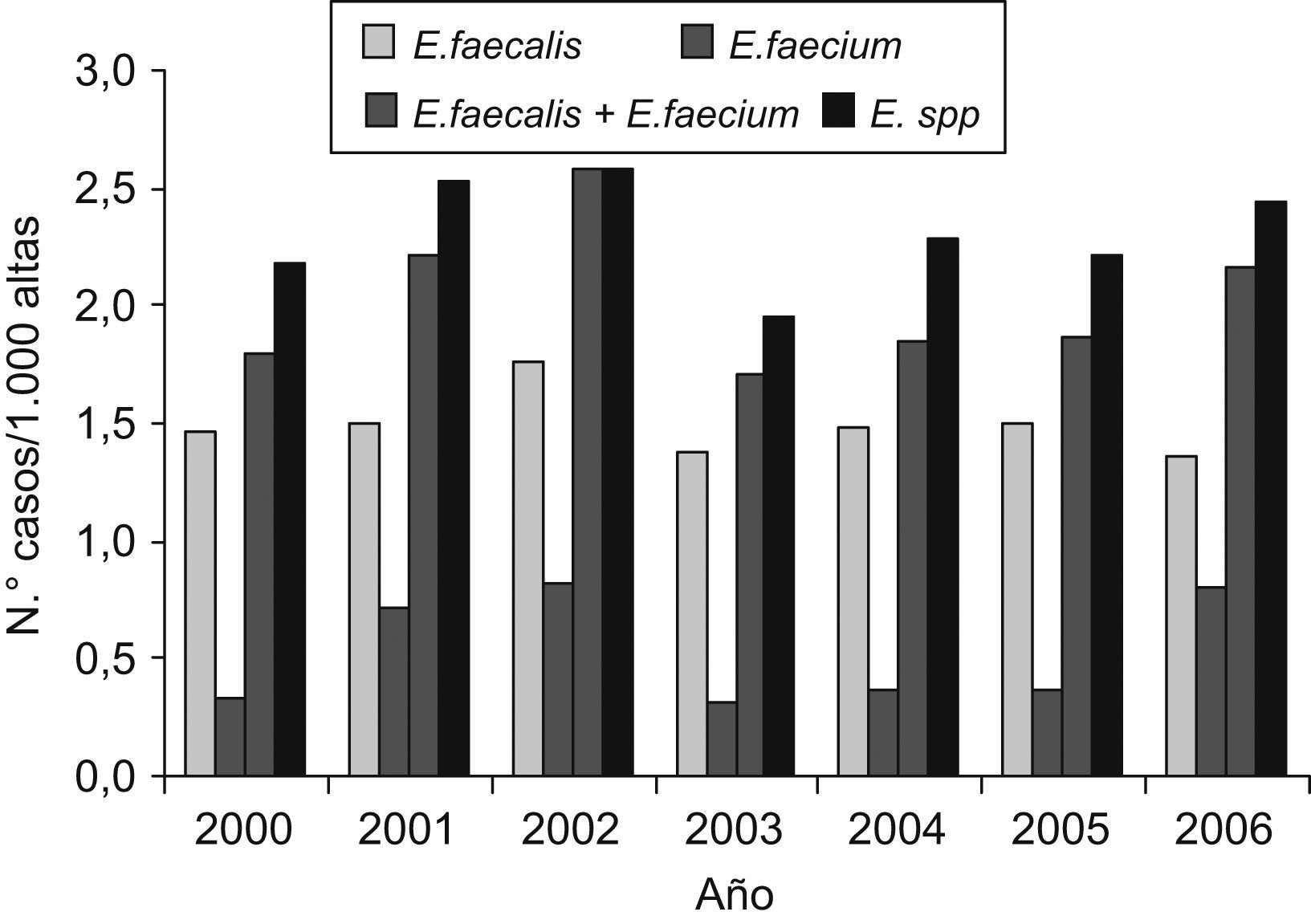
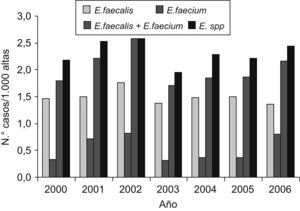
ResultadosDurante el período de estudio se registró un total de 4.172 episodios de bacteriemia por algún tipo de microorganismo patógeno. De ellos, Enterococcus spp. causó un total de 261 (6,26%). De éstos, 241 (92.34%) fueron por E. faecalis o E. faecium. Dentro del género Enterococcus, E. faecalis se aisló en 178 episodios, lo que representó un 73,86% del total, y E. faecium se aisló en 63 episodios, lo que representó un 26,14% del total. De las 241 bacteriemias por enterococos, 228 (94,6%) cumplieron los criterios de inclusión y 13 (5,4%) quedaron excluidas por criterios de edad (2 pacientes [15,4%]), por no disponer de datos de hospitalización por muerte precoz durante su estancia en urgencias (7 pacientes [53,8%]) o por tratarse de un segundo episodio de bacteriemia durante el mismo ingreso (4 pacientes [30,8%]). En la figura 1 se describe la evolución de los distintos aislamientos de enterococo durante el período de estudio, sin observarse diferencias entre las distintas especies.
De las 228 bacteriemias analizadas, 147 fueron nosocomiales (64,5%), 18 de origen intra-UCI (7,9%) y 63 estuvieron relacionadas con asistencia sanitaria extrahospitalaria (27,6%). Las características de estas últimas se expresan en la tabla 4.
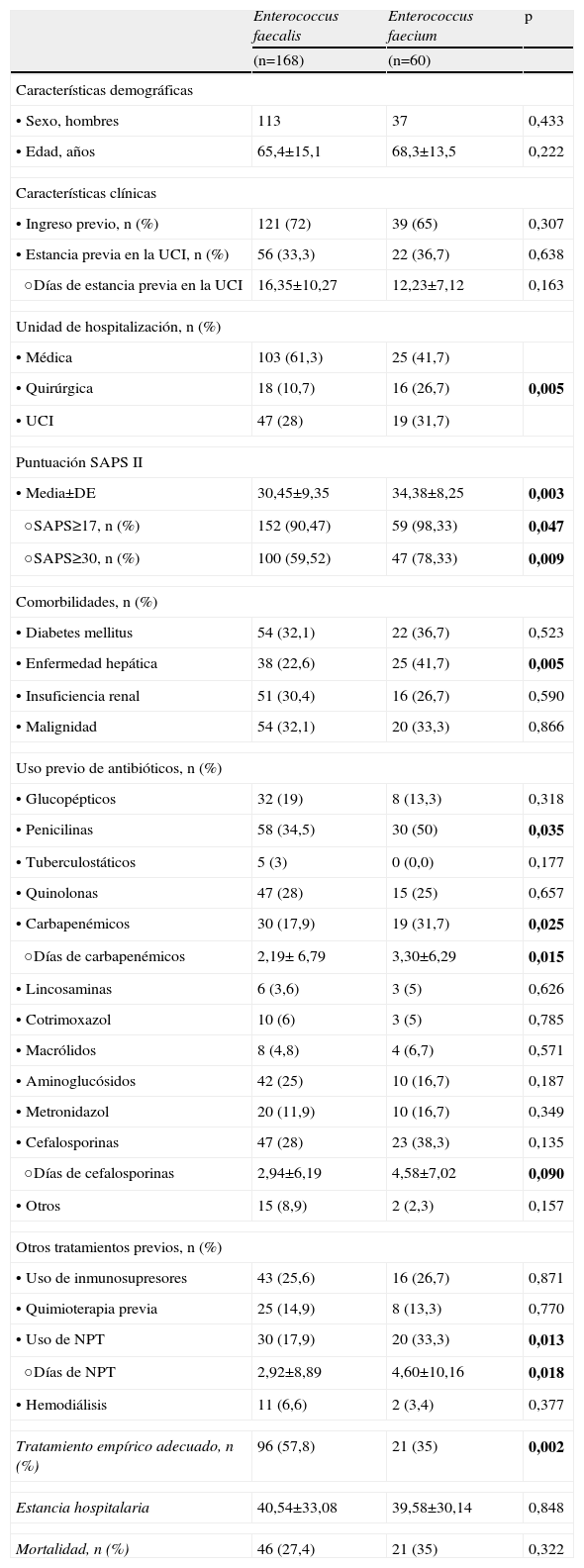
El estudio univariado de las variables clínicas y microbiológicas relacionadas con las bacteriemias se muestra en las tablas 1 y 2 respectivamente. De acuerdo con las variables clínicas, se observó que E. faecium se aisló más frecuentemente en unidades quirúrgicas y en la UCI (58,3%), mientras que E. faecalis fue más frecuente en unidades médicas (61,3%) (tabla 1). En concordancia con estos datos, los pacientes con mayor puntuación en el SAPS al ingreso tuvieron mayor probabilidad de desarrollar bacteriemia por E. faecium (tabla 1). En cuanto a las comorbilidades estudiadas, únicamente la enfermedad hepática se asoció de forma significativa a la adquisición de bacteriemia por E. faecium frente a E. faecalis con el 41,7% (tabla 1).
Comparación entre pacientes incluidos en el estudio con bacteriemias por Enterococcus faecalis y Enterococcus faecium
| Enterococcus faecalis | Enterococcus faecium | p | |
| (n=168) | (n=60) | ||
| Características demográficas | |||
| •Sexo, hombres | 113 | 37 | 0,433 |
| •Edad, años | 65,4±15,1 | 68,3±13,5 | 0,222 |
| Características clínicas | |||
| •Ingreso previo, n (%) | 121 (72) | 39 (65) | 0,307 |
| •Estancia previa en la UCI, n (%) | 56 (33,3) | 22 (36,7) | 0,638 |
| ○Días de estancia previa en la UCI | 16,35±10,27 | 12,23±7,12 | 0,163 |
| Unidad de hospitalización, n (%) | |||
| •Médica | 103 (61,3) | 25 (41,7) | |
| •Quirúrgica | 18 (10,7) | 16 (26,7) | 0,005 |
| •UCI | 47 (28) | 19 (31,7) | |
| Puntuación SAPS II | |||
| •Media±DE | 30,45±9,35 | 34,38±8,25 | 0,003 |
| ○SAPS≥17, n (%) | 152 (90,47) | 59 (98,33) | 0,047 |
| ○SAPS≥30, n (%) | 100 (59,52) | 47 (78,33) | 0,009 |
| Comorbilidades, n (%) | |||
| •Diabetes mellitus | 54 (32,1) | 22 (36,7) | 0,523 |
| •Enfermedad hepática | 38 (22,6) | 25 (41,7) | 0,005 |
| •Insuficiencia renal | 51 (30,4) | 16 (26,7) | 0,590 |
| •Malignidad | 54 (32,1) | 20 (33,3) | 0,866 |
| Uso previo de antibióticos, n (%) | |||
| •Glucopépticos | 32 (19) | 8 (13,3) | 0,318 |
| •Penicilinas | 58 (34,5) | 30 (50) | 0,035 |
| •Tuberculostáticos | 5 (3) | 0 (0,0) | 0,177 |
| •Quinolonas | 47 (28) | 15 (25) | 0,657 |
| •Carbapenémicos | 30 (17,9) | 19 (31,7) | 0,025 |
| ○Días de carbapenémicos | 2,19± 6,79 | 3,30±6,29 | 0,015 |
| •Lincosaminas | 6 (3,6) | 3 (5) | 0,626 |
| •Cotrimoxazol | 10 (6) | 3 (5) | 0,785 |
| •Macrólidos | 8 (4,8) | 4 (6,7) | 0,571 |
| •Aminoglucósidos | 42 (25) | 10 (16,7) | 0,187 |
| •Metronidazol | 20 (11,9) | 10 (16,7) | 0,349 |
| •Cefalosporinas | 47 (28) | 23 (38,3) | 0,135 |
| ○Días de cefalosporinas | 2,94±6,19 | 4,58±7,02 | 0,090 |
| •Otros | 15 (8,9) | 2 (2,3) | 0,157 |
| Otros tratamientos previos, n (%) | |||
| •Uso de inmunosupresores | 43 (25,6) | 16 (26,7) | 0,871 |
| •Quimioterapia previa | 25 (14,9) | 8 (13,3) | 0,770 |
| •Uso de NPT | 30 (17,9) | 20 (33,3) | 0,013 |
| ○Días de NPT | 2,92±8,89 | 4,60±10,16 | 0,018 |
| •Hemodiálisis | 11 (6,6) | 2 (3,4) | 0,377 |
| Tratamiento empírico adecuado, n (%) | 96 (57,8) | 21 (35) | 0,002 |
| Estancia hospitalaria | 40,54±33,08 | 39,58±30,14 | 0,848 |
| Mortalidad, n (%) | 46 (27,4) | 21 (35) | 0,322 |
DE: desviación estándar; NPT: nutrición parenteral total; SAPS: Simplified Acute Physiology Score; UCI: unidad de cuidados intensivos.
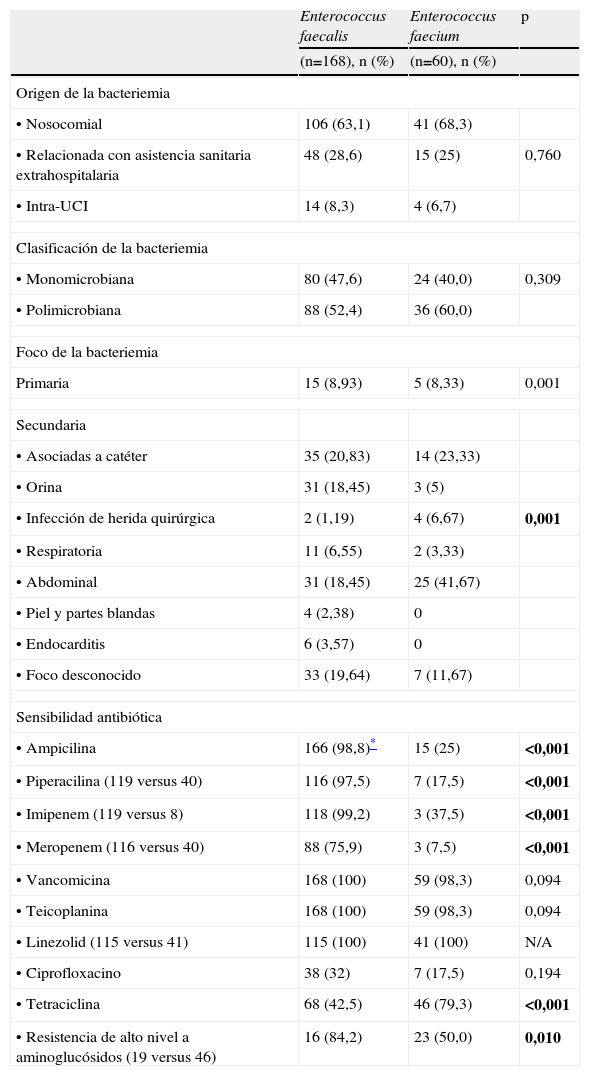
Comparación de datos microbiológicos de bacteriemias por Enterococcus faecalis y Enterococcus faecium
| Enterococcus faecalis | Enterococcus faecium | p | |
| (n=168), n (%) | (n=60), n (%) | ||
| Origen de la bacteriemia | |||
| •Nosocomial | 106 (63,1) | 41 (68,3) | |
| •Relacionada con asistencia sanitaria extrahospitalaria | 48 (28,6) | 15 (25) | 0,760 |
| •Intra-UCI | 14 (8,3) | 4 (6,7) | |
| Clasificación de la bacteriemia | |||
| •Monomicrobiana | 80 (47,6) | 24 (40,0) | 0,309 |
| •Polimicrobiana | 88 (52,4) | 36 (60,0) | |
| Foco de la bacteriemia | |||
| Primaria | 15 (8,93) | 5 (8,33) | 0,001 |
| Secundaria | |||
| •Asociadas a catéter | 35 (20,83) | 14 (23,33) | |
| •Orina | 31 (18,45) | 3 (5) | |
| •Infección de herida quirúrgica | 2 (1,19) | 4 (6,67) | 0,001 |
| •Respiratoria | 11 (6,55) | 2 (3,33) | |
| •Abdominal | 31 (18,45) | 25 (41,67) | |
| •Piel y partes blandas | 4 (2,38) | 0 | |
| •Endocarditis | 6 (3,57) | 0 | |
| •Foco desconocido | 33 (19,64) | 7 (11,67) | |
| Sensibilidad antibiótica | |||
| •Ampicilina | 166 (98,8)* | 15 (25) | <0,001 |
| •Piperacilina (119 versus 40) | 116 (97,5) | 7 (17,5) | <0,001 |
| •Imipenem (119 versus 8) | 118 (99,2) | 3 (37,5) | <0,001 |
| •Meropenem (116 versus 40) | 88 (75,9) | 3 (7,5) | <0,001 |
| •Vancomicina | 168 (100) | 59 (98,3) | 0,094 |
| •Teicoplanina | 168 (100) | 59 (98,3) | 0,094 |
| •Linezolid (115 versus 41) | 115 (100) | 41 (100) | N/A |
| •Ciprofloxacino | 38 (32) | 7 (17,5) | 0,194 |
| •Tetraciclina | 68 (42,5) | 46 (79,3) | <0,001 |
| •Resistencia de alto nivel a aminoglucósidos (19 versus 46) | 16 (84,2) | 23 (50,0) | 0,010 |
N/A: no aplicable; UCI: unidad de cuidados intensivos.
Asimismo, el uso previo de penicilinas y carbapenémicos se asoció de manera significativa al desarrollo de bacteriemia por E. faecium.
En el análisis de otros tratamientos previos, tanto el uso y los días de uso de NPT se asociaron de forma significativa al desarrollo de bacteriemias por este microorganismo.
Respecto al tratamiento empírico, éste fue adecuado en una mayor proporción de pacientes con bacteriemia por E. faecalis (57,8%) (tabla 1). No obstante, esta circunstancia no tuvo impacto en la mortalidad bruta o los días de estancia hospitalaria observada en los pacientes de ambos grupos.
Desde el punto de vista microbiológico (tabla 2), no hubo diferencias en el origen de las bacteriemias ni si éstas eran monomicrobianas y polimicrobianas. Sin embargo, se observaron diferencias significativas entre los 2 grupos con relación al foco de la bacteriemia.
Tal como era de esperar, la sensibilidad de E. faecalis frente a ampicilina fue muy superior a la observada para E. faecium. Asimismo, la resistencia de alto nivel a aminoglucósidos fue superior en el grupo de E. faecalis (84,2%) (tabla 2). La sensibilidad a glucopéptidos fue total en ambas especies, excepto en una cepa de E. faecium que mostró resistencia. Ninguna cepa de ambas especies presentó resistencia frente a linezolid.
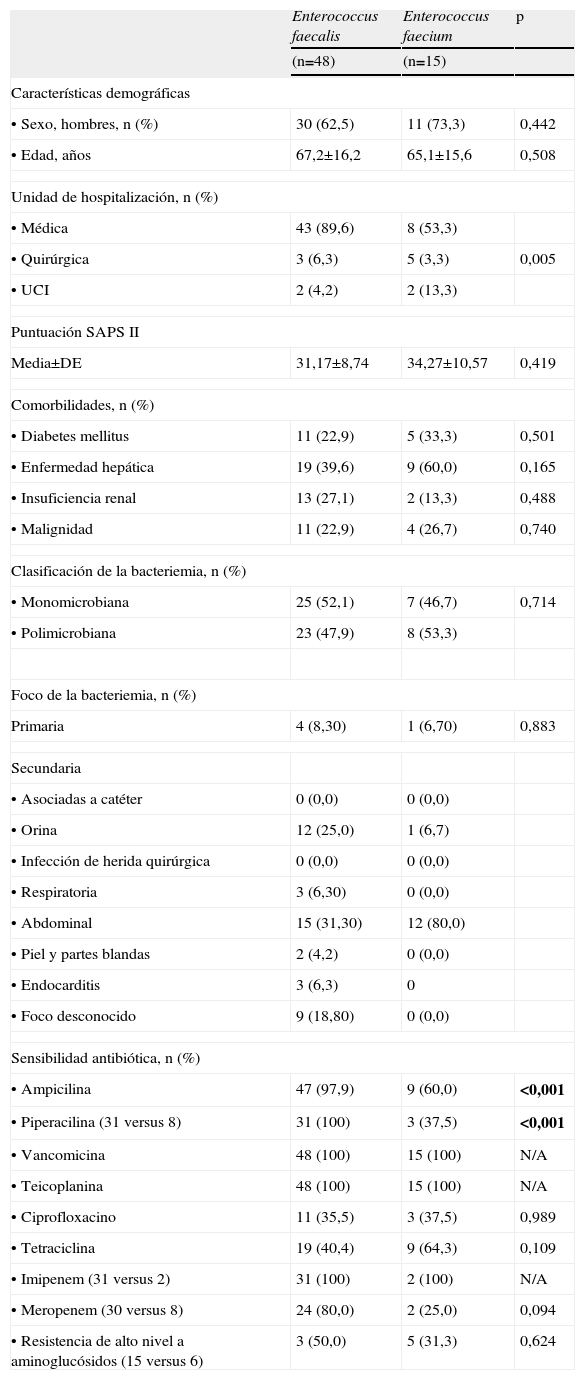
El análisis univariado de las características de los casos asociados a asistencia sanitaria extrahospitalaria no mostró ninguna diferencia significativa entre los 2 grupos de enterococos (tabla 3).
Características clínicas y microbiológicas de bacteriemias asociadas a asistencia sanitaria extrahospitalaria por Enterococcus faecalis y Enterococcus faecium
| Enterococcus faecalis | Enterococcus faecium | p | |
| (n=48) | (n=15) | ||
| Características demográficas | |||
| •Sexo, hombres, n (%) | 30 (62,5) | 11 (73,3) | 0,442 |
| •Edad, años | 67,2±16,2 | 65,1±15,6 | 0,508 |
| Unidad de hospitalización, n (%) | |||
| •Médica | 43 (89,6) | 8 (53,3) | |
| •Quirúrgica | 3 (6,3) | 5 (3,3) | 0,005 |
| •UCI | 2 (4,2) | 2 (13,3) | |
| Puntuación SAPS II | |||
| Media±DE | 31,17±8,74 | 34,27±10,57 | 0,419 |
| Comorbilidades, n (%) | |||
| •Diabetes mellitus | 11 (22,9) | 5 (33,3) | 0,501 |
| •Enfermedad hepática | 19 (39,6) | 9 (60,0) | 0,165 |
| •Insuficiencia renal | 13 (27,1) | 2 (13,3) | 0,488 |
| •Malignidad | 11 (22,9) | 4 (26,7) | 0,740 |
| Clasificación de la bacteriemia, n (%) | |||
| •Monomicrobiana | 25 (52,1) | 7 (46,7) | 0,714 |
| •Polimicrobiana | 23 (47,9) | 8 (53,3) | |
| Foco de la bacteriemia, n (%) | |||
| Primaria | 4 (8,30) | 1 (6,70) | 0,883 |
| Secundaria | |||
| •Asociadas a catéter | 0 (0,0) | 0 (0,0) | |
| •Orina | 12 (25,0) | 1 (6,7) | |
| •Infección de herida quirúrgica | 0 (0,0) | 0 (0,0) | |
| •Respiratoria | 3 (6,30) | 0 (0,0) | |
| •Abdominal | 15 (31,30) | 12 (80,0) | |
| •Piel y partes blandas | 2 (4,2) | 0 (0,0) | |
| •Endocarditis | 3 (6,3) | 0 | |
| •Foco desconocido | 9 (18,80) | 0 (0,0) | |
| Sensibilidad antibiótica, n (%) | |||
| •Ampicilina | 47 (97,9) | 9 (60,0) | <0,001 |
| •Piperacilina (31 versus 8) | 31 (100) | 3 (37,5) | <0,001 |
| •Vancomicina | 48 (100) | 15 (100) | N/A |
| •Teicoplanina | 48 (100) | 15 (100) | N/A |
| •Ciprofloxacino | 11 (35,5) | 3 (37,5) | 0,989 |
| •Tetraciclina | 19 (40,4) | 9 (64,3) | 0,109 |
| •Imipenem (31 versus 2) | 31 (100) | 2 (100) | N/A |
| •Meropenem (30 versus 8) | 24 (80,0) | 2 (25,0) | 0,094 |
| •Resistencia de alto nivel a aminoglucósidos (15 versus 6) | 3 (50,0) | 5 (31,3) | 0,624 |
DE: desviación estándar; N/A: no aplicable; SAPS: Simplified Acute Physiology Score; UCI: unidad de cuidados intensivos.
En la tabla 4 se muestran las variables asociadas al desarrollo de bacteriemia por E. faecium cuando se comparó con E. faecalis.
Análisis de regresión logística de los factores independientemente asociados a la adquisición de bacteriemia por Enterococcus faecium frente a Enterococcus faecalis
| Factor | OR (IC del 95%) | p |
| Unidad médica quirúrgica | 4,223 (1,768–10,428) | 0,001 |
| Usos de penicilinas previos | 2,008 (1,019–3,956) | 0,044 |
| Más de 5 días de cefalosporinas previos | 2,564 (1,220–5,390) | 0,013 |
| Más de 5 días de carbapenémicos previos | 2,652 (1,120–6,278) | 0,027 |
| SAPS ingreso superior a 30 | 3,530 (1,707–7,299) | 0,001 |
| Enfermedad hepática de base | 3,754 (1,792–7,863) | <0,001 |
IC: intervalo de confianza; OR: odds ratio; SAPS: Simplified Acute Physiology Score.
El presente estudio se diseñó para determinar los factores diferenciales para la adquisición de bacteriemia por E. faecalis frente a E. faecium. Cuando se analizaron los factores clínicos, únicamente el ingreso en una unidad quirúrgica, el tratamiento prolongado con cefalosporinas y carbapenémicos (>5 días), la exposición previa a penicilinas, el SAPS II al ingreso superior a 30 y la enfermedad hepática de base fueron factores independientemente asociados al aislamiento de E. faecium.
El número de bacteriemias por E. faecalis y E. faecium en nuestro hospital representa el 5,78% del total, y E. faecalis es el causante de casi tres cuartas partes de los casos. Estos datos son concordantes con la literatura médica, ya que en España en el período comprendido entre 1990 y 2006 la incidencia de infecciones por Enterococcus spp. fue del 5,8%, y se situó como quinto patógeno más frecuentemente aislado en infecciones nosocomiales5.
En el presente estudio, el 26,14% de las bacteriemias tuvo como agente causal a E. faecium. Este porcentaje es similar al descrito recientemente en la literatura médica5,6.
La distribución de E. faecium por unidades de hospitalización médicas y quirúrgicas fue similar a la descrita previamente por otros autores22. Sin embargo, en nuestro centro hubo una mayor frecuencia de aislamientos en pacientes ingresados en la UCI. Este dato sería explicable por el hecho de que una mayor gravedad, medida mediante el índice SAPS II, se relacionase con el riesgo de desarrollar bacteriemia por E. faecium frente a E. faecalis. Noskin et al mediante la utilización de un índice de gravedad diferente (severity of illness score) ya describieron que los pacientes con bacteriemias por E. faecium estaban más graves que los pacientes con bacteriemia por E. faecalis18. Sin embargo, cuando se aplica el sistema Acute Physiology and Chronic Health Evaluation (APACHE), la relación entre infección y colonización por E. faecium frente a E. faecalis y la puntuación obtenida con este indicador no son concluyentes23,24.
La asociación entre el uso y la duración de la NPT y el desarrollo de bacteriemia por E. faecium también podría enmarcarse dentro de este contexto. Este hallazgo se ha reportado en un pequeño estudio retrospectivo de casos y controles, en el que se estudiaron infecciones asociadas a catéter comparadas con otro grupo con colonización gastrointestinal en pacientes oncológicos25.
En el presente estudio, la presencia de enfermedad hepática de base se asoció de forma independiente al desarrollo de bacteriemia por E. faecium. La enfermedad hepática se ha reconocido previamente como factor predisponente para el desarrollo de bacteriemias por enterococo4,24,26,27. Los resultados obtenidos en este estudio podrían explicarse en parte por el hecho de que un elevado porcentaje de las bacteriemias por E. faecium fueron de origen abdominal. Michaud et al28 observaron que el ingreso en un centro de referencia para enfermedades hepatobiliares y el foco abdominal eran factores predisponentes para la adquisición de bacteriemia por E. faecium.
La prevalencia de enterococo como patógeno nosocomial ha aumentado debido a la selección de estos microorganismos en relación con el uso de antibióticos de amplio espectro y sin actividad intrínseca frente a ellos23,29,30. En el presente estudio se observó que el tratamiento antibiótico previo con cefalosporinas (>5 días) y carbapenémicos se asoció de forma significativa al desarrollo de bacteriemia por E. faecium. Un estudio reciente que comparó los factores de riesgo asociados a bacteriemias por E. faecalis y E. faecium resistentes a vancomicina en pacientes con cáncer también puso de manifiesto que el uso de carbapenémicos era un factor de riesgo independiente de aislamiento de E. faecium23.
En lo que concierne al foco de infección, el hecho de que E. faecium fuese más frecuentemente aislado en bacteriemias asociadas a catéter secundarias a infección de herida quirúrgica y en bacteriemias de origen abdominal podría justificarse por la propia gravedad de los pacientes, a los que generalmente se les realiza instrumentación u otros procedimientos invasivos.
Como era de esperar, el patrón de resistencia antimicrobiana fue diferente entre E. faecalis y E. faecium. La ampicilina presentó actividad frente a casi un 100% de los aislamientos de E. faecalis y sólo frente a un 25% de E. faecium. Estos datos son concordantes con lo publicado por otros autores en España31, que encontraron un incremento de la resistencia de E. faecium a ampicilina desde el 18% en 1991 hasta el 71% en el 2000. En nuestro estudio sólo se encontró un caso de resistencia a la vancomicina en el grupo de E. faecium. En Europa, la prevalencia y epidemiología de E. faecium resistente a la vancomicina es variable. En 6 países (Alemania, Grecia, Irlanda, Israel, Eslovenia y Turquía) ha ido aumentando significativamente en los últimos 6 años como resultado de brotes institucionales. Sin embargo, según el Annual Report of the European Antibiotic Resistance Surveillance System 2007 (disponible en: URL: http://www.rivm.nl/earss/result/Monitoring_reports/), se observa un descenso de la resistencia a vancomicina en Croacia, Portugal y Reino Unido, fruto posiblemente de las políticas de control instauradas.
El tratamiento de infecciones enterocócicas graves, como la endocarditis, debe efectuarse combinando penicilina, ampicilina o vancomicina con gentamicina o estreptomicina, ya que presenta un efecto sinérgico y bactericida frente a este microorganismo y constituye el tratamiento de elección32. Sin embargo, este efecto bactericida sinérgico desaparece cuando los enterococos presentan resistencia a penicilina o vancomicina o tienen resistencia de alto nivel a los aminoglucósidos, una situación clínica relativamente frecuente, sobre todo en E. faecalis. En nuestro estudio se observó que el porcentaje de resistencia de alto nivel a gentamicina para E. faecalis concordaba con lo reportado en la literatura médica12.
El perfil de resistencia antibiótica observado en el presente estudio favoreció que una mayor proporción de pacientes con bacteriemia por E. faecalis recibiese un tratamiento antibiótico empírico correcto. Sin embargo y a pesar de la más que conocida relación entre la elección de un tratamiento empírico adecuado y un mejor pronóstico y eficacia del tratamiento33, en nuestro estudio no se pudo demostrar que la elección del tratamiento empírico tuviese impacto sobre la mortalidad bruta ni sobre la estancia hospitalaria. Algunos autores han relacionado factores, como la propia enfermedad de base o una etiología polimicrobiana de la infección, como determinantes en la mortalidad atribuible a la bacteriemia por enterococo34. En nuestro estudio, el origen monomicrobiano o polimicrobiano de la bacteriemia no tuvo impacto sobre estas variables.
Este trabajo tiene las limitaciones propias de su carácter retrospectivo, motivo por el que no se pueden extraer conclusiones de causalidad. Además, hay que añadir que los pacientes con mortalidad precoz en el servicio de urgencias y de los que, por tanto, no se disponía de datos de hospitalización no se incluyeron en el análisis, lo que podría haber tenido una influencia en la mortalidad. Adicionalmente, el objetivo de este estudio fue la comparación de los factores que se asociaron a la adquisición de bacteriemia por E. faecium cuando se compararon con las bacteriemias producidas por E. faecalis, lo que impide conocer qué factores influyen en la adquisición de una bacteriemia enterocócica frente a las producidas por el resto de los microorganismos.
Como conclusión y dado el diferente patrón de sensibilidad que presentan ambas especies, habría que señalar la importancia de conocer las variables que predisponen a la adquisición de bacteriemia por E. faecium frente a E. faecalis para establecer un tratamiento antibiótico empírico adecuado.
Este trabajo ha sido realizado en el marco del Doctorado en Medicina de la Universitat Autònoma de Barcelona.