Sr. Editor: En la actualidad, la alta prevalencia de cepas de Neisseria gonorrhoeae resistentes a fluoroquinolonas (NGRQ) constituye un problema en muchos países, con gran repercusión en el tratamiento de elección de la gonorrea1. En nuestro hospital, desde su aparición en 2004, todas las NGRQ aisladas han presentado resistencia de alto nivel (concentración inhibitoria mínima [CIM] ≥ 4 μg/ml). El objetivo del presente estudio fue determinar los mecanismos moleculares presentes en estas cepas, y establecer la relación genética entre ellas mediante electroforesis en gel de campos pulsantes (PFGE).
Se analizaron 24 cepas de N. gonorrhoeae aisladas consecutivamente en el período 2004-2005 en 22 varones con uretritis y 2 mujeres, una con cervicitis y otra con enfermedad inflamatoria pélvica (EIP). Se obtuvo información en el momento de la consulta sobre edad, sexo, hábitos sexuales y lugar de adquisición de la infección. La determinación de la CIM a ciprofloxacino, penicilina y tetraciclina se realizó mediante Etest (Biodisk, Solna, Suecia) en medio GC agar base suplementado (BioMeriéux, Francia). Se utilizó N. gonorrhoeae ATCC 49226 como cepa control. Se identificaron las mutaciones en los genes gyrA, gyrB y parC de 8 NGRQ y 6 cepas sensibles mediante reacción en cadena de la polimerasa (PCR) y secuenciación de los productos amplificados que incluían las regiones QRDR. El ADN genómico de todas las cepas resistentes se examinó por PFGE tras digestión con la endonucleasa SpeI. Las similitudes de los patrones de bandas se estimaron mediante el coeficiente de Dice y se analizaron usando el programa Molecular Analyst Fingerprinting (Image Analysis System, Bio-Rad).
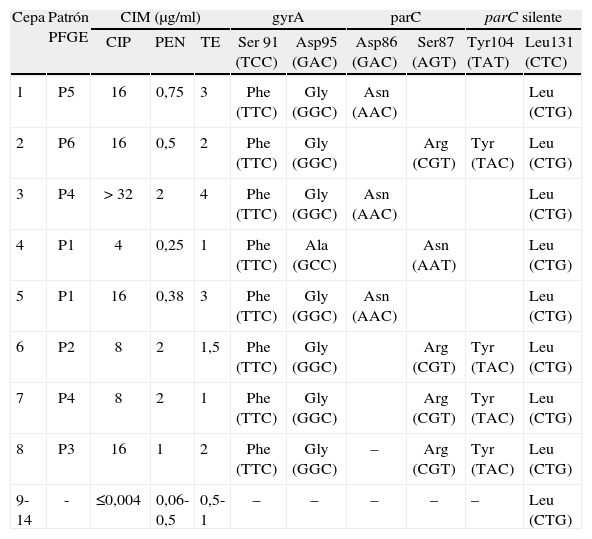
En nuestro hospital, la primera NGRQ (cepa 1) se aisló en 2004. El aislado procedía de un paciente con uretritis adquirida en Rumanía, con una CIM de 16 μg/ml. Durante el período 2004-2005 se aislaron 24 cepas de gonococo, 8 de las cuales (33%) presentaban resistencia de alto nivel a ciprofloxacino (CIM ≥ 4 μg/ml). No se aisló ninguna cepa con resistencia intermedia. La sensibilidad de estas cepas a la penicilina y la tetraciclina se muestran en la tabla 1. Todos los pacientes eran heterosexuales, con edades comprendidas entre los 22 y los 56 años. Dos pacientes (cepas 2 y 6) habían sido tratados días antes con ciprofloxacino, sin responder al tratamiento. El análisis molecular mostró diferentes patrones de mutaciones en los genes gyrA y parC en las 8 cepas resistentes a ciprofloxacino, si bien todas ellas contenían de forma constante mutaciones en los codones Ser91 y Asp95 en gyrA. En parC las mutaciones afectaron a Asp86 o Ser87. Ninguna de las cepas estudiadas presentó mutaciones en gyrB. El análisis de los patrones obtenidos por PFGE mostró seis patrones de bandas distintos (tabla 1). Sin embargo, tres de estos perfiles (P1, P2 y P3) presentaban una homología de un 85% entre sí y podrían ser considerados variaciones subclonales dentro de un mismo genotipo. Estas cepas fueron aisladas de pacientes que habían adquirido la infección en Vizcaya. Dos cepas mostraron un patrón distinto a los anteriores (P4) y fueron adquiridas también en nuestra provincia. Los patrones P5 y P6 correspondieron a dos cepas adquiridas en Rumanía (caso 1) y Almería (caso 2). No se ha encontrado relación entre los patrones de mutaciones y los patrones genéticos obtenidos por PFGE.
Sensibilidad y caracterización molecular de las cepas de Neisseria gonorrhoeae resistentes a fluoroquinolonas
| Cepa | Patrón PFGE | CIM (μg/ml) | gyrA | parC | parC silente | |||||
| CIP | PEN | TE | Ser 91 (TCC) | Asp95 (GAC) | Asp86 (GAC) | Ser87 (AGT) | Tyr104 (TAT) | Leu131 (CTC) | ||
| 1 | P5 | 16 | 0,75 | 3 | Phe (TTC) | Gly (GGC) | Asn (AAC) | Leu (CTG) | ||
| 2 | P6 | 16 | 0,5 | 2 | Phe (TTC) | Gly (GGC) | Arg (CGT) | Tyr (TAC) | Leu (CTG) | |
| 3 | P4 | > 32 | 2 | 4 | Phe (TTC) | Gly (GGC) | Asn (AAC) | Leu (CTG) | ||
| 4 | P1 | 4 | 0,25 | 1 | Phe (TTC) | Ala (GCC) | Asn (AAT) | Leu (CTG) | ||
| 5 | P1 | 16 | 0,38 | 3 | Phe (TTC) | Gly (GGC) | Asn (AAC) | Leu (CTG) | ||
| 6 | P2 | 8 | 2 | 1,5 | Phe (TTC) | Gly (GGC) | Arg (CGT) | Tyr (TAC) | Leu (CTG) | |
| 7 | P4 | 8 | 2 | 1 | Phe (TTC) | Gly (GGC) | Arg (CGT) | Tyr (TAC) | Leu (CTG) | |
| 8 | P3 | 16 | 1 | 2 | Phe (TTC) | Gly (GGC) | – | Arg (CGT) | Tyr (TAC) | Leu (CTG) |
| 9-14 | - | ≤0,004 | 0,06-0,5 | 0,5-1 | – | – | – | – | – | Leu (CTG) |
CIM: concentración inhibitoria mínima; CIP: Ciprofloxacino; P1, P2, P3, P4, P5, P6: patrones obtenidos por PFGE tras digestión con SpeI; PEN: penicilina; PFGE: electroforesis en gel de campos pulsantes; TE: tetraciclina.
El alto porcentaje de resistencia a quinolonas en nuestro ámbito, al igual que en el resto de Europa2, ha obligado a modificar las recomendaciones para el tratamiento empírico de la infección gonocócica3,4. La aparición de NGRQ y su brusco aumento en nuestro hospital (del 64% en la actualidad) nos hizo pensar en que se estuviera expandiendo una variante resistente. El análisis molecular de estas cepas ha mostrado mutaciones conjuntas en gyrA y parC. Diferentes trabajos han correlacionado el nivel de resistencia de los gonococos a quinolonas y el número y localización de las mutaciones en la QRDR de los genes gyrA y parC. Generalmente, las mutaciones en gyrA son necesarias para el desarrollo de resistencia a fluoroquinolonas, y la presencia simultánea de una o más mutaciones en parC aumentan el nivel de resistencia5–7. El estudio genético de las cepas por PFGE, junto al estudio epidemiológico, indicó una diversidad en los patrones encontrados. Los perfiles P1, P2 y P3, que podrían ser considerados variaciones subclonales dentro de un mismo genotipo, sin embargo presentan distintas mutaciones en el QRDR. La caracterización molecular de estos aislamientos muestra una considerable diversidad entre las NGRQ aisladas. Estos resultados parecen indicar que el rápido aumento en la prevalencia de resistencia a fluoroquinolonas en nuestra área no se debe a la expansión endémica de una o dos cepas, sino a la diseminación multiclonal de variantes resistentes de cepas locales e importadas. El escaso número de casos de nuestro trabajo limita la extrapolación de los resultados, pero la caracterización molecular de NGRQ es una importante herramienta para el estudio de los posibles patrones de diseminación. La alta prevalencia de gonococos con resistencia a antibióticos constituye un creciente problema sanitario que ha provocado que las opciones de tratamiento se hayan visto limitadas en los últimos años. Se deben recomendar, por lo tanto, otros antibióticos para el tratamiento de las infecciones gonocócicas y continuar con la vigilancia epidemiológica y, en especial, la resistencia a fluoroquinolonas.