La vacunación frente a rotavirus ha condicionado un descenso significativo de la enfermedad. El presente trabajo pretende evaluar las características clínicas y epidemiológicas de la gastroenteritis aguda (GEA) por virus en un área de alta cobertura vacunal frente a rotavirus.
MétodoEvaluación prospectiva microbiológica mediante coprocultivo y reacción en cadena de la polimerasa en tiempo real (RT-PCR) para virus gastroentéricos, y genotipificado de las cepas de rotavirus de los casos de GEA en menores de 5 años que acudieron a urgencias o fueron hospitalizados en nuestro centro de noviembre a marzo de 2009-2010 y 2010-2011.
ResultadosSe incluyeron 51 pacientes con una edad media (desviación estándar) de 19,1 (13,9) meses. El coprocultivo fue negativo en 23 muestras (45% de los casos), identificándose mediante RT-PCR un microorganismo causal en 16 de estas muestras (el 70%). El rotavirus fue el microorganismo más detectado (53%) y el genotipo G1[P8] el más abundante. En el 14% de los casos (7 pacientes) se identificó coinfección, siendo el rotavirus y el astrovirus los agentes más frecuentemente involucrados.
ConclusionesEl rotavirus, principalmente el G1[P8], se ha identificado como la causa más frecuente de GEA en nuestro estudio. La utilización de RT-PCR mejora significativamente la sensibilidad diagnóstica en el contexto de la GEA, y pone de relieve un porcentaje elevado de coinfecciones virales.
Vaccination against rotavirus has led to a significant decline of the disease. The aim of the present work is to evaluate the clinical and epidemiological features of the viral acute gastroenteritis (AGE) in an area with high immunization coverage against rotavirus.
MethodA prospective microbiological evaluation was made of stool culture and Real Time Polymerase Chain Reaction (RT-PCR) to gastroenteric virus and genotyping of rotavirus strains in < 5 year-old with AGE episodes attended by or admitted to our hospital from November-March of 2009-2010 and 2010-2011.
ResultsA total of 51 patients were included, with a mean age (standard deviation) of 19.1 (13.9) months. Stool culture was negative in 23 samples (45% of the samples analyzed), and it was identified a responsible microorganism in 70% by the RT-PCR (16 samples). Rotavirus was the most common isolated microorganism (53%), and G1[P8] the most frequent genotype. A co-infection was detected in 14% of samples (7 patients), and rotavirus and astrovirus were the most frequent etiological agents involved.
ConclusionsRotavirus, basically G1[P8], is the most common AGE responsible agent identified in our study. The use of RT-PCR enhances the AGE diagnostic sensitivity, and uncovers an important number of viral co-infections.
El rotavirus es la principal causa de gastroenteritis aguda (GEA) en la infancia, causante de más de 500.000 muertes anuales y de más de 2 millones de hospitalizaciones en todo el mundo1. En el momento actual disponemos de vacunas seguras y eficaces, cuya efectividad ha sido demostrada también en nuestro medio2.
Este trabajo pretende evaluar las características clínicas y epidemiológicas de la GEA por virus en un área de alta cobertura vacunal (> 40%) frente a rotavirus3.
MétodoSe realizó un estudio observacional, prospectivo, no intervencionista de cohortes con recogida de datos clínicos mediante doble encuesta (personal y telefónica con los padres) y de datos microbiológicos mediante cultivo de muestra de heces. Fueron candidatos al estudio los casos de GEA acontecidas en niños menores de 5 años que consultaron en el servicio de urgencias pediátricas o que desarrollaron una GEA durante su hospitalización en el Hospital Clínico Universitario de Santiago de Compostela durante los meses de noviembre a marzo de 2009-2010 y 2010-2011. El caso de GEA se definió como 3 o más deposiciones de consistencia más blanda de lo normal en 24 h, acompañadas o no de vómitos. Infección nosocomial se definió de forma clínica como pacientes que fueron ingresados en el hospital sin signos de GEA pero que la desarrollaron durante su hospitalización. Aquellos pacientes con GEA de inicio en las primeras 48 h de ingreso se consideraron GEA adquiridas en la comunidad. Se realizó coprocultivo estándar con búsqueda de bacterias y parásitos, así como determinación de antígenos de rotavirus y adenovirus mediante inmunoanálisis (Test Vikia ROTA-ADENO, Biomerieux). Posteriormente se enviaban todas las muestras al Centro Nacional de Microbiología (ISCIII), donde se procesaba realizando una suspensión al 10% de cada muestra en 0,1mol/l de tampón fosfato salino y aplicando RT-PCR para rotavirus, astrovirus, norovirus y adenovirus. El ARN viral se extraía de 140μl de la suspensión fecal al 10% usando un kit comercial (QIAamp viral RNA minikit, QIAGEN GmBH, Alemania), según las instrucciones del fabricante. Los 60μl de ARN eluido se almacenaban a −80°C hasta que se usaban los métodos previamente descritos para la determinación de serotipos de rotavirus G y P. Los genotipos de rotavirus se identificaron mediante caracterización molecular.
Se realizó un análisis descriptivo de las variables incluidas en los cuestionarios, expresándose como media (desviación estándar) o n (%) según correspondía. Se compararon los casos en función de la presencia o no de rotavirus, estableciéndose la significación estadística en una p < 0,01. Para el manejo y análisis estadístico de los datos se empleó el programa estadístico informático SPSS para Windows, versión 15.
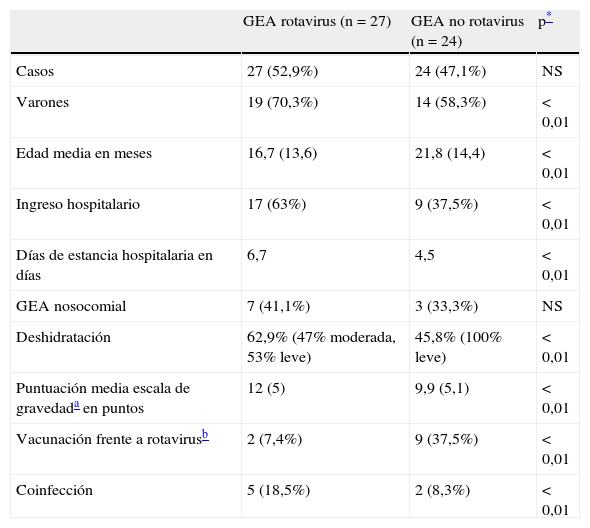
ResultadosSe incluyeron 51 pacientes para el estudio cuyas características se resumen en la tabla 1. El coprocultivo convencional y/o las pruebas antigénicas rápidas frente a rotavirus y adenovirus fueron negativas en el 45,1% (n = 23) de los casos, pero la realización posterior de pruebas moleculares identificó un microorganismo causal en el 69,6% (n = 16) de estas muestras negativas. El rotavirus fue el agente más frecuentemente detectado (en 27 muestras; 53%), siendo el genotipo más prevalente el G1[P8] (37% de las GEA por rotavirus; n = 10), seguido del G9[P8] y del G2[P4] (11,1% [n = 3] de las cepas de rotavirus causantes de GEA cada uno). El norovirus y el astrovirus fueron detectados de forma aislada en el 9,8% (n = 5) y 5,9% (n = 3) de los casos de GEA, respectivamente. La etiología bacteriana fue responsable del 7,8% (n = 4) de los casos de GEA, identificando Salmonella (n = 2) y Campylobacter (n = 2). En un 23,5% (n = 12) de los casos incluidos de GEA no fue posible identificar ningún agente etiológico.
Resumen de las características principales de los pacientes incluidos en el estudio. Comparación en función de que su etiología fuese o no por rotavirus
| GEA rotavirus (n = 27) | GEA no rotavirus (n = 24) | p* | |
| Casos | 27 (52,9%) | 24 (47,1%) | NS |
| Varones | 19 (70,3%) | 14 (58,3%) | < 0,01 |
| Edad media en meses | 16,7 (13,6) | 21,8 (14,4) | < 0,01 |
| Ingreso hospitalario | 17 (63%) | 9 (37,5%) | < 0,01 |
| Días de estancia hospitalaria en días | 6,7 | 4,5 | < 0,01 |
| GEA nosocomial | 7 (41,1%) | 3 (33,3%) | NS |
| Deshidratación | 62,9% (47% moderada, 53% leve) | 45,8% (100% leve) | < 0,01 |
| Puntuación media escala de gravedada en puntos | 12 (5) | 9,9 (5,1) | < 0,01 |
| Vacunación frente a rotavirusb | 2 (7,4%) | 9 (37,5%) | < 0,01 |
| Coinfección | 5 (18,5%) | 2 (8,3%) | < 0,01 |
Entre paréntesis se expresa porcentaje o desviación estándar, según corresponda.
Escala de gravedad: días de duración de la diarrea: 1-4 días = 1 punto; 5 días = 2 puntos; 6 o más días = 3 puntos; número máximo de evacuaciones diarreicas en 24 h: 1-3 deposiciones = 1 punto; 4-5 deposiciones = 2 puntos; 6 o más deposiciones = 3 puntos; días de duración de los vómitos: 1 día = 1 punto; 2 días = 2 puntos; 3 o más días = 3 puntos; número máximo de vómitos en 24 h: 1 vómito = 1 punto; 2 vómitos = 2 puntos; 3 o más vómitos = 3 puntos; fiebre: 37,1-38,4 °C = 1 punto; 38,5-38,9 °C = 2 puntos; 39 °C o más = 3 puntos; deshidratación: 1-5% = 2 puntos; 6% o más = 3 puntos; tratamiento: rehidratación = 1 punto; ingreso = 2 puntos.
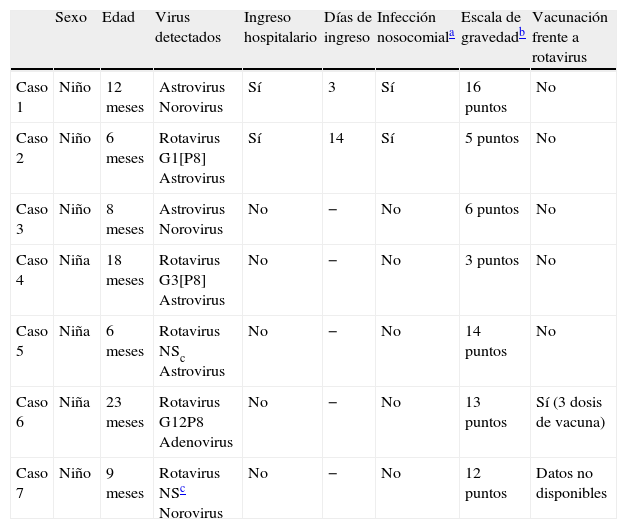
En el 13,7% de las muestras (n = 7) se demostró la presencia de coinfección entre 2 virus. En 5 de los 7 casos de coinfección estaba involucrado el rotavirus. Los genotipos involucrados en las coinfecciones fueron el G1[P8] (n = 1), G3[P8] (n = 1) y G12[P8] (n = 1), no siendo posible el genotipificado de las 2 cepas de rotavirus restantes. Las características más relevantes de los pacientes con coinfección se exponen en la tabla 2.
Descripción de los 7 casos de coinfección identificados durante el estudio
| Sexo | Edad | Virus detectados | Ingreso hospitalario | Días de ingreso | Infección nosocomiala | Escala de gravedadb | Vacunación frente a rotavirus | |
| Caso 1 | Niño | 12 meses | Astrovirus Norovirus | Sí | 3 | Sí | 16 puntos | No |
| Caso 2 | Niño | 6 meses | Rotavirus G1[P8] Astrovirus | Sí | 14 | Sí | 5 puntos | No |
| Caso 3 | Niño | 8 meses | Astrovirus Norovirus | No | − | No | 6 puntos | No |
| Caso 4 | Niña | 18 meses | Rotavirus G3[P8] Astrovirus | No | − | No | 3 puntos | No |
| Caso 5 | Niña | 6 meses | Rotavirus NSc Astrovirus | No | − | No | 14 puntos | No |
| Caso 6 | Niña | 23 meses | Rotavirus G12P8 Adenovirus | No | − | No | 13 puntos | Sí (3 dosis de vacuna) |
| Caso 7 | Niño | 9 meses | Rotavirus NSc Norovirus | No | − | No | 12 puntos | Datos no disponibles |
Escala de gravedad: días de duración de la diarrea: 1-4 días = 1 punto; 5 días = 2 puntos; 6 o más días = 3 puntos; número máximo de evacuaciones diarreicas en 24 h: 1-3 deposiciones = 1 punto; 4-5 deposiciones = 2 puntos; 6 o más deposiciones = 3 puntos; días de duración de los vómitos: 1 día = 1 punto; 2 días = 2 puntos; 3 o más días = 3 puntos; número máximo de vómitos en 24 h: 1 vómito = 1 punto; 2 vómitos = 2 puntos; 3 o más vómitos = 3 puntos; fiebre: 37,1-38,4 °C = 1 punto; 38,5-38,9 °C = 2 puntos; 39 °C o más = 3 puntos; deshidratación: 1-5% = 2 puntos; 6% o más = 3 puntos; tratamiento: rehidratación = 1 punto; ingreso = 2 puntos.
La GEA viral, concretamente la GEA por rotavirus, continúa siendo la causa más frecuente de GEA en nuestro medio, fundamentalmente por casos acontecidos en sujetos no vacunados. La cepa G1 de rotavirus presentó un predominio claro con respecto al resto de cepas, seguido del genotipo G2 (11,1%, 3 casos), mientras que no se detectó ningún caso del genotipo G4. Este descenso en los casos de GEA por rotavirus G4 en nuestro país ya había sido previamente documentado4. Con respecto al genotipo P, se ve un claro predominio de [P8], que se detecta en el 83,3% (n = 15) de los rotavirus genotipificados en nuestra serie.
Clínicamente, los casos de rotavirus presentaron una mayor gravedad que los de otra etiología. Los pacientes con deshidratación en grado moderado o superior en nuestra serie presentaban una infección por rotavirus y, en todos ellos, los sujetos no estaban vacunados. Esto refuerza la importancia de la vacunación frente a rotavirus, que ha demostrado una importante efectividad5, también en nuestro medio2,3. Los 2 casos de GEA por rotavirus en sujetos vacunados detectados en nuestra serie fueron leves, y no pueden considerarse fallos vacunales, ya que estas vacunas previenen las formas moderadas-graves de enfermedad, pero no la infección.
Los datos publicados sobre la coinfección en pacientes con GEA reflejan que el rotavirus desempeña un papel principal en el desarrollo de este tipo de infecciones. Román et al.6 refieren hasta un 5% de casos de coinfección, y Tran et al.7, un 3,3%, ambos porcentajes sensiblemente inferiores al 13,7% (n = 7) observado en nuestra serie. El porcentaje tan elevado de coinfecciones que hemos detectado está muy probablemente en relación con la utilización de técnicas moleculares. Si bien otros factores, como la propia vacunación o la alta prevalencia de casos nosocomiales en nuestra serie, podrían contribuir a explicar esta diferencia. La importancia clínica de estas coinfecciones y el impacto de la vacunación sobre esta forma de GEA podría contribuir a explicar la gran efectividad de la vacuna frente a las gastroenteritis de cualquier etiología, al evitar el papel copatogénico o sinérgico que el rotavirus podría tener en estos casos8.
En nuestra serie, el 19,6% (n = 10) de los pacientes fueron diagnosticados de GEA nosocomial, producida hasta en el 70% (n = 7) de los casos por rotavirus, sin identificar ninguna cepa de rotavirus responsable de brote epidémico. Un reciente metaanálisis muestra una incidencia aproximada de rotavirus nosocomial del 2,9% de hospitalizaciones, y que puede alcanzar el 8% en lactantes durante la estación de rotavirus9. Sobre la enfermedad previa al desarrollo de la GEA nosocomial, nuestros datos marcan un claro predominio de enfermedades respiratorias, suponiendo un 70% (n = 7) de todas las GEA nosocomiales. Esto es debido a la coincidencia estacional del virus respiratorio sincitial, principal motivo de ingreso de los lactantes durante los meses invernales.
El rotavirus –fundamentalmente el genotipo G1[P8]– continúa siendo la causa más frecuente de GEA grave en nuestro medio en los meses fríos. El empleo de técnicas moleculares para la evaluación etiológica de la GEA incrementa significativamente la sensibilidad diagnóstica y pone de relieve un número mayor de infecciones por rotavirus, así como de coinfecciones virales. La vigilancia epidemiológica activa del rotavirus es esencial para evaluar el impacto de la vacunación y la eventual aparición de cambios en la epidemiología de la enfermedad.
FinanciaciónLas actividades de investigación de FMT se han apoyado por becas de la Consellería de Sanidade/Xunta de Galicia (intensificación RHI07/2-ACTIVIDAD investigadora, PS09749 y 10PXIB918184PR), Instituto de Salud Carlos III (intensificación de la ACTIVIDAD investigadora) y el Fondo de Investigación Sanitaria (FIS, PI070069/PI1000540) del plan Nacional de I + D + i y Fondos FEDER.
Conflicto de interesesFMT ha recibido becas de investigación y/u honorarios como consultor/asesor y/o representante y ha llevado a cabo ensayos de vacunas de GlaxoSmithKline, Sanofi Pasteur MSD, Pfizer Inc/Wyeth, Novartis y MedImmune Inc.
En este trabajo han colaborado además los siguientes investigadores de ReGALIP (www.regalip.org): Juan Sánchez Lastres, Angel López-Silvarrey, Lorenzo Redondo Collazo, Jesús Velo Regueira, Rosa Veiguela Moreno, Nazareth Martinón Torres, Jose María Martinón Sánchez, Lucia Vilanova Trillo, Natalia Fernández Pedrós y Miriam Cebey López.