Introducción
Las complicaciones infecciosas son todavía una de las causas más importantes de morbimortalidad en los grandes quemados. A pesar de los avances en el desarrollo de nuevos agentes quimioterápicos, la infección es la causa de fallecimiento en más del 50% de los pacientes quemados1,2. La quemadura es un sustrato ideal para el crecimiento bacteriano y una puerta abierta para la invasión bacteriana. La pérdida de la barrera epitelial, la malnutrición inducida por la respuesta hipermetabólica y la respuesta inmunosupresiva generalizada provocada por la quemadura promueven la infección en este tipo de pacientes3.
A pesar del cambio terapéutico ocurrido en la última década, con una actitud quirúrgica precoz y más agresiva en los últimos años4,5, la práctica habitual en muchos centros de quemados y en casi la totalidad de centros españoles es el aislamiento estricto de los pacientes quemados con la intención de disminuir las complicaciones infecciosas6,7.
En el presente estudio determinamos la epidemiología, cronología y origen de la colonización bacteriana en los grandes quemados con el objetivo de determinar el origen endógeno o exógeno de estas infecciones y el índice de contaminación cruzada entre pacientes.
Métodos
Población estudiada
Se estudiaron prospectivamente 30 pacientes en edad pediátrica afectados de grandes quemaduras durante un período de 9 meses en el centro de quemados de la University of Texas Medical Branch, Galveston, Texas, EE.UU. Siguiendo los protocolos de actuación del Institutional Review Board de la University of Texas, se obtuvo un consentimiento informado de cada paciente y/o de sus padres o tutores. Los criterios de inclusión en el estudio se resumen en la tabla 1.
Tratamiento general
Una vez ingresados en el centro y acabado el estudio habitual de pacientes politraumatizados, los pacientes fueron reanimados con fluidos intravenosos para mantener las constantes y la producción urinaria dentro de parámetros normales. Los pacientes recibieron nutrición enteral con sonda nasogastroduodenal con una dieta de Vivonex-TEN (Sandoz Nutrition, Minneapolis, MN), la cual se compone de una fórmula elemental que contiene 82,3% de hidratos de carbono, 3% de grasa (ácido linoleico) y 14,7% de proteínas. Tras las primeras 24 h de reanimación, los pacientes fueron tratados quirúrgicamente y todas las quemaduras de espesor completo fueron escindidas y las heridas cubiertas con injertos de piel autólogos e injertos de piel heterólogos. Todos los pacientes recibieron profilaxis antibiótica preoperatoria con vancomicina, piperacilina y amikacina. Ésta se realizó de acuerdo con el protocolo de la unidad basado en la revisión periódica de los antibiogramas de las cepas aisladas en la unidad. No se realizó ningún tipo de descontaminación intestinal. Los pacientes fueron operados posteriormente a intervalos de una semana hasta conseguir la curación de todas sus heridas.
Los pacientes fueron tratados en un centro de quemados con régimen de visitas abiertas. Se realizó aislamiento de contacto únicamente en los momentos de contacto directo con las heridas de los pacientes durante la limpieza y cura de las heridas, revisión de los pacientes, y limpieza y preparación de los pacientes en el quirófano. Este aislamiento consistió en bata impermeable no estéril y guantes no estériles. En el resto de circunstancias no se practicó ningún tipo de aislamiento especial. La dedicación de personal de enfermería fue de ratio 1:1 (personal de enfermería/paciente) en pacientes grandes quemados críticos (necesidad de ventilación asistida y soporte inotrópico, además de las grandes curas diarias) y de 1/2 en pacientes grandes quemados de dependencia alta (necesidad de grandes curas y vigilancia intensiva, aunque sin necesidad de soporte ventilatorio ni de drogas inotrópicas).
Todos los pacientes fueron ingresados en habitaciones individuales. El régimen de visitas fue totalmente abierto, sin ningún tipo de restricción en cuanto a horario o número de visitantes. No obstante, las recomendaciones habituales consisten en permitir el descanso del paciente de 21:00 a 08:00 h y limitar el número máximo de visitantes a dos por paciente. Dada la naturaleza filantrópica del hospital, los pacientes provinieron de todos los estratos sociales.
Diseño del estudio
Se obtuvieron cultivos de esputo, orina, sangre, quemaduras, aspirado gástrico y heces en el momento de la admisión al centro y dos veces por semana a partir de ese momento. Se realizaron cultivos cuantitativos de las muestras de la quemadura (biopsia cutánea) según el método Robson-Heggers8. A modo de breve resumen, las muestras se pesaron asépticamente, se mojaron en alcohol y se flamearon para prevenir cualquier contaminante. Todas las manipulaciones se realizaron bajo protección y cobertura de campana de flujo laminar. Las muestras se diluyeron en tioglicolato suplementado y se homogenizaron. Una vez homogenizadas, se preparan soluciones decrecientes en múltiplos de 10, que se siembran en placas de agar, y se incuban a 37 °C durante 24 h. Las placas se leen en la disolución que contenga 30 colonias o más por placa. Muestras de tejido que contengan más de 105 colonias por gramo de tejido son indicativas de sepsis de la quemadura. Al mismo tiempo se practicó examen histológico de las biopsias para realizar el diagnóstico de infección invasiva, determinada por la detección de microorganismos en tejidos viables.
Una vez obtenidos los resultados de los cultivos, éstos se estratificaron cronológicamente por paciente, con el objetivo de determinar el orden cronológico de aparición de patógenos en los diferentes cultivos y el orden de colonización por fluido. Los diferentes biotipos de los patógenos identificados (características bioquímicas y antibiotipo) se determinaron y cruzaron con los resultados obtenidos en el resto de pacientes para determinar la colonización cruzada de los pacientes.
Análisis estadístico
Se realizó una estratificación de los pacientes según edad y superficie corporal quemada. El análisis estadístico se realizó con ANOVA unidireccional para los resultados de cultivos, test de Fisher para las variables discontinuas y regresión lineal para la comparación de cultivos ordenados cronológicamente. Los datos porcentuales de cultivos se expresaron como total de cultivos positivos. El número de pacientes con cultivos negativos se dio aparte. Se apartó una significación estadística en p < 0,05. Todos los datos se expresaron en media ± EEM.
Resultados
Las características clínicas de los pacientes se exponen en la tabla 2. En general, los pacientes presentaron grandes quemaduras en una extensión corporal media del 65%, con un componente de quemaduras de tercer grado (espesor completo) del 57%. Los mayoría de los pacientes requirieron una media de 12 días de ventilación asistida, y los pacientes fueron dados de alta 38 días tras la quemadura. La mortalidad en esta cohorte de pacientes fue del 10% (3 pacientes). Las causas de muerte fueron estrés respiratorio en 2 pacientes e infección por Aspergillus sp. en un paciente. Esta fue de localización pulmonar y de quemaduras y tejidos blandos circundantes. El diagnóstico se realizó mediante examen anatomopatológico de biopsia cutánea, cultivo del hongo en el laboratorio, corroborado por el examen necrópsico.
En los cultivos tomados tras la admisión al centro, los pacientes mostraron cultivos positivos en la quemaduras del orden de 103 colonias/g de tejido. El tratamiento quirúrgico de las quemaduras redujo la colonización a 98 ± 58 colonias/g de tejido. Los microorganismos aislados fueron flora cutánea habitual (40%, Staphylococcus sp.; 40%, S. epidermidis; 10%. S. aureus, y 10%, Micrococcus sp.). Tras 7 ± 5 días, las quemaduras se colonizaron con patógenos gramnegativos entéricos fermentadores y no fermentadores, con un predominio de Pseudomonas aeruginosa (40%), Escherichia coli (10%) Enterobacter cloacae (10%) y Klebsiella pneumoniae (6,6%), y patógenos grampositivos con predominio de Enterococcus faecalis (20%) y E. faecium (10%). A partir de la tercera semana posquemadura, la colonización de las quemaduras fue predominantemente por P. aeruginosa (80%) y E. faecalis (15%).
Los cultivos de aspirado gástrico fueron negativos inmediatamente tras la quemadura. Tras 6 ± 2 días, todos los pacientes presentaron cultivos positivos. Los organismos más comúnmente aislados fueron K. pneumoniae y Klebsiella sp. (65%), Candida sp. (45%), P. aeruginosa (40%) y E. faecalis (20%). Los resultados de los cultivos de aspirado gástrico se mantuvieron constantes el resto de la hospitalización.
El cultivo de heces aisló flora habitual no patógena en el ingreso de los pacientes. Tras 7 ± 1 días, todos los pacientes presentaron cultivos con patógenos no habituales en heces. Los organismos más habituales fueron P. aeruginosa en 55% de los pacientes y E. faecalis en 35% de los casos. Tras 3 semanas la colonización de las heces fue disminuyendo, con un total de un 25% de cultivos positivos previo al alta de los pacientes.
Los aspirados traqueales fueron positivos en un 25% en los cultivos iniciales, con un predominio de los cocos grampositivos (45%, S. aureus; 35%, S. epidermidis). A partir de 7 ± 4 días, los pacientes presentaron cultivos de esputo positivos en un 65% a P. aeruginosa. S. aureus siguió siendo positivo en un 15% de los casos, mientras que E. faecalis y Klebsiella sp. le siguieron en incidencia.
Los hemocultivos fueron negativos tras el ingreso en todos los casos. Se recuperaron organismos en un 15% de los casos, todos ellos coincidentes con casos de sepsis y shock séptico. Los resultados reflejaron en todos los casos la misma identificación de gérmenes y biotipos que los cultivos de quemadura y/o aspirado traqueal (R2 = 0,726; p < 0,05).
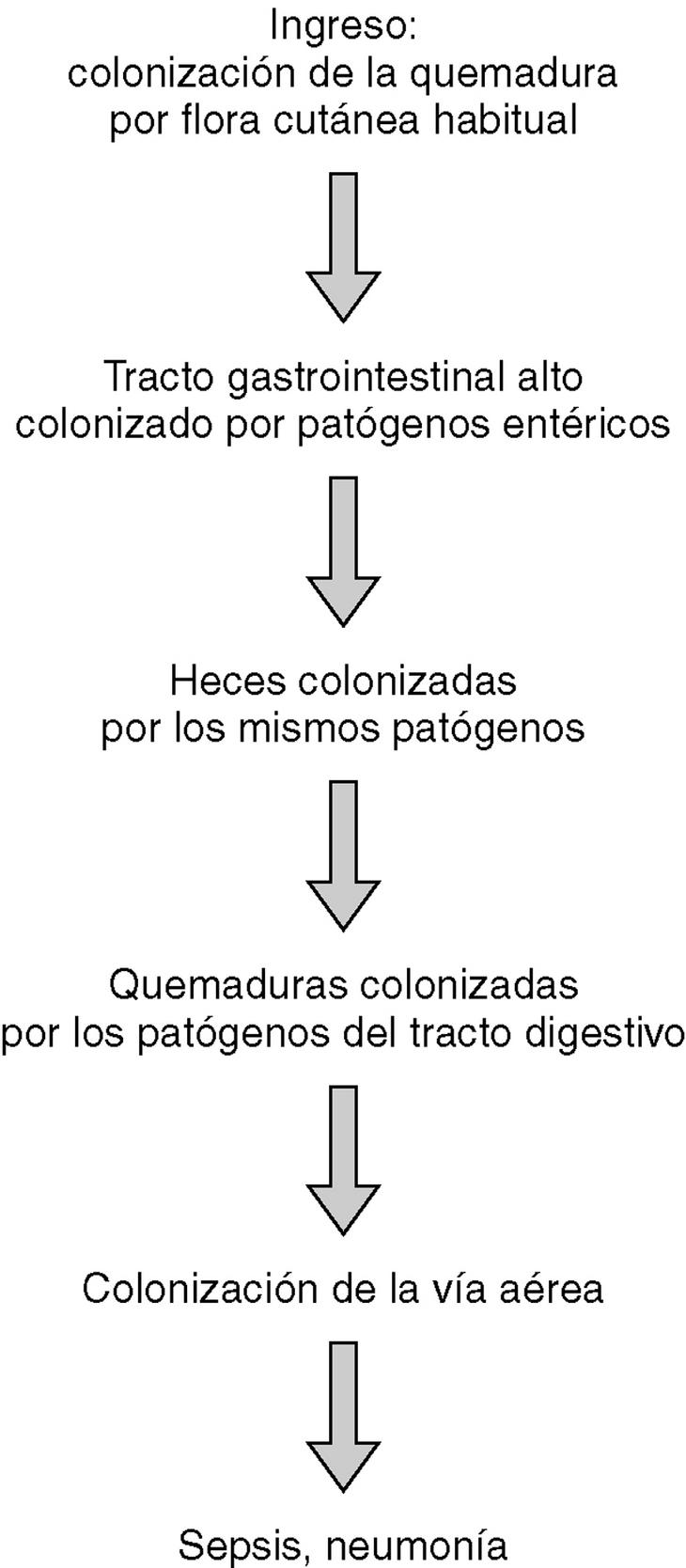
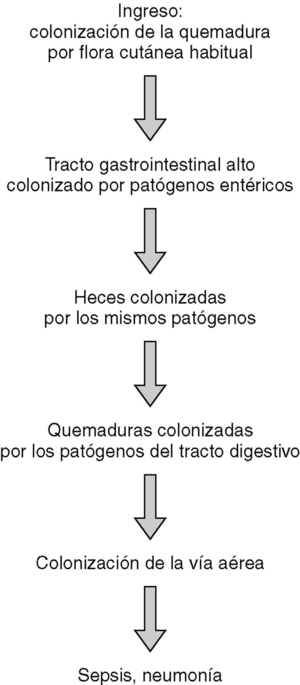
La cronología de la colonización de los pacientes quemados críticos se refleja en la figura 1. En general, en el momento de su ingreso los pacientes mostraron una colonización de las quemaduras por flora cutánea habitual. En una media de 6 días, el contenido gástrico se colonizó por patógenos gramnegativos entéricos y hongos, todos ellos flora habitual hospitalaria. Esta colonización del estómago precedió en todos los casos la colonización por los mismos organismos de las heces (R2 = 0,675; p < 0,05). Una vez que fueron colonizadas las heces por estos patógenos, los mismos colonizaron las quemaduras (R2 = 0,824; p < 0,05), y finalmente, la vía aérea superior (R2 = 0,705; p < 0,05). La colonización de las quemaduras y de la vía aérea superior por flora patógena gastrointestinal reflejó asimismo un correlación muy significativa (R2 = 0,699; p < 0,05) entre ambas, sin que pudiera detectarse ningún período temporal entre ambas, por lo que se puede asumir que sucedieron al unísono.
El estudio de los biotipos de los patógenos aislados reflejó que las mismas cepas que colonizaron el estómago, colonizaron subsecuentemente el tracto intestinal y finalmente las quemaduras y la vía respiratoria superior (p < 0,001), lo cual sugiere una colonización endógena de los pacientes. Asimismo, el estudio de los biotipos de las cepas aisladas en los diferentes pacientes no mostró ninguna correlación significativa. No se encontraron los mismos biotipos en pacientes distintos (p < 0,000), lo cual sugiere que la contaminación cruzada de los pacientes quemados no es significativa, a pesar de no realizar ningún tipo de aislamiento estricto.
Discusión
El estudio de la cronología de la colonización por flora patógena de pacientes grandes quemados demuestra que la colonización y subsecuente infección en este tipo de paciente se produce de forma endógena9,10. Los pacientes quemados sufren en primera instancia una colonización de sus quemaduras por flora cutánea autóctona con predominio de cocos grampositivos, mientras que el resto de fluidos y cavidades corporales no están todavía colonizadas. Tras una semana, y debido a un proceso de colonización progresiva por patógenos gramnegativos entéricos, se produce una cadena de colonización, que se inicia en el tracto gastrointestinal y finaliza en las quemaduras y la vía aérea superior. El estudio de biotipos de las cepas aisladas también refleja que esta colonización y subsecuente riesgo de infección y sepsis sucede de manera endógena, esto es, a partir del tracto gastrointestinal del propio paciente. Este estudio de biotipos sugiere que no existe una contaminación cruzada entre pacientes. Al no haberse realizado estudios genéticos de tipificación molecular, cuya sensibilidad y especificidad es superior a las técnicas fenotípicas, no puede descartarse completamente esta contaminación cruzada11-13, aunque lo anterior refleja que no existe en la actualidad una necesidad absoluta de aislar estrictamente los pacientes grandes quemados, y que el tratamiento de este tipo de pacientes en centros abiertos no produce ningún tipo de aumento de las complicaciones infecciosas en ausencia de endemia o brotes epidémicos por cepas nosocomiales multirresistentes14,15. En estos casos, la transmisión directa entre pacientes a través de colonización temporal de las manos del personal sanitario fue el posible mecanismo de transmisión, por lo que en casos de cepas multirresistentes el aislamiento de contacto, la higiene de las manos y la limpieza ambiental son de extrema importancia16.
La mayoría de los avances en el tratamiento de las quemaduras se han producido en los últimos 50 años. A mediados del siglo pasado, el shock, la sepsis y el fallo multiorgánico causaban una mortalidad del 50% en pacientes afectados de quemaduras en el 50% de la superficie corporal17. Hoy en día, se consigue una supervivencia en el 50% de los pacientes afectados de quemaduras en el 95% de la superficie corporal18. Uno de los avances más importantes que disminuyeron la mortalidad en los pacientes quemados fue el control de la infección. Entre 1966 y 1975, el 60-80% de los pacientes con quemaduras de más del 50% de la superficie corporal fallecían a causa de sepsis bacteriana. Tras la introducción de tratamientos antimicrobianos tópicos, la sepsis a partir de la quemaduras infectadas disminuyó. Entre estos tratamientos tópicos cabe destacar la sintetización de la sulfadiazina argéntica19, la cual, junto al aislamiento estricto de los pacientes y la adición de nistatina al régimen de tratamiento tópico fueron responsables de este declive en la incidencia de complicaciones infecciosas20. Las razones que llevaron a la instauración de un aislamiento estricto en los centros de quemados son multifactoriales. En primer lugar, a pesar de los nuevos tratamientos antibacterianos, los pacientes seguían sucumbiendo a la sepsis tardía de la quemadura la cual se consideraba que era adquirida por los pacientes por contaminación cruzada y por patógenos hospitalarios10. Más relevante fue el conocimiento del desarrollo de una respuesta hipermetabólica e inmunosupresora en el paciente quemado, la cual, junto a la pérdida de la barrera cutánea, colocan al paciente en una situación de riesgo21. Por último, la falta de un tratamiento quirúrgico eficaz, dejaba a los tratamientos quimioterápicos antibacterianos como los únicos agentes activos frente a la invasión bacteriana22.
Los resultados obtenidos en esta serie de pacientes demuestran objetivamente que la colonización de los pacientes grandes quemados y su subsecuente infección se produce a través de un cambio de la flora cutánea habitual por patógenos gramnegativos y una contaminación endógena a través del tracto digestivo que acaba en una colonización de la quemadura y de la vía aérea que resulta en muchos casos en sepsis de la quemadura o de origen neumónico. Esto demuestra que el aislamiento estricto de los pacientes quemados no diminuye la contaminación ni la infección de los pacientes. Es más, se ha demostrado que aumenta los fallos en los protocolos de control de infección, al aumentar la complejidad de los procedimientos23. En el mismo estudio se demostró que el simple aislamiento de barrera durante las curas y el lavado de manos es suficiente para controlar la contaminación cruzada. La causa de la colonización de las quemaduras en pacientes grandes quemados por microorganismos patógenos entéricos de origen endógeno sigue en debate. A pesar de que la contaminación cruzada en el propio paciente es posible cuando no se dan las circunstancias higiénicas necesarias3,14, es posible que la translocación bacteriana desde el tubo digestivo pueda ser un fenómeno crucial en este cambio progresivo de la flora microbiana en los pacientes grandes quemados24. Se ha postulado que el fallo de la barrera epitelial de la mucosa intestinal, probablemente debido a apoptosis de las células mucosas25 y a la hipoperfusión causada por el shock posquemadura y la continua redistribución de fluidos corporales26 promueve la translocación bacteriana a los ganglios linfáticos, bazo y a la quemadura27. No obstante, a pesar de ser un proceso relevante en la experimentación animal, todavía no se han demostrado evidencias claras en experimentación clínica. Uno de los mecanismos que se ha postulado para controlar esta cadena de colonización bacteriana en pacientes ingresados en unidades de cuidados intensivos es la descontaminación digestiva selectiva28, basada en la administración de diferentes combinaciones de antimicrobianos por vía enteral y la aplicación de pastas orales para conseguir la disminución de la colonización del tracto intestinal y subsecuente desarrollo de neumonía gnosocomial y sepsis. Su efectividad sigue estando en debate, tanto en la población de pacientes ingresados en unidades de cuidados intensivos generales29, como en el tratamiento de pacientes grandes quemados30,31, en los que se han obtenido resultados dispares.
El avance en el tratamiento de los grandes quemados que ha cambiado drásticamente la incidencia de las complicaciones infecciosas es la cirugía precoz32. Este hecho puede haber incluido un sesgo en los resultados que podría afectar a la interpretación de los mismos. No obstante, si bien la cirugía precoz ha demostrado que es muy eficaz en la reducción de la carga bacteriana en los pacientes quemados33, en el mismo estudio se demostró que los pacientes que no son intervenidos quirúrgicamente de manera precoz, siguen mostrando el mismo patrón de cambio de flora bacteriana de origen endógeno. Asimismo, en un estudio epidemiológico de más de 2.000 pacientes quemados tratados en un centro de quemados en régimen de aislamiento estricto, se produjo la misma incidencia de complicaciones infecciosas y la misma mortalidad34. Los pacientes incluidos en este estudio fueron tratados con cirugía precoz, por lo que estos datos sugieren que los datos obtenidos que determinan el origen endógeno de las infecciones en los pacientes quemados son bastante fiables.
En resumen, el estudio de la cronología de la colonización bacteriana en los pacientes grandes quemados demuestra que la colonización e infección bacteriana en nuestro centro sucede de forma endógena con una nula colonización cruzada entre enfermos. Usando técnicas de aislamiento de barrera durante las curas y la higiene de las manos del personal y familiares se controla de forma eficaz la contaminación cruzada de los enfermos. Cuando se realiza un contacto directo con las heridas de los pacientes o con fluidos corporales es necesario el lavado formal de las manos con jabón antiséptico. En el resto de circunstancias la higiene con soluciones o geles de alcohol glicerol es suficiente16. Los datos obtenidos en nuestro estudio sugieren que cuando se cumplen las circunstancias de hospitalización y de manejo de los enfermos indicadas anteriormente, el aislamiento estricto no es necesario y se puede abandonar salvo que exista una situación de endemia mantenida por microorganismos nosocomiales multirresistentes.