Introducción
El tratamiento con inhibidores de la proteasa (IP) se ha mostrado muy eficaz en la reducción de la morbilidad y mortalidad asociadas a la infección por el virus de la inmunodeficiencia humana (VIH), tanto en ensayos clínicos como en extensos estudios observacionales1-3. Sin embargo, en los ensayos clínicos los pacientes son cuidadosamente seleccionados para su inclusión, con incentivos y refuerzos para el adecuado cumplimiento del tratamiento, siendo los abandonos por efectos secundarios o decisiones del propio paciente y las pérdidas de seguimiento mucho menores que en la "vida real", mostrando por tanto una efectividad del tratamiento muy superior a la observada en cohortes clínicas4-9. Los estudios observacionales han señalado algunos factores que pudieran ser predictores de una mejor respuesta como: mayor edad8-9, mayor número de linfocitos CD4+4,5,7,8,10,11, carga viral plasmática (CVP) baja5-7,9,10,12, ausencia de tratamiento previo4,7,12, utilización de dos o más nuevos fármacos en pacientes pretratados6,8-10 y el uso de IP diferentes a saquinavir en cápsulas de gelatina dura (saquinavir-hgc) a las dosis estándar establecidas para este fármaco4,7,11. Sin embargo, en estos estudios la asignación del IP en los diferentes grupos no fue aleatoria y algunos sesgos han podido influir en los resultados como, por ejemplo, la asignación de pacientes más deteriorados a un particular fármaco por los datos preliminares existentes sobre su eficacia. Por otra parte, la medida real de la eficacia de un tratamiento puede verse influida por el análisis mediante cortes transversales periódicos evaluados por "intención de tratar", que penalizan a las combinaciones de fármacos más tóxicas y a los pacientes en estadios más avanzados, que generalmente toleran peor los tratamientos. Más aún, algunos estudios considerados "observacionales", incluyen pacientes previamente enrolados en ensayos clínicos13 y ciertos grupos de riesgo como los adictos a drogas por vía parenteral (ADVP) suelen estar escasamente representados al suponer los médicos un menor cumplimiento de la terapia antirretroviral de gran actividad (TARGA) en estos colectivos14,15.
Los objetivos de este estudio han sido la descripción de la respuesta inmunológica, virológica y clínica de una terapia antirretroviral con nelfinavir como IP, en una cohorte no seleccionada de pacientes VIH que eran seguidos de manera habitual en la práctica clínica diaria, así como la investigación de los factores asociados a la respuesta al tratamiento.
Método
Pacientes
Los pacientes de este estudio fueron prospectivamente seleccionados en 15 centros andaluces entre el 1 de abril de 1999 y el 1 de abril del 2000, con un período de seguimiento que alcanzó hasta el 1 de junio del 2001. Los pacientes incluidos tenían más de 18 años de edad e iniciaban nelfinavir como parte de su tratamiento antirretroviral. Para su inclusión fueron necesarios un recuento de linfocitos CD4+ y CVP tomados en los 30 días previos al inicio del tratamiento con nelfinavir (determinación basal) y al menos una determinación subsiguiente y una revisión clínica a partir del primer mes de tratamiento. Se pidió a los facultativos que incluían a los pacientes que clasificaran las razones para incluir cada caso dentro de las cuatro siguientes: primer TARGA en pacientes vírgenes, excluyendo a aquellos que participaban en un ensayo clínico (grupo A), fracaso virológico a un tratamiento antirretroviral previo de gran eficacia (grupo B), toxicidad/mala cumplimentación al tratamiento previo (grupo C) y decisión personal/otras razones (grupo D). Todos los pacientes recibieron las dosis recomendadas de los distintos fármacos antirretrovirales empleados, siguiendo las guías internacionalmente aceptadas16,17 y no se realizaron ajustes de dosis entre nelfinavir y los análogos no nucleósidos inhibidores de la retrotranscriptasa (NN). La prescripción de nelfinavir se hizo en dos (1.250 mg/12 h) o tres tomas (750 mg/8 h) dependiendo del clínico que atendía al paciente. No era necesario un consentimiento informado firmado por el paciente para participar en el estudio. Todos los pacientes toxicómanos debían estar en tratamiento sustitutivo con metadona y los que no lo estaban y mantenían una drogadicción activa, eran enviados a su Centro Provincial de Drogodependencia para evaluación psicológica e inicio de terapia de deshabituación, previas a su participación en el estudio. Sin embargo, una vez iniciada la medicación, si el paciente no continuaba su terapia de deshabituación pero expresaba su deseo de continuar el tratamiento antiviral, se le mantenía en el estudio.
Los datos clínicos y analíticos se recogieron al inicio del tratamiento y en cada una de las visitas sucesivas (al mes de tratamiento y luego cada 3 meses), mediante un cuestionario estándar. Miembros del equipo de coordinación recogían y analizaban los cuestionarios enviados, realizando visitas periódicas a los centros para asegurar la correcta inclusión de los pacientes y la exactitud de los datos. El estadio de la infección VIH y la definición de casos de sida se hizo siguiendo los criterios universalmente aceptados, considerando también la leishmaniasis visceral como un episodio oportunista definitorio de sida.
Cuando un paciente interrumpía el tratamiento con nelfinavir los facultativos debían comunicar la causa. Se registraron las reacciones adversas atribuidas a nelfinavir y la intensidad del efecto se evaluó siguiendo la escala de graduación de efectos adversos del AIDS Clinical Trial Group. La adhesión al tratamiento fue evaluada por los médicos que atendían a cada paciente mediante las respuestas de éstos a preguntas sobre su cumplimentación, número de visitas fallidas y, en algunos hospitales, con la información aportada por el servicio de farmacia. Se consideró que la adhesión era adecuada cuando el clínico que atendía al paciente consideraba que el cumplimiento de las tomas era superior al 90%.
Puntos finales
Se midió la respuesta de la CVP y el recuento de linfocitos CD4+ y se consideró que el paciente había obtenido respuesta virológica con el tratamiento cuando el descenso del ARN-VIH plasmático fue ≥ 1 log10 o una CVP inferior a 500 copias/ml en la última visita; este dintel se eligió porque no todos los centros utilizaron la misma técnica para la determinación. Los pacientes con una CVP por debajo del límite de detección al inicio del tratamiento con nelfinavir fueron incluidos en este estudio para averiguar la tolerancia y la eficacia a largo plazo de este fármaco, pero se excluyeron para la evaluación de los factores pronósticos relacionados con una respuesta virológica. Se les consideró respondedores si la CVP permaneció indetectable durante el período de estudio. Entre los pacientes que alcanzaron una CVP indetectable, la recaída se definió como dos determinaciones consecutivas de más de 500 copias/ml (utilizando la fecha de la primera de las dos mediciones) o una determinación única de más de 1.000 copias/ml. El recuento de linfocitos CD4+ se realizó siguiendo técnicas estándar de citometría de flujo y la respuesta inmunológica se definió como el incremento de al menos 50 células CD4+ tras el inicio del tratamiento. La respuesta clínica se valoró considerando la aparición de nuevos episodios oportunistas definitorios de sida y/o muerte relacionada con esta entidad.
Análisis estadístico
Las variables continuas se analizaron mediante el test de Student (distribución normal) o los de Mann-Whitney y Wilcoxon (varianzas desiguales o distribución no normal). Las variables categóricas se analizaron mediante el test de la chi cuadrado. La respuesta virológica e inmunológica al año de seguimiento se analizó mediante el coeficiente de correlación de Pearson. El seguimiento de cada paciente empezaba el primer día de tratamiento con nelfinavir y terminaba con su última visita registrada. Sin embargo, en el análisis del tiempo necesario para alcanzar una CVP indetectable y el de aparición de la recaída, así como en los factores relacionados con estos dos acontecimientos, el día de cese del seguimiento se consideró la fecha en que interrumpieron el tratamiento con nelfinavir. Los cambios en el régimen antirretroviral prescrito durante el período de seguimiento que no afectaran a nelfinavir no se consideraron para el análisis. Las interrupciones en el tratamiento con nelfinavir consideradas no permanentes se recogieron como períodos continuos de tratamiento. Una primera evaluación de la eficacia se realizó mediante análisis de cortes transversales en los pacientes que mantenían el tratamiento con nelfinavir (pacientes "en tratamiento"), así como en todos los pacientes seleccionados con independencia del tratamiento (análisis "por intención de tratar"), considerando en este último supuesto la ausencia de datos = fracaso. El método de curvas actuariales de Kaplan-Meier se utilizó para determinar la proporción de pacientes que alcanzaban una CVP indetectable y la proporción de los que recayeron. Se utilizaron además modelos de riesgo proporcional de Cox para la investigación de los factores relacionados con la respuesta virológica y la posterior recaída como: edad, sexo, grupo de riesgo, diagnóstico previo de sida, recuento de linfocitos CD4+ y CVP al inicio, incremento de linfocitos CD4+ en la última visita, tratamientos antirretrovirales previos y número de nuevos fármacos antivirales prescritos a la par que nelfinavir, excluyendo aquellos pacientes que no lograron completar al menos 3 meses de tratamiento con este fármaco, por cualesquiera causas. Para evitar sesgos, la estimación por parte de los facultativos de la adherencia del paciente al tratamiento no se incluyó en el análisis.
La aparición de episodios oportunistas y muertes se midió mediante la tasa de incidencia en pacientes-año, utilizando la distribución de Poisson para el cálculo de los intervalos de confianza. Los datos se procesaron utilizando el paquete estadístico SPSS versión 10.0 (SPSS Inc; Chicago, Illinosis, USA).
Resultados
Características de los pacientes
Un total de 891 pacientes reunían los criterios exigidos y se seleccionaron inicialmente para el estudio excluyéndose 99 de ellos (11,1%) por no tener al menos una visita de seguimiento tras el inicio del tratamiento. En la tabla 1 se presentan las características de los pacientes incluidos finalmente. Los pacientes no tratados previamente fueron similares en edad, sexo, factor de riesgo para la adquisición del VIH y recuento de linfocitos CD4+ a los pacientes pretratados. Por el contrario, aquellos estaban en un estado menos avanzado (28% con diagnóstico previo de sida frente al 40% de los pretratados, p < 0,01) y mostraban una CVP inicial más alta (4,93 log10 copias/ml frente a 3,96 log10, p < 0,01).
Sólo una minoría de los pacientes (n = 254; 32,1%) no había recibido tratamiento previo (grupo A). De los pacientes pretratados, 317 (59%) iniciaron tratamiento con nelfinavir por fracaso virológico (grupo B), 187 (34,7%) por toxicidad/pobre cumplimiento al tratamiento previo (grupo C) y 34 (6,3%) por decisión personal/otras razones (grupo D). En general, los pacientes pretratados habían experimentado múltiples tratamientos y el 75,5% de ellos habían recibido dos o más tratamientos previos antes de iniciar nelfinavir. Casi todos habían recibido análogos nucleósidos inhibidores de la retrotranscriptasa (AN): zidovudina y lamivudina (90,8%), estavudina (80,8%), y didanosina y zalcitabina (51,3 y 31,1%). Sólo 7 pacientes (1,3%) habían usado un NN (nevirapina) y, en cambio, todos ellos habían tomado previamente IP, aunque la mayoría (75%) había recibido únicamente un fármaco de esta familia: indinavir (65%), saquinavir-hcg (52,3%) y ritonavir (11,3%). La mediana de tratamiento previo con IP de 14 meses (IQR: 3-52). Todos los pacientes no tratados previamente iniciaron nelfinavir con dos AN simultáneos, pero el 42,2% (n = 227) de los pacientes pretratados inició un nuevo tratamiento con nelfinavir sin añadir ningún otro nuevo fármaco, el 25,6% pudo recibir algún otro y tan sólo el 23,9% recibió otros dos nuevos fármacos no tomados previamente. El régimen de dosificación de nelfinavir fue de dos veces al día en 289 pacientes (36,5%) y de tres en 503 (63,5%) y 97 pacientes pretratados recibieron simultáneamente saquinavir-hgc.
Tolerancia y toxicidad
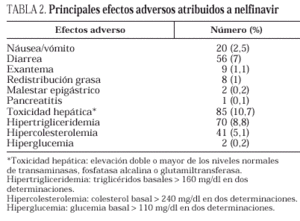
Tras una mediana de seguimiento de 12 meses (IQR = 10-13), un total de 304 (38,3%) pacientes interrumpieron el tratamiento con nelfinavir y las razones fueron: efectos secundarios (n = 57; 7,2%), fracaso virológico (n = 87; 10,9%), decisión personal/otras (n = 14; 1,7%), muerte (n = 11; 1,3%) y pérdida de seguimiento (n = 136; 17%). Las interrupciones debidas a los efectos secundarios ocurrieron antes (mediana, 6 meses; IQR, 2-11) que las debidas a fracaso virológico (mediana, 11 meses; IQR, 5-13). Noventa y tres pacientes (16,4%) presentaron al menos una reacción adversa de cualquier grado a nelfinavir y 45 (5,6%) tuvieron al menos una reacción grave. La mayor parte de los efectos adversos fueron gastrointestinales (especialmente la diarrea) y los más relevantes se detallan en la tabla 2. En los pacientes no tratados se midieron los niveles plasmáticos de colesterol y triglicéridos en cada visita, observándose un incremento del colesterol en la visita final con respecto a niveles basales (mediana de 192 frente a 160 mg/dl; p < 0,01) y, en menor medida, de los triglicéridos (mediana de 155 frente a 127 mg/dl, p = 0,08 test de Wilcoxon).
El 64,5% de los pacientes tomaron más del 90% de las dosis prescritas, con diferencias significativas entre los grupos de riesgo: 77,7 y 83% de adherencia en homosexuales y hemofílicos, mientras que ADVP y heterosexuales mostraron tasas del 60,7 y 59%, respectivamente (p = 0,01). Los pacientes perdidos para el seguimiento a lo largo del estudio eran ADVP en una mayor proporción (73,2% frente a 64,9%, p = 0,04), y también no tratados con más frecuencia (39,7% frente a 19,8%, p = 0,01) mostrando una pobre adherencia previa al tratamiento (33,5% frente a 70,7%, p = 0,01) y una peor tasa de respuesta virológica (44,5% frente a 61,6%; p = 0,01). Es de destacar que la mitad de las pérdidas sucedieron en los primeros 3 meses.
Respuesta virológica e inmunológica
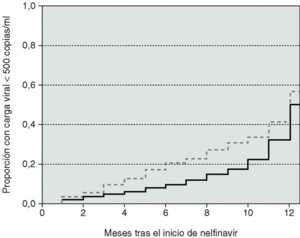
Si consideramos la última visita de los pacientes en tratamiento con nelfinavir, la respuesta virológica se obtuvo globalmente en 503 (63,5%) individuos, siendo significativamente mejor en los no tratados previamente: 79,5% de respuesta y 72,4% con CVP indetectable frente a 55,5 y 46,8% en pacientes pretratados (p < 0,01). Sin embargo, debido al alto número de pérdidas de seguimiento en el grupo de pacientes vírgenes, los resultados a los 12 meses fueron mucho peores en un análisis por intención de tratar: 41,3% de respuesta (37,4% con CVP no detectable) en pacientes no tratados y 37,7% (31,2% con CVP no detectable) en pacientes pretratados (p = 0,03). La figura 1 muestra el porcentaje de respuestas durante el primer año dependiendo del tipo de paciente y del método de análisis. En los pacientes pretratados, la respuesta fue significativamente inferior (p < 0,01) en los pertenecientes al grupo B (54,5% de respuesta en pacientes "en tratamiento" y 34,8% en análisis por intención de tratar) que en aquellos del grupo C (71,5 y 42,9% de respuesta según los dos tipos de análisis).
Figura 1. Porcentaje de pacientes con respuesta virológica dependiendo del tipo de análisis utilizado. IT: análisis por intención de tratar (perdido = fracaso); ET: pacientes en tratamiento con nelfinavir.
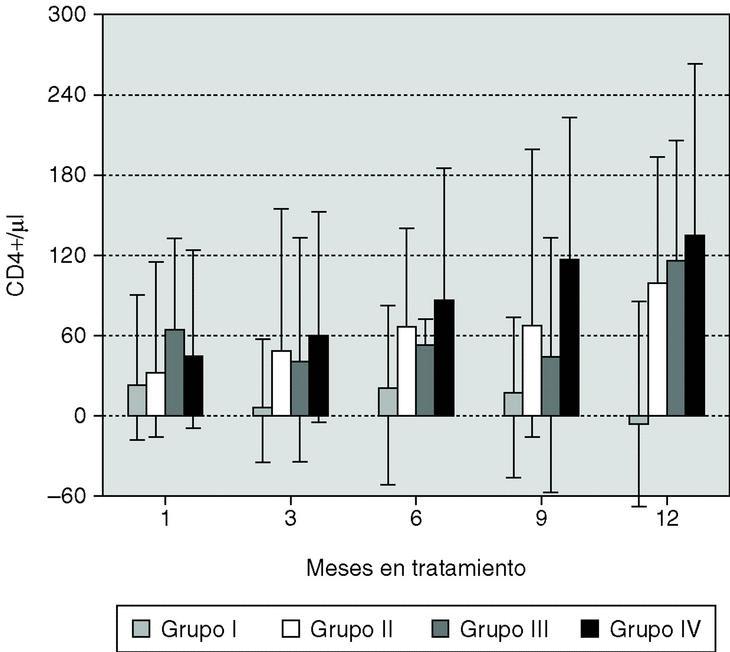
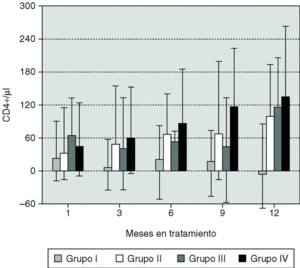
El 58,4% de los pacientes experimentó un incremento de linfocitos CD4+ mayor de 50 x 106/l a lo largo del período de estudio y en el 44,1% éste fue superior a 100 x 106/l. No se encontró relación entre el incremento y las características demográficas, de tratamiento previo o nivel basal de linfocitos CD4+ de los pacientes. Por el contrario, se observó una correlación inversa entre los niveles basales de CD4+ y CVP (r = 0,29; p < 0,01) y el incremento en los linfocitos CD4+ también se correlacionó con los niveles basales más bajos de linfocitos CD4+ (r = 0,26; p < 0,01) y con la respuesta viral al tratamiento. Para permitir un análisis más detallado de la relación entre las respuestas virológica e inmunológica, los pacientes se clasificaron en cuatro grupos (fig. 2) dependiendo de la respuesta virológica obtenida a partir de los 3 meses de tratamiento hasta el final del tratamiento: no respondedores (n = 182); respondedores transitorios (n = 107); respondedores parciales (n = 34); y respondedores completos (n = 408). El grado de restauración inmunológica medido como incremento de linfocitos CD4+ varió de manera significativa con el tipo de respuesta virológica. Así, la mediana del incremento de CD4 al año de tratamiento fue de +134 células CD4+ en los respondedores completos mientras que hubo un decremento medio de 6 células en el mismo período en el grupo de no respondedores. Sin embargo, el aumento de linfocitos CD4+ en el grupo IV (respondedores completos) fue similar al experimentado por los respondedores parciales (grupo III) a lo largo de todo el período de seguimiento, e incluso la respuesta inmunológica se sostuvo hasta el mes 9 en aquellos pacientes con respuesta virológica transitoria (grupo II). Más aún, un 34,6% de los pacientes sin ninguna respuesta virológica mostraban un incremento mayor de 50 células CD4+ en el mes 12.
Figura 2. Incremento de CD4+ para 4 grupos con niveles plasmáticos de ARN-VIH: grupo I, descenso nunca > 1 log10; grupo II, por debajo de 500 copias/ml o descenso > 1 log10 al menos dos veces, pero superior a 1.000 copias/ml o mayor que al inicio en su última visita; grupo III, descenso > 1 log10, pero nunca por debajo de 500 copias/ml; grupo IV, por debajo de 500 copias/ml en al menos dos ocasiones y en su última visita.
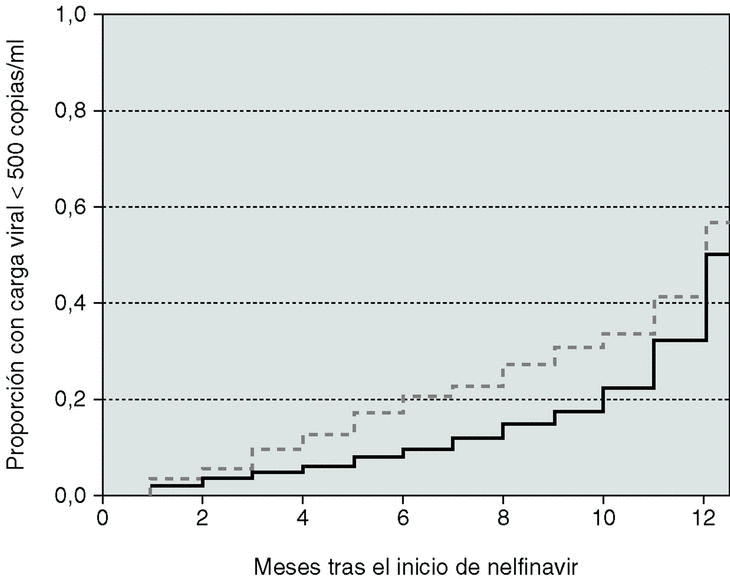
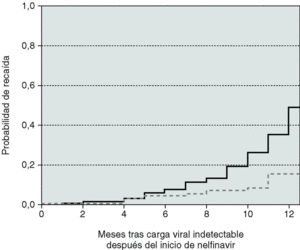
Las curvas de Kaplan-Meier reflejaron un aumento escalonado en la probabilidad estimada para alcanzar una CVP indetectable a los 12 meses de tratamiento. De los 792 pacientes, 128 iniciaron el tratamiento con nelfinavir con CVP indetectable y, de los restantes 664, la probabilidad de CVP indetectable a los 12 meses fue del 52% (IC 95%: 48-57). Los pacientes vírgenes alcanzaron concentraciones indetectables en un porcentaje estimado del 57% durante el primer año, comparado con el 49% en los pretratados (p < 0,01, test del log rank, fig. 3).
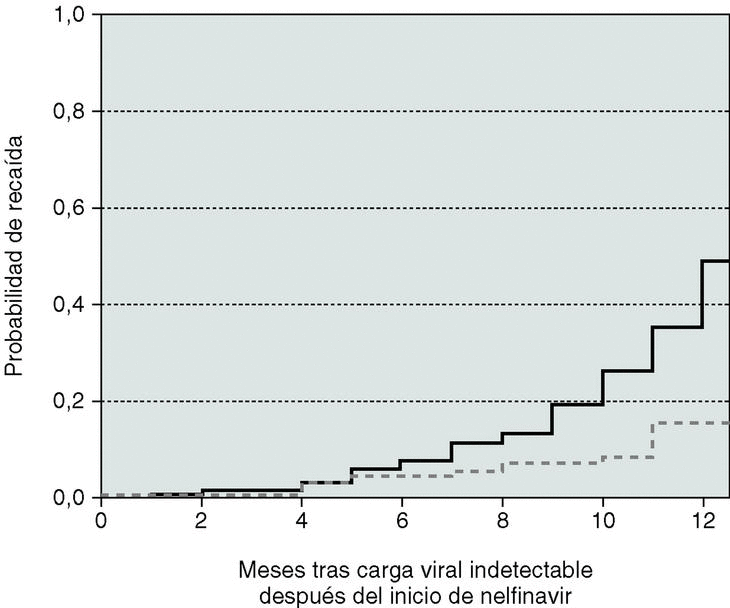
Figura 3. A) Probabilidad de carga viral indetectable tras el inicio de tratamiento. B) Probabilidad de recaída en aquellos pacientes que habían logrado una carga viral indetectable con el tratamiento. Pacientes vírgenes: línea discontinua. Pacientes pretratados: línea negra.
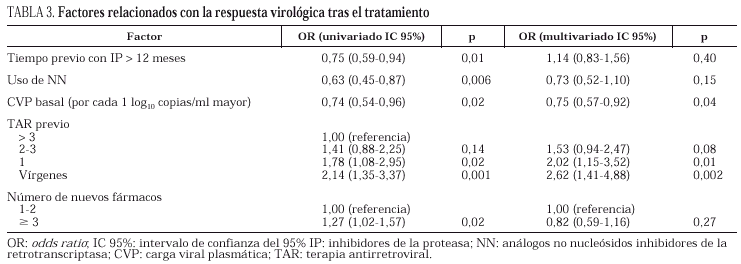
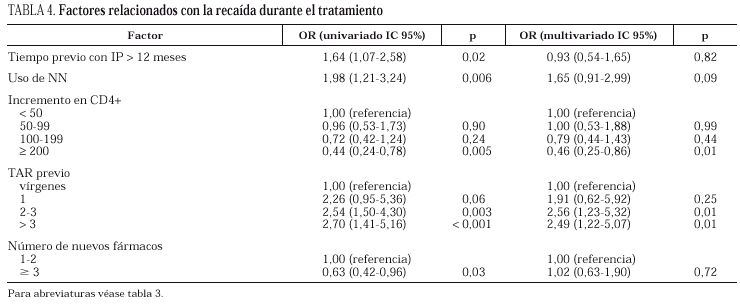
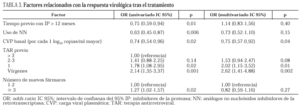
En la tabla 3 se detallan los factores relacionados (modelos de regresión de Cox) con la respuesta virológica al tratamiento en los pacientes con CVP detectable al inicio, y con la recaída en aquellos sujetos que habían obtenido una respuesta favorable en un principio. Tras los ajustes pertinentes, los factores asociados a una respuesta favorable fueron: una menor CVP basal, no tratamiento previo y, en los pacientes pretratados, haber recibido tan sólo un tratamiento. La edad, el sexo, el grupo de riesgo, el estadio de la infección, el recuento inicial de linfocitos CD4+, así como el número de nuevos fármacos usados conjuntamente con nelfinavir y el tiempo de tratamiento con IP previos no fueron predictores de la respuesta ni siquiera cuando se analizaron separadamente los grupos B y C. Curiosamente, el uso de NN (más un AN) en el nuevo régimen se asoció a una peor respuesta que cuando se usaron dos AN en el subgrupo de pacientes en rescate (datos no mostrados), aunque estas diferencias no perduraron en el análisis multivariado.
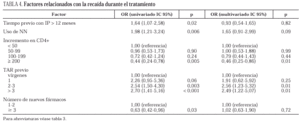
En los 407 pacientes totales que alcanzaron una CVP indetectable a lo largo del seguimiento, la probabilidad estimada de recaída un año después fue del 24% (intervalo de confianza del 95% [IC 95%]: 10-38) para pacientes no tratados y del 49% (IC 95%: 38-59) para pretratados (p < 0,01 en el test del log-rank). Los pacientes nula o escasamente tratados y aquellos que habían experimentado un mayor incremento en los linfocitos CD4+ (> 200 células) mostraron un riesgo significativamente menor de recaída sin influencia de la CVP (tabla 4). El uso o no de dos nuevos fármacos asociados al nelfinavir tampoco fue un factor predictivo y los resultados del análisis no fueron diferentes cuando se incluyeron tan sólo los pacientes pretratados que entraron en el estudio por fracaso virológico "estricto" (grupo B).
Respuesta clínica
A lo largo del período de seguimiento 31 pacientes tuvieron 36 nuevos episodios definitorios de sida y la tasa de incidencia fue de 4,6 (3-6) por 100 personas/año y el 58% de ellos se produjeron durante los primeros 3 meses de tratamiento, 55,5% en respondedores y 44,5% en no respondedores. Por el contrario, 14 de 17 (82,3%) episodios tardíos (después de 3 meses) se produjeron en pacientes no respondedores. Once pacientes murieron, pero sólo 9 muertes estuvieron relacionadas con la infección por el VIH, lo que arroja una incidencia de una muerte (0,7-2) por 100 personas/año. Seis pacientes no respondedores murieron de múltiples infecciones oportunistas y síndrome consuntivo y 2 pacientes, que habían experimentado una respuesta viral favorable, a causa de linfomas no hodgkinianos. El paciente restante, también respondedor pero con muy bajos recuentos de linfocitos CD4+, murió de tuberculosis.
Discusión
Este estudio, realizado en una amplia cohorte de pacientes procedentes de la práctica clínica habitual, proporciona una sólida evidencia de que una considerable parte de ellos logra una negativización de la CVP mientras toma el tratamiento antirretroviral. El alto porcentaje de ADVP de esta serie sólo es un reflejo de la proporción real de este grupo de riesgo en el colectivo de pacientes con sida en nuestra comunidad autónoma. En este colectivo, la respuesta a la TARGA no ha sido diferente a la de otros grupos de riesgo como así se ha demostrado en otros estudios8,10,12,13 y es de resaltar que, en nuestro estudio, el grado de adherencia de los que permanecían en seguimiento tras los primeros 3 meses, se juzgó inferior al de homosexuales y hemofílicos, pero similar al de heterosexuales.
Los resultados de la eficacia virológica en los pacientes vírgenes de esta cohorte fue similar (76,5%) a la comunicada en diversos ensayos clínicos con nelfinavir si se consideran los pacientes en tratamiento18,19, pero muy inferior si se realiza un análisis por intención de tratar (41,7%) que tiende a considerarse hoy como el estándar20. Sin embargo, los pacientes en esta cohorte no estaban seleccionados ni estaban especialmente motivados y tampoco estuvieron monitorizados más de lo que permite la práctica clínica habitual en nuestros hospitales. Son por tanto muy representativos del "mundo real", donde las pérdidas de seguimiento son mucho más frecuentes de lo deseable21,22 y es de resaltar que la mayor parte éstas se produjeron en el grupo de pacientes vírgenes, la mayor parte asintomáticos, lo que quizá refleje la dificultad para el cumplimiento de un tratamiento en ocasiones plagado de efectos secundarios que en teoría se les prescribe para su bienestar.
Por el contrario, la eficacia (49% de pacientes con CVP indetectable) observada en pacientes pretratados se parece a la registrada en grandes cohortes observacionales de pacientes pretratados pero no experimentados con IP4-13 y es indiscutiblemente mejor que la comunicada en pequeñas series de pacientes previamente tratados con IP23-27. Sin embargo, las comparaciones entre estudios deben hacerse siempre con precaución debido a los diferentes regímenes empleados, las características de los sujetos incluidos, los diferentes puntos de corte respecto a la indetectabilidad viral y los distintos métodos a los análisis20. Los análisis mediante intención de tratar en cortes transversales, empleados con frecuencia en ensayos clínicos, penalizan a los pacientes con frecuentes visitas "fallidas" y tampoco reflejan la eficacia real del primer régimen elegido. En cambio, los estudios mediante curvas de supervivencia son más representativos ya que incluyen una estimación del tiempo requerido para alcanzar la respuesta o para experimentar la eventual recaída, así como los factores relacionados en ellas28. Sin embargo, es preciso recordar aquí que en este estudio los pacientes previamente tratados que iniciaban nelfinavir se agrupaban bajo un solo epígrafe (grupos B y C), asumiendo que un fracaso del tratamiento previo no estaba relacionado con los efectos secundarios que el régimen pudiera haber producido. Obviamente, esto puede no ser cierto en muchos casos y, aunque los análisis de la eficacia observada excluyendo los pacientes con efectos secundarios (grupo C) fueron inferiores pero aún aceptables (54,5% de respuesta en pacientes "en tratamiento" del grupo B), los resultados podrían no ser válidos para una cohorte seleccionada de pacientes en fracaso virológico y estricta constatación de ningún efecto secundario al régimen previo. Nelfinavir posee una excelente tolerancia comparado con otros IP29,30, tal como ha sido refrendado en este estudio, y debido a sus escasas interacciones con otros fármacos, es un antirretroviral no desdeñable para una terapia "de rescate", especialmente en pacientes con mala tolerancia a regímenes previos donde posiblemente el no cumplimiento de la medicación tenga más peso que las hipotéticas resistencias emergentes.
La CVP basal y la toma previa de antirretrovirales fueron factores predictores de la respuesta al tratamiento con nelfinavir, tal como se ha reseñado en otros estudios4,5,7,8,10,11. En cambio, el recuento inicial de linfocitos CD4+ ha generado en ocasiones resultados divergentes31. En este estudio los mayores niveles de CVP se observaron en pacientes con CD4+ más bajos inicialmente, pero los mayores incrementos de estas células se dieron también en este grupo, lo cual podría explicar su falta de poder predictivo, ya que incrementos mayores de 200 células sí se mostraron como un buen factor pronóstico de la duración de la respuesta. La no influencia del uso de dos o más nuevos fármacos además de nelfinavir en los pacientes pretratados de esta cohorte, probablemente sólo refleje nuestra impotencia para ofertar nuevos y potentes fármacos en vez de antirretrovirales "reciclados" en pacientes con numerosas mutaciones acumuladas32. Nelfinavir usado como primer IP se ha asociado a una menor incidencia de resistencias cruzadas por su peculiar perfil mutacional (D30N) que haría posibles futuros rescates con indinavir, ritonavir o saquinavir33. Sin embargo, estudios genotípicos y fenotípicos realizados en pacientes en fracaso tratados durante largo tiempo con IP, han mostrado que las resistencias cruzadas que se generan pueden afectar también a futuros rescates con nelfinavir34. En este estudio, la mayoría de los pacientes en fracaso habían recibido previamente uno o más IP durante mucho tiempo antes de cambiar a nelfinavir, lo cual podría explicar en parte la peor evolución de aquellos que iniciaron el rescate con una CVP elevada al inicio y el limitado éxito en mantener una CVP indetectable durante un año (24% de recaída en vírgenes y 49% en pretratados).
A pesar de ello, el beneficio en términos de mejoría clínica e inmunológica fue incuestionable y tal como se ha descrito previamente en otras cohortes, la tasa de nuevos episodios definitorios de sida y de muertes fueron tan sólo una mínima fracción de los registrados durante la época previa a la introducción de la TARGA6-8. Más aún, la mayoría de los episodios observados con la TARGA se produjeron en los primeros meses, lo cual no siempre debe interpretarse como una falta de eficacia, sino más bien una manifestación de infecciones que estaban latentes en pacientes muy inmunodeprimidos. Estos beneficios podrían explicarse por el importante aumento en el recuento de linfocitos CD4+, que se mantuvo a pesar incluso de una respuesta virológica no completa, como ya se ha descrito35. Cuando este estudio se inició, la supresión completa de la replicación viral se consideraba el objetivo principal de cualquier intervención terapéutica16,17. Sin embargo, las recomendaciones más recientes contemplan objetivos más modestos en pacientes pretratados, en los que moderadas reducciones de la CVP se acompañan de evidentes beneficios en la evolución clínica36. Elegir el mejor tratamiento para pacientes con múltiples fracasos previos es el máximo reto al que muchas veces hemos de enfrentarnos en la práctica diaria y nuestros resultados reavivan de nuevo la cuestión sobre si es lícito cambiar un tratamiento bien tolerado ante el único hallazgo de una replicación viral que persiste, en pacientes con opciones terapéuticas futuras muy limitadas.
Finalmente, es preciso reseñar que nuestro estudio presenta algunas limitaciones evidentes. En primer lugar, el seguimiento realizado no permite establecer conclusiones definitivas en los pacientes sin respuesta virológica completa y buena respuesta inmunológica. Los factores que podrían influir en la amplitud del intervalo entre fracaso virológico y posterior descenso del número de linfocitos CD4+ aún no están claramente establecidos y en este sentido se precisan estudios de seguimiento a más largo plazo. Segundo, el dintel que se ha utilizado como "indetectable" no puede considerarse en modo alguno equivalente a una completa supresión de la replicación viral. Se ha demostrado que para lograr una respuesta terapéutica duradera es preciso suprimir la replicación al máximo posible, utilizando técnicas de detección ultrasensibles37,38, lo cual podría explicar la elevada tasa de recaídas observada en este estudio. Tercero, la adhesión al tratamiento no fue uniforme y objetivamente medida en este estudio y la estimación realizada por los médicos que atendían a los pacientes se basó fundamentalmente en las manifestaciones de los propios sujetos y en el número de visitas fallidas. Por lo tanto, la adherencia pudo estar sobrestimada en las declaraciones de los pacientes a sus médicos y algunas interrupciones debidas a un hipotético fracaso virológico (al comprobarse una CVP detectable) podrían haber sido debidas en realidad a un pobre cumplimiento.
En conclusión, este amplio estudio realizado en una población mayoritariamente ADVP demuestra que el índice de fracasos en pacientes vírgenes que inician una TARGA con IP es bastante mayor que el comunicado en los ensayos clínicos. Un régimen que contenga nelfinavir como IP es bien tolerado y permite obtener unos resultados apreciables en pacientes pretratados, al menos durante un tiempo limitado, sobre todo si habían tenido efectos adversos con tratamientos anteriores. En pacientes con un fracaso previo y opciones de rescate viables es preferible el cambio con CVP bajas para evitar en la medida de lo posible el desarrollo de resistencias cruzadas. A pesar de la elevada tasa de recaídas posteriores, la mayoría de los pacientes obtendrán una mejoría clínica e inmunológica mantenida.
Anexo
Los miembros del Grupo Andaluz para el Estudio de las Enfermedades Infecciosas (GAEI) pertenecientes a los hospitales que han participado en este estudio se detallan a continuación:
Hospital Universitario Virgen del Rocío (Sevilla): A. de Alarcón, P. Viciana, L. López-Cortés, R. Luque, M.E. Jiménez-Mejías, J. Palomino, E. Cordero, E. Cañas, J.M. Cisneros, J. Pachón, M. Bernabeu y M.J. Rodríguez.
Hospital Universitario Virgen Macarena (Sevilla): M.A. Colmenero, M.A. Muniaín, A. Domínguez, J. Rodríguez-Baño, F.J. Conde, J.L. Villanueva, M.D. del Toro, J.M. Domínguez, J. Gálvez, E. López-Herrero y M.J. Ríos.
Hospital Universitario Virgen de Valme (Sevilla): F. Lozano, J. Gómez-Mateos, E.V. León y J.E. Corzo.
Hospital Comarcal Virgen de la Merced (Osuna, Sevilla): J. Marín y J. Mesa.
Hospital Clínico San Cecilio (Granada): J. Hernández-Quero, J. Cánora, R. Castillo, J.R. Domínguez, P. García, M.M. Gómez, M.A. Martínez, L. Muñoz, M.E. Troncoso e I. Vargas.
Hospital Virgen de las Nieves (Granada): L. Aliaga, M.A. Ibáñez, M. López, M.A. López, S. Moya, O.M. Balghata, J. Pascuau y B. Valera.
Hospital General Básico Santa Ana (Motril, Granada): V.M. Gutiérrez-Ravé y J.L. Ramos.
Hospital Juan Ramón Jiménez (Huelva): E. Pujol, R. Creagh, D. Merino y F.J. Martínez-Marcos.
Hospital Infanta Elena (Huelva): I. Suárez, A. Menchero, J.M. Fajardo y B. Barón.
Hospital Universitario Puerta del Mar (Cádiz): E. Guzmán, R. Pérez, J. Pastorín, F.J. Guerrero y J.A. Girón.
Hospital Punta de Europa (Algeciras, Cádiz): M. Torres-Tortosa, J. Canueto, I. Moreno y F.J. Caballero.
Hospital Clínico de Puerto Real (Puerto Real, Cádiz): A. Vergara, R. Valiente, I. Trouillet, D. Selma, E. Cruz y M. Cousinou.
Hospital del SAS (Jerez de la Frontera, Cádiz): S. Pérez-Cortés, J.A. Terrón, L. Rodríguez y M.J. Jiménez.
Hospital Universitario Virgen de la Victoria (Málaga): M. Márquez, R. Palacios, A.M. Parra, J. Ruiz, F. Salgado, J. Santos y M. González.
Hospital Costa del Sol (Marbella, Málaga): J. de la Torre, A. del Arco y J.L. Prada.
Miembros de la secretaría de la Sociedad Andaluza de Enfermedades Infecciosas, que han participado activamente en la elaboración del estudio: M. Milla y M.J. Valdayo.