Introducción
Las infecciones de piel y tejidos blandos son las que afectan a piel y anejos cutáneos, tejido celular subcutáneo, fascias y músculo estriado y, junto con las infecciones de vías respiratorias, son las más frecuentes en clínica humana.
Están producidas por una amplia variedad de microorganismos, que forman parte de la microbiota de la piel y de las mucosas o que proceden del medio ambiente. Pueden ser primarias, si aparecen de novo, sin puerta de entrada aparente (p. ej., erisipelas) o secundarias, por rotura de la integridad de la piel1. Si atendemos al momento de aparición de la infección y a su evolución, se pueden separar en agudas y crónicas. Las primeras se producen por un daño externo sobre la piel intacta: los microorganismos penetran a través de soluciones de continuidad en la piel o las mucosas, secundariamente a la aparición de una herida, de una quemadura o de una mordedura (origen exógeno), como complicación de la cirugía (origen endógeno), o se producen desde un foco de infección distante a través de la sangre (diseminación hematógena)2. Las infecciones crónicas están favorecidas por determinados factores del huésped, como el déficit de perfusión, la presión mantenida de la piel sobre prominencias óseas o enfermedades metabólicas como la diabetes. Es el caso de las úlceras vasculares y las úlceras por presión o de la infección del pie diabético. Estas infecciones suelen ser polimicrobianas, con participación de aerobios y anaerobios.
El espectro de este tipo de infecciones abarca desde procesos leves hasta cuadros graves con gran afección sistémica que precisan de una intervención inmediata3.
Tradicionalmente se consideran en potencia patógenos a los estreptococos betahemolíticos, Staphylococcus aureus, Enterococcus spp., Bacillus anthracis, Pseudomonas aeruginosa y otros bacilos gramnegativos tipo Enterobacteriaceae, tanto en las heridas agudas como en las crónicas. No es despreciable la presencia de microorganismos anaerobios en ambos tipos de lesiones (Bacteroides spp., Prevotella spp., Porphyromonas spp. y Peptostreptococcus spp.). La microbiota anaerobia está implicada en un 38-48% de los procesos, según las diferentes series.
Se consideran microbiota habitual algunos microorganismos aerobios (Corynebacterium spp., estafilococos coagulasa negativo, Micrococcus spp., Aerococcus spp., especies de Neisseria spp. no patógenas y estreptococos alfa y no hemolíticos, etc.) y anaerobios (Propionibacterium spp., Clostridium spp., Peptostreptococcus spp.).
La etiología de estas infecciones varía en función del tipo de herida. Staphylococcus aureus es responsable del 43-46% de todas las infecciones de piel y tejidos blandos en enfermos hospitalizados en Estados Unidos y Canadá4,5. También origina el 25-30% de los abscesos cutáneos6,7. La mayoría de estas infecciones son monomicrobianas; sin embargo, en otras series, se describe que el 30-50% de los abscesos cutáneos7, el 50% de las heridas traumáticas8 y el 47% de las infecciones necrotizantes de tejidos blandos9 tienen una microbiota polimicrobiana aerobia y anaerobia.
Las infecciones de las heridas quirúrgicas se relacionan con el tipo de procedimiento empleado. Staphylococcus aureus es el microorganismo más frecuente en cirugía limpia; en la limpia-contaminada y la contaminada predominan las enterobacterias10.
En las infecciones de mordeduras se aíslan microorganismos de la microbiota comensal de la boca del agresor. Son polimicrobianas en el 74% de lo casos, con predominio de S. aureus, Peptostreptococcus spp. y Bacteroides spp. Es característico pero menos frecuente el aislamiento de otros microorganismos como Pasteurella multocida, Capnocytophaga canimorsus, Bartonella henselae y Eikenella corrodens11,12. Las muestras tomadas en las primeras 12 h tras la mordedura presentan el riesgo de aislar los microorganismos comensales de la boca del agresor; su aislamiento puede no ser significativo y no permite predecir si posteriormente se producirá la infección.
La mayoría de las infecciones de quemaduras son bacterianas y monomicrobianas. Los grampositivos muestran escasa tendencia invasiva local y no suelen llegar a la fascia. Por el contrario, los gramnegativos invaden con mayor facilidad los tejidos sanos subyacentes, y producen con frecuencia bacteriemia e infecciones a distancia13. P. aeruginosa y S. aureus son la principal causa de infección.
La etiología de las infecciones de las heridas crónicas, como las úlceras por presión o las úlceras vasculares venosas, es polimicrobiana. S. aureus es el principal patógeno. No obstante, los anaerobios (Peptostreptococcus spp. y bacilos gramnegativos pigmentados y no pigmentados) desempeñan un papel importante. Representan el 30% de todos los microorganismos que colonizan estas heridas y, cuando hay clínica de infección, se aíslan en el 41-49% de los casos.
En cuanto al pie diabético, las infecciones agudas en enfermos sin tratamiento antibiótico previo suelen ser monomicrobianas y en un 80-90% están causadas por cocos grampositivos aerobios (S. aureus y estreptococos betahemolíticos), mientras que las infecciones crónicas o de heridas profundas suelen ser polimicrobianas (90%), sumándose los gramnegativos y los anaerobios. En infecciones crónicas es frecuente aislar entre 3 y 5 microorganismos diferentes en la misma muestra. La patogenicidad de cada uno de ellos resulta difícil de determinar.
En muchas de estas infecciones se ha observado sinergia entre aerobios y anaerobios, lo cual potencia la aparición de infección. Los aerobios consumen O2 y disminuyen el potencial de óxido-reducción, favoreciendo la proliferación de los anaerobios. Algunos aerobios (como S. aureus) producen metabolitos (p. ej., vitamina K) que potencian el crecimiento de determinados anaerobios (entre ellos, Prevotella melaninogenica)14. Por último, ciertos microorganismos (como Escherichia coli, Klebsiella pneumoniae, Bacteroides spp.) producen succinato, que se acumula en los tejidos e inhibe la fagocitosis de S. aureus y E. coli15,16.
El diagnóstico de infección es clínico y no microbiológico17-19. Este último se reserva para los casos en que se precisa conocer la etiología de la infección, bien porque sean de particular gravedad, se sospechen microorganismos menos frecuentes (p. ej., en enfermos inmunodeprimidos), haya habido mala respuesta a tratamientos antimicrobianos previos, o se trate de heridas de larga evolución que no cicatrizan dentro de un período de tiempo razonable.
Diagnóstico microbiológico de las infecciones de piel y partes blandas
Obtención de la muestra
La dificultad que entraña la recogida de muestras de buena calidad para estudio microbiológico es un punto crítico. La muestra debe tomarse de una zona representativa de la infección, en cantidad adecuada y evitando, en lo posible, la contaminación con la flora comensal.
Consideraciones generales
Se recomienda tomar la muestra antes de iniciar un tratamiento antibiótico empírico y únicamente de aquellas lesiones que presenten signos clínicos de infección, que se estén deteriorando o que no cicatricen después de un período de tiempo prolongado.
La toma de muestras debe ir precedida de la limpieza y desinfección del área de la toma. En biopsias y heridas cerradas, se recomienda desinfectar la piel con clorhexidina al 2% o etanol 70°, seguidamente "pintar" con povidona yodada 10%, dejar secar y eliminar el yodo con etanol antes de tomar la muestra. En heridas abiertas, se aconseja eliminar el material necrótico y los tejidos desvitalizados y lavar "a chorro" con suero salino estéril.
Se preconiza tomar muestra de tejido viable infectado, y no de restos superficiales.
La muestra de tejido o la obtenida por aspiración son las mejores desde el punto de vista microbiológico. Aunque, en general, no se recomienda tomar muestras superficiales mediante torunda, es un método sencillo, barato, no invasivo y útil para la mayoría de las heridas abiertas. Se ha cuestionado el procedimiento por la microbiología de la superficie de la herida puede no reflejar exactamente lo que ocurre en su profundidad, y porque pueden aislarse microorganismos de la flora comensal del individuo e incluso microorganismos patógenos que no participan en la infección. Sin embargo, cualquier microorganismo presente en la profundidad de la herida es muy probable que también esté en la superficie17. Además, estas muestras permiten un estudio semicuantitativo que es más fácil de realizar que los estudios cuantitativos, y se ha demostrado que existe una buena correlación entre los cultivos semicuantitativos de torundas y los cultivos cuantitativos de biopsias20-23.
En un estudio en el que se preguntaba a profesionales del cuidado de heridas de Estados Unidos, con una experiencia media de 11 años en este campo, los encuestados contestaron que tratan sin realizar cultivo hasta el 69,7% de las heridas18. El diagnóstico de infección se basaba en datos clínicos en el 98,3% de las ocasiones. Acerca de los motivos para cultivar una herida, el 64,7% manifestó que dependía de la situación de ésta, y el 20,2% que se cultivaban las heridas en que el tratamiento previo había fracasado. Cuando se cultivaban, la muestra se obtenía con torunda en el 53,4% de los casos, con torunda/biopsia en función del tipo de herida en el 41,8%, y mediante biopsia únicamente en el 4,3% de las ocasiones.
Si la muestra se recoge con torunda, siempre que sea posible, se remitirán dos torundas de la misma herida; una se empleará para inocular los medios de cultivo y la otra, para realizar la extensión para tinción de Gram. En caso de recibir una sola torunda se inocularán primero los medios de cultivo y por último se efectuará la extensión para Gram.
Las muestras de trayectos fistulosos no representan la verdadera etiología en casos de osteomielitis subyacente.
En enfermos con infección grave o repercusión sistémica se recomienda, además, extraer hemocultivos3.
La obtención de muestras se detalla a continuación2,24. En el caso de abscesos cerrados, se recomienda aspirar el pus con jeringa y aguja, preferiblemente a través de una zona de piel sana. Si así no se obtiene muestra, se puede inyectar suero salino estéril subcutáneo, e intentar volver a aspirar. Una vez realizada la aspiración, se debe expulsar el aire, tapando la aguja con una gasa estéril impregnada en alcohol para eliminar el riesgo de aerosoles. A continuación, se cambia la aguja por otra estéril y se inocula el contenido, previa desinfección del tapón de goma, en un vial de transporte para anaerobios. Como alternativa, se puede ocluir el cono de la jeringa con un tapón, asegurarlo bien y enviar así la muestra al laboratorio.
En el caso de heridas abiertas, se recomienda muestrear con una torunda un área de aproximadamente 1 cm2 del tejido celular subcutáneo de los bordes de la herida o de la base de la lesión. No es apropiado frotar con fuerza, para evitar el sangrado. En el caso de heridas muy secas, se aconseja mojar la torunda en suero salino estéril antes de la toma. Se recomienda que la torunda sea de alginato. Se enviará en medio de transporte específico (p. ej., Amies/ Stuart/medio de transporte para anaerobios).
En el caso de muestras de pus, se propugna aspirarlo de la zona más profunda de la herida con jeringa y aguja. La muestra se inocula en un vial de transporte para anaerobios, como en el caso de los abscesos cerrados.
En el caso de muestras de tejidos obtenidos mediante curetaje y biopsias, se recomienda obtener suficiente muestra, evitando las zonas necróticas. Estas muestras pueden obtenerse mediante punción-aspiración con aguja fina o con cualquier dispositivo al efecto (p. ej., biopsia con sacabocados, también llamada punch), o mediante procedimiento quirúrgico abierto. En las quemaduras se recomienda realizar dos incisiones paralelas, de unos 1-2 cm de longitud, separadas 1,5 cm; luego, con bisturí y pinzas estériles, se obtendrá una muestra lo suficientemente profunda como para llegar hasta tejido viable. En determinadas heridas (p. ej. quemaduras o heridas crónicas) se aconseja recoger más de una muestra, de diferentes zonas de la herida, porque una única muestra puede no reflejar todos los microorganismos productores de infección. Si los fragmentos son pequeños, se inoculan en un sistema de transporte para anaerobios. Si son más grandes, se introducen en contenedores estériles sobre una gasa estéril, humedecida en suero salino estéril para evitar su desecación. Las biopsias se dividen en dos mitades: una se envía para estudio microbiológico y la otra, para estudio histológico.
Identificación de la muestra, cumplimentación de la hoja de petición y transporte al laboratorio
Esta información se recoge en el apartado 5 del documento técnico del protocolo microbiológico número 1a "Recogida, transporte y procesamiento general de las muestras en el laboratorio de Microbiología" de la SEIMC25.
Además, en la tabla 3 de dicho documento se resumen las condiciones para transporte y conservación de muestras; y en las tablas 4 y 5, los sistemas de transporte para la investigación de microorganismos aerobios y anaerobios, respectivamente.
Los criterios de rechazo se recogen en el aparatado 4 de dicho documento.
Medios de cultivo, reactivos, productos
El laboratorio someterá la muestra a un procesamiento en función de sus protocolos de trabajo y de la información que aporta el servicio solicitante sobre la muestra y el enfermo. Por tanto, el procesamiento dependerá de varios factores:
Petición del servicio solicitante.
Tipo de muestra/técnica de obtención.
Diagnóstico del enfermo/enfermedad de base.
Motivo de la petición.
Cualquier otra información aportada en el volante de la petición.
La frecuencia de aislamiento de flora polimicrobiana en este tipo de muestras y la posibilidad de aislar microorganismos fastidiosos hace necesaria una buena elección de los medios de cultivo.
Medios de cultivo: agar sangre; agar chocolate; agar MacConkey/agar CNA optativos; agar Saboureaud; agar Brucella/agar kanamicina-vancomicina/agar bacteroides-bilis esculina (BBE).
Caldos de enriquecimiento: caldo brain-heart-infusion (BHI); caldo tripticasa-soja (TSB) o caldo tioglicolato. Este último es el más indicado para el aislamiento de anaerobios. El empleo de caldo de enriquecimiento sólo está indicado en las muestras invasivas, en que la carga bacteriana puede ser baja y las características de obtención de la muestra obligan a apurar al máximo las posibilidades diagnósticas. En las muestras no invasivas no parece aportar ventajas y tiene el inconveniente de permitir el crecimiento de los microorganismos contaminantes de ciclo vital más rápido, que no reflejan la situación infecciosa real.
Colorantes para tinción de Gram.
Remitimos al lector al ya citado documento técnico del protocolo microbiológico número 1a de la SEIMC "Recogida, transporte y procesamiento general de las muestras en el laboratorio de Microbiología"25, en cuya tabla 7 se detallan las recomendaciones de medios de cultivo y tinción de Gram para el procesamiento de estas muestras.
Procesamiento de la muestra
El trabajo con muestras biológicas y agentes biocontaminantes requiere, como norma general, la manipulación y el procesamiento de las muestras dentro de dispositivos de seguridad biológica de tipo II, con lo cual se minimiza el riesgo de contaminación tanto del manipulador como de la muestra.
Las muestras se inoculan sucesivamente en los medios de cultivo seleccionados, comenzando por los medios sólidos (primero los medios anaerobios), seguidos de los caldos y finalmente se procede a la extensión sobre portaobjetos para la tinción de Gram. En las muestras remitidas con 2 torundas, una de ellas se empleará para la inoculación de los medios y la otra, para preparar la extensión sobre porta para Gram.
El pretratamiento de las muestras se recoge en la sección 7.2.1. del mencionado documento técnico del protocolo microbiológico número 1a de la SEIMC "Recogida, transporte y procesamiento general de las muestras en el laboratorio de Microbiología"25. La preparación de las extensiones y la inoculación de la muestra en los medios de cultivo se recogen en las secciones 7.2.2. y 7.2.3., respectivamente, de dicho documento, y en el apartado 5.4.2. del procedimiento microbiológico número 22 "Diagnóstico microbiológico de las infecciones de piel y tejidos blandos" de la SEIMC24. Nos interesa señalar los siguientes aspectos:
Cultivo de anaerobios a partir de torundas. Existe controversia acerca de la utilidad de la toma de muestras con torunda para aislamiento de anaerobios. Algunos autores17,26 consideran necesario cultivar todas las muestras de heridas, aunque se recojan con torunda, para aislamiento de anaerobios, siempre y cuando la muestra se envíe en un sistema de transporte adecuado. En el caso de torundas, estos autores consideran que los medios de transporte habituales (p. ej., Amies/Stuart) son válidos si el envío al laboratorio no se retrasa.
Cultivo cualitativo. Se siembra la muestra sobre uno de los cuadrantes de cada placa; con un asa estéril, se realizan estrías desde la zona de descarga (cuadrante 1) por el resto de los cuadrantes de la placa (cuadrantes 2, 3 y 4), tal como se describe en el protocolo 3.3.1. "Procesamiento de muestras para aislamiento de bacterias aerobias", figura 3.3.1-1, del "Manual de Procedimientos en Microbiología Clínica" de la ASM27, y se lleva a cabo la extensión sobre porta para Gram. Las muestras de biopsias y tejidos se homogeneizan previamente en 1-2 ml de caldo de enriquecimiento durante 30 s y se inocula 0,1 ml del homogeneizado en los medios de cultivo, en el caldo y se realiza la extensión sobre porta para Gram.
Cultivo semicuantitativo. En muestras de infecciones de heridas quirúrgicas recogidas con torunda, éstas se siembran como para hacer un recuento cuantitativo de orina (tal como se describe en el protocolo 3.12, "Cultivos de orina", figura 3.12-1a, del "Manual de Procedimientos en Microbiología Clínica" de la ASM)28; es decir, se hace una estría de descarga a lo largo del diámetro de una placa de agar chocolate, que luego se extiende perpendicularmente sobre toda la superficie de la placa con un asa de siembra. Con posterioridad se siembra el resto de placas con la misma técnica descrita para los cultivos cualitativos, y se prepara la extensión sobre porta para Gram. Para el resto de infecciones/resto de muestras, las muestras se inoculan para cultivo semicuantitativo con la misma técnica que se ha descrito para los cultivos cualitativos, inoculando los 4 cuadrantes de una placa de agar chocolate, y por último se prepara la extensión sobre porta para Gram.
Cultivo cuantitativo. Se hace de muestras de tejidos y biopsias. Se pesa la muestra y se homogeniza en solución salina, inoculando en los medios de cultivo 4 diluciones de este homogeneizado (101, 102, 103 y 104), tal como se recoge en el protocolo 3.13.2 "Cultivos cuantitativos de muestras de tejido de heridas", del "Manual de Procedimientos en Microbiología Clínica" de la ASM29. La extensión para Gram se realiza de la dilución 101. Los resultados de los cultivos cuantitativos para anaerobios no han rendido buenos resultados ("Manual de Procedimientos en Microbiología Clínica" de la ASM29).
Las condiciones de incubación de los medios de cultivo se recogen en la sección 7.2.4. del citado documento técnico del protocolo microbiológico 1a de la SEIMC "Recogida, transporte y procesamiento general de las muestras en el laboratorio de Microbiología"25. La temperatura de incubación es de 35-37 °C, y el crecimiento se ve favorecido por una atmósfera enriquecida con CO2. El aislamiento de anaerobios requiere una atmósfera adecuada, bien sea mediante jarras y sobres generadores de atmósfera o con cabinas específicas para incubación de anaerobios.
Valoración de la tinción de Gram y de los medios de cultivo
Las placas y los caldos se leen diariamente, salvo en el caso de las placas incubadas en anaerobiosis, cuya primera lectura no debe realizarse hasta pasadas un mínimo de 48 h de incubación.
En los cultivos semicuantitativos y cuantitativos, el recuento de colonias se efectúa a las 48 h de incubación.
Los medios de cultivo para aerobios se incuban 48 h en el caso de muestras no invasivas y al menos 4 días cuando se trata de muestras invasivas. Los medios de cultivo para anaerobios se incuban durante 7 días. En las heridas de mordeduras, se recomienda incubar las placas durante un mínimo de 7-10 días, ya que algunos patógenos son de crecimiento más lento. Para los microorganismos fastidiosos, el tiempo y condiciones de incubación se adecuan a cada uno de ellos. Si se sospecha actinomicosis, el tiempo de incubación debe ser mayor, por lo general entre 2 y 4 semanas.
Los caldos se incuban durante un mínimo de 4 días. Cuando se observa turbidez, se subcultivan a medios sólidos siguiendo las recomendaciones de la ASM que se recogen en el procedimiento microbiológico número 22 "Diagnóstico microbiológico de las infecciones de piel y tejidos blandos" de la Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica (SEIMC)24.
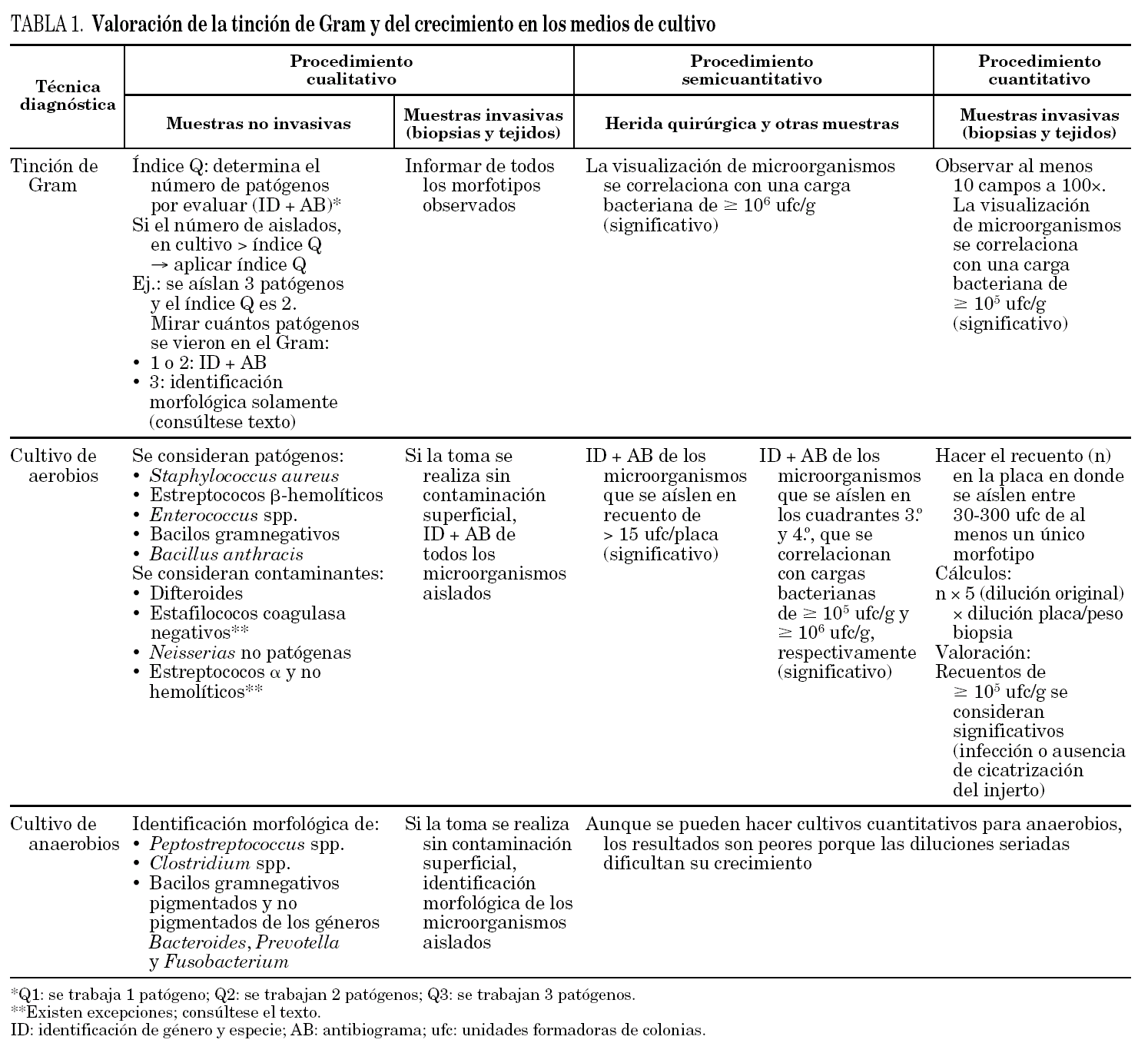
La valoración de la tinción de Gram y del crecimiento en los medios de cultivo se detalla a continuación y se resume en la tabla 1.
La valoración microbiológica de los cultivos cualitativos de muestras no invasivas
La valoración microbiológica de los cultivos cualitativos de muestras no invasivas se inicia con la evaluación de la tinción de Gram y, tras la incubación, se procede a la valoración de los aislamientos en los medios de cultivo.
Valoración del Gram. La tinción de Gram se usa como un método de despistaje para evaluar la calidad de diferentes tipos de muestras clínicas, incluidas muestras respiratorias, orina y muestras no invasivas de heridas. La base científica de esta tinción consiste en que la presencia de polimorfonucleares se considera indicativa de la existencia de inflamación o infección, y la de células epiteliales, indicativa de contaminación superficial de la muestra. Esta tinción también nos ayuda a la hora de decidir cuántos microorganismos se van a trabajar en muestras con cultivos polimicrobianos. Además, la visualización en el Gram de determinados microorganismos puede indicar la realización de procedimientos especiales de trabajo (p. ej., inoculación de la muestra en medios especiales, incubar los medios en determinadas condiciones o prolongar la incubación).
Los cultivos de heridas son difíciles de interpretar, sobre todo cuando son polimicrobianos o la muestra no se ha recogido mediante un procedimiento invasivo. La mayoría de los microbiólogos está de acuerdo en qué microorganismos se consideran patógenos en este tipo de muestras, si bien existe diferencia de opiniones en cuanto a cómo valorar el aislamiento de más de dos o tres de estos patógenos potenciales. Con el objetivo de desarrollar un método normalizado y racional para la evaluación de este tipo de cultivos, Matkoski y cols. han aplicado dos protocolos que se utilizan de forma habitual en la evaluación de muestras de tracto respiratorio inferior, el índice Q (Q score)30 y el índice Q23431, en la evaluación de los cultivos de todo tipo de heridas. La ASM, en el protocolo 3.13.1. "Cultivos de heridas y de tejidos blandos" de su "Manual de Procedimientos en Microbiología Clínica"2, recomienda realizar una tinción de Gram de todas estas muestras y evaluarla de manera muy similar a como se aconseja en el índice Q, por lo que recomendamos este índice y pasamos a describirlo a continuación.
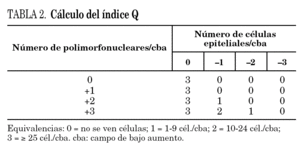
En la extensión teñida con la tinción de Gram se determina el número de células epiteliales (puntúan negativamente) y de polimorfonucleares (puntúan positivamente) por campo de bajo aumento (cba; ×10), y se calcula el índice Q con ayuda de la tabla 2.
Valoración de los cultivos cualitativos. El índice Q es el valor numérico que se obtiene en la tabla, e indica el número de patógenos que se deben evaluar (identificación y antibiograma) en muestras no invasivas.
En este índice se consideran potencialmente patógenos los siguientes microorganismos: S. aureus, estreptococos betahemolíticos, Enterococcus spp., bacilos gramnegativos y Bacillus anthracis.
Se consideran flora habitual: difteroides, estafilococos coagulasa negativos, especies de Neisseria spp. no patógenas y estreptococos alfa y no-hemolíticos.
Cuando la muestra es de buena calidad (Q3), se identifican y se hace antibiograma de hasta 3 microorganismos que se consideren patógenos potenciales. Si el índice es más bajo (p. ej., Q1 o Q2), se identifican y se hace antibiograma de 1 o 2 patógenos potenciales, respectivamente.
Si en el cultivo se aíslan más patógenos de los que indica el índice Q (p. ej., 3 patógenos potenciales en el cultivo y Q2), prevalece el Gram. Se vuelve a mirar el Gram y se cuenta cuántos patógenos se ven. Si se ven 1 o 2, se identifican y se les hace antibiograma. Si se ven 3, sólo se identifican morfológicamente (a nivel de género y especie pero sin antibiograma), pues este número3 está por encima del índice Q, que en este caso es de 2.
Para la identificación morfológica se recomienda emplear las siguientes pruebas microbiológicas: tinción de Gram de la colonia; tipo de hemólisis en agar sangre; fermentación de la lactosa en agar MacConkey; oxidasa; catalasa; coagulasa; serogrupado de estreptococos con látex, y pirrolidonil-arilamidasa.
En determinados casos, como cuando se aísla S. aureus, aun tratándose muestras contaminadas de mala calidad, puede determinarse la sensibilidad a oxacilina, si se considera necesario para el control de la infección nosocomial.
No es aconsejable rechazar o no procesar ninguna muestra sin consultar previamente con el clínico.
La identificación de los anaerobios se hace sólo a nivel de morfotipos bacterianos, según la tinción de Gram, en Peptostreptococcus spp., Clostridium spp. y bacilos gramnegativos, pigmentados o no, de los géneros Bacteroides, Prevotella y Fusobacterium. Es importante recordar que muchos anaerobios grampositivos se vuelven gramvariables tras la exposición al oxígeno. Con la excepción de Clostridium perfringens, el aislamiento de anaerobios se suele informar como "flora mixta aerobia-anaerobia". La identificación a nivel de género y especie se reserva para los aerobios.
En el caso de muestras invasivas (biopsias y tejidos), cuando se procesan de manera cualitativa, y siempre que la toma se haya realizado de manera correcta sin contaminación superficial, no es necesario emplear el índice Q. Se informan todos los morfotipos observados en el Gram y se trabajan (identificación y antibiograma) todos los microorganismos aislados.
La valoración microbiológica de los cultivos semicuantitativos de muestras no invasivas
La valoración microbiológica de los cultivos semicuantitativos de muestras no invasivas también se inicia con la evaluación de la tinción de Gram y, tras la incubación, se procede a la valoración de los aislamientos en los medios de cultivo.
Valoración del Gram. La visualización de microorganismos en el Gram de muestras obtenidas con torunda se correlaciona con una carga bacteriana en el cultivo de ≥ 106 unidades formadoras de colonia (ufc)/g29, y por tanto se deben informar todos los morfotipos bacterianos que se observen.
Valoración del cultivo. El recuento semicuantitativo de una herida quirúrgica se interpreta de la misma manera que los cultivos semicuantitativos de catéteres por la técnica de Maki32. Recuentos de > 15 ufc por placa de un mismo microorganismo son diagnósticos de infección por ese microorganismo, y permiten detectar qué microorganismos son responsables de la infección (porque superan el dintel) y cuáles son meros colonizadores (porque no lo alcanzan). Se trabajan (identificación y antibiograma) únicamente los microorganismos que se recuperen en recuento significativo.
La interpretación de los cultivos semicuantitativos del resto de muestras no invasivas, sembrados por el método de los 4 cuadrantes, se hace de la siguiente manera33: si se observa crecimiento en el primer cuadrante, se correlaciona con un recuento de ≥ 103 ufc/g; si se aprecia en el segundo cuadrante, se correlaciona con un recuento de ≥ 104 ufc/g; si se observa en el tercer cuadrante, se correlaciona con un recuento de ≥ 105 ufc/g, y, por último, si se advierte crecimiento en el cuarto cuadrante, se correlaciona con un recuento de ≥ 106 ufc/g. Se trabajan (identificación y antibiograma) únicamente los microorganismos que se recuperan en recuento significativo (≥ 105 ufc/g).
En ambos casos, los anaerobios se identifican sólo a nivel de morfotipos bacterianos, como hemos mencionado anteriormente.
La valoración microbiológica de los cultivos cuantitativos de muestras invasivas (biopsias y tejidos)
La valoración microbiológica de los cultivos cuantitativos de muestras invasivas (biopsias y tejidos) se inicia, igualmente, con la evaluación de la tinción de Gram y, tras la incubación, se procede a la valoración de los aislamientos en los medios de cultivo.
Valoración del Gram. En el Gram del homogeneizado de la muestra, se recomienda examinar al menos 10 campos con objetivo de gran aumento (100×). La visualización de microorganismos se correlaciona con una carga bacteriana en el tejido de ≥ 105 ufc/g29.
Valoración del cultivo. El recuento cuantitativo se obtiene a partir de la placa de recuento en la que se observe un crecimiento de entre 30 y 300 de, al menos, un único morfotipo bacteriano, tal como se describe en el protocolo 3.13.2, "Cultivos cuantitativos de muestras de tejido de heridas", del "Manual de Procedimientos en Microbiología Clínica" de la ASM29.
Consideraciones generales
Cada laboratorio elegirá las técnicas microbiológicas que aplicar en cada muestra en función de sus disponibilidades.
Los cultivos cualitativos evalúan la flora presente en las heridas con infección clínica o que no cicatrizan adecuadamente. Proveen información sobre la diversidad de microorganismos existentes y sobre la posibilidad de sinergia entre ellos. Los cultivos semicuantitativos y cuantitativos ofrecen información acerca de la densidad o carga bacteriana de la herida. Si se asume que la microbiología de una herida, en términos cualitativos, permanece constante, se ha visto que la probabilidad de infección aumenta a medida que la carga bacteriana se incrementa, hasta un dintel crítico en el que muchos autores consideran que la infección o la ausencia de cicatrización son inevitables.
En cuanto a la tinción de Gram, los resultados de la tinción, en especial cuando la muestra se considera crítica, se deben informar con celeridad. La observación de microorganismos intraleucocitarios es patognomónica de infección por dichos microorganismos.
El índice Q es aplicable a cualquier tipo de heridas abiertas, pues ha demostrado que permite estandarizar y optimizar el procesamiento de muestras de todo tipo de heridas.
Se debe informar de la presencia de microorganismos en la extensión de Gram de las muestras recogidas para cultivo semicuantitativo o cuantitativo, ya que se correlaciona con recuentos bacterianos significativos.
Cualquier aislamiento que pueda tener significado clínico y sea susceptible de reconducir la actitud terapéutica frente al enfermo debe ser informado con la mayor brevedad posible mediante informes provisionales.
Los cultivos cualitativos de muestras no invasivas se evalúan según el índice Q, como hemos descrito con anterioridad. Se valora siempre el crecimiento de microorganismos considerados esencialmente patógenos como S. aureus, estreptococos betahemolíticos y P. aeruginosa, con independencia del índice Q. El aislamiento de estafilococos coagulasa negativos tiene valor microbiológico en aquellas muestras en que se aíslan en cultivo puro, sobre todo en muestras invasivas cuando el Gram es sugestivo de su presencia, en muestras significativas (p. ej., esternotomía) o asociadas a implantes de materiales protésicos y en muestras de enfermos con compromiso del sistema inmune34,35. El aislamiento de estreptococos alfa (grupo viridans) o no hemolíticos, Enterococcus spp. o de bacilos grampositivos se considera significativo cuando se aíslan de muestras invasivas en cultivo puro o claramente predominante y la tinción de Gram sugiere su implicación. Son valorables los aislamientos de bacilos gramnegativos fastidiosos: Brucella spp., Haemophilus spp., Pasteurella spp., Francisella spp., etc. Estos microorganismos son frecuentes en muestras de mordeduras. El aislamiento de levaduras, en principio se considera como flora comensal. Se valora sólo en los casos en que se aíslan en cultivo puro o claramente predominante y en las muestras de localizaciones anatómicas por lo común estériles. El aislamiento de anaerobios se suele informar como "flora mixta anaerobia" o "flora mixta aerobia-anaerobia", con la excepción de Clostridium perfringens.
En cuanto a los cultivos semicuantitativos y cuantitativos, numerosos estudios han demostrado que recuentos bacterianos superiores a 105 ufc por gramo de tejido en una herida (tanto aguda como crónica) son predictores de la existencia de infección o de fallo en la cicatrización en caso de injerto. Se trabajan (identificación y antibiograma) los microorganismos que superen este dintel. La excepción a esta norma son S. aureus, P. aeruginosa y los estreptococos betahemolíticos, que se trabajarán siempre (identificación y antibiograma) aunque no lo superen. Los anaerobios que se aíslen en recuento significativo se identifican sólo a nivel de morfotipos bacterianos, como ya hemos comentado.
El laboratorio debe ser estricto en la valoración microbiológica de los aislados, por cuanto si se emite un informe con el aislamiento (identificación) y determinación de la sensibilidad a los antimicrobianos de uno o más microorganismos, puede interpretarse como diagnóstico de infección y dar lugar a que se administre tratamiento antimicrobiano innecesariamente.
Los cultivos sin aislamientos se informan como "No se aíslan microorganismos".
Consideraciones particulares
En quemaduras infectadas, infecciones del pie diabético y heridas de evolución crónica se recomienda tomar más de una muestra de diferentes zonas de la herida, pues una única muestra puede no reflejar todos los microorganismos causantes de la infección. En las quemaduras, el diagnóstico de infección invasiva requiere el aislamiento de > 105 ufc/g de bacterias y que mediante histología se determine la presencia de microorganismos en la dermis por debajo de la escara y alrededor de los tejidos sanos adyacentes. En las infecciones del pie diabético no se recomienda tomar muestras no invasivas ni realizar cultivos cuantitativos. Para consideraciones más específicas de cada tipo de herida se remite al lector a los protocolos del procedimiento microbiológico número 22 "Diagnóstico microbiológico de las infecciones de piel y tejidos blandos" de la Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica (SEIMC)24.
Correspondencia: Dra. A. Burillo.
Servicio de Microbiología Clínica. Hospital Madrid-Montepríncipe.
Avda. Montepríncipe, 25. 28660 Boadilla del Monte. Madrid. España.
Correo electrónico: burilloa@arrakis.es
Manuscrito recibido el 2-3-2007; aceptado el 2-3-2007.