Introducción
Diez años después de su descripción, Candida dubliniensis se aísla con una frecuencia creciente en todo el mundo, tanto de muestras clínicas orales y vaginales como profundas1-4. La incidencia de C. dubliniensis varía según el tipo de hospital, y se ha comunicado que representa el 3,3% de los aislamientos tradicionalmente identificados como C. albicans5 y el 7% de las candidemias6 en hospitales universitarios.
El aumento del número de aislamientos de C. dubliniensis hace necesaria su correcta identificación en el laboratorio, ya que puede tener implicaciones epidemiológicas y terapéuticas1,7. Sin embargo, la identificación de C. dubliniensis es difícil por la semejanza fenotípica que presenta con C. albicans, lo cual obliga a menudo a realizar pruebas especiales poco asequibles en el laboratorio de Microbiología clínica.
Para la diferenciación entre C. dubliniensis y C. albicans se utilizan tanto pruebas genotípicas como fenotípicas1. Las pruebas genotípicas, que incluyen reacción en cadena de la polimerasa (PCR) con cebadores específicos y el empleo de sondas, se consideran el método más fiable de identificación de C. dubliniensis, aunque, por su sofisticación, no están al alcance de la mayoría de laboratorios. Las pruebas fenotípicas se usan con mayor frecuencia e incluyen el crecimiento a 45 °C, el color de las colonias en medios cromógenos, la producción de clamidosporas, el perfil de asimilación de carbohidratos y la reactividad con anticuerpos anti-C. dubliniensis.
La prueba Bichro-Dubliì (Fumouze Diagnostics, Levallois-Perret, Francia) utiliza un látex sensibilizado con el anticuerpo monoclonal 12F7-F2 que reacciona con un antígeno específico de la superficie de la pared celular de C. dubliniensis8. El objetivo de este trabajo ha sido estudiar la utilidad de esta prueba para la identificación de C. dubliniensis, tanto en cepas de colección como en aislamientos clínicos recientes.
Métodos
Cepas de colección y muestras clínicas
Las cepas utilizadas en este estudio (55 de C. dubliniensis y 20 de C. albicans) procedían de la Colección de Hongos del Departamento de Inmunología, Microbiología y Parasitología, Facultad de Medicina y Odontología, Universidad del País Vasco; Centraalbureau voor Schimmelcultures, Baarn, Holanda (cepas CBS 2747, CBS 8500 y CBS 8501); National Collection of Pathogenic Fungi, Bristol, Reino Unido (cepa NCPF 3949), y la Colección Española de Cultivos Tipo, Valencia, España (cepa CECT 11473). La identidad de las cepas de colección se confirmó por el perfil de asimilación de azúcares con la prueba API ID 32C (bioMérieux, Marcy-l'Etoile, Francia) y por PCR con cebadores específicos basados en la secuencia de la ADN topoisomerasa II9. Los cuatro genotipos descritos en C. dubliniensis se determinaron de acuerdo con la técnica descrita por Brena et al9. La utilidad de Bichro-Dubliì para diferenciar C. dubliniensis de C. albicans en aislamientos clínicos se estudió con 135 aislamientos de 135 muestras clínicas (69 respiratorias, 25 urinarias, 12 orofaríngeas, 9 genitales, 6 cutáneas, 6 esofágicas, 3 de hemocultivos, 2 óticas, 1 peritoneal, 1 de absceso, 1 de punta de catéter) recibidas en la Unidad de Micología del Servicio de Microbiología del Hospital Universitario La Fe, en las que crecieron colonias de color verde en CHROMagar Candida (CHROMagar, París, Francia).
Bichro-Dubliì
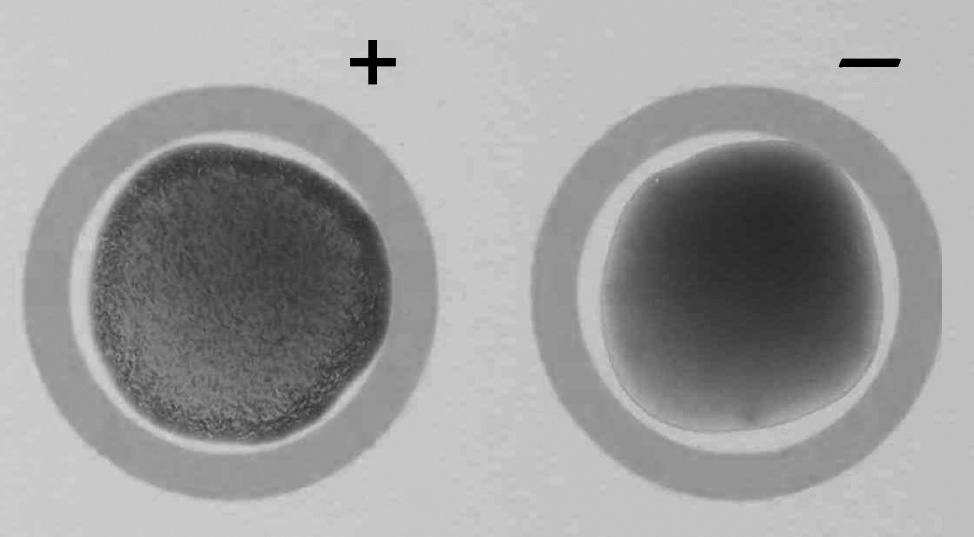
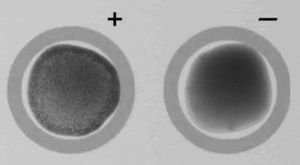
La identificación de C. dubliniensis con la prueba Bichro-Dubliì se realizó siguiendo las instrucciones del fabricante. Brevemente, 2-3 colonias de color verde de cada aislamiento se resuspendieron durante 3-5 min en 20 μl del reactivo de látex con un palillo desechable. En la reacción positiva, las bolas de látex aglutinadas se desplazan progresivamente hacia la periferia, formando un anillo azul que deja el centro de la preparación de color rosado. En la reacción negativa no existe aglutinación y el reactivo mantiene el color púrpura original (fig. 1). La identidad de los aislamientos identificados por la prueba Bichro-Dubliì como C. dubliniensis se confirmó por los métodos fenotípicos y genotípicos mencionados en el apartado anterior.
Figura 1. Resultado positivo (+) y negativo () con la prueba Bichro-Dubliì.
Resultados
La prueba Bichro-Dubliì fue positiva en 54 de las 55 cepas de C. dubliniensis de colección (sensibilidad 98,2%) y negativa en las 20 cepas de C. albicans de referencia (especificidad 100%). Los cuatro genotipos de C. dubliniensis fueron positivos con la prueba Bichro-Dubliì, aunque la aglutinación de las cepas del genotipo 4 era más lenta. Bichro-Dubliì identificó 4 aislamientos de C. dubliniensis en las 135 muestras clínicas que habían dado colonias verdes en CHROMagar Candida. Sin embargo, esta identificación no habría sido posible por el color de las colonias, ya que las 4 cepas de C. dubliniensis, aisladas en un lavado broncoalveolar, un esputo y dos frotis orales, dieron lugar a colonias de color verde que eran indistinguibles de las producidas por C. albicans.
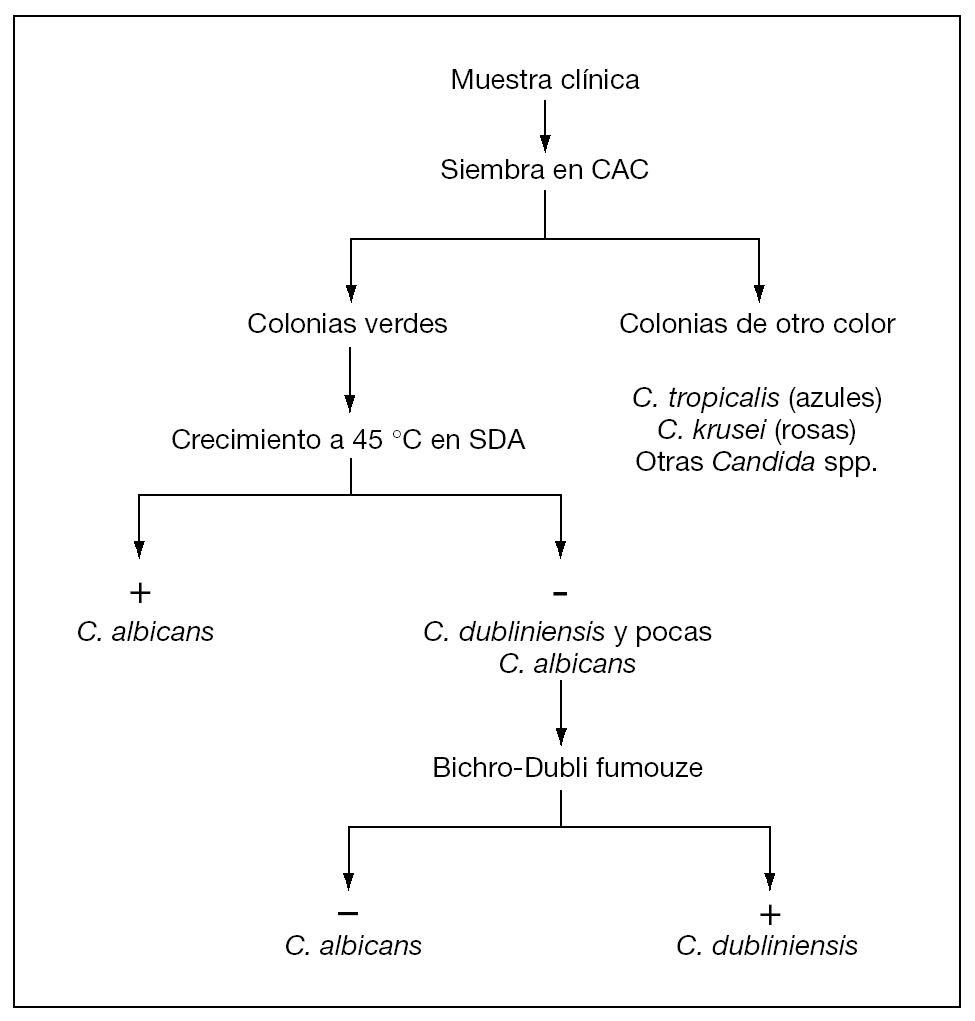
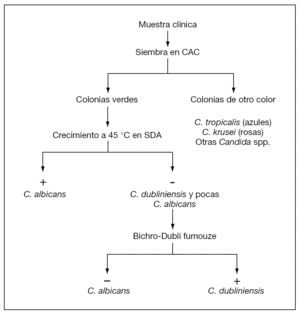
Dada la baja incidencia de C. dubliniensis, y en un intento de ahorrar costes evitando tener que realizar la prueba Bichro-Dubliì a todos los aislamientos que dan color verde en CHROMagar Candida, se propone un algoritmo para la identificación de C. dubliniensis en el laboratorio de Microbiología Clínica (fig. 2). Según este algoritmo, las colonias de color verde en CHROMagar Candida se siembran a 45 °C en agar glucosado de Sabouraud durante 24 h y los aislamientos que no crezcan se consideran de forma presuntiva de la especie C. dubliniensis, realizándose la identificación definitiva con la prueba Bichro-Dubliì.
Figura 2. Algoritmo para la identificación de C. dubliniensis combinando el color de las colonias en CHROMagar Candida (CAC), el crecimiento a 45 °C en agar glucosado de Sabouraud (SDA) y la prueba Bichro-Dubliì.
Discusión
La diferenciación rápida y sencilla entre C. dubliniensis y C. albicans es difícil, ya que las técnicas más fiables requieren métodos genotípicos1. La utilización de medios cromógenos como el CHROM-Pal10 o especiales como el agar caseína11 permite esta diferenciación, pero no se utilizan habitualmente en los laboratorios de Microbiología Clínica. El crecimiento a 45 °C puede utilizarse para diferenciar C. dubliniensis y C. albicans, ya que C. dubliniensis no crece a 45 °C12. Sin embargo, aunque la mayoría de los aislamientos de C. albicans crece a 45 °C, se ha demostrado que el 36% de los aislamientos de C. albicans no crece a esa temperatura13.
Una prueba como Bichro-Dubliì, basada en la aglutinación de partículas de látex, puede ser más utilizada en los laboratorios de Microbiología Clínica por su sencillez. Los resultados presentados en este estudio confirman estudios previos8,14 y ponen de manifiesto que la prueba Bichro-Dubliì permite la diferenciación rápida y sencilla entre C. dubliniensis y C. albicans. Esta prueba es más barata (2,5 €/prueba) que la identificación por PCR con cebadores específicos (3,8 €/prueba). Sin embargo, dada la baja prevalencia de C. dubliniensis en las muestras clínicas, la aplicación del Bichro-Dubliì a todos los aislamientos de C. albicans puede resultar costosa.
Dada la amplia utilización de CHROMagar Candida en muchos laboratorios para el aislamiento e identificación presuntiva de levaduras y la incapacidad de C. dubliniensis para crecer a 45 °C, Bichro-Dubliì podría utilizarse para diferenciar C. dubliniensis y C. albicans entre aquellos aislamientos que den colonias de color verde en CHROMagar Candida y no crezcan a 45 °C. Bichro-Dubliì también podría ser de utilidad en la detección directa de C. dubliniensis en botellas de hemocultivo, como ha sido propuesto para C. albicans15.
Agradecimientos
Este trabajo ha sido financiado con los proyectos G03/075, RESITRA; PI050511, Infección y trasplante. Consolidación de Resitra en el marco Retics. Explotación de la cohorte Resitra, del Fondo de Investigación Sanitaria del Ministerio de Sanidad y Consumo y 9/UPV 0093.327-13550/2001 de la Universidad del País Vasco.
Correspondencia: Dr. J. Pontón.
Departamento de Inmunología, Microbiología y Parasitología.
Facultad de Medicina y Odontología. Universidad del País Vasco.
Apartado 699, 48080 Bilbao. Vizcaya. España.
Correo electrónico: jose.ponton@ehu.es
Manuscrito recibido el 14-7-2006; aceptado el 29-1-2007.