Introducción
Streptococcus pneumoniae participa en múltiples procesos infecciosos tanto invasivos (sepsis, meningitis) como no invasivos (infecciones del tracto respiratorio, conjuntivitis). Es el patógeno bacteriano asociado más frecuentemente a neumonía adquirida en la comunidad. A pesar de las mejoras del tratamiento, se describen tasas de mortalidad de hasta el 20% en pacientes adultos con bacteriemia1.
Los macrólidos se han considerado durante las últimas décadas una alternativa al uso de las penicilinas para infecciones por este microorganismo. En la actualidad se observa, en nuestro país, un continuo incremento en las resistencias a macrólidos para S. pneumoniae (21,4% según datos del European Antimicrobial Resistance Surveillance System [EARSS]2; 31,2% según el estudio PROTEKT3). La comercialización de macrólidos con mejores pautas de administración (claritromicina y azitromicina) ha contribuido en gran medida a su uso generalizado, circunstancia que se asocia al incremento continuado de las resistencias.
La resistencia a macrólidos en S. pneumoniae se debe a tres mecanismos principales: a) metilación del ARN ribosómico 23S en el nucleótido de la diana de la eritromicina, codificado por los genes erm; b) bombas de expulsión, codificadas por los genes mef; y c) mutación en el ARN ribosómico 23S o en las proteínas ribosómicas L4 o L224. El primer mecanismo, el más frecuente en Europa5-7, se relaciona con resistencia de alto nivel a eritromicina (concentración mínima inhibitoria [CMI] ≥ 64 μg/ml) y otros macrólidos, lincosamidas y estreptograminas tipo B (fenotipo MLSB). El segundo mecanismo parece ser más frecuente en Norteamérica8,9 y se relaciona con resistencia de nivel medio a eritromicina (CMI: 1-32 μg/ml) y sensibilidad a macrólidos de más de 14 átomos, lincosamidas y estreptograminas B (fenotipo M). El tercer mecanismo es muy poco común. El diferente nivel de resistencia a eritromicina según su mecanismo genético podría generar distintas actitudes y cierta incertidumbre en cuanto a las indicaciones de los macrólidos en S. pneumoniae resistentes10.
Se ha desarrollado una nueva familia de antibióticos para evitar estos mecanismos de resistencia, los ketólidos (telitromicina, cetromicina), relacionados estructural y funcionalmente con los macrólidos. No parecen ser susceptibles a ninguno de los mecanismos citados, debido a su escasa actividad inductiva, aunque se describe alguna cepa resistente a telitromicina relacionada con mutaciones en las proteínas ribosómicas L4 o L224.
El objetivo de nuestro trabajo fue conocer la prevalencia, en Gran Canaria y Lanzarote, de la resistencia a macrólidos en S. pneumoniae, sus mecanismos genéticos de resistencia, su frecuencia relativa, su relación con los serogrupos y la corresistencia asociada, a partir de aislados de muestras clínicas, tanto invasivas como no invasivas, así como conocer el estado de sensibilidad de estas cepas a la telitromicina.
Material y métodos
Aislamientos
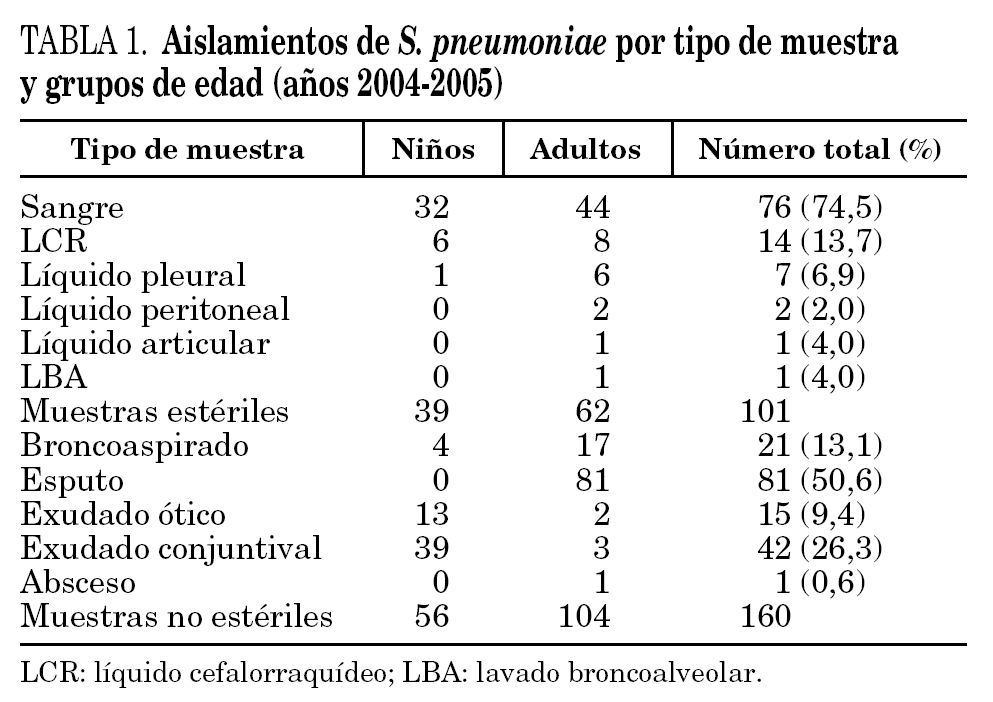
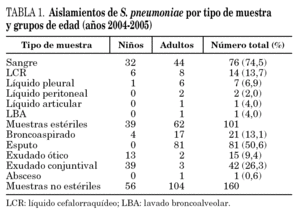
Las cepas de S. pneumoniae estudiadas se obtuvieron de muestras clínicas recogidas durante dos años (de enero 2004 a diciembre 2005) en el Hospital Universitario de Gran Canaria Dr. Negrín, Hospital Universitario Materno-Infantil de Gran Canaria y Hospital General de Lanzarote, que atienden en conjunto una población de 577.502 habitantes, incluida la totalidad de la población pediátrica. Las cepas se agruparon en invasivas y no invasivas (tabla 1). Del Hospital General de Lanzarote se estudiaron únicamente cepas invasivas.
Identificación y serogrupado
La identificación de S. pneumoniae se llevó a cabo por la observación de colonias alfahemolíticas umbilicadas en agar sangre y sensibles a optoquina. En casos dudosos se identificó la especie por la determinación de la solubilidad en bilis y la aglutinación con partículas de látex revestidas de antisuero específico (Pneumo-Kit Slidex Test, bioMérieux, Marcy l'Etoile, Francia). El serogrupo se asignó mediante aglutinación con látex con antisueros específicos (Pneumotest-Latex, Statens Serum Institut, Copenhague, Dinamarca).
Pruebas de susceptibilidad antibiótica
Para las cepas no invasivas se realizó antibiograma por técnica de difusión en agar según normas del Clinical and Laboratory Standard Institute (CLSI)11. Los antibióticos incluidos fueron: penicilina G, cefotaxima, eritromicina, clindamicina, levofloxacina, vancomicina, teicoplanina, rifampicina, cloranfenicol, tetraciclina y cotrimoxazol. En los aislados con sensibilidad reducida a eritromicina se midió la CMI para este antibiótico por E-Test® (AB-Biodisk, Solna, Suecia). Para las muestras invasivas se realizó sistemáticamente antibiograma por E-Test® para los antibióticos descritos previamente, además de quinupristina-dalfopristina y linezolid. Los resultados de sensibilidad se informaron siguiendo los criterios descritos por el CLSI. Para telitromicina, las pruebas de sensibilidad se efectuaron por técnica de difusión disco-placa.
Determinación de fenotipos de resistencia a macrólidos
Se realizó según el test de inducción con discos de eritromicina (15 μg) y clindamicina (2 μg) separados 20 mm entre sí, en medio de Müller-Hinton con sangre (5%)10,12. Se determinaron cuatro fenotipos posibles de acuerdo con los resultados del test: a) fenotipo S (eritromicina y clindamicina sensibles); b) fenotipo M (eritromicina resistente y clindamicina sensible sin achatamiento del halo de inhibición de la clindamicina); c) fenotipo MLSB inducible (eritromicina resistente y clindamicina sensible con achatamiento del halo de inhibición de la clindamicina), y d) fenotipo MLSB constitutivo (eritromicina y clindamicina resistentes, sin ningún tipo de achatamiento de halo de inhibición).
Determinación del mecanismo genético de resistencia a macrólidos
La detección de ADN específico por técnica de reacción en cadena de la polimerasa (PCR) para los genes de ermB y mefA/E se realizó según los primers y condiciones descritos por Amezaga et al12.
Se definió enfermedad invasiva por neumococo (EIN) en todo paciente con aislamiento de S. pneumoniae en sangre, líquido cefalorraquídeo (LCR), líquido pleural, líquido articular, líquido pericárdico, lavado broncoalveolar (LBA) o líquido peritoneal. Se definió corresistencia a la detección de resistencia a eritromicina y, al menos, otro tipo de antibiótico no macrólido.
Resultados
En el período comprendido entre enero de 2004 y diciembre de 2005, se aislaron 275 cepas de S. pneumoniae (una cepa por paciente) con significación clínica, 14 de las cuales no se pudieron recuperar, por lo que el estudio se realizó sobre un total de 261 cepas. Bacteriemia (76) y meningitis bacteriana aguda (14) cubrían el 89,2% de los casos de las cepas aisladas a partir de muestras estériles. En las cepas no invasivas, obtenidas exclusivamente en pacientes de la isla de Gran Canaria, predominaron las cepas aisladas a partir de procesos respiratorios (63,5%) (tabla 1).
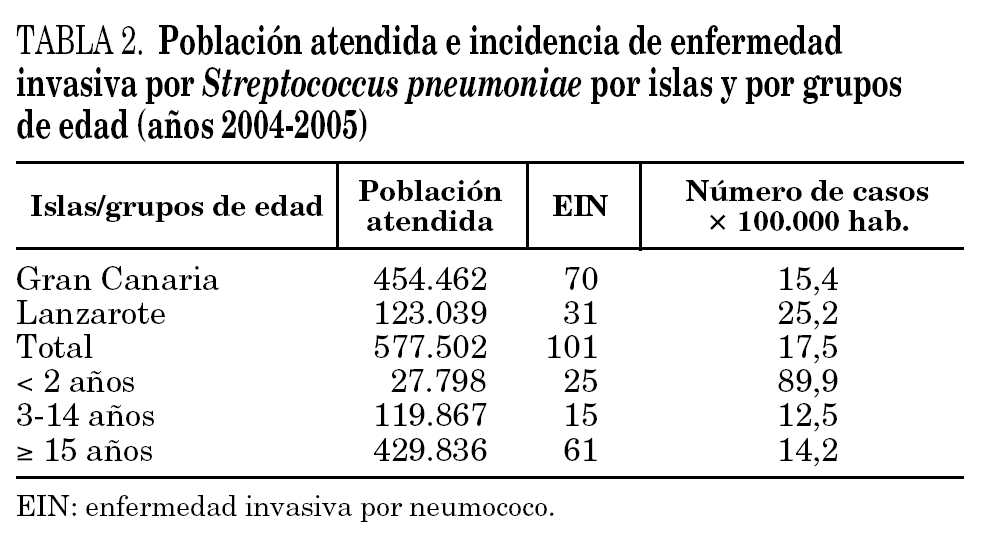
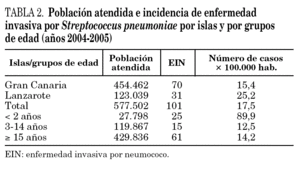
Se aisló un total de 101 cepas invasivas de S. pneumoniae, lo que corresponde con una incidencia global de EIN del 17,5 × 100.000 habitantes. Analizando la incidencia de EIN por grupos de edad, destacamos el grupo de niños menores de 2 años, con una incidencia de 89,9 casos × 100.000 habitantes (tabla 2).
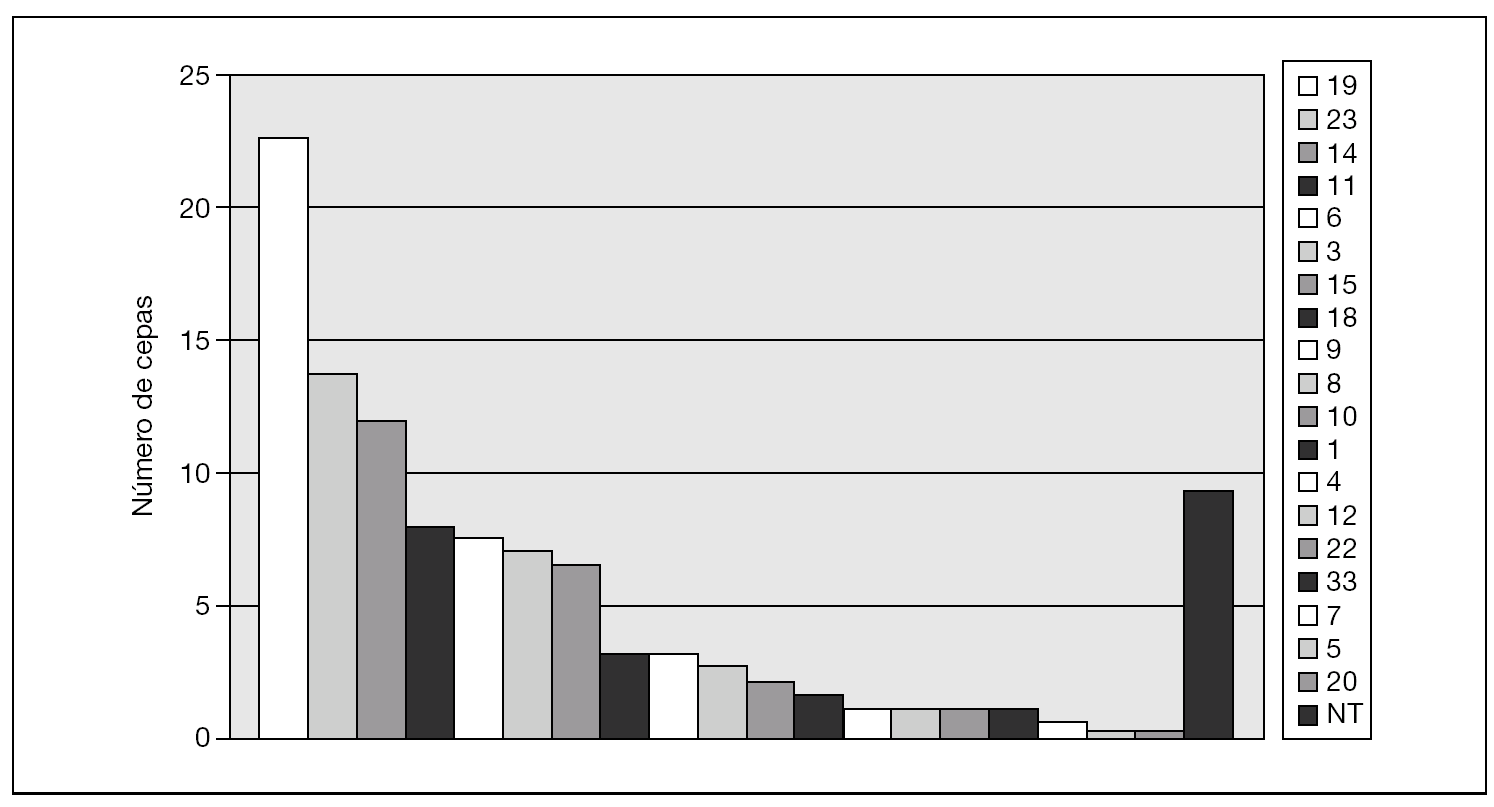
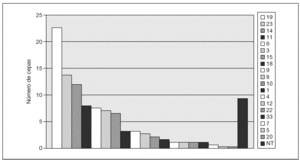
La figura 1 muestra los serogrupos más prevalentes: 19 (23 cepas: 22,8%), 23 (14 cepas: 12,3%) y 14 (12 cepas: 10,7%). Se observaron diferencias de serogrupos entre las islas en EIN: en Lanzarote, el serogrupo 14 fue el más frecuente (25,8%), seguido del 19 (16,1%), 18 y 23 (ambos con 12,9%). Por el contrario, en Gran Canaria los serogrupos más frecuentes fueron el 19 (32,3%), el 6 (12,8%) y el 3 (8,6%) (fig. 2).
Figura 1. Serogrupos detectados en el total de aislamientos de Streptococcus pneumoniae (años 2004-2005).NT: no tipables.
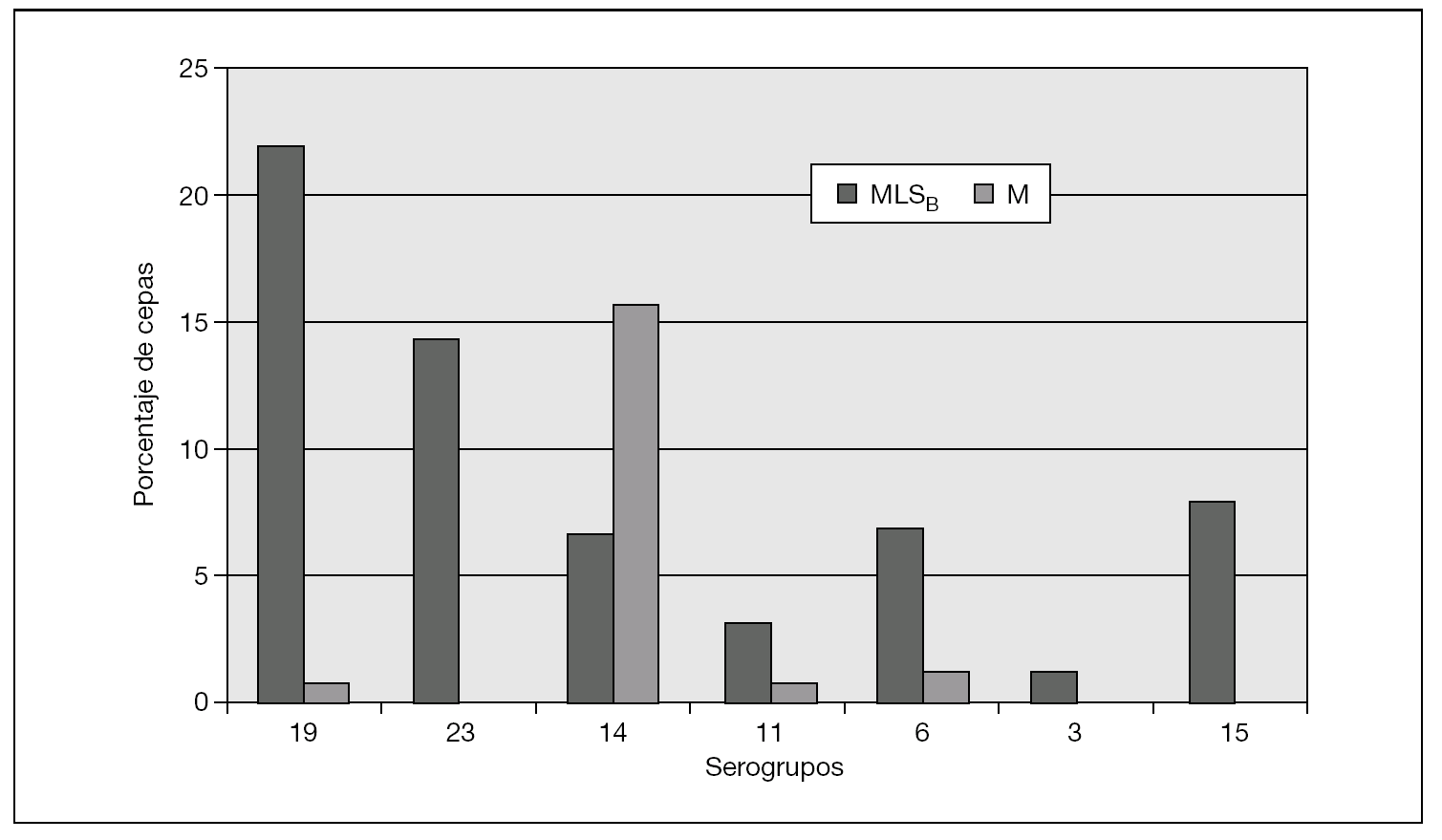
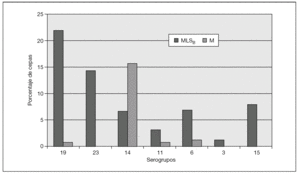
Figura 2. Frecuencia relativa de fenotipos de resistencia en los serogrupos de Streptococcus pneumoniae resistentes a macrólidos (años 2004-2005).
El 59,4% de las cepas (155) fue sensible a los macrólidos. No se detectó gen ermB ni mefA/E, excepto en un caso de bacteriemia por una cepa del serogrupo 8 con CMI para eritromicina de 0,19 μg/ml y repetidamente positivo para el gen mefA/E.
El 40,6% de las cepas (106) de S. pneumoniae fue resistente a macrólidos.
El 79,2% (84) de las cepas resistentes a macrólidos presentaba fenotipo de resistencia MLSB constitutivo, con CMI para eritromicina ≥ 64 μg/ml (64 a > 256 μg/ml). En todos los casos se detectó el gen ermB, excepto en una cepa del serogrupo 11 con CMI para eritromicina > 256 μg/ml (repetidamente negativa para los genes ermB y mefA/E). En 7 cepas, además del gen ermB, se detectó el gen mefA/E, con expresión de tipo MLSB constitutivo. Todas ellas fueron del serogrupo 19 y se localizaron en la isla de Gran Canaria, sin aparente relación entre los pacientes. En el resto de las cepas con fenotipo MLSB constitutivo, no se detectó el gen mefA/E. No se detectó ninguna cepa con fenotipo MLSB inducible.
El 20,8% de las cepas (22) con resistencia a macrólidos presentó fenotipo de resistencia M, con CMI para eritromicina ≤ 32 μg/ml (rango de 1 a 32 μg/ml). En 17 cepas (77,3%) se detectó el gen mefA/E. En 5 cepas con CMI de 2, 4, 12, 16 y 16 μg/ml, la detección del gen mefA/E fue repetidamente negativa. Procedieron de cepas de los serogrupos 14 (dos cepas), 9, 19 y no tipable. En ninguna cepa con fenotipo M se detectó el gen ermB.
En la distribución de resistencias a macrólidos por serogrupos, expresaron predominio de fenotipo MLSB los serogrupos 3, 6, 11, 15, 19 y 23. Por el contrario, el fenotipo M predominó exclusivamente en el serogrupo 14. Destacamos los datos del serogrupo 14, con el 82,1% de cepas resistentes (14 con mefA/E, 7 con ermB y 2 desconocido); el serogrupo 19, con el 51,8% de las cepas resistentes (27 con ermB, 7 con mefA/E y 1 desconocido), y el serogrupo 23, con el 43,7% de cepas resistentes (14 con ermB). Por el contrario, en el serogrupo 3 tan sólo encontramos un 11,8% de resistencias (2 cepas de 17 con ermB) y en el serogrupo 11, el 21% (4 cepas de 19, 3 con ermB y 1 con mefA/E).
Refiriéndonos únicamente a las 101 cepas invasivas, la distribución de resistencias para los diversos serogrupos por islas se indica en la tabla 3. Para la isla de Gran Canaria, destacamos el predominio del fenotipo MLSB que implicaba fundamentalmente al serogrupo 19. En Lanzarote predominó el fenotipo M, implicando en exclusiva al serogrupo 14.
El 66,7% de las cepas con resistencia única a macrólidos era del serogrupo 14. El 67,1% de las cepas corresistentes con penicilina G y cotrimoxazol también pertenecía al serogrupo 14. La combinación más frecuente de corresistencia fue con penicilina G, cotrimoxazol y tetraciclina, en el 38,4%, afectando fundamentalmente a los serogrupos 19, 6 y 14. El 50% de las cepas con corresistencia para penicilina G y tetraciclina, y el 36,8% de las cepas con la corresistencia para penicilina G, cotrimoxazol y tetraciclina, pertenecían al serogrupo 19.
Encontramos 5 cepas (1,9%) resistentes a levofloxacina, de los serogrupos 23 (2 cepas), 6, 11 y 19. Únicamente detectamos 2 cepas (0,8%) resistentes a telitromicina, procedentes de un líquido pleural y un hemocultivo. Ambas cepas poseían el gen ermB y pertenecían al serogrupo 19. Además, fueron resistentes a eritromicina, penicilina G, cotrimoxazol y tetraciclina.
Discusión
La técnica de referencia para el serotipado de S. pneumoniae es la reacción de quellung (prueba de Neufeld); sin embargo, este método es relativamente complicado de realizar y requiere cierto nivel de experiencia, por lo que no se utiliza en los laboratorios asistenciales habituales y se circunscribe a laboratorios de investigación o de referencia. El Statents Serum Institut (Copenhague, Dinamarca) diseñó un test de aglutinación con partículas de látex (Pneumotest Latex Kit) con un 95,5% de correlación con serogrupos comparado con la técnica de referencia13. Según esa técnica, el serogrupo más prevalente en Gran Canaria fue el 19 (32,8%), seguido de los serogrupos 6 y 9 (12,8% cada uno). Estos datos en cuanto a frecuencia de serogrupos son similares a los detectados a nivel nacional. Franco-Álvarez et al14 describen como serogrupos más frecuentes el 19 (15%), el 6 (11%) y el 3 y 23 (6%). Sin embargo, la prevalencia de serogrupos en Lanzarote se distancia de manera llamativa de la media, tanto nacional como de la isla de Gran Canaria, donde el serogrupo más frecuente es el 14 (25,8%), seguido del 19 (16,1%) y el 3 y 23 (12,9% cada uno). La diversidad y frecuencia de serogrupos es muy variable en el tiempo y por áreas geográficas, de tal manera que en los países mediterráneos, se describe un predominio en EIN de los serogrupos 19, 6, 9, 23, 14 y, en ocasiones, 3 y 1815,16. En los países escandinavos, Reino Unido, Estados Unidos y algunas áreas de Canadá, se describe como más prevalente en EIN el serogrupo 1417-19. Las razones epidemiológicas del predominio del serogrupo 14 en la isla de Lanzarote nos son desconocidas, pero se puede plantear como hipótesis más plausible la introducción de un clon de este serogrupo en la isla y su expansión en la población. Esto ya fue demostrado por Henriques et al en un estudio colaborativo sobre epidemiología molecular de las EIN con un clon del serogrupo 14 en Suecia20. En las áreas donde predomina este serogrupo, la mayoría de las cepas invasivas pertenecen al clon England9-14. El estudio epidemiológico por electroforesis en gel de campos pulsantes (PFGE) y por Multilocus sequence typing (MLST) de estas cepas clarificaría la identidad clonal de las mismas.
En nuestro estudio encontramos una tasa de resistencia a macrólidos del 40,6%. En un estudio colaborativo a nivel nacional realizado por García Rey et al a partir de datos de resistencia a neumococo del año 1999, encontraba para la provincia de Las Palmas tasas de resistencia a eritromicina del 42,7%21.
Por mecanismos de resistencia, sobre el total de cepas resistentes a eritromicina, el 79,2% se comportó como fenotipo MLSB y en todas excepto una se detectó gen ermB. Morosini et al en un estudio prospectivo a nivel nacional para caracterizar los mecanismos de resistencia a macrólidos en S. pneumoniae, encontraron en un 93,6% de las cepas resistentes el gen ermB22. Pérez-Trallero et al encontraron un 95% de cepas resistentes a eritromicina con fenotipo MLSB, descartando precisamente las cepas de Las Palmas6. Es decir, los datos registrados en el total del Estado parecen ser más altos que los referidos para Canarias, situación que se confirma en nuestro estudio. Siete casos con fenotipo MLSB presentaron al mismo tiempo los genes ermB y mefA/E, y fueron todos del serogrupo 19. Estos datos ya fueron encontrados por Waites et al en Corea del Sur, donde observaron que el 76% de los aislados resistentes a macrólidos que presentaban el gen ermB y el gen mefA eran del serotipo 19F23. Farrell et al, estudiando 1.043 cepas de neumococo resistentes a macrólidos procedentes de 24 países como parte del estudio PROTEKT (1999-2000), encontraron 71 con los genes ermB, mefA y msrA, siendo el 85,5% de los serotipos 19A o 19F24.
Como fenotipo M se expresaron el 20,8% de nuestras cepas resistentes a eritromicina, datos más altos de los hallados a nivel nacional por diversos autores; Morosini et al sólo encuentran un 2,4% de las cepas resistentes con expresión fenotípica M y portadoras del gen mefA22; Pérez-Trallero et al encontraron un 5% de cepas con las mismas características6. Sin embargo, en ese trabajo ya se afirmaba que en las cepas remitidas desde Gran Canaria el fenotipo M estaba presente en el 20% de los casos. En nuestro estudio, de las cepas que expresaron resistencia como fenotipo M, en el 77,3% (17/22) se detectó el gen mefA/E. En las 5 cepas restantes no se detectó el gen mefA/E. A pesar de la alta homología entre los genes mefA y mefE, es posible que por problemas de sensibilidad o por los primers utilizados, tuviéramos dificultad para detectar genes mef distintos del gen mefA. Así, en Norteamérica parece predominar el gen mefE y en Europa Occidental, el gen mefA24,25. En el estudio de McEllistrem et al, de 349 cepas resistentes a eritromicina aisladas en el área metropolitana de Baltimore, un 73,1% fueron portadoras del gen mefE y tan sólo un 1,7% del gen mefA8. Wierzbowski et al en Manitoba (Canadá), en un estudio de cepas resistentes a eritromicina (años 1997-2002), encuentran un 95% de cepas portadoras únicamente del gen mefE y un 5% con el gen mefA9.
Si nos referimos exclusivamente a las cepas causantes de EIN, un aspecto llamativo en nuestro estudio fue el diferente perfil de mecanismo de resistencia a los macrólidos por islas, de tal manera que en Gran Canaria dicho perfil fue el previsible y ya referido por otros autores26,27. Sin embargo, en Lanzarote, aun siendo pocos casos, el perfil de resistencia fue más propio de países anglosajones o nórdicos que de países mediterráneos (incluido el resto de España), con fenotipo M en el 80% de las cepas, todas del serogrupo 14. Excepto una, todas presentaban el gen mefA/E. Esta asociación entre fenotipo M, gen mefA/E y serogrupo 14, es ampliamente reconocida en la bibliografía especializada9,19.
El perfil de resistencia y corresistencia de nuestras cepas en relación con los serogrupos está de acuerdo con lo referido previamente. La presencia aislada de resistencia a macrólidos se asocia con el serogrupo 14. Littauer et al encontraron que el 92,3% de las cepas con resistencia única a macrólidos pertenecía al serogrupo 1419; en nuestro estudio fue del 66,7%. La corresistencia con penicilina G y cotrimoxazol, que en nuestro estudio fue del 67,1%, está frecuentemente asociada con el fenotipo M y el serogrupo 149. De la misma manera, la corresistencia con penicilina G, tetraciclina y cotrimoxazol se asocia con el serogrupo 19 (en concreto con el serotipo 19F)25. En nuestro estudio, para el serogrupo 19, los datos obtenidos fueron del 36,8%.
En conclusión, en este trabajo aportamos la situación actual de la resistencia a los macrólidos en las cepas de Streptococcus pneumoniae, aisladas en las islas de Gran Canaria y Lanzarote y su relación con los serogrupos. Se constata una situación diferente a la del resto del país, destacando el papel del fenotipo M en general (20,8%) y en particular en la isla de Lanzarote para cepas causantes de EIN (80%), con una estrecha relación entre fenotipo M, gen mefA/E y serogrupo 14. Como hallazgo significativo destacamos la detección de un grupo de cepas del serogrupo 19 con presencia de los genes ermB y mef A/E. La relación entre serogrupo y corresistencia fue similar a la de otras áreas geográficas.
Agradecimientos
Agradecemos la inestimable colaboración de los técnicos especialistas de laboratorio Laura Cardona Reyes y Dunia Montesdeoca Molina.
Correspondencia: Dra. I. Horcajada-Herrera.
Servicio de Microbiología. Hospital Universitario de Gran Canaria.
Dr. Negrín Barranco de la Ballena, s/n.
35010 Las Palmas de Gran Canaria. España.
Correo electrónico: horcajadaherrera@yahoo.es
Manuscrito recibido el 18-9-2006; aceptado el 22-2-2007.