Infecciones en el trasplante cardíaco
El trasplante cardíaco (TC) es una alternativa terapéutica para pacientes con cardiopatías terminales no tratables médicamente, con mala calidad de vida y un riesgo elevado de muerte precoz. Según datos del Registry of the International Society for Heart and Lung Transplantation1 hasta finales del 2006 se han efectuado 69.536 trasplantes y en España, desde primero realizado en 1984, hasta 2005, se han efectuado 4.967 trasplantes de corazón, con una media de casi 300 anuales en los últimos cuatro años2. La supervivencia esperada para un paciente trasplantado es del 80 al 87% después del primer año, del 60 al 75% a los 5 años1-6, y la duración media del injerto es de 8 años y 6 meses. Sin embargo, a pesar de todos los avances de los últimos años en la cirugía, inmunosupresión y manejo de las complicaciones, la infección continúa siendo una causa importante de morbilidad y mortalidad (mortalidad precoz, 10%; mortalidad global, 18%).
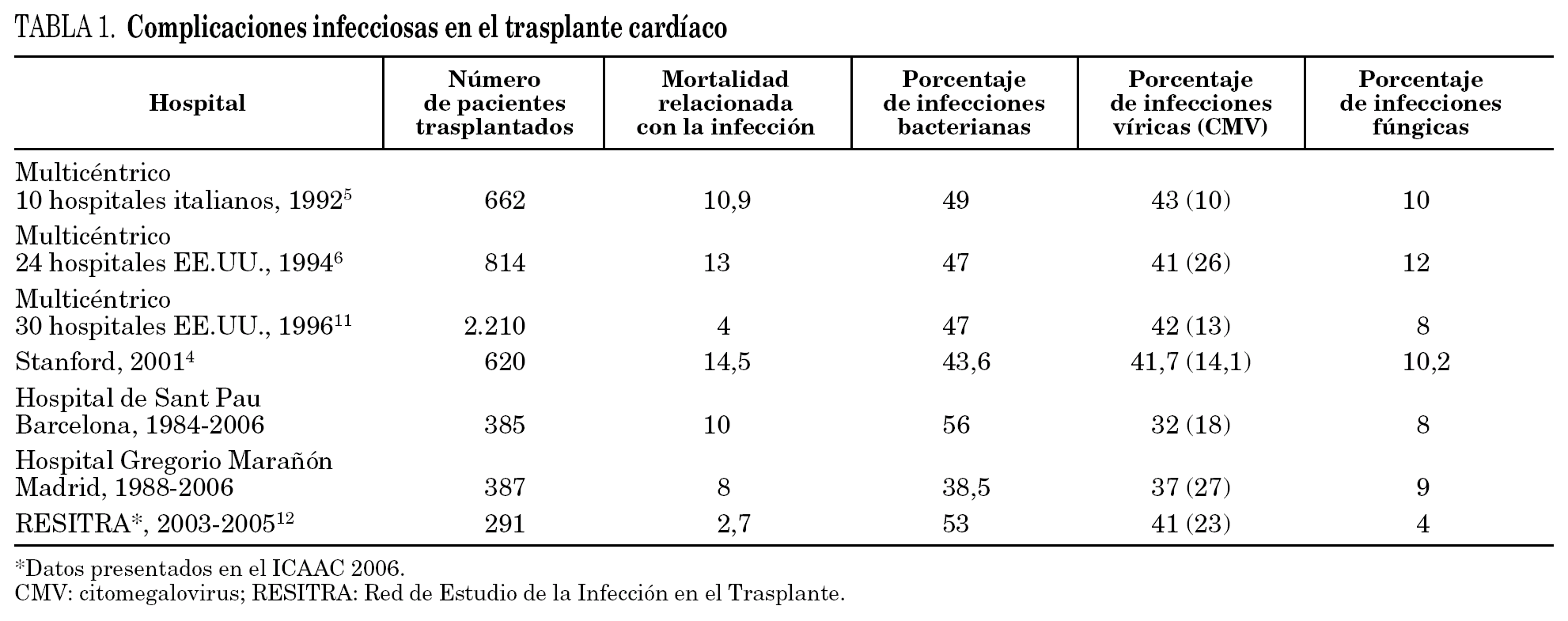
La incidencia global de infección en el TC oscila entre el 30 y el 60%, con una mortalidad relacionada del 4-15% (tabla 1) y las infecciones más frecuentes son las bacterianas (43-60%), seguidas de las víricas (40-45%) y, en menor proporción, las fúngicas y las causadas por protozoos (8-14%)7. Los microorganismos responsables de las infecciones pueden adquirirse antes, durante o después del TC, pero la mayoría de infecciones se manifiesta durante los 3 primeros meses y se localiza principalmente en el pulmón y la cavidad torácica8-11. En la tabla 2 se presentan los factores que predisponen a la infección en los pacientes con TC.
Al igual que ocurre en los otros tipos de trasplante de órgano sólido, la frecuencia y la etiología de las infecciones varía en relación con el tiempo transcurrido desde el trasplante8,10. Durante el primer mes después de la cirugía (estancia en la unidad de cuidados intensivos [UCI], catéteres, drenajes, intubación endotraqueal, sondas urinarias, etc.), las infecciones más comunes son las ocasionadas por bacterias nosocomiales que afectan la herida operatoria, el pulmón o el tracto urinario y que con frecuencia son bacteriémicas y de pronóstico grave. Entre el segundo y el sexto mes, cuando la inmunidad está más alterada por el tratamiento inmunosupresor, aparecen infecciones por bacterias oportunistas, herpes virus (particularmente citomegalovirus [CMV]), hongos y protozoos. A partir del sexto mes, si se reduce la inmunosupresión y los pacientes no presentan rechazo, las infecciones más frecuentes son las adquiridas en la comunidad. Sin embargo, los pacientes con rechazo continúan con el riesgo de presentar infecciones oportunistas. En la tabla 3 se presentan la cronología, etiología y momento de aparición de las infecciones en el paciente con TC.
Infecciones bacterianas
Son las más frecuentes7-10 y constituyen entre un 40 y un 50% de todas las infecciones. La mayoría (> 90%) aparece durante el primer mes, se localiza en la cavidad torácica y, casi siempre, se relaciona con la cirugía, el posoperatorio y las instrumentaciones prequirúrgicas y posquirúrgicas. Entre el segundo y el sexto mes, las infecciones nosocomiales son menos frecuentes, y pueden aparecer infecciones por bacterias intracelulares como Legionella pneumophila, Listeria monocytogenes o Nocardia asteroides.
En la serie de Stanford publicada en 20014, en la que revisan las complicaciones infecciosas de 620 pacientes trasplantados de corazón, se diagnosticaron 1073 episodios infecciosos (1,73 episodios infecciosos/paciente). El 43,6% de las infecciones fueron bacterianas y de éstas, la localización mas frecuente fue la pulmonar (35%), seguida de la urinaria (24,4%). Las bacterias gramnegativas, Escherichia coli y Pseudomonas aeruginosa, fueron responsables del 53% de las infecciones bacterianas: E. coli, en las infecciones urinarias y P. aeruginosa, en las pulmonares. Los estafilococos fueron los agentes etiológicos del 36% de las 468 infecciones bacterianas (infecciones de catéter, mediastinitis, bacteriemias, abscesos).
Bacterias grampositivas
Los microorganismos que habitualmente colonizan la piel y las mucosas (Staphylococcus aureus, Staphylococcus epidermidis) pueden causar infecciones de la herida operatoria, mediastinitis, infecciones de catéteres, o infecciones sistémicas bacteriémicas. S. aureus también puede ocasionar bronconeumonías, endocarditis y espondilodiscitis7,9-13.
El neumococo suele causar neumonías o infecciones pleuropulmonares en los distintos períodos del postrasplante14. La infección invasiva neumocóccica es más frecuente en los niños trasplantados15, y puede prevenirse con la vacunación.
Las celulitis estreptocócica y estafilocócica pueden aparecer en fases más tardías del trasplante debido a la fragilidad cutánea por el tratamiento crónico con corticoides.
El enterococo se asocia fundamentalmente con infecciones urinarias, aunque también puede causar bacteriemias, mediastinitis, infecciones de catéteres e infecciones abdominales7.
L. monocytogenes puede producir diversos síndromes como la bacteriemia aislada, la meningitis, la meningoencefalitis y la cerebritis sin meningitis. También se han descrito miocarditis o abscesos miocárdicos por Listeria7,16.
N. asteroides ocasiona una enfermedad supurativa de localización inicialmente pulmonar que puede extenderse por contigüidad hacia el espacio pleural y la pared torácica. Puede metastatizar asimismo a otros órganos (cerebro, tejido celular subcutáneo, riñones, huesos, etc.). Aunque las nocardiosis son más frecuentes en los pacientes con TC que en otros tipos de trasplante de órgano sólido, desde que se utilizan ciclosporina y cotrimoxazol para la profilaxis de Pneumocystis jirovecii ha disminuido su incidencia7,17,18. En general se trata de infecciones tardías que se presentan en pacientes con rechazo crónico y tratamiento inmunosupresor intenso. En una serie australiana de 540 trasplantes torácicos18, se diagnosticaron 10 nocardiosis pulmonares sin afectación extrapulmonar y que en ningún caso contribuyó a la mortalidad.
Rhodococcus equi, una bacteria grampositiva de morfología difteroide, produce unas manifestaciones clínicas y radiológicas muy parecidas a la nocardiosis, con afectación pulmonar y abscesos cutáneos y cerebrales. En nuestro país se ha descrito el primer caso de infección pulmonar por R. equi en un paciente con TC19.
Bacterias gramnegativas
Las enterobacterias y los bacilos gramnegativos no fermentadores son responsables de la mayoría de infecciones graves (neumonías, bacteriemias, infecciones de la herida operatoria, infecciones urinarias y de catéteres) precoces y constituyen la principal causa de mortalidad infecciosa en este período inicial7-10.
Legionella puede causar infecciones esporádicas o neumonías nosocomiales en los pacientes trasplantados20,21. Junto con las manifestaciones respiratorias pueden aparecer alteraciones neurológicas, digestivas y renales. También se han descrito infecciones de la esternotomía y mediastinitis por Legionella, secundarias a la contaminación de la herida o de los drenajes mediastínicos con agua del grifo7. Horbach21 encontró una incidencia de legionelosis en el 17% de los trasplantados cardíacos, pero otros autores7 refieren una incidencia del 4%. La puerta de entrada de las infecciones por salmonelas gastroenteríticas suele ser la digestiva pero con frecuencia la infección cursa con bacteriemia y localizaciones metastásicas (renales, osteoarticulares pleurales o del sistema cardiovascular)22.
Otras bacterias y micobacterias
Las bacterias anaerobias se han aislado en pacientes con infecciones pleuropulmonares7, diverticulitis, peritonitis o sinusitis. Se han descrito infecciones de la esternotomía por Mycoplasma hominis23 inmediata que cursaron con cultivos convencionales negativos. Una serie australiana con 4 casos apunta la posibilidad de la transmisión nosocomial7.
En España, la incidencia de tuberculosis en el TC es de 1,35/100 TC, unas 20 veces mayor que la correspondiente a la población inmunocompetente. La tuberculosis suele aparecer en los primeros 6 meses pos-TC, puede ser una reactivación o mas raramente una primoinfección, y es frecuente la localización extrapulmonar24.
También se han descrito infecciones tardías por micobacterias no tuberculosas ambientales25 con localización predominantemente cutánea (Mycobacterium marinum, M. ulcerans) o pulmonar (M. avium-intracellulare, M. kansasii).
Infecciones fúngicas
Las infecciones fúngicas constituyen una complicación muy grave del TC. Aunque son menos frecuentes que las bacterianas y las víricas, tienen una mortalidad relacionada muy superior (30-100%)26. En distintas series publicadas en los últimos años, la incidencia de las micosis invasivas oscila entre el 2 y el 15%4-6.
La mayoría de infecciones fúngicas graves aparece durante los tres primeros meses postrasplante, cuando el nivel de inmunosupresión es máximo, y Aspergillus spp. es el responsable de la mayoría de infecciones (> 60%)26,27. La infección por Aspergillus suele ser más precoz (media, 25-30 días) y se localiza principalmente en el pulmón aunque puede diseminarse. En cambio, las infecciones por Candida son más tardías (media, 45 días), a menudo son diseminadas y raramente afectan al pulmón7.
Desde el punto de vista epidemiológico, las infecciones por Candida, Aspergillus o los mucorales suelen ser nosocomiales, mientras que las micosis endémicas y la criptococosis casi siempre se adquieren en la comunidad. Grossi, en una revisión multicéntrica de 1.852 trasplantes cardíacos efectuados en 12 hospitales italianos, describe que el 2,2% (41/1.852) de los pacientes presentó una infección fúngica. La aspergilosis representó el 64% de todas las micosis invasivas y Candida fue responsable del 23%27. La mortalidad de los pacientes con aspergilosis fue del 29,4% y la de los pacientes con candidiasis, del 33,3%. Un estudio sobre autopsias efectuadas en pacientes con TC28 mostró que el 13,2% de los pacientes presentaba micosis invasivas. En este estudio se demostró un incremento de las infecciones pulmonares y diseminadas por Aspergillus en la última década y que la mayoría de las infecciones candidiásicas se localizaban en el tracto digestivo. En la serie de Stanford4, de las 109 infecciones fúngicas que presentaron 620 pacientes, 41 (37,6%) se localizaron en el pulmón y 30 fueron diseminadas (27,5%).
Aspergilosis
Actualmente, la incidencia de la aspergilosis en el TC es aproximadamente del 4-5% y se han descrito brotes nosocomiales en relación con la contaminación de los sistemas de ventilación y con la realización de obras cerca del hospital o en el propio centro hospitalario. La presentación clínica más frecuente es la aspergilosis pulmonar invasiva con fiebre, tos no productiva y rara vez dolor pleurítico o hemoptisis26-29. La infección puede presentarse de forma focal o nodular o bien, como neumonía unilateral o bilateral. La aspergilosis puede diseminarse por vía hematógena o extenderse a estructuras contiguas, como los grandes vasos, y producir hemorragias en ocasiones fatales. La radiografía de tórax inicial puede ser normal o mostrar la aparición de pequeños infiltrados o nódulos periféricos que pueden cavitarse. En general, los infiltrados se detectan mejor por la tomografía computarizada (TAC), y pueden ser variados (nódulos, cavitación, signo de media luna, signo del halo, lesiones triangulares con base pleural que corresponden a infartos hemorrágicos, etc.).
Más raramente, se han descrito pacientes con aspergilosis bronquial obstructiva o infecciones focales como mediastinitis, osteomielitis, abscesos cutáneos, abscesos cerebrales, aneurisma micótico en la sutura aórtica e infarto intestinal7,26,27. La afectación neurológica casi siempre es una complicación metastásica de la aspergilosis pulmonar, y a menudo se asocia a un rechazo agudo y/o a infecciones graves bacterianas o por CMV.
Candidiasis
La infección por Candida casi siempre es de origen endógeno y suele iniciarse por la colonización de la piel o las mucosas lesionadas, el tracto gastrointestinal y las vías urinarias. C. albicans es la especie más común, aunque cada vez se aíslan con mayor frecuencia otras especies como C. tropicalis, C. krusei, C. parapsilosis y C. glabrata. La presentación clínica más frecuente es la candidiasis mucocutánea; como el muguet oral, la candidiasis esofágica y las vulvovaginitis. La candidiasis invasiva, las neumonías, las pericarditis o las mediastinitis son raras y se han descrito más a menudo en pacientes con trasplante cardiopulmonar7,10,26,27.
Otras infecciones fúngicas
La criptococosis es poco frecuente6,27 y se presenta casi exclusivamente en el período tardío como una meningitis subaguda con fiebre, cefalea, déficit neurológicos y trastornos mentales. Algunos pacientes pueden presentar lesiones cutáneas (foliculitis, vesículas, nódulos, úlceras, etc.), que indican casi siempre una infección sistémica. También se han descrito osteomielitis o prostatitis en el curso del trasplante.
Pneumocystis jirovecii puede causar neumonías intersticiales bilaterales con insuficiencia respiratoria en el curso de los primeros 6 meses del TC y durante los períodos de rechazo tratados con dosis altas de corticoides o globulinas antitimocíticas. Antes de la profilaxis generalizada con cotrimoxazol, su incidencia oscilaba entre el 3 y el 12% pero actualmente esta complicación es excepcional9,10.
Las mucormicosis o zigomicosis son infecciones causadas por hongos inferiores de la clase Zygomicetos (Rhizopus, Mucor, Rhizomucor, Absidia, Cunninghamella, Saksenaea), que suelen tener una evolución rápida, con muy mal pronóstico. La infección puede ser de localización rinocerebral, pulmonar, gastrointestinal, cutánea, cerebral o diseminada. En el TC son poco frecuentes, pero se han descrito pacientes con mucormicosis rinocerebral, pulmonar y cutánea30,31.
Las micosis sistémicas regionales (Histoplasma capsulatum, Coccidioides immitis, Blastomyces dermatitidis) son las principales micosis adquiridas en la comunidad en las zonas endémicas. En nuestro medio, sólo las debemos considerar en pacientes procedentes o con antecedentes de un viaje a un país endémico o de residencia en él. De las micosis endémicas, la coccidioidomicosis es la que afecta con más frecuencia a los pacientes con TC, y tiene una gran tendencia a diseminarse y a recidivar si no se utiliza un tratamiento de mantenimiento7.
Recientemente se han descrito infecciones sistémicas por hongos poco usuales y resistentes32,33. Las infecciones por los hongos dematiáceos y claros suelen cursar con una sintomatología y unas lesiones histopatológicas muy parecidas a la aspergilosis. Estas infecciones suelen ser tardías (media, 22 meses) y la mayoría de pacientes presenta infecciones cutáneas o de partes blandas, aunque un 12% de los enfermos tiene infecciones diseminadas con abscesos cerebrales. Las lesiones cutáneas se manifiestan como pápulas, pústulas, nódulos purpúricos o úlceras necróticas localizadas que en ocasiones curan con el tratamiento quirúrgico. Las infecciones por hongos levaduriformes se manifiestan con una clínica similar a la candidiasis invasiva, con fiebre persistente, lesiones cutáneas y fungemia secundaria a un catéter.
Infecciones víricas
Citomegalovirus
Citomegalovirus (CMV) es el microorganismo que más a menudo causa infección en el trasplante cardíaco34,35. Puede afectar al 30-90% de los pacientes que no reciben profilaxis y causar infección clínicamente significativa en 7-35%. El factor de riesgo esencial es el estado serológico de receptor y donante. La enfermedad por CMV (síntomas y signos atribuibles a CMV) se relaciona con el estado serológico, ya que la infección primaria (receptor negativo [R] con donante positivo [D+]) suele ser sintomática con más frecuencia que las reactivaciones. La infección primaria se adquiere, bien a través del injerto o de las transfusiones de sangre, por lo cual se recomienda que éstas se efectúen siempre utilizando filtros leucocitarios o productos de donantes seronegativos (D).
La presentación clínica más común y menos grave es el síndrome mononucleósico, que consiste en la aparición de fiebre, mialgias, artralgias, odinofagia y mal estado general, junto con leucopenia, trombocitopenia y elevación ocasional de las enzimas hepáticas. En los trasplantados cardíacos, las enfermedades focales más frecuentes son la neumonía y la afección gastrointestinal, que comporta especial gravedad. Sus manifestaciones clínicas consisten en dolor abdominal, diarrea, hemorragia digestiva, perforación y reactivación ulcerosa, aunque puede ser asintomática. Ello da lugar a que su diagnóstico sea en ocasiones difícil de establecer. Entre el 10 y el 25% de los trasplantados cardíacos con enfermedad por CMV pueden padecer recurrencias, en ocasiones asociadas a la presencia de hipogammaglobulinemia36,37.
Además, la enfermedad por CMV incrementa el riesgo de sufrir una infección oportunista y existen datos, tanto clínicos como experimentales, que sugieren que puede reducir la supervivencia del injerto y favorecer la aparición de rechazo crónico38-43. Por último, la enfermedad por CMV condiciona un importante incremento en los costes de la atención que estos pacientes precisan y en la duración de los ingresos hospitalarios35,44-48.
El diagnóstico de certeza de enfermedad por CMV se basa en la demostración de cuerpos de inclusión citomegálicos en muestras tisulares. En la práctica clínica, los métodos más habituales de diagnóstico son la detección de la presencia de CMV mediante la antigenemia o la reacción en cadena de la polimerasa (PCR), que comportan rapidez y sensibilidad. Estudios recientes sugieren que incluso cargas virales bajas pueden condicionar un efecto deletéreo sobre los receptores de trasplante49. Sin embargo, aún existe controversia sobre cuál es la mejor manera de prevenir la infección por CMV y sus complicaciones en el trasplante cardíaco50. Remitimos al lector interesado al documento de consenso elaborado por el GESITRA (www.seimc.org) con los niveles de evidencia.
Muy en resumen, el tratamiento de elección continúa siendo ganciclovir i.v. seguido de valganciclovir oral. Con respecto a la profilaxis, no se considera ético seleccionar D para R, pero es recomendable administrar los hemoderivados con filtro leucocitario. Los R/D+ deben recibir profilaxis universal (A-I), aunque la pauta utilizada está en discusión. Muchos centros prefieren utilizar valganciclovir oral (900 mg/día) hasta un máximo de 3 meses, precedido en ocasiones por unos días de ganciclovir i.v. La asociación de gammaglobulina hiperinmune (CMVIg [inmunoglobulina anticitomegalovirus]; 100 mg/kg los días 1, 7, 14, 21 y 28) con ganciclovir intravenoso (5 mg/kg/12 h durante los primeros 14-21 días postrasplante) es también una opción eficaz (B-II).
En receptores seropositivos R+ generalmente se utiliza una aproximación basada en el tratamiento anticipado, que consiste en la monitorización secuencial cuantitativa de CMV y que se aplica a pacientes que no reciban profilaxis universal51. Cuando la antigenemia o la PCR resulta positiva se recomienda la utilización de ganciclovir i.v. (en dosis de 5 mg/kg/12 h) o de valganciclovir oral hasta su negativización (B-II). En los casos de replicación persistente o intolerancia se valorará la utilización de gammaglobulina específica (B-II). Otros grupos apoyan la administración de profilaxis universal corta con ganciclovir intravenoso durante 14 (A-II)-28 (A-I) días postrasplante a receptores positivos, lo que reduce la tasa de enfermedad por CMV y en algunos estudios mejora la supervivencia.
Los pacientes que reciban inducción con OKT3 durante períodos prolongados o que los necesiten por un rechazo corticorresistente deben recibir ganciclovir i.v. en dosis plenas durante 14 días, ± CMVIg (A-II). Nuestro grupo recomienda descartar la presencia de hipogammaglobulinemia, sobre todo en pacientes con enfermedad por CMV recidivante, y en caso de detectarse, administramos terapia de reposición con inmunoglobulinas (B-III)38.
Virus de Epstein-Barr
El virus de Epstein-Barr (VEB) se ha relacionado con una amplia gama de complicaciones infecciosas en la población trasplantada, que incluye elevaciones serológicas asintomáticas, síndrome mononucleósico, hepatitis aguda o crónica, neumonitis y síndromes linfoproliferativos. Se estima que dos tercios de los pacientes seronegativos y un 30% de los seropositivos desarrollarán infección por VEB después del trasplante. El diagnóstico se efectúa mediante serología (anticuerpos heterófilos y específicos), PCR o hibridación in situ. En la actualidad se recomienda efectuar seguimiento mediante PCR cuantitativa, al menos a todos los receptores seronegativos.
El síndrome linfoproliferativo postrasplante relacionado con VEB se reconoce cada vez con más frecuencia, tal vez debido a la mayor supervivencia de los pacientes. Parece ser más común después de una infección primaria y tras la administración de globulina antitimocítica y/o OKT3. Puede presentarse de tres formas bien diferenciadas. La primera consiste en un síndrome mononucleósico grave con afectación de las amígdalas y los ganglios próximos. En la segunda existe infiltración de diversas vísceras por linfocitos B polimorfos. La tercera consiste en la aparición de tumores localizados en tracto gastrointestinal, cuello, cerebro, tórax, etc. La apariencia histológica de estos tumores es similar a la de los linfomas, pero es posible demostrar secuencias genéticas de VEB. Se han descrito incluso tumores cardíacos relacionados con VEB en trasplantes de corazón52. En su tratamiento se suele asociar la reducción de la inmunosupresión junto a la administración de aciclovir, aunque no está clara la eficacia clínica de los antivirales.
Otros virus
Las infecciones por herpes simple en los trasplantados de órgano sólido suelen deberse a reactivaciones, estar limitadas a la orofaringe y ser de diagnóstico y tratamiento sencillos. Sólo muy ocasionalmente se han descrito infecciones sistémicas graves, que pueden presentarse como hepatitis fulminantes en el primer mes postrasplante o en forma de neumonitis.
El herpes zóster en una complicación tardía que puede afectar al 6-17% de los trasplantados cardíacos53,54. No suele revestir gravedad, a diferencia de las primoinfecciones por el virus varicela-zóster (VVZ), frecuentes sobre todo en niños, que pueden ser graves. Por ello se recomienda conocer el estado serológico del receptor (IgG frente a VVZ) y la administración de inmunoglobulina hiperinmune en las primeras 72 h tras el contacto sospechoso. Si la enfermedad llega a desarrollarse, el tratamiento consiste en la administración de aciclovir intravenoso a altas dosis. La vacuna OKA frente a la varicela ha demostrado ser eficaz y segura en población trasplantada infantil.
Hay virus emergentes como el West Nile que han afectado ya a trasplantes cardíacos55,56. Se transmite mediante la picadura de un mosquito, sobre todo de la especie Culex, pero también a través de los órganos donados por pacientes virémicos y por tranfusiones. Los trasplantados tienen una alta probabilidad de desarrollar cuadros graves de encefalitis (40%) que conllevan una elevada morbi-mortalidad (25%)57.
El virus herpes humano 6 (HHV-6) se ha descrito en trasplantados cardíacos y produce cuadros de encefalitis, fiebre muy elevada y supresión medular58,59. El sarcoma de Kaposi, tumor de estirpe vascular causado por el HHV-8, es infrecuente en el trasplante cardíaco. Puede estar relacionado tanto con la primoinfección por este virus, como con reactivaciones60-62. La manifestación clínica más frecuente es la aparición de lesiones violáceas en mucosas y piel, incluyendo la cicatriz de la esternotomía, aunque puede haber también lesiones viscerales, sobre todo en pulmón y tracto digestivo. El tratamiento consiste en reducir la inmunosupresión y administrar quimioterapia, normalmente daunorubicina liposomal. El uso de antivirales tales como cidofovir es más controvertido.
El virus BK es un poliomavirus que permanece latente en el tracto urinario y causa nefropatía intersticial grave y estenosis ureteral en trasplantados renales y de progenitores hematopoyéticos. La experiencia en trasplantes cardíacos es aún reducida. Nuestro grupo ha detectado una elevada prevalencia de viruria y viremia por virus BK en trasplantados de corazón, aunque ningún caso claro de nefropatía intersticial hasta el momento63. Sin embargo, sí se han descrito hasta el momento cuatro casos en la literatura especializada64.
Finalmente, debemos recordar que los receptores cardíacos, sus familiares y todo el personal implicado en su cuidado deben vacunarse anualmente de la gripe.
Infecciones parasitarias
Toxoplasmosis
Las infecciones producidas por Toxoplasma gondii son especialmente características de los trasplantados cardíacos dado que el riesgo de infección primaria (transmisión de la infección de un donante seropositivo a un receptor seronegativo) es muy elevado (superior al 50%), pues los quistes están presentes en el músculo cardíaco del donante. La incidencia es mucho menor en los trasplantados hepáticos (< 20%) y en los renales (< 1%). La infección transmitida mediante transfusiones es más rara, pero no cabe excluirla en receptores seronegativos.
La enfermedad suele manifestarse en los primeros tres meses postrasplante, mediante la aparición de fiebre, malestar general, mialgias y síndrome mononucleósico. Con menos frecuencia pueden aparecer síntomas neurológicos, pulmonares o miocárdicos o coriorretinitis. El diagnóstico suele establecerse mediante serología, examen directo, cultivo o PCR. En ocasiones se logra por la detección del parásito en una biopsia miocárdica. Las lesiones producidas por T. gondii suelen ser múltiples, con preferencia por la localización periventricular, y captan contraste en anillo. La mortalidad puede alcanzar el 60%.
La posibilidad de toxoplasmosis diseminada debe considerarse en el diagnóstico diferencial cuando aparezca un cuadro séptico con cultivos negativos, en particular si se acompaña de manifestaciones neurológicas y respiratorias y el paciente era seronegativo65. El tratamiento consiste en la administración de pirimetamina y sulfadiazina durante un año. La incidencia de toxoplasmosis tras el trasplante cardíaco ha descendido drásticamente tras el uso sistemático de profilaxis, que debe administrarse a todos los receptores de trasplante cardíaco seronegativos que reciben el injerto de un paciente seropositivo o con serología desconocida. La pauta más extendida es la administración de pirimetamina (25 mg/día) durante 6 semanas, aunque recientemente se ha demostrado que es suficiente con el uso de cotrimoxazol que se proporciona para prevenir la neumonía por Pneumocystis66. Es de recordar que se han descrito cuadros de uropatía obstructiva por depósito de cristales en relación con la sulfadiacina67. El diagnóstico suele obtenerse mediante serología o estudio de la médula ósea. El tratamiento consiste en la administración de sulfadiacina y pirimetamina. En pacientes alérgicos a las sulfamidas, cabe administrar clindamicina.
Enfermedad de Chagas
Merece quizás una mención especial la enfermedad de Chagas que es endémica en México, América Central y en el cono sur (Brasil, Bolivia, Paraguay, Argentina, Chile, Uruguay). Está causada por Tripanosoma cruzi, y las formas crónicas pueden originar una miocardiopatía de muy mal pronóstico y que constituye una de las indicaciones más importantes de trasplante cardíaco en América Latina, sobre todo en Brasil, donde supone la tercera indicación en frecuencia. Se recomienda realizar serología a todo donante y receptor nacido o residente en dichas zonas (análisis inmunoenzimático [ELISA] o inmunofluorescencia indirecta [IFI]; título > 1/80 significativo). Está formalmente contraindicada la utilización de órganos de donantes con infección aguda y el uso del corazón de un donante con infección crónica. El trasplante de otros órganos procedentes de donantes con infección crónica es más controvertido (contraindicación relativa). Si se trasplantaran, se recomienda el seguimiento del receptor mediante métodos parasitológicos y serológicos. En caso de trasplante cardíaco de donante sano y receptor con enfermedad chagásica se iniciará tratamiento específico durante el pretrasplante y el postrasplante con benznidazol. El 70% de estos pacientes desarrollará parasitemia postrasplante y un tercio de ellos tendrá manifestaciones clínicas asociadas, sobre todo miocarditis que ha de diferenciarse del rechazo, nódulos subcutáneos y excepcionalmente enfermedad diseminada. Las biopsias miocárdicas suelen mostrar infiltración linfocítica, con edema y áreas de necrosis. La visualización del microorganismo establece el diagnóstico68. La administración de benznidazol (10 mg/kg/día durante 60 días) suele resultar en la remisión de la parasitemia en la primera semana de tratamiento, aunque puede recidivar. Otros fármacos que se han usado también en estos pacientes son nifurtimox y alopurinol.
Otras infecciones parasitarias
La leishmaniasis es muy rara en los trasplantados cardíacos, aunque debe considerarse en pacientes con fiebre no clara, sobre todo si se acompaña de pancitopenia y esplenomegalia69.
Se han descrito algunos casos de transmisión de malaria a receptores de trasplante renal, hepático y cardíaco a partir de un donante infectado70 y dos casos de estrongiloidiasis71,72.
Otras infecciones parasitarias como la neurocisticercosis y la estrongiloidiasis son muy poco frecuentes en nuestro medio, aunque su incidencia puede incrementarse con los viajes y la inmigración73. La infección por Strongyloides stercoralis es endémica en zonas tropicales y subtropicales, aunque se han descrito también casos en zonas templadas como el sur y el este de Europa, el Cáucaso, Bélgica, el Reino Unido y Estados Unidos. El parásito puede causar diarrea aguda, enfermedad gastrointestinal crónica paucisintomática o infección sistémica (estrongiloidiasis diseminada o síndrome de hiperinfección). Es importante recordar que el parásito puede permanecer indetectable durante décadas y una vez que el paciente recibe inmunosupresión diseminarse, causando infecciones sistémicas graves con sepsis secundaria, manifestaciones cutáneas, pulmonares neurológicas y gastrointestinales que comportan alta mortalidad73,74. Por tanto, es imprescindible interrogar al candidato a trasplante sobre la posibilidad de exposición remota o reciente a S. stercoralis, lo cual debe suscitar una cuidadosa investigación de la presencia del parásito en las heces. Recomendamos la técnica de concentración de Harada-Mori74. También puede resultar muy útil la búsqueda del parásito en el aspirado duodenal obtenida con el test de la cuerda. Dado el riesgo de hiperinfestación postrasplante, se recomienda administrar un curso de ivermectina o tiabendazol antes del trasplante, incluso a los pacientes con simple sospecha de infección.
Tratamiento
El tratamiento antimicrobiano en los pacientes trasplantados debe iniciarse (siempre que sea posible) después de recoger todas las muestras adecuadas para el diagnóstico microbiológico. La elección del tratamiento empírico inicial se basará en la localización de la infección y en su gravedad.
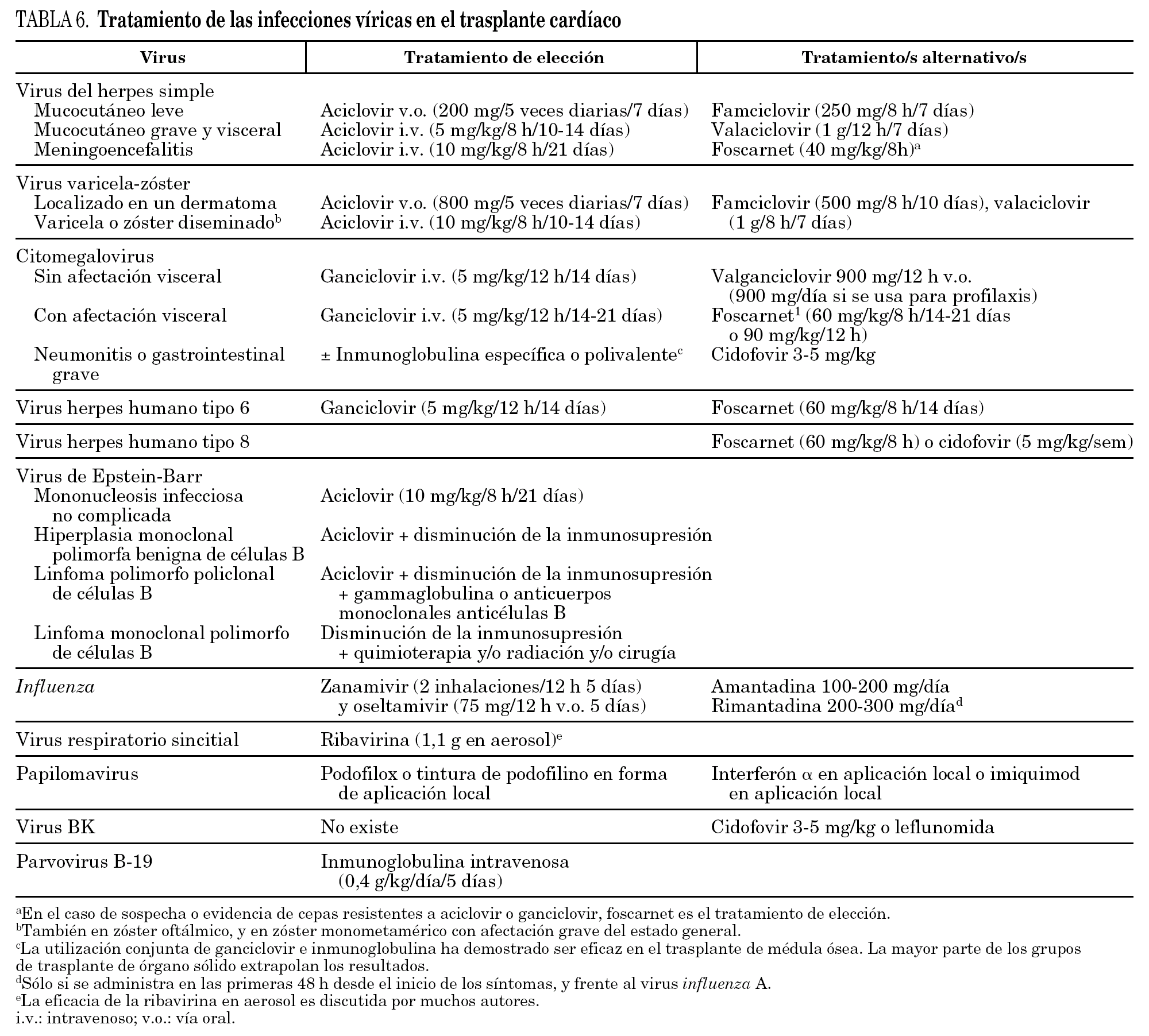
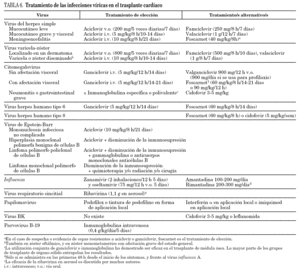
En las tablas 4, 5, 6 y 7 se presentan los antimicrobianos recomendados para el tratamiento de las infecciones en el trasplantado cardíaco.
Síndromes infecciosos en el TC
Neumonías
El pulmón es el órgano donde se localiza la mayoría de infecciones del paciente con trasplante de corazón7-10. La neumonía es una infección grave que actualmente afecta a un 15-30% de los pacientes, con una mortalidad relacionada del 23%. Los factores que predisponen a esta infección son la intubación prolongada, la infección por CMV y el infarto pulmonar preoperatorio14.
En el posoperatorio inmediato y durante el primer mes, las neumonías más frecuentes son las causadas por bacterias nosocomiales, que, a veces, deben distinguirse de las atelectasias posoperatorias, las hemorragias o embolias pulmonares, o de un edema pulmonar. Más raramente pueden ser de etiología fúngica, en particular aspergilar. Estas neumonías, a menudo, están relacionadas con aspiraciones, la intubación, la ventilación mecánica u otras infecciones sistémicas posoperatorias y pueden acompañarse de un empiema pleural.
Entre el primer y el sexto mes, los pacientes con TC tienen un mayor riesgo de presentar neumonías por Legionella20,21, Nocardia y P. jirovecii. Estas infecciones pueden ser polimicrobianas y a menudo asociadas al CMV o a otros patógenos oportunistas como Aspergillus. A partir del sexto mes son frecuentes las neumonías adquiridas en la comunidad (neumococo, Haemophilus influenzae, virus respiratorios) o las infecciones por micobacterias. Por ello es recomendable prevenir estas infecciones con las vacunaciones adecuadas (vacuna antineumocócica, antigripal y anti-H. influenzae). En estas fases tardías, los pacientes con rechazo que requieren tratamiento inmunosupresor intenso, continúan con riesgo de presentar infecciones oportunistas por los patógenos descritos previamente.
Infecciones de la herida operatoria
Las infecciones de la esternotomía se presentan en un 5-30% de los pacientes con TC y pueden ser graves cuando se propagan al mediastino. Los patógenos responsables son los mismos que afectan a los pacientes posoperados de cirugía cardíaca, y predominan los estafilococos (S. aureus, S. epidermidis) y los bacilos gramnegativos (Serratia marcescens, P. aeruginosa, etc.)7. La mediastinitis es una complicación grave que se presenta en un 2,5-7,5% de los pacientes y puede cursar con bacteriemia, inestabilidad esternal y supuración9,11. Es necesario efectuar una TAC torácica para confirmar la extensión de la infección, que siempre debe drenarse quirúrgicamente. También se han descrito mediastinitis por Nocardia asteroides17, por Aspergillus fumigatus y otros casos con cultivos convencionales negativos causadas por Mycoplasma o Legionella7.
Infecciones cutáneas
En el paciente trasplantado, la piel es un órgano diana de muchas infecciones diseminadas. Algunas infecciones bacterianas (Nocardia, micobacterias atípicas, estafilococos) y otras fúngicas (Aspergillus, Candida, criptococo, etc.) pueden presentarse con lesiones cutáneas inespecíficas, por lo que siempre se debe efectuar una biopsia con cultivo cuando aparezcan lesiones nuevas7. Las infecciones por varicela zóster son frecuentes a partir de los 6-12 meses53,54 y se han descrito casos de sarcoma de Kaposi en pacientes con dosis elevadas de inmunosupresores9,60,61.
Bacteriemias
Las bacteriemias son frecuentes principalmente en el primer mes del posoperatorio. Suelen ser secundarias a infecciones pulmonares, catéteres, herida operatoria o vías urinarias, aunque en un 20% de los casos no se encuentra el foco primario. Los microorganismos que se aíslan más a menudo son los estafilococos y los bacilos gramnegativos7,10. Las bacteriemias polimicrobianas o las candidemias son raras.
En los períodos más tardíos, los pacientes pueden presentar bacteriemias por Listeria monocytogenes o por Salmonella sp.
Infecciones urinarias
Aunque son menos habituales que en el trasplante renal, se presentan en relación con el sondaje urinario. Suelen ser causadas por bacterias gramnegativas, enterococo o por Candida. Aparecen con frecuencia durante el primer mes, pueden cursar con bacteriemia y en el hombre, complicarse con una prostatitis.
Infecciones del sistema nervioso
Las infecciones del sistema nervioso central (SNC) son poco frecuentes pero por su gravedad requieren un diagnóstico y tratamiento precoz. La mayoría se da en los primeros 6 meses postrasplante (máximo, del segundo al cuarto mes), excepto la meningitis criptococócica que suele ser más tardía y de evolución subaguda o crónica7,10.
Mycobacterium tuberculosis y Listeria monocytogenes pueden causar meningitis agudas o subagudas y, esta última más raramente, cerebritis o romboencefalitis.
Los abscesos cerebrales suelen ser originados por N. asteroides o por Aspergillus spp. y casi siempre son secundarios a una infección pulmonar. La mucormicosis rinocerebral es más frecuente en pacientes trasplantados de riñón pero se han descrito algunos casos en pacientes con TC30.
Otras infecciones
Las pericarditis, miocarditis o endocarditis13,75 son poco frecuentes. Stamm16 describió 2 pacientes con bacteriemia, miocarditis y abscesos miocárdicos por Listeria monocytogenes que curaron con antibióticos pero que requirieron un retrasplante. Se han descrito endocarditis causadas por microorganismos aislados en hemocultivos del donante. En nuestro hospital, un paciente falleció con una pancarditis por Staphylococus aureus resistentes a meticilina (MRSA) transmitida a partir de un donante, cuyos hemocultivos resultaron positivos post mortem75. Keating76 publicó la transmisión de una aspergilosis invasiva a partir de un donante colonizado por A. fumigatus en la que el receptor del TC presentó al cabo de 3 meses una endocarditis aspergilar con metástasis oculares y cutáneas.
Las gastroenteritis agudas suelen ser causadas por los enteropatógenos habituales, aunque las debidas a Salmonella pueden ser más graves, con sepsis y metástasis extradigestivas. Las diarreas hemorrágicas pueden aparecer tras infecciones por Campylobacter, Salmonella, Shigella, Clostridium difficile y el CMV7,10.
Las mucositis orofaríngeas causadas por el HHV-1 o Candida sp. son frecuentes aunque, por lo general, no revisten gravedad y se controlan con tratamiento tópico. Las esofagitis que cursan con dolor retroesternal suelen ser secundarias a infecciones por CMV, virus herpes simple o más raramente Candida28.
Las infecciones abdominales pueden aparecer durante los 3 primeros meses del trasplante, en relación con patologías previas a éste (litiasis biliar, diverticulosis). Las colecistitis y las diverticulitis pueden complicarse con abscesos, perforación intestinal y peritonitis.
NOTA
Los artículos publicados en la sección "Formación Médica Continuada" forman parte de grupos temáticos específicos (antibiograma, antimicrobianos, etc.). Una vez finalizada la publicación de cada tema, se irán presentando al Sistema Español de Acreditación de la Formación Médica Continuada (SEAFORMEC) para la obtención de créditos.
Una vez concedida la acreditación, esta se anunciará oportunamente en la Revista y se abrirá un período de inscripción gratuito para los socios de la SEIMC y suscriptores de la Revista, al cabo del cual se iniciará la evaluación, durante un mes, que se realizará a través de la web de Ediciones Doyma.
Correspondencia: Dra. M. Gurguí.
Unidad de Enfermedades Infecciosas. Hospital de la Santa Creu i Sant Pau.
Sant Antoni M.ª Claret, 167. 08025 Barcelona. España.
Correo electrónico: mgurgui@santpau.es
Manuscrito recibido el 26-5-2007; aceptado el 28-6-2007.