Las infecciones de transmisión sexual (ITS) suponen una importante carga de morbimortalidad. A nivel mundial todos los años se producen millones de casos de ITS como sífilis, infección por clamidias o gonococia, y actualmente se asiste a un incremento de la resistencia a los antimicrobianos en patógenos como el gonococo. La demora en el diagnóstico es uno de los factores que justifica la dificultad para controlar estas infecciones. Las pruebas de diagnóstico rápido permiten instaurar el tratamiento etiológico en la primera consulta, lo que lleva a tratar a más pacientes, tanto sintomáticos como asintomáticos, de forma más efectiva, e interrumpir sin demoras la cadena epidemiológica de transmisión. La OMS incluye estas pruebas en su estrategia mundial contra las ITS.
Sexually transmitted infections (STIs) are responsible for an enormous burden of morbidity and mortality. Worldwide, millions of cases of STIs, such as syphilis, chlamydia, or gonorrhoea occur every year, and there is now an increase in antimicrobial resistance in pathogens, such as gonococcus. Delay in diagnosis is one of the factors that justifies the difficulty in controlling these infections. Rapid diagnostic tests allow the introduction of aetiological treatment at the first visit, and also leads to treating symptomatic and asymptomatic patients more effectively, as well as to interrupt the epidemiological transmission chain without delay. The World Health Organisation includes these tests in its global strategy against STIs.
A nivel mundial, las infecciones de transmisión sexual (ITS) suponen una importante carga de morbimortalidad, puesto que comprometen la calidad de vida, la salud sexual y reproductiva, la salud del recién nacido y del niño, facilitan indirectamente la transmisión del virus de la inmunodeficiencia humana (VIH) y provocan cambios celulares que preceden a algunos tipos de cáncer. La OMS nos ofrece datos de una realidad que nos resulta lejana desde los países desarrollados. Así, la sífilis provoca más de 300.000 muertes fetales y neonatales al año y expone a otros 215.000 niños a muerte prematura. También estima que todos los años se registran 357 millones de nuevos casos de 4 tipos de ITS curables: 131 millones de infecciones por Chlamydia trachomatis (CT), 78 millones por Neisseria gonorrhoeae (NG), 6 millones por Treponema pallidum (TP) y 142 millones por Trichomonas vaginalis (TV). Igualmente, se calcula que el virus del paliloma humano (VPH) es responsable de 530.000 casos de cáncer cervicouterino y de 264.000 muertes. Tampoco podemos olvidarnos de la aparición de cepas multirresistentes de gonococo que nos amenazan con una gonorrea intratable.
Si bien es cierto que se han logrado avances como la disminución de la transmisión vertical de la sífilis de los países en desarrollo, de forma global la prevalencia de las ITS se mantiene o incluso se incrementa. A esto contribuyen numerosos factores, pero tiene especial importancia la demora que se produce en los tratamientos en espera de un resultado diagnóstico. Mediante un modelo matemático se ha demostrado que si se emplea una prueba diagnóstica rápida con una sensibilidad tan reducida como del 63%, se consigue mejorar el porcentaje de pacientes tratados frente a esperar al resultado de una prueba de elevada sensibilidad disponible en una segunda consulta a la que muchos pacientes no acuden1. Por ello, las pruebas diagnósticas que proporcionen resultados inmediatos permitirán administrar tratamientos etiológicos a un mayor número de pacientes infectados y se evitarán nuevos contagios al interrumpir la cadena de transmisión de la infección.
Para ello, hay que reforzar la capacidad de los laboratorios y también avanzar en el diseño e implementación de pruebas diagnósticas en el lugar de la atención al enfermo que permitan el diagnóstico sistemático y precoz de las ITS en todos los individuos sospechosos de padecerlas, incluso aunque estén asintomáticos.
En esta revisión actualizaremos los conocimientos sobre técnicas de diagnóstico rápido de los principales patógenos productores de ITS y vulvovaginitis, pero dejaremos al margen los virus de las hepatitis y el VIH.
Antecedentes, concepto y características de las pruebas rápidas en infecciones de transmisión sexualLas pruebas diagnósticas en las ITS pueden servir para varios propósitos: a) diagnóstico; b) cribado de grupos de alto riesgo; c) monitorización del tratamiento; d) vigilancia epidemiológica; e) investigación de brotes; f) validación del manejo sindrómico en países con pocos recursos; g) detección de patrones de resistencia; h) asegurar la calidad en las pruebas de laboratorio, y en i) investigación2.
Las pruebas diagnósticas empleadas en las ITS son: a) microscopia directa; b) cultivo; c) detección de antígenos; d) serología; e) detección de metabolitos microbianos (test de Whiff, por ejemplo), y f) métodos moleculares. Todas ellas se pueden considerar como rápidas por lo menos en algunos de sus formatos, excepto el cultivo.
Las pruebas rápidas en ITS pueden considerarse como tal, o como pruebas a la cabecera del enfermo (point-of-care-test [POCT]). En esta revisión se consideran indistintamente los 2 tipos. Se pueden definir las POCT como las pruebas diagnósticas que permiten que en la misma visita se realice el diagnóstico y se indique el tratamiento. Las diferencias entre unas y otras se detallan en la tabla 1 (modificado de Muralidhar3).
Diferencias entre prueba rápida y POCT
| Característica | Prueba rápida | POCT |
|---|---|---|
| Dificultad | Simple | Simple (puede usarse en atención primaria) |
| Tiempo | <30min | <20-30min |
| Fuente de electricidad | Sí, necesaria | No |
| Personal entrenado | Sí, necesario | No |
| Control de calidad | No, controles internos | Sí (más fiabilidad) |
POCT: pruebas a la cabecera del enfermo.
Fuente: modificado de Muralidhar3.
Las pruebas rápidas/POCT dirigidas al diagnóstico de las ITS deben cumplir los siguientes requisitos establecidos por la OMS4:
ASSURED
- •
Affordable (económico).
- •
Sensitive (sensible).
- •
Specific (específico).
- •
User-friendly (uso amigable, pocos pasos y mínimo entrenamiento).
- •
Rapid and robust (rápido y robusto, almacenable a temperatura ambiente, resultados en <30min).
- •
Equipment-free (sin equipos).
- •
Deliverable to end-users (disponible para usuarios finales que lo necesiten).
Además deben cumplir, si son POCT, con controles de calidad incluidos en las pruebas, deben ser seguras ambientalmente y de coste mínimo.
Un aspecto importante es qué opinan los usuarios de lo que deben ser las cualidades de las pruebas rápidas/POCT en ITS. En un estudio de grupos focales se encontró que, como cualidades de una prueba rápida, estas deberían ser de alta sensibilidad y especificidad, tiempo de realización corto y bajo coste5.
Para las POCT hay varios tipos de tecnologías6:
- a)
Reacciones de precipitación/aglutinación como el RPR en la sífilis.
- b)
Inmunocromatografía de diferentes formatos: b1) de flujo lateral; b2) múltiple, por ej. VIH+sífilis, VIH+sífilis+VHB/VHC, treponémicos+no treponémicos; b3) mediante flujo como el dot-blot; b4) con lectores/escáneres para eliminar el sesgo del observador, que incrementa la sensibilidad y sirve para cuantificar.
- c)
Tecnologías emergentes como ensayos microfluídicos (detectan múltiples analitos como VIH y sífilis) o la tecnología amplificación isotérmica o loop-mediated isothermal amplification (LAMP), que consigue la amplificación mediante el empleo de 4 cebadores y enzima polimerasa en una reacción a temperatura constante (60-65°C) y ofrece resultados en menos de 1h.
Las POCT se desarrollaron como complemento a la centralización en laboratorios «core» permitiendo determinaciones descentralizadas disponibles 24h/365 días. Suelen ser combinaciones de microorganismos basados en síndromes, se puede hacer recogida por el propio paciente, no requieren personal entrenado y son rápidas como para poder hacer una toma de decisiones. De todas ellas, las de ITS están entre las que se ha establecido su coste-efectividad7.
Independientemente de la terminología y la disquisición que se pueda hacer entre pruebas rápidas o POCT, incluimos en esta revisión los tipos de pruebas que consideramos intercambiables, ya sean con/sin equipamiento en la consulta o en un laboratorio de proximidad, y que tratan de dar una respuesta lo más rápida posible.
El laboratorio de respuesta rápida en infecciones de transmisión sexual y necesidades en diferentes entornos: atención primaria, urgencias, centros de infecciones de transmisión sexual, laboratorios de referenciaLa centralización de laboratorios hace que la presencia de un laboratorio de respuesta rápida sea difícil en nuestro entorno, pero es posible disponer de los siguientes métodos en los distintos entornos de trabajo:
- a)
Atención primaria: por ej., tinción de Gram y criterios de Amsel para vaginosis bacteriana.
- b)
Urgencias: normalmente cuenta con un laboratorio de apoyo.
- c)
Centro de ITS: las anteriores, campo oscuro, sedimento de orina.
- d)
Laboratorio de referencia: todas las técnicas rápidas.
En los países en desarrollo las pruebas rápidas/POCT tienen un enorme interés pues contribuyen a reducir la enorme carga de enfermedad que soportan. Permiten pasar de administrar tratamientos sindrómicos (dirigidos de forma ciega y simultánea frente a varios patógenos productores de un mismo síndrome) a administrar tratamientos etiológicos (dirigidos de forma específica frente al patógeno causal). Se evita el uso innecesario de antimicrobianos y la aparición de resistencias, se reduce el coste y se interrumpe de forma más eficaz la cadena de transmisión de la infección. Pero existen problemas, pues aspectos como el coste, la necesidad de refrigeración de los reactivos o requerimientos de suministro eléctrico (por ejemplo, para un microscopio) pueden suponer que pruebas muy útiles en un determinado entorno pueden no serlo en otro. Por ello todos los requisitos ASSURED son igual de importantes.
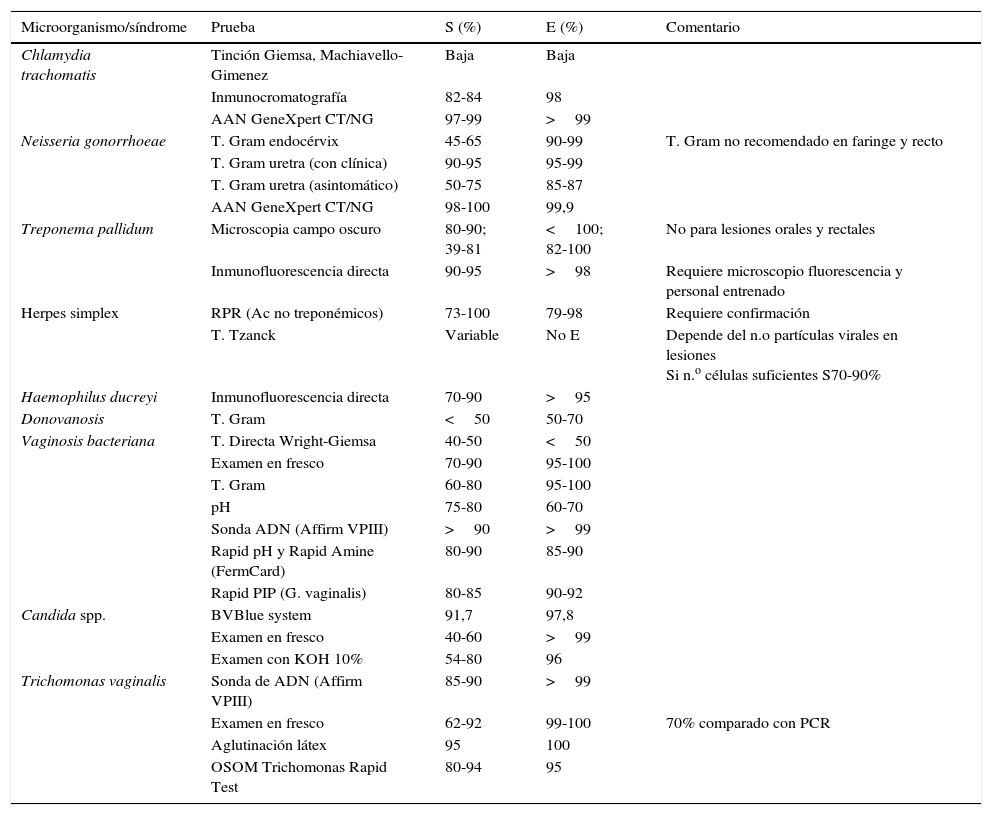
Pruebas de diagnóstico rápido en infecciones de transmisión sexual y evidencias de las mismasEn la tabla 2 se exponen las técnicas rápidas para ITS (modificado de Aznar Martín et al.8).
Listado de pruebas rápidas para infecciones de transmisión sexual
| Microorganismo/síndrome | Prueba | S (%) | E (%) | Comentario |
|---|---|---|---|---|
| Chlamydia trachomatis | Tinción Giemsa, Machiavello-Gimenez | Baja | Baja | |
| Inmunocromatografía | 82-84 | 98 | ||
| AAN GeneXpert CT/NG | 97-99 | >99 | ||
| Neisseria gonorrhoeae | T. Gram endocérvix | 45-65 | 90-99 | T. Gram no recomendado en faringe y recto |
| T. Gram uretra (con clínica) | 90-95 | 95-99 | ||
| T. Gram uretra (asintomático) | 50-75 | 85-87 | ||
| AAN GeneXpert CT/NG | 98-100 | 99,9 | ||
| Treponema pallidum | Microscopia campo oscuro | 80-90; 39-81 | <100; 82-100 | No para lesiones orales y rectales |
| Inmunofluorescencia directa | 90-95 | >98 | Requiere microscopio fluorescencia y personal entrenado | |
| Herpes simplex | RPR (Ac no treponémicos) | 73-100 | 79-98 | Requiere confirmación |
| T. Tzanck | Variable | No E | Depende del n.o partículas virales en lesiones Si n.o células suficientes S70-90% | |
| Haemophilus ducreyi | Inmunofluorescencia directa | 70-90 | >95 | |
| Donovanosis | T. Gram | <50 | 50-70 | |
| Vaginosis bacteriana | T. Directa Wright-Giemsa | 40-50 | <50 | |
| Examen en fresco | 70-90 | 95-100 | ||
| T. Gram | 60-80 | 95-100 | ||
| pH | 75-80 | 60-70 | ||
| Sonda ADN (Affirm VPIII) | >90 | >99 | ||
| Rapid pH y Rapid Amine (FermCard) | 80-90 | 85-90 | ||
| Rapid PIP (G. vaginalis) | 80-85 | 90-92 | ||
| Candida spp. | BVBlue system | 91,7 | 97,8 | |
| Examen en fresco | 40-60 | >99 | ||
| Examen con KOH 10% | 54-80 | 96 | ||
| Trichomonas vaginalis | Sonda de ADN (Affirm VPIII) | 85-90 | >99 | |
| Examen en fresco | 62-92 | 99-100 | 70% comparado con PCR | |
| Aglutinación látex | 95 | 100 | ||
| OSOM Trichomonas Rapid Test | 80-94 | 95 |
E: especificidad; S: sensibilidad.
Fuente: modificado de Aznar Martín et al.8.
La microscopia y el cultivo son las determinaciones que se deben realizar rutinariamente a las mujeres sintomáticas (nivel de evidencia III, B)9. La observación microscópica de levaduras en el exudado vaginal mediante visualización en fresco o tras tinción de Gram tiene la ventaja de la rapidez, pero su sensibilidad es baja (50%).
Criterios para el diagnóstico de la candidiasis vaginal (nivel de evidencia III, B)10:
- -
Ausencia de olor a pescado en la «prueba de Whiff» con solución de hidróxido potásico en espéculo y en la prueba de olor a amina en el porta son de apoyo, ya que la candidiasis no suele coexistir con la vaginosis bacteriana o la infección por TV, pero no es diagnóstico.
- -
Presencia de levaduras o pseudohifas en el examen en fresco del exudado vaginal (40-60% de sensibilidad).
- -
Presencia de levaduras o pseudohifas en la tinción de Gram del exudado vaginal (hasta un 65% de sensibilidad).
El sistema BD Affirm VP III (Becton Dickinson, Franklin Lakes, New Jersey, Estados Unidos) determina mediante hibridación la presencia de material genético de TV, Gardnerella vaginalis (GV) y determinadas especies de Candida (Candida albicans, Candida glabrata, Candida kefyr, Candida krusei, Candida parapsilosis y Candida tropicalis), con una sensibilidad para Candida del 85-90% y una especificidad de >99%. Los resultados se consiguen en menos de 1h.
ChancroideActualmente está indicada la utilización de la técnica de PCR para la detección de Haemophilus ducreyi (HD), debido a la baja sensibilidad de la tinción de Gram (la típica en «banco de peces» con bacilos gramnegativos pequeños pleomórficos). La microscopia tiene una sensibilidad del 50% comparada con el cultivo, y además los falsos positivos son frecuentes11. Existe comercializada una PCR en formato múltiple para HD y TP.
ClamidiasLa mayoría de las pruebas disponibles para el diagnóstico se realizan en el laboratorio y pueden presentar demora entre la recogida y el resultado.
La tinción de Gram uretral es la prueba estándar de diagnóstico de la uretritis no gonocócica, pero es dependiente del observador y tiene baja especificidad, por eso actualmente se está introduciendo también el uso del citómetro de flujo para detectar leucocituria en la orina como un marcador inflamatorio de uretritis no gonocócica (UNG) por CT y Mycoplasma genitalium (MG)12.
Las pruebas POCT basadas en EIA tienen sensibilidad reducida, si bien nuevos formatos presentan sensibilidades entre el 82-84% comparado con técnicas de amplificación de ácidos nucleicos (AAN)13,14.
Las pruebas de AAN son la referencia diagnóstica, pero, en general, se realizan en el laboratorio y su realización dura horas. Nuevos formatos como la AAN isotérmica (LAMP) está disponible comercialmente, ofrece buena sensibilidad (97,1%) y especificidad (97,9%), y el tiempo de ejecución de la técnica es menor de 1h, pero la realización es compleja y debe realizarla personal entrenado, por lo que no se puede emplear como POCT.
Las nuevas técnicas basadas en AAN (GeneXpert CT/NG, Cepheid, Sunnyvale, CA, Estados Unidos) son adecuadas para muestras genitales y reducen el tiempo requerido para emitir el resultado15. En muestras extragenitales requieren más validaciones16. Su sensibilidad es muy elevada (97-99%) así como su especificidad (>99%) tanto para muestras vaginales, endocervicales y de orina17.
Linfogranuloma venéreo (LGV)El diagnóstico requiere sospecha clínica, y para su confirmación son necesarias pruebas de laboratorio muy especializadas. En primer lugar, debe demostrarse la presencia de CT en las lesiones, habitualmente mediante técnicas de AAN. Las muestras empleadas son tanto genitales como extragenitales: rectales, faríngeas y orina18. Las muestras positivas para clamidia deben valorarse en un segundo tiempo mediante una PCR específica para el ADN de clamidias productoras de LGV. También se emplean técnicas de tipificación mediante RFLP o mediante secuenciación. Por todo ello, no existe actualmente un método rápido de detección, aunque la PCR de GeneXpert podría cumplir estos criterios, pero se suele utilizar en un segundo paso, cuando se ha detectado ya la presencia de clamidia.
GonocociaEl diagnóstico de gonococia se establece mediante la detección de NG en el lugar de la infección. El método a usar dependerá de la clínica, de las condiciones de transporte al laboratorio y de las pruebas disponibles.
Tinción de Gram para uretritis: la tinción de Gram es una técnica rápida y tan sensible como el cultivo en la uretritis sintomática en hombres, pero es poco sensible en otras localizaciones. Se debe observar con el objetivo de ×1.000 con aceite de inmersión, durante al menos 2min, buscando la presencia de leucocitos polimorfonucleares (PMN), núcleo rosa y citoplasma sin color, usualmente >4-5 leucocitos PMN por campo de inmersión. Si se realiza una tinción de Gram de orina se recomienda recoger los primeros 10-15ml de la primera parte de la micción y observar el sedimento después de centrifugar para observar la presencia de ≥10PMN. El gonococo aparece como cocos gramnegativos ovales, arriñonados y en parejas intra y extracelularmente8. En muestras uretrales de varones sintomáticos ofrece una sensibilidad elevada (90-95%) y permite el diagnóstico inmediato (III, C)19. La sensibilidad de la misma muestra en varones asintomáticos es claramente inferior (50-75%). No se recomienda en muestras rectales de pacientes sintomáticos ni en uretrales de mujeres (III, C). Tampoco se debe emplear en muestras faríngeas.
El criterio clásico para determinar la existencia de una uretritis es la observación de 4-5 PMN con el objetivo de campo de inmersión y presencia o ausencia de diplos gramnegativos, sea uretritis gonocócica o no gonocócica20. Este criterio se basó en la mejor sensibilidad y especificidad establecida con el cultivo de NG y de CT, pero con los sistemas de AAN se ha visto que para las UNG es demasiado estricto, considerando además que hay variación entre microscopistas y que la sensibilidad varía en función del grado de uretritis (las de bajo grado dan más falsos negativos). Considerar que con <5 PMN no hay uretritis hace perder un 32% de los casos por CT, un 37% por MG, un 38% por adenovirus y un 44% por virus herpes, de lo que se deduce que no es un buen punto de corte para excluir la infección21. Distintos trabajos22-26 ponen de manifiesto que para determinar la existencia de uretritis, un punto de corte de ≥5 PMN es poco sensible (tabla 3), y que bajarlo a ≥2 PMN aumenta la sensibilidad (tabla 4).
Tinción de azul de metileno para uretritis: otro aspecto a considerar en las tinciones es si hay superioridad de la tinción de Gram frente a otras. Se ha comparado la tinción de Gram con la tinción de azul de metileno y con una mezcla de azul de metileno y violeta de genciana (4/1 partes)27,28, que favorece la visualización intra o extracelular de los diplococos.
La principal ventaja es que el tiempo de realización es menor: 4min (Gram) frente a 10-15s (azul de metileno), con una sensibilidad del 97,3%, una especificidad del 99,6% y una concordancia del 100%. Aunque la morfología bacteriana no se ve con sus características tintoriales en el azul de metileno, no es un factor importante para visualizar la presencia de PMN y con ello, si existe uretritis.
Tinción de Gram para cervicitis: se realiza del exudado de cérvix y se considera que >10 PMN con el objetivo ×1.000 es sugestivo de infección.
Métodos de AAN: la detección de NG mediante AAN es más sensible que el cultivo y puede emplearse sobre una amplia variedad de muestras: uretral, orina en el varón, endocervical o vaginal en la mujer. La muestra de orina en la mujer tiene menor sensibilidad y no es una muestra óptima (II, B)29.
En recto y faringe es más sensible que el cultivo, pero las muestras positivas deben confirmarse mediante otra técnica de AAN que emplee una diana diferente (III, C).
De todas formas, con los formatos actuales las técnicas de AAN no se pueden considerar pruebas rápidas, aunque la incorporación de la técnica LAMP hace que sea adecuada dada su rapidez, sensibilidad y especificidad. Existe comercializada una técnica LAMP de idéntico fabricante, formato y características a la ya mencionada para clamidia, que aunque es rápida (<1h), no puede emplearse como POCT debido a su complejidad.
La técnica de AAN GeneXpert CT/NG, de características ya citadas en el apartado de «Clamidias», presenta excelente sensibilidad (98-100%) y especificidad (99,9%) en muestras vaginales, endocervicales y de orina de varones, y con resultados inferiores en muestras de orina de mujeres17.
SífilisLas pruebas rápidas para el diagnóstico de la sífilis mediante la detección de anticuerpos han demostrado excelentes resultados en el cribado prenatal de sífilis, especialmente en países en desarrollo. Las oportunidades de acceder a las gestantes son escasas, y el diagnóstico, y en su caso el tratamiento, ha de ser en el mismo momento de la consulta. Se calcula que en el África subsahariana, con seroprevalencia de sífilis del 8,3%, solo el 38% de las gestantes tienen acceso al cribado neonatal, por lo que se calcula que medio millón de niños mueren todos los años debido a las secuelas de una sífilis congénita6. Frente a las técnicas serológicas de laboratorio que se emplean en los países desarrollados y que precisan centrífuga, las nuevas técnicas de inmunocromatografía pueden considerarse auténticas POCT ya que pueden realizarse en sangre total obtenida por punción digital, los reactivos no precisan refrigeración y obtienen resultados en 15-20min. Aunque son fáciles de realizar, es necesario seguir estrictamente las instrucciones del fabricante para garantizar su exactitud. Emplean antígenos recombinantes y captan anticuerpos treponémicos específicos, por lo que la realización en exclusiva de este test induce tratamientos innecesarios en pacientes previamente tratados y curados en los que persisten anticuerpos treponémicos de por vida. Sería ideal, en estos casos positivos en el cribado inicial, poder recurrir a laboratorios de referencia para determinar la actividad de la enfermedad mediante pruebas no treponémicas. Se ha comercializado un sistema POCT dual que determina por separado la presencia de anticuerpos treponémicos y no treponémicos, lo que permite la confirmación diagnóstica cuando ambos son positivos, pero la ausencia de cuantificación de los anticuerpos no treponémicos impide determinar el título inicial para el control del tratamiento. También es posible la determinación dual en el mismo ensayo de anticuerpos frente a la sífilis y frente al VIH.
En nuestro entorno las cosas son muy diferentes, y las pruebas serológicas se llevan a cabo habitualmente en el contexto de las demás pruebas de laboratorio, y un resultado inicial positivo de una prueba no treponémica se confirmaría con otra prueba treponémica, y al contrario, si empleamos una prueba inicial treponémica, habitualmente un EIA, el resultado positivo lo confirmamos con una prueba no treponémica (algoritmo inverso). Son determinaciones que se realizan de forma programada en el laboratorio.
Pero no cabe duda que en ciertas situaciones en las que la inmediatez del diagnóstico destaque sobre otras consideraciones, la realización de un RPR solo precisa de una centrífuga, del reactivo y del conocimiento de la técnica por parte del encargado de llevarla a cabo.
La microscopia de campo oscuro requiere de la existencia de un microscopio de dichas características (que no todos los laboratorios tienen) y de un microscopista experto en esta técnica de cierta complejidad para el observador. Muestras no genitales, especialmente las orales, pueden contener treponemas no patógenos que condicionan falsos positivos, por lo que no se recomienda su empleo. Existe una recomendación II, A para la realización de microscopia de campo oscuro sobre muestras de chancro siempre que se disponga de un microscopista experto y de un equipo adecuado30.
Por el contrario, las técnicas de PCR sí se pueden emplear en muestras orales y en otras muestras extragenitales y genitales, con un grado de recomendación I, A30, puesto que los treponemas comensales no interfieren con la técnica. Son técnicas solo disponibles en centros de referencia, pero tampoco se consideran de respuesta rápida a no ser que sean tipo LAMP.
TricomoniasisEl examen en fresco es de fácil realización, rápido, de bajo coste y elevada especificidad (98%), aunque tiene baja sensibilidad (62-92%) y es dependiente del observador. Para su realización se mezcla en un portaobjetos una gota de secreción uretral o vaginal con una gota de suero fisiológico o salino al 0,5% atemperado a 37°C, se pone un cubreobjetos y se observa al microscopio para observar la movilidad característica de las tricomonas. La preparación debe leerse antes de pasados 10min desde la toma de la muestra, pues las tricomonas disminuyen su movilidad característica pasado ese tiempo, con lo que se dificulta su identificación31.
Como ya se ha citado en el apartado de «Candidiasis», el sistema BD Affirm VP III también determina la presencia de TV, en este caso con una sensibilidad del 89,2% y una especificidad del 99,3% comparado con el cultivo.
Existen técnicas POCT como OSOM Trichomonas Rapid Test (Sekisui Diagnostic, Hartwell Place, Lexington, Estados Unidos), que determina la presencia de antígeno y que ha demostrado elevada sensibilidad (80-94%) y especificidad (95%). No requiere instrumentación y da los resultados en 30min, pero hay que tener en cuenta que son posibles los falsos positivos (IIb, B)32.
Virus del herpes simplex (VHS)Existen varias técnicas rápidas:
- a)
Microscopia óptica. No es una técnica adecuada. El examen directo mediante la tinción de Tzanck o de Papanicolaou es poco sensible e inespecífico. No diferencia entre VHS-1 y 2, y las inclusiones intranucleares tipo Cowdry A no son exclusivas del VHS. Además, un resultado negativo no descarta la posibilidad de herpes genital.
- b)
Microscopia electrónica. Está en desuso ya que requiere concentraciones superiores a 108viriones/ml. Proporciona resultados rápidos, pero es poco sensible y requiere un equipo no disponible generalmente en laboratorios clínicos.
- c)
Inmunofluorescencia directa. La detección de antígenos del VHS se puede realizar mediante inmunofluorescencia o por técnicas inmunoenzimáticas. Son técnicas rápidas con una sensibilidad y especificidad en pacientes sintomáticos que oscilan entre el 70 y el 90%. Sobre muestra directa la sensibilidad disminuye a medida que evoluciona la lesión en el tiempo. El empleo de anticuerpos monoclonales aporta una buena especificidad y permite diferenciar VSH-1 y 2. Actualmente se emplea más como complemento para la identificación vírica en los cultivos celulares.
- d)
Las técnicas de AAN son las recomendadas para el diagnóstico del herpes genital (Ib, A)33. La detección de ADN del virus mediante PCR incrementa la detección en un 11-71% comparado con el cultivo. Permite, además, condiciones menos estrictas que el cultivo en cuanto a almacenamiento y transporte de las muestras. Permite la diferenciación entre VHS-1 y 2, que debería establecerse en todos los nuevos diagnósticos (III, B). No se precisa confirmación de los resultados positivos.
El diagnóstico de vaginosis puede realizarse basándose en 3 criterios (Amsel, Nugent o Ison) (II, B)10.
Los criterios clínicos de Amsel34 están basados en la presencia de 3 de los siguientes síntomas o signos: a) flujo vaginal fino, homogéneo, blanco, adherido a las paredes vaginales y uniforme; b) pH vaginal>4,5; c) olor a pescado tras añadir a la muestra KOH al 10%, y d) más de un 20% de células clave en preparaciones en fresco (microscopio con el objetivo ×40).
Puede confirmarse por criterios objetivos microscópicos visualizados en la tinción de Gram del exudado vaginal mediante la puntuación de Nugent35 (tabla 5). Se considera el patrón oro. El diagnóstico microbiológico de la vaginosis bacteriana se realiza mediante tinción de Gram del exudado vaginal, determinando la cantidad relativa de los morfotipos característicos de la microbiota vaginal alterada (bacilos grampositivos, gramnegativos y bacterias curvas) y la presencia de células clave (células epiteliales tapizadas de morfotipos grampositivos y gramnegativos que pierden los contornos). La citología cervical teñida por el método de Papanicolaou no es un método adecuado por su baja sensibilidad.
Interpretación de los criterios de Nugent
| Puntuación | Bacilos grampositivos (Lactobacillus spp.) | Bacilos pequeños gramnegativos (Gardnerella vaginalis) | Bacilos curvados gramnegativos (Mobilluncus spp.) |
|---|---|---|---|
| 0 | 4+ (>30 morfotipos/campo) | 0 | 0 |
| 1 | 3+ (5-30 morfotipos/campo) | 1+ (<1 morfotipo/campo) | 1+ 2+ (<5 morfotipos/campo) |
| 2 | 2+ (1-4 morfotipos/campo) | 2+ (1-4 morfotipos/campo) | 3+ 4+ (>5 morfotipos/campo) |
| 3 | 1+ (<1 morfotipo/campo) | 3+ (5-30 morfotipos/campo) | – |
| 4 | 0 | 4+ (>30 morfotipos/campo) | – |
Sin embargo, la guía BASHH recomienda (gradoC) el uso de los criterios de Ison y Hay36, pues reflejan las posibilidades reales de microbiota mejor que los criterios de Nugent.
Grado 0: No se relaciona con vaginosis bacteriana; solamente células epiteliales, sin morfotipos de lactobacilos. Puede indicar uso reciente de antibióticos.
Grado 1 (normal): predominan los morfotipos de Lactobacillus.
Grado 2 (intermedio): microbiota mixta con algunos lactobacilos presentes, pero también presenta morfotipos de Gardnerella o Mobiluncus.
Grado 3 (vaginosis bacteriana): predominan morfotipos de Gardnerella y/o Mobiluncus; se observan células clave; lactobacilos muy escasos o ausentes.
Grado 4: no se relaciona con vaginosis bacteriana; solo se observan cocos grampositivos, sin lactobacilos.
También existen sistemas comerciales pero algunos no están comercializados en España:
OSOM BVBlue (Sekisui Diagnostic, Hartwell Place, Lexington, Estados Unidos), mide niveles de sialidasa.
Pip Activity TestCard (Litmus Concepts Inc, Santa Clara, California, Estados Unidos), valora prolinaaminopeptidasa.
BD Affirm VP III (Becton Dickinson, Franklin Lakes, New Jersey, Estados Unidos), mediante una sonda de ADN detecta elevadas concentraciones de GV, con sensibilidad mayor del 90% y especificidad mayor del 99%.
Se han descrito sistemas basados en PCR, pero no están comercializados.
Pruebas a la cabecera del enfermo (POCT) y plataformas múltiplesEn relación con las pruebas POCT, las pruebas más desarrolladas actualmente son para el VIH y después para TP; en el caso del gonococo siguen teniendo los mismos problemas de reacciones cruzadas, y hay escasa experiencia en otras como las utilizadas para el VPH o VHS.
Se están desarrollando plataformas múltiple, como por ejemplo la diseñada para 9 patógenos por FilmArray (BioFire Diagnostics, Salt Lake City, Utah, Estados Unidos), con primeros resultados prometedores pero aún no comercializada37.
Futuro de las pruebas rápidas en infecciones de transmisión sexualLograr el control de las ITS va a depender en gran medida de disponer de diagnósticos etiológicos que, además de sensibles y específicos, sean rápidos y que permitan el tratamiento etiológico inmediato. La OMS así lo recomienda en la Estrategia mundial del sector de la salud contra las infecciones de transmisión sexual 2016-202138.
Un diagnóstico rápido puede conseguirse si se dispone de un laboratorio en las inmediaciones de la consulta con técnicas rápidas y personal dispuesto para su ejecución inmediata. Esto puede ser posible en algunos centros muy especializados, pero las tendencias de centralización de los laboratorios van en el sentido contrario. Las PCR múltiple con resultados en 1-2h pueden ser aquí una alternativa, entre ellas GenXpert (Cepheid, Sunnyvale, California, Estados Unidos).
También puede conseguirse dotando a las consultas de material básico de laboratorio (reactivos de tinción, centrífugas y microscopios) y formando al clínico en su manejo, situación que si bien existe en algunos centros, no parece que sea fácil de generalizar.
El futuro del diagnóstico rápido pasa más bien por el desarrollo e implementación de pruebas POCT que permitan diagnosticar la mayor cantidad posible de patógenos (idealmente en formato múltiple) y que cumplan la mayor parte, si no todos, los criterios ASSURED propuestos por la OMS. Disponemos de pruebas rápidas para la sífilis y para el VIH, pero todavía no disponemos de verdaderas pruebas rápidas que a pie del enfermo y en pocos minutos nos permitan el diagnóstico de infecciones muy prevalentes y curables como las producidas por CT, TV o NG. En general, las técnicas disponibles no alcanzan los niveles de sensibilidad y especificidad proporcionados por las técnicas de PCR.
Entre las pruebas más prometedoras descritas en la literatura, podemos citar el ensayo para CT con la tecnología microwave accelerated metal enhanced fluorescence (MAMEF), que en 9min proporciona resultados con sensibilidad y especificidad del 82 y 93%, respectivamente39.
También se depositan esperanzas en las técnicas microfluídicas, que son microsistemas que integran las operaciones de ensayo y la preparación de la muestra en un chip, con las ventajas que requieren cantidades de muestra muy pequeñas, menor tiempo de respuesta y son portátiles. En general, estas técnicas funcionan bien para la detección de anticuerpos debido a la abundancia de moléculas diana. Para otras muestras, como la orina o las obtenidas con un hisopo, será necesario el procesamiento previo de la muestra antes de introducirla en el microsistema. Presenta limitaciones para la detección de antígenos debido a que pueden encontrarse en la muestra pocas moléculas diana.
El futuro también pasa por la determinación de la presencia de resistencias antimicrobianas, especialmente importante para NG o MG. Se está trabajando en formatos de arrays y microfluidos, por el momento solo en laboratorios muy especializados, aunque lo ideal sería que pudiesen usarse en la consulta a pie del enfermo.
Conflicto de interesesNo existe.