Un grupo de expertos de la Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica (SEIMC) y de la Sociedad Española de Oncología Médica (SEOM) han revisado en este documento los principales aspectos que deben considerarse en la evaluación de los pacientes con cáncer sólido y complicaciones infecciosas. Para ello se han establecido unas recomendaciones sobre la profilaxis de las infecciones más prevalentes en estos pacientes, el uso de vacunas, las medidas de control de la infección por catéteres vasculares y la prevención de la infección ante determinadas maniobras quirúrgicas. A continuación, se han revisado los criterios de manejo de la neutropenia febril y del uso de factores estimulantes de colonias, para terminar dando una serie de pautas sobre el tratamiento del paciente oncológico con infección grave. El documento se completa con una serie de medidas para el control de la infección hospitalaria.
A group of experts from the Spanish Society of Infectious Diseases and Clinical Microbiology (SEIMC) and the Spanish Society of Medical Oncology (SEOM) have reviewed in this paper the main aspects to be considered in the evaluation of patients with solid cancer and infectious diseases. They have established a series of recommendations on the prevention of the most prevalent infections in these patients, the use of vaccines, the control measures of vascular catheter infection and prevention of infections before certain surgical procedures. Also the criteria for management of febrile neutropenia and the use of colony-stimulating factors were revised. Finally they provide a series of recommendations for the treatment of cancer patients with severe infection. The document is completed with a series of measures for the control of hospital infection.
A lo largo de las 2 últimas décadas, se han logrado notables avances en el tratamiento del paciente oncológico. Sin duda, uno de los más destacables ha sido la reducción en la morbimortalidad por complicaciones infecciosas como consecuencia de los progresos logrados en la prevención y tratamiento de estas infecciones, así como el acortamiento del periodo de neutropenia gracias al empleo de factores de crecimiento hematopoyético.
A pesar de estos avances, las complicaciones infecciosas continúan siendo una de las principales causas de muerte en el paciente con cáncer. Estos pacientes están sometidos a un mayor riesgo de reactivación de ciertas infecciones y tienen un riesgo incrementado de padecer infecciones nosocomiales como consecuencia de las intervenciones quirúrgicas, el uso de catéteres venosos o urinarios y otros dispositivos, así como a las manipulaciones a las que son sometidos. La aparición de microorganismos multirresistentes en los últimos años ha contribuido a dificultar el abordaje antibiótico de estos pacientes. Por otro lado, el uso cada vez más frecuente de nuevos anticuerpos monoclonales y terapias biológicas ha incrementado en estos enfermos el riesgo de padecer determinadas infecciones graves.
Aunque existen numerosas guías clínicas dirigidas al paciente hematológico, son escasas las guías dirigidas específicamente al paciente con un tumor sólido. Por ello, expertos de la Sociedad Española de Enfermedades Infecciosas (SEIMC) y la Sociedad Española de Oncología Médica (SEOM) han decidido realizar este documento, en el que se revisa la información existente en este tema y se realizan una serie de recomendaciones basadas en la mejor evidencia disponible, para que sirvan a oncólogos e infectólogos en su práctica clínica diaria.
Evaluación inicial del paciente oncológicoLa evaluación inicial del paciente oncológico pretende detectar infecciones activas o latentes con riesgo de reactivación en pacientes con cáncer sólido que van a recibir un tratamiento potencialmente inmunosupresor.
La evaluación clínica debe incluir: (1) antecedentes de enfermedades infecciosas que pueden haber quedado latentes y reactivarse en caso de inmunosupresión; (2) historia epidemiológica completa que incluya los contactos con pacientes con patología infecciosa, así como con otros pacientes inmunodeprimidos; (3) procedencia del paciente y las estancias o viajes a países fuera de nuestro entorno con enfermedades endémicas que potencialmente puedan reactivarse; y (4) antecedentes de posibles reacciones medicamentosas a antibióticos. En la mujer, además, se debe aconsejar la revisión ginecológica y el cribado del virus del papiloma humano (VPH).
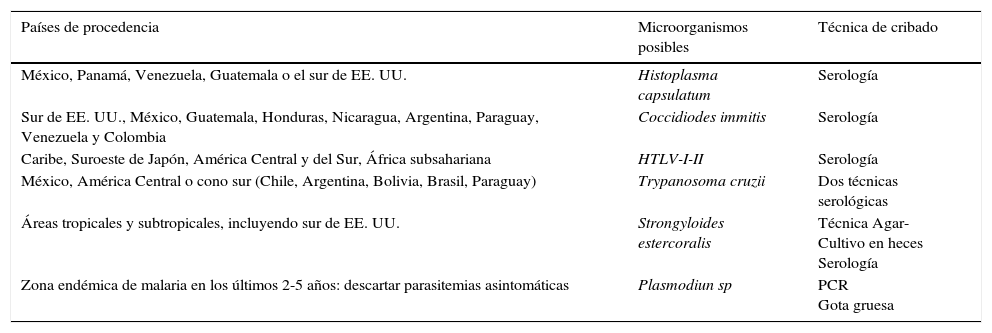
La evaluación microbiológica inicial está destinada a realizar un cribado de las principales infecciones crónicas o latentes que puedan reactivarse en caso de inmunosupresión en el paciente y dependerá del tipo de tratamiento quimioterápico recibido y del riesgo de inmunosupresión concreto de cada paciente oncológico. En casos indicados según el tratamiento y el riesgo de inmunosupresión, sería conveniente conocer la serología para: (1) virus de la hepatitis A, B y C (VHA, VHB y VHC); (2) virus varicela zoster (VVZ); y (3) virus de inmunodeficiencia humana (VIH). Además, se debe descartar la existencia de tuberculosis (TBC) latente mediante la realización de una prueba de Mantoux y/o alguna técnica de cuantificación de liberación de gamma-interferón (IGRA) en todo paciente con antecedentes dudosos sobre dicha enfermedad, en contacto de afectos o en poblaciones de riesgo como los institucionalizados. En pacientes procedentes de determinadas áreas geográficas es conveniente tener en cuenta determinadas enfermedades regionales (tabla 1).
Enfermedades regionales o importadas según el área geográfica de procedencia
| Países de procedencia | Microorganismos posibles | Técnica de cribado |
|---|---|---|
| México, Panamá, Venezuela, Guatemala o el sur de EE. UU. | Histoplasma capsulatum | Serología |
| Sur de EE. UU., México, Guatemala, Honduras, Nicaragua, Argentina, Paraguay, Venezuela y Colombia | Coccidiodes immitis | Serología |
| Caribe, Suroeste de Japón, América Central y del Sur, África subsahariana | HTLV-I-II | Serología |
| México, América Central o cono sur (Chile, Argentina, Bolivia, Brasil, Paraguay) | Trypanosoma cruzii | Dos técnicas serológicas |
| Áreas tropicales y subtropicales, incluyendo sur de EE. UU. | Strongyloides estercoralis | Técnica Agar- Cultivo en heces Serología |
| Zona endémica de malaria en los últimos 2-5 años: descartar parasitemias asintomáticas | Plasmodiun sp | PCR Gota gruesa |
HTLV-I-II: virus linfotrópicos de células T humanas tipo I y II; PCR: reacción en cadena de la polimerasa.
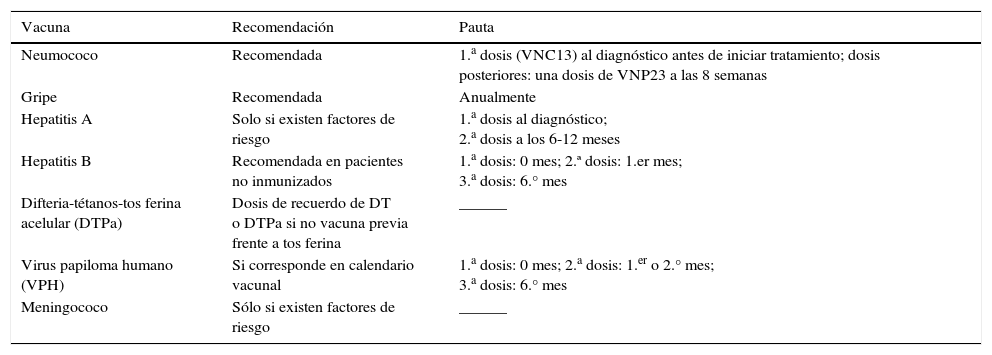
Las vacunas indicadas en el paciente con cáncer sólido están descritas en la tabla 2 y deben ser vacunas inactivadas1. Las vacunas con microorganismos vivos atenuados como rotavirus, triple vírica (sarampión, parotidis, rubéola) y varicela están contraindicadas durante la quimioterapia2.
Vacunas recomendadas en adultos con tumores sólidos
| Vacuna | Recomendación | Pauta |
|---|---|---|
| Neumococo | Recomendada | 1.a dosis (VNC13) al diagnóstico antes de iniciar tratamiento; dosis posteriores: una dosis de VNP23 a las 8 semanas |
| Gripe | Recomendada | Anualmente |
| Hepatitis A | Solo si existen factores de riesgo | 1.a dosis al diagnóstico; 2.a dosis a los 6-12 meses |
| Hepatitis B | Recomendada en pacientes no inmunizados | 1.a dosis: 0 mes; 2.ª dosis: 1.er mes; 3.a dosis: 6.° mes |
| Difteria-tétanos-tos ferina acelular (DTPa) | Dosis de recuerdo de DT o DTPa si no vacuna previa frente a tos ferina | ______ |
| Virus papiloma humano (VPH) | Si corresponde en calendario vacunal | 1.a dosis: 0 mes; 2.a dosis: 1.er o 2.° mes; 3.a dosis: 6.° mes |
| Meningococo | Sólo si existen factores de riesgo | ______ |
Los pacientes con tumores sólidos activos y aquellos en tratamiento con quimioterapia deben recibir anualmente la vacuna antigripal2. Se recomienda que los pacientes sean vacunados frente al neumococo según las pautas establecidas para enfermos inmunodeprimidos.
Dependiendo de las características antes comentadas (tipo de quimioterapia, duración de ésta, situación clínica del paciente), es aconsejable emplear una dosis de recuerdo de la vacuna antitetánica y antidiftérica. Los pacientes que no hayan sido vacunados contra la tos ferina se recomienda utilizar la vacuna difteria-tétanos-tos ferina acelular (DTPa). Asimismo, hay que considerar la vacunación de VPH, las del meningococo y las de VHA, siempre que haya indicación específica. La administración de la vacuna frente a VHB debe ser valorada en aquellos pacientes no inmunizados, tras evaluar su situación serológica y clínica.
Los pacientes deben recibir las vacunas indicadas antes de comenzar la quimioterapia. En el caso de vacunas inactivadas, se recomienda su administración al menos 2 semanas antes del inicio del tratamiento (salvo la vacuna antigripal, que se administrará anualmente, incluso durante el tratamiento con quimioterapia), mientras que las vacunas vivas atenuadas deben ser empleadas al menos 4 semanas antes de iniciar el tratamiento3.
Prevención de la hepatitis BEl cribado del VHB es especialmente importante en pacientes considerados de alto riesgo (por ejemplo, los pacientes tratados con everolimus, temozolomida, rituximab, etc.), y se debe valorar, según juicio médico, en el resto de pacientes. Se llevará a cabo mediante la detección de antígeno de superficie (HBsAg), el anticuerpo del núcleo de la hepatitis B (anti-HBc) y el anticuerpo de superficie de la hepatitis B (anti-HBs). Si todo es negativo, no hay infección y el paciente debe ser vacunado antes de iniciar la terapia inmunosupresora. Si HBsAg es positivo, se debe completar el estudio con la determinación de la carga viral, el antígeno e (HBeAg), pruebas de función hepática y biopsia hepática, si procede. En función de los resultados, se puede saber si el paciente tiene una hepatitis crónica, está en fase de inmunotolerancia o es un portador inactivo de VHB. En el caso de una hepatitis crónica, el paciente debe recibir tratamiento antiviral con entecavir o tenofovir. En los otros dos casos, el paciente deberá recibir profilaxis antiviral.
Si HBsAg es negativo y anti-HBc es positivo, se trata de una hepatitis B resuelta. En este caso, independientemente de cómo sea el anti-HBs, se deben determinar niveles de ácido desoxirribonucleico (ADN) viral. Si la carga viral es positiva, se trata de una infección oculta y por tanto el paciente debe recibir profilaxis. Si la carga viral es negativa, se debe comprobar periódicamente la posibilidad de reactivación durante todo el tratamiento inmunosupresor para detectarla precozmente e iniciar el tratamiento lo antes posible. Esta monitorización se realizará mediante la determinación de la bioquímica hepática, HBsAg y/o carga viral. En pacientes de alto riesgo, la mayoría de los autores considera que se debe iniciar directamente una pauta de profilaxis4,5. Para los pacientes que no tienen factores de riesgo de HBV ni se prevee que con el tratamiento oncologico exista activación del riesgo de la enfermedad, la evidencia actual no soporta la detección del VHB antes de iniciar el tratamiento contra el cáncer6.
Prevención de la tuberculosisTodos los pacientes que, una vez descartada la enfermedad activa, tengan uno o más de los siguientes criterios deben recibir profilaxis de la TBC4-10: (1) prueba cutánea de derivado proteico purificado (PPD) positiva (≥5 mm); (2) prueba de IGRA positiva; (3) antecedentes de TBC tratada incorrectamente; (4) hallazgos radiológicos sugestivos de lesiones residuales de TBC, tales como lesiones fibronodulares apicales, engrosamiento pleural, etc.; o (5) contacto con un paciente con TBC activa. Las pautas son las habituales con las precauciones conocidas.
Prevención de la infección de catéter venoso centralActualmente, no existe suficiente evidencia para recomendar un tipo específico de catéter venoso central (CVC) de larga duración, ya sea CVC tunelizado (Hickman), «port-a-cath» (PAC), o CVC de inserción periférica (PICC); ni una localización de inserción determinada, aunque en general se desaconseja el acceso femoral por llevar asociado un mayor riesgo de infección8.
Las medidas más importantes en la prevención de infecciones de CVC son: (i) la educación y entrenamiento de los profesionales sanitarios; (ii) el cuidado estricto de la higiene de manos; y (iii) el uso de técnicas asépticas durante la colocación y el recambio de apósitos9. No se recomienda el recambio rutinario de los CVC, ni la aplicación de antimicrobianos tópicos en el punto de inserción, ya que pueden favorecer las infecciones fúngicas y la aparición de resistencias. El uso de CVC recubiertos o impregnados con antimicrobianos/antisépticos como clorhexidina y sulfadiazina de plata o minociclina/rifampicina y/o catéteres impregnados con heparina puede disminuir el riesgo de infecciones, aunque su beneficio es relativo y su coste es elevado10. No se ha demostrado que la administración profiláctica de antibióticos antes de la colocación de un CVC reduzca la incidencia de infecciones11.
Prevención de la infección tras procedimientos endoscópicosGeneralmente, no se recomienda la administración de antibióticos profilácticos antes de un procedimiento endoscópico para evitar el desarrollo de endocarditis bacteriana, ya que los casos son escasos y no existen suficientes datos que avalen su relación, ni la utilidad de los antibióticos en este contexto12.
En el caso de una colangiopancreatografía retrógrada endoscópica (CPRE), se debe considerar la administración de antibioterapia profiláctica para la cobertura de bacilos entéricos gram-negativos y enterococos en pacientes con obstrucción en los que exista la posibilidad de no conseguir un drenaje completo de la vía biliar. Si el procedimiento no logra resolver la obstrucción, se aconseja mantener el antibiótico12. En las gastrostomías percutáneas endoscópicas (PEG), la administración de antibioterapia (cefazolina, 1g iv; 30 minutos antes del procedimiento) ha demostrado reducir de forma significativa el riesgo de infección13.
Prevención de la infección por Pneumocystis jiroveciSe debe considerar la profilaxis frente a Pneumocystis jiroveci (P. jiroveci) en aquellos pacientes que van a recibir: (1) temozolamida con radioterapia; (2) fármacos que produzcan linfopenia T profunda; y (3) esteroides en dosis equivalente a ≥20mg/día de prednisona durante 4 semanas o más14.
La pauta de elección es cotrimoxazol (800/160mg, un comprimido 3 veces por semana). En caso de alergia a co-trimoxazol, se debe considerar la posibilidad de desensibilización15,16. Alternativamente, se puede usar atovaquona (1,5g/día)17, dapsona (100mg/día), aunque se debe descartar la deficiencia de glucosa-6-fosfato deshidrogenasa (G6PD)18, o pentamidina inhalada (300mg, 4 veces por semana o iv mensual)19,20. Se debe mantener la profilaxis al menos mientras dure el tratamiento quimioterápico, y se recomienda prolongarlo al menos 2 meses o hasta que la cifra de linfocitos CD4 esté por encima de 200U/mm3.
Situaciones especialesDada las características actuales de la población residente en España y las relaciones frecuentes entre distintas zonas geográficas, hay que tener en cuenta la prevención de la hiperinfestación por Strongyloides stercoralis20 y la prevención de la enfermedad de Chagas (Trypanosoma cruzi)21.
Prevención con factores estimulantes de colonias de granulocitosLa administración profiláctica de factores estimulantes de colonias de granulocitos (G-CSF) reduce la incidencia, duración y severidad de la neutropenia y previene las infecciones asociadas22. Por tanto, se debe realizar una estimación del riesgo de neutropenia febril (NF) antes del inicio de la quimioterapia, teniendo en cuenta diferentes factores, como el tipo de tumor, el esquema de quimioterapia empleado, las características del paciente o la intención del tratamiento. Se recomienda el uso profiláctico de G-CSF en aquellos pacientes con un riesgo estimado de NF superior al 20%23,24. Si el riesgo estimado se encuentra entre el 10% y el 20%, se aconseja realizar una valoración individualizada, planteando administrar G-CSF principalmente si la intención del tratamiento es curativa, con el fin de evitar retrasos y reducciones de dosis, o en pacientes de alto riesgo, como mayores de 65 años, con episodios previos de NF, afectación extensa de médula ósea, en aquellos que han sido sometidos recientemente a una cirugía extensa, sobre todo si incluye una resección intestinal. Su empleo profiláctico es más controvertido en pacientes con tumores muy avanzados, frágil estado general o nutricional, comorbilidades importantes, en los que el beneficio de la quimioterapia y más aun el de mantener una intensidad de dosis es dudoso. No está indicado el uso rutinario de G-CSF en pacientes con un riesgo menor de 10%, salvo circunstancias específicas que impliquen graves consecuencias en caso de NF.
El tratamiento con G-CSF en la NF disminuye la duración de la hospitalización y el tiempo hasta la recuperación de los neutrófilos, pero no se asocia con un beneficio en la supervivencia de los pacientes25,26. Por tanto, se debe considerar su administración en aquellos casos que se asocien con un alto riesgo de complicaciones, como ocurre ante una neutropenia severa (neutrófilos <100/mm3) o que se prevé de larga duración (>10 días). Asimismo, se debe considerar su uso en pacientes mayores de 65 años, en casos de sepsis, neumonía, infección fúngica invasiva, hospitalización en el momento de aparición de la fiebre o episodios previos de NF27.
Profilaxis antibióticaSe considera que los pacientes con tumores sólidos que reciben quimioterapia convencional tienen un bajo riesgo de sufrir complicaciones infecciosas25,28. En estos pacientes, las fluorquinolonas poseen algún efecto protector29,30, pero no disminuyen la mortalidad. En pacientes de alto riesgo, las fluorquinolonas han demostrado su efectividad en la prevención de infecciones en fase neutropénica30, especialmente en el primer ciclo de quimioterapia31. Dado el alto número de pacientes que requieren tratamiento para prevenir una infección, el coste, los efectos adversos, la aparición de superinfecciones y la selección de resistencias32–37, la profilaxis antibacteriana en pacientes de bajo riesgo que reciben quimioterapia convencional con o sin agentes biológicos no está indicada34,36. En situaciones específicas, como durante el primer ciclo de quimioterapia, cuando se prevé una neutropenia profunda y prolongada, con regímenes citostáticos muy agresivos, cuando existe alta morbilidad de base o en pacientes de edad avanzada, se considerará su administración de forma individualizada38,39.
Neutropenia febrilEvaluación del riesgo de infección en un paciente con neutropenia febrilLa tasa de complicaciones infecciosas en los pacientes con NF es del 25%-30% y la mortalidad alcanza el 11% en algunos grupos27. Sin embargo, este riesgo no es homogéneo, por lo que el sobre-tratamiento de episodios de bajo riesgo es común39. El objetivo de la evaluación del riesgo de infección en estos pacientes es predecir el riesgo de complicaciones graves y, por lo tanto, la necesidad de ingreso hospitalario y tratamiento parenteral. En la evaluación inicial se debe incluir la valoración de: (1) datos de respuesta inflamatoria sistémica, mediante la exploración de signos vitales como temperatura, frecuencia cardiaca y respiratoria; (2) datos de sepsis grave como hipotensión, signos de hipoperfusión tisular o de disfunción orgánica aguda; y (3) existencia de foco/s primarios o secundarios de infección, teniendo en cuenta el contexto clínico-epidemiológico.
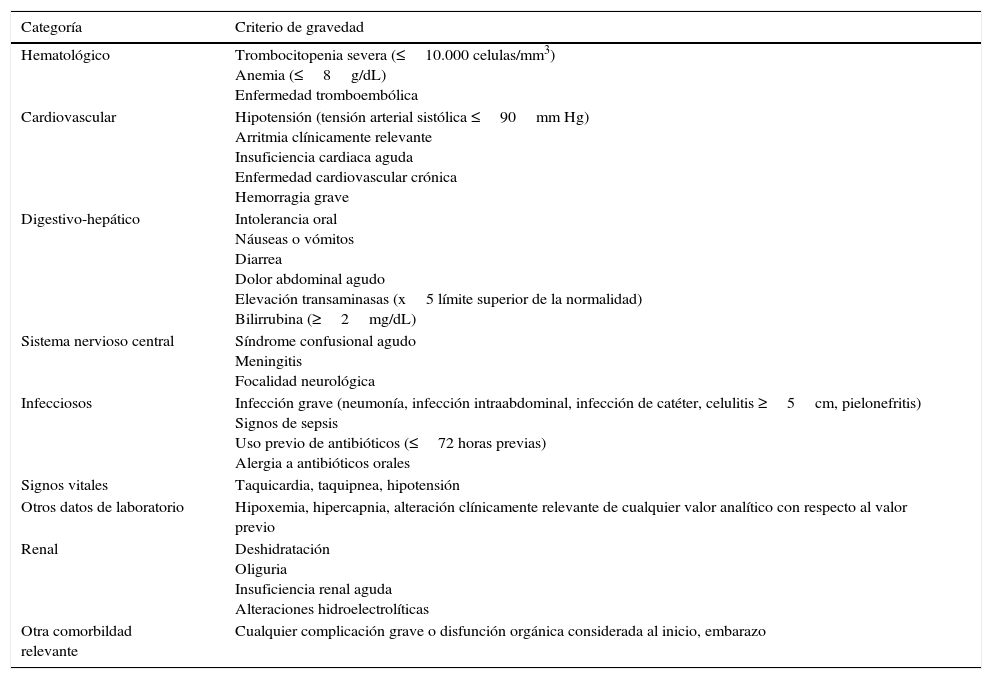
La herramienta pronóstica más validada es la escala del Multinational Association of Supportive Care in Cancer (MASCC)40, aunque no es específica de pacientes con tumores sólidos y en el 9%-15% de los episodios clasificados de bajo riesgo se pueden desarrollar complicaciones infecciosas40–42. La selección de pacientes en ensayos clínicos de tratamiento oral/ambulatorio se ha basado en criterios de exclusión, considerándose que los resultados han sido satisfactorios43. Los pacientes definidos de forma empírica como de “bajo riesgo” son aquellos que tienen neutropenia (<500 neutrófilos/mm3) durante menos de 7 días de duración, sin complicaciones en la evaluación inicial y sin disfunción orgánica aguda43,44 (tabla 3).
Criterios de riesgo de complicaciones que excluyen al paciente del manejo oral/ambulatorio
| Categoría | Criterio de gravedad |
|---|---|
| Hematológico | Trombocitopenia severa (≤10.000 celulas/mm3) Anemia (≤8g/dL) Enfermedad tromboembólica |
| Cardiovascular | Hipotensión (tensión arterial sistólica ≤90mm Hg) Arritmia clínicamente relevante Insuficiencia cardiaca aguda Enfermedad cardiovascular crónica Hemorragia grave |
| Digestivo-hepático | Intolerancia oral Náuseas o vómitos Diarrea Dolor abdominal agudo Elevación transaminasas (x5 límite superior de la normalidad) Bilirrubina (≥2mg/dL) |
| Sistema nervioso central | Síndrome confusional agudo Meningitis Focalidad neurológica |
| Infecciosos | Infección grave (neumonía, infección intraabdominal, infección de catéter, celulitis ≥5cm, pielonefritis) Signos de sepsis Uso previo de antibióticos (≤72 horas previas) Alergia a antibióticos orales |
| Signos vitales | Taquicardia, taquipnea, hipotensión |
| Otros datos de laboratorio | Hipoxemia, hipercapnia, alteración clínicamente relevante de cualquier valor analítico con respecto al valor previo |
| Renal | Deshidratación Oliguria Insuficiencia renal aguda Alteraciones hidroelectrolíticas |
| Otra comorbildad relevante | Cualquier complicación grave o disfunción orgánica considerada al inicio, embarazo |
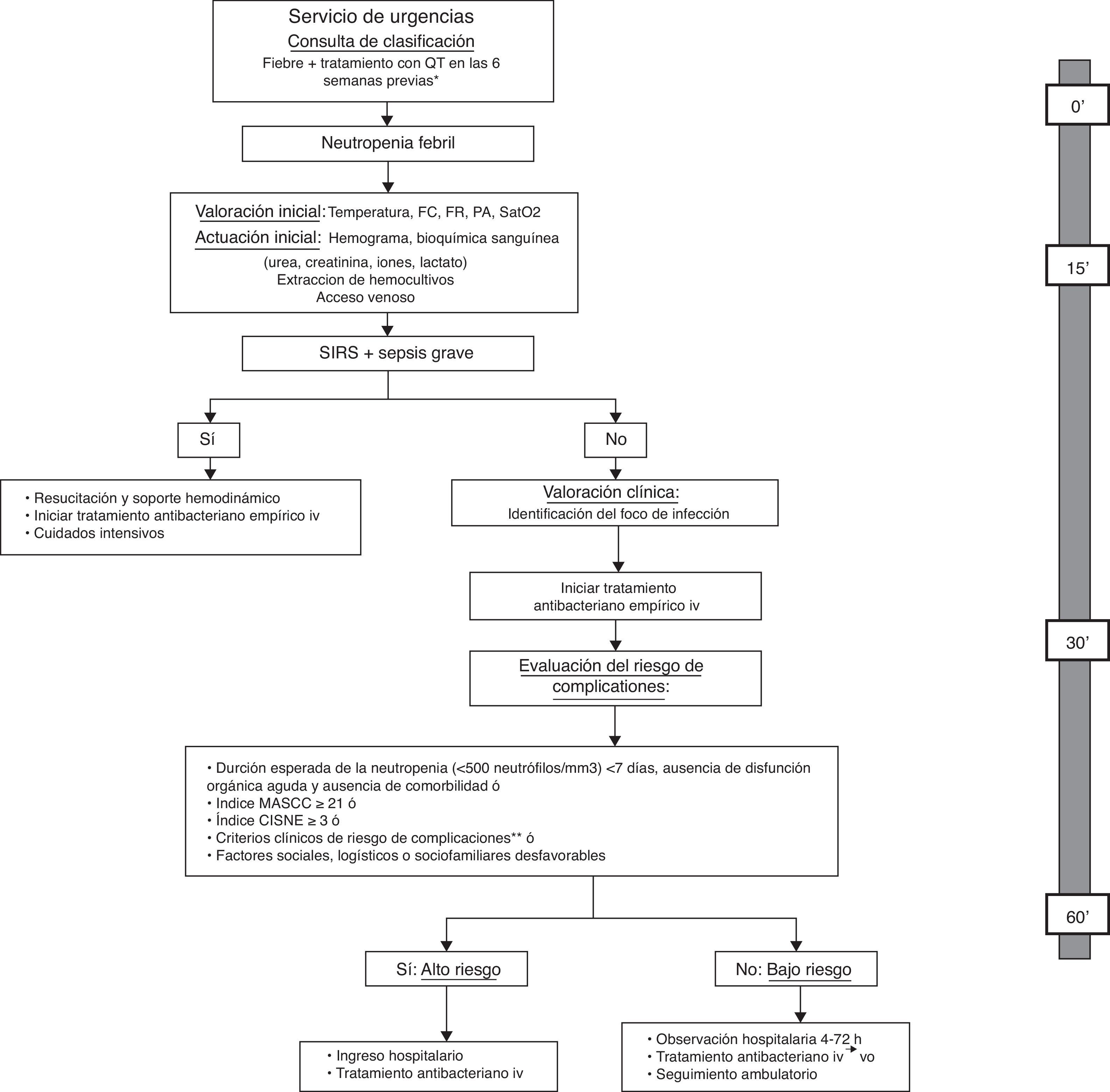
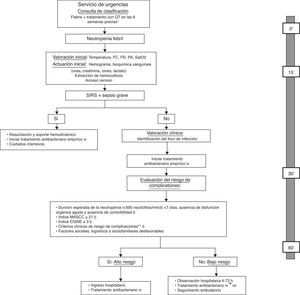
La American Society of Clinical Oncology (ASCO) recomienda evitar el manejo ambulatorio de pacientes que tengan algún criterio clínico de riesgo, y que están resumidos en la tabla 3, independientemente de la clasificación del paciente en una u otra escala de riesgo33. Además, recientemente, se ha publicado el primer índice pronóstico para predecir la incidencia de complicaciones graves en pacientes con tumores sólidos y, aparentemente, episodios estables de NF45. El Clinical Index of Stable Febrile Neutropenia (CISNE) incluye 6 predictores asociados de forma independiente con la incidencia de complicaciones graves (ECOG PS≥2 [2 puntos], bronquitis crónica [1 punto], enfermedad cardiovascular [1 punto], mucositis NCI grado≥2 [1 punto], monocitos <200/mm3 [1 punto] e hiperglicemia inducida por estrés [2 puntos]). Estos factores se integran en una escala de 0 a 8, que permite clasificar a los pacientes en tres categorías pronósticas: riesgo bajo (0 puntos), riesgo medio (1-2 puntos) y riesgo alto (≥3 puntos). La finalidad última de este índice es prevenir el alta precoz a los pacientes que, a pesar de su aparente estabilidad clínica, tienen un riesgo alto de complicaciones (≥3 puntos). Otros factores sociales, psicológicos o logísticos deben ser tenidos en cuenta para decidir la modalidad de tratamiento. En la figura 1 se propone un algoritmo de actuación para la atención de pacientes con NF en el Servicio de Urgencias que ayude al clínico en la elección de la modalidad de tratamiento.
Algoritmo de actuación para la atención inicial del paciente con neutropenia febril en el Servicio de Urgencias y evaluación del riesgo de complicaciones y de la modalidad de tratamiento, incluyendo el tiempo máximo deseable para cada una de las actuaciones.
Modificado de: Bell MS, Scullen P, McParlan D, et al. Neutropenic sepsis guideline. In edition Northern Ireland Cancer Network 2010; 1-11.
*No es necesario esperar a la confirmación analítica de la neutropenia para iniciar la evaluación; **criterios clínicos de riesgo: aparición de alteraciones o empeoramiento de disfunción orgánica, comorbilidad, alteración de signos vitales, síntomas o signos clínicos, infección focal documentada o datos analíticos o de imagen.
FC: frecuencia cardiaca; FR: frecuencia respiratoria; iv: intravenoso; MASCC: Multinational Association for Supportive Care in Cancer; PA: presión arterial; QT: quimioterapia; Sat02: saturación arterial de oxígeno; SIRS: síndrome de respuesta inflamatoria sistémica; vo: vía oral.
Aunque la hospitalización y el tratamiento intravenoso de los pacientes con NF han logrado una reducción significativa de la mortalidad, la hospitalización puede originar por sí misma múltiples problemas, tales como toxicidad por tratamientos intravenosos, aumento de los costes, exposición a patógenos nosocomiales y pérdida de calidad de vida del paciente. Por este motivo, se han desarrollado estrategias de tratamiento hospitalario o ambulatorio, según la estratificación del riesgo individual.
El tratamiento antibiótico empírico debe iniciarse lo antes posible, debido a que una demora en su inicio puede comprometer el pronóstico del paciente. Antes de iniciar el tratamiento antibiótico, se deben recoger hemocultivos (si el paciente es portador de CVC, hacer una de las extracciones a través del catéter) y muestras de posibles focos de infección en función de los datos clínicos (orina, esputo, exudado, lesiones mucosas o cutáneas, heces, líquido cefalorraquídeo, antígenos urinarios para neumococo y/o Legionella, frotis nasal para virus influenza en periodo estacional, etc.).
Tratamiento ambulatorio oralLos pacientes de bajo riesgo son candidatos a tratamiento ambulatorio, siempre que el paciente tolere la vía oral y tenga buen soporte sociofamiliar. La combinación más usada es ciprofloxacino con amoxicilina-clavulánico, y en pacientes alérgicos a β-lactámicos, ciprofloxacino con clindamicina46. En un ensayo clínico multicéntrico, aleatorizado, doble-ciego publicado recientemente, moxifloxacino resultó igual de eficaz que la combinación de amoxicilina-clavulánico con ciprofloxacino, y con menos efectos adversos gastrointestinales47. Sin embargo, moxifloxacino tiene una menor actividad antipseudomónica y mayor riesgo de hepatotoxicidad. Además es necesario tener en consideración las tasas de resistencia local a quinolonas en bacilos gram-negativos. Los pacientes que están recibiendo profilaxis con fluoroquinolonas no deben recibir tratamiento empírico con estos antibióticos por el riesgo de que la infección sea causada por bacterias que se hayan hecho resistentes a los mismos.
Los pacientes que son dados de alta con tratamiento ambulatorio oral deberán seguir un control a las 48 horas para comprobar la buena evolución clínica, los resultados de microbiología, intentar ajustar el tratamiento antibiótico y definir su duración. Si aparece un empeoramiento clínico, se debe valorar la realización de nuevas pruebas diagnósticas y el ingreso hospitalario con tratamiento antibiótico intravenoso.
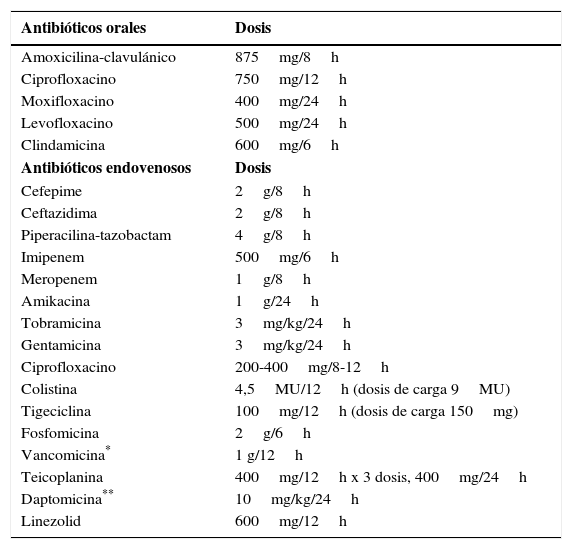
Tratamiento intravenosoLos pacientes con NF de alto riesgo precisan ingreso hospitalario y antibiótico intravenoso. Las opciones de tratamiento incluyen antibióticos β-lactámicos antipseudomónicos, como piperacilina combinado con tazobactam, cefepima, meropenem o imipenem junto con cilastatina. En muchos centros, la ceftazidima ya no se considera adecuada en monoterapia debido a su baja actividad frente a muchos microorganismos gram-positivos, como los estreptococos. En el caso de alergia a los antibióticos β-lactámicos, la alternativa es la combinación de vancomicina con aztreonam (y con metronidazol si existe un foco abdominal). En aquellos pacientes que presentan complicaciones o en los que se sospecha una infección por patógenos resistentes, se debe valorar el uso de otros fármacos, como aminoglicósidos, quinolonas, y glicopéptidos, y más ocasionalmente daptomicina, linezolid, fosfomicina, tigeciclina y rifampicina. La adición empírica de un glicopéptido al régimen antibiótico inicial no mejora en general el pronóstico de estos pacientes48 aunque puede ser considerado en casos concretos (mucositis, infección de catéter, colonización por Staphylococcus aureus (S. aureus) resistente a meticilina, hemocultivo positivo para cocos gram-positivo a la espera de antibiograma, etc). En la tabla 4 se refieren las dosis de los antibióticos orales y endovenosos de uso habitual.
Dosis de los antibióticos orales y endovenosos de uso habitual
| Antibióticos orales | Dosis |
|---|---|
| Amoxicilina-clavulánico | 875mg/8h |
| Ciprofloxacino | 750mg/12h |
| Moxifloxacino | 400mg/24h |
| Levofloxacino | 500mg/24h |
| Clindamicina | 600mg/6h |
| Antibióticos endovenosos | Dosis |
| Cefepime | 2g/8h |
| Ceftazidima | 2g/8h |
| Piperacilina-tazobactam | 4g/8h |
| Imipenem | 500mg/6h |
| Meropenem | 1g/8h |
| Amikacina | 1g/24h |
| Tobramicina | 3mg/kg/24h |
| Gentamicina | 3mg/kg/24h |
| Ciprofloxacino | 200-400mg/8-12h |
| Colistina | 4,5MU/12h (dosis de carga 9MU) |
| Tigeciclina | 100mg/12h (dosis de carga 150mg) |
| Fosfomicina | 2g/6h |
| Vancomicina* | 1 g/12h |
| Teicoplanina | 400mg/12h x 3 dosis, 400mg/24h |
| Daptomicina** | 10mg/kg/24h |
| Linezolid | 600mg/12h |
MU: millones de unidades.
Las últimas guías de la Infectious Diseases Society of America (IDSA) publicadas recientemente recomiendan el uso de un fármaco β-lactámico antipseudomónico en monoterapia como tratamiento antibiótico inicial en la NF25. Un metaanálisis encontró que la monoterapia era significativamente más ventajosa que la combinación de un β-lactámico con un aminoglucósido, con menos efectos adversos, menor morbilidad y con tasas de supervivencia similares49. No obstante, no se puede excluir completamente que algún subgrupo de pacientes sí pueda beneficiarse del uso inicial de combinaciones de antibióticos, por lo que pragmáticamente se han usado 2 tipos de estrategias: las de escalada y de desescalada. En particular, en las últimas décadas, estamos observando un aumento de las infecciones por bacterias gram-negativas en los pacientes con cáncer, y paralelamente, también estamos observando una urgencia de la multirresistencia entre estos microorganismos50,51. Ante esta situación, surge la duda de si el tratamiento empírico inicial con un antibiótico β-lactámico en monoterapia es suficientemente seguro en los pacientes con NF52, en particular cuando coexisten criterios de gravedad asociados.
La estrategia de escalada consiste en comenzar con un tratamiento intravenoso en monoterapia, y en el caso de que el paciente se deteriore o bien se aísle un patógeno resistente, la terapia se escalará a un antibiótico o combinación de antibióticos de espectro más amplio. Las ventajas de esta estrategia son que evita el uso temprano de algunos antibióticos de amplio espectro, que produce menos toxicidad, que tiene un coste económico menor y un menor riesgo de selección de resistencias, fundamentalmente a los carbapenémicos. Por el contrario, el pronóstico de los pacientes se puede ver comprometido en el caso de que los microorganismos resistentes no estén adecuadamente cubiertos desde el principio.
La estrategia de escalada se debe utilizar en aquellos pacientes de alto riesgo en las siguientes situaciones: (1) presentación clínica no complicada; (2) ausencia de factores de riesgo de infección por bacterias resistentes; y (3) en centros en los que la prevalencia de microorganismos resistentes es baja.
Las opciones terapéuticas iniciales incluyen un antibiótico β-lactámico antipseudomónico no carbapenémico como cefepime, ceftazidima, piperacilina combinado con tazobactam. Los carbapenemes deberían evitarse en pacientes sin complicaciones que carecen de factores de riesgo para bacterias resistentes. No obstante, pueden ser la opción más adecuada en pacientes con ingreso previo reciente (<1 mes), uso previo de antibióticos, o procedimientos invasivos previos, que podrían tener un mayor riesgo de infecciones por bacilos gram-negativos con betalactamasas de espectro ampliado.
Por el contrario, en la estrategia de desescalada el tratamiento antibiótico inicial administrado cubre incluso a los patógenos más resistentes. Posteriormente, la terapia se desescala a un tratamiento de menor espectro, una vez se descarta la presencia de patógenos resistentes, o bien se identifica un patógeno y se define su perfil de sensibilidad antibiótica. La principal ventaja de la desescalada es que es más probable que se logre una cobertura antibiótica inicial adecuada. En contraposición, esta estrategia conlleva a un uso muchas veces innecesario de antibióticos de amplio espectro, los médicos generalmente no suelen desescalar cuando tienen la oportunidad de hacerlo, y existe un mayor riesgo de selección de resistencias.
La estrategia de desescalada se debe utilizar: (1) en presentaciones clínicas complicadas; (2) cuando existen factores de riesgo de infección por bacterias resistentes; y (3) en aquellos centros donde la prevalencia de microorganismos resistentes es alta.
Las opciones terapéuticas iniciales incluyen: (1) monoterapia con meropenem o imipenem en pacientes gravemente enfermos o cuando existe historia previa de colonización/infección por enterobacterias productoras de β-lactamasas de espectro extendido; (2) β-lactámico antipseudomónico combinado con aminoglucósido o quinolona en pacientes gravemente enfermos o si se sospecha de la presencia de bacilos gram-negativos no fermentadores resistentes (Pseudomonas aeruginosa o Acinetobacter spp.); (3) β-lactámico junto con colistina con o sin aminoglucósido, fosfomicina o tigeciclina si hay sospecha de infección por bacilos gram-negativos productores de carbapenemasas, o bacilos gram-negativos no fermentadores multirresistentes, (4) β-lactámico combinado con cotrimoxazol si se sospecha infección por Stenotrophomonas maltophilia. En cualquier caso, si existen factores de riesgo de infección por un microorganismo gram-positivo resistente o se trata de una infección grave relacionada con el catéter vascular o de piel y partes blandas, se puede añadir un glicopéptido, daptomicina o linezolid a la terapia inicial.
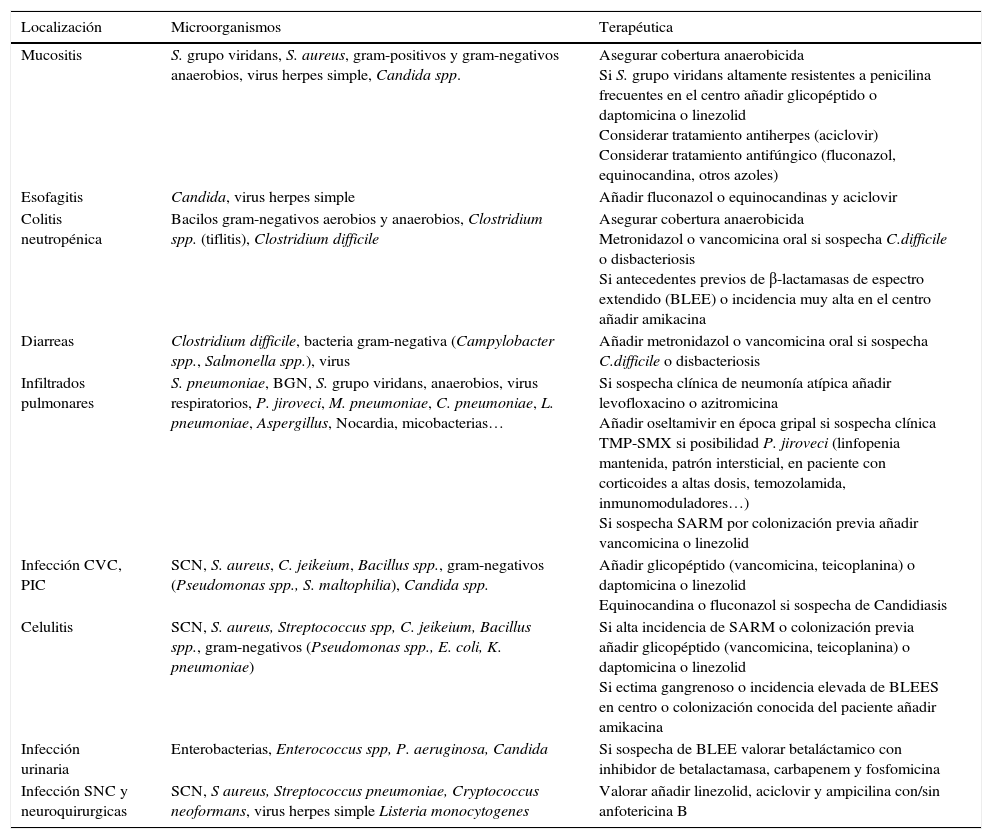
Seguimiento clínico una vez iniciado el tratamiento empíricoA las 48-72 horas de iniciar el tratamiento empírico se debe valorar la evolución clínica y los resultados desde el punto de vista microbiológico. En el caso de aislar un agente etiológico o un foco clínico, el tratamiento se debe intentar simplificar y ajustar al perfil de sensibilidad antibiótica de cada microorganismo o tipo de infección, tal y como queda reflejado en la tabla 5.
Recomendaciones para el tratamiento de la neutropenia febril cuando existe un foco clínico evidente
| Localización | Microorganismos | Terapéutica |
|---|---|---|
| Mucositis | S. grupo viridans, S. aureus, gram-positivos y gram-negativos anaerobios, virus herpes simple, Candida spp. | Asegurar cobertura anaerobicida Si S. grupo viridans altamente resistentes a penicilina frecuentes en el centro añadir glicopéptido o daptomicina o linezolid Considerar tratamiento antiherpes (aciclovir) Considerar tratamiento antifúngico (fluconazol, equinocandina, otros azoles) |
| Esofagitis | Candida, virus herpes simple | Añadir fluconazol o equinocandinas y aciclovir |
| Colitis neutropénica | Bacilos gram-negativos aerobios y anaerobios, Clostridium spp. (tiflitis), Clostridium difficile | Asegurar cobertura anaerobicida Metronidazol o vancomicina oral si sospecha C.difficile o disbacteriosis Si antecedentes previos de β-lactamasas de espectro extendido (BLEE) o incidencia muy alta en el centro añadir amikacina |
| Diarreas | Clostridium difficile, bacteria gram-negativa (Campylobacter spp., Salmonella spp.), virus | Añadir metronidazol o vancomicina oral si sospecha C.difficile o disbacteriosis |
| Infiltrados pulmonares | S. pneumoniae, BGN, S. grupo viridans, anaerobios, virus respiratorios, P. jiroveci, M. pneumoniae, C. pneumoniae, L. pneumoniae, Aspergillus, Nocardia, micobacterias… | Si sospecha clínica de neumonía atípica añadir levofloxacino o azitromicina Añadir oseltamivir en época gripal si sospecha clínica TMP-SMX si posibilidad P. jiroveci (linfopenia mantenida, patrón intersticial, en paciente con corticoides a altas dosis, temozolamida, inmunomoduladores…) Si sospecha SARM por colonización previa añadir vancomicina o linezolid |
| Infección CVC, PIC | SCN, S. aureus, C. jeikeium, Bacillus spp., gram-negativos (Pseudomonas spp., S. maltophilia), Candida spp. | Añadir glicopéptido (vancomicina, teicoplanina) o daptomicina o linezolid Equinocandina o fluconazol si sospecha de Candidiasis |
| Celulitis | SCN, S. aureus, Streptococcus spp, C. jeikeium, Bacillus spp., gram-negativos (Pseudomonas spp., E. coli, K. pneumoniae) | Si alta incidencia de SARM o colonización previa añadir glicopéptido (vancomicina, teicoplanina) o daptomicina o linezolid Si ectima gangrenoso o incidencia elevada de BLEES en centro o colonización conocida del paciente añadir amikacina |
| Infección urinaria | Enterobacterias, Enterococcus spp, P. aeruginosa, Candida | Si sospecha de BLEE valorar betaláctamico con inhibidor de betalactamasa, carbapenem y fosfomicina |
| Infección SNC y neuroquirurgicas | SCN, S aureus, Streptococcus pneumoniae, Cryptococcus neoformans, virus herpes simple Listeria monocytogenes | Valorar añadir linezolid, aciclovir y ampicilina con/sin anfotericina B |
CVC, PICC: catéter venoso central de inserción periférica; SARM: Staphylococcus aureus resistente a meticilina; SCN: Staphylococcus coagulasa negativo; SNC: sistema nervioso central; TMP-SMX: trimetropima y sulfametoxazol.
En las situaciones en las que no se ha documentado ningún foco clínico ni agente etiológico y el paciente está estable, se debe intentar desescalar el tratamiento antibiótico a un agente de menor espectro y/o deben retirarse los fármacos que se han administrado en combinación (aminoglucósido, quinolona, colistina, etc.). Si la presentación inicial era no grave, y el paciente lleva más de 72 horas afebril y está asintomático, se puede valorar la posibilidad de suspender el tratamiento. En cambio, si el paciente se encontraba en una situación clínica grave o inestable, es recomendable no modificar el tratamiento antibiótico inicial.
En la mayoría de las infecciones documentadas suele ser suficiente con 10-14 días de tratamiento antibiótico. En algunos casos, el tratamiento puede extenderse más allá de la resolución de la fiebre y la neutropenia, si es necesario. En el caso que se documente infección del catéter debe valorarse su retirada o sellado con antimicrobianos, en función de las características del paciente y microorganismo aislado. En los pacientes con fiebre persistente, se deberá hacer una reevaluación completa con búsqueda activa de posibles focos de infección o de otras causas de fiebre como toxicidad medicamentosa, fiebre tumoral etc.
Los biomarcadores son parámetros analíticos que pueden complementar a otras variables clínicas y microbiológicas en la evaluación de un episodio de NF y su gravedad. Asimismo, la normalización de sus valores apoya la respuesta al tratamiento. De los parámetros bioquímicos, los de mayor interés son la hiperglucemia de estrés como reactante de la fase aguda y la hipoalbuminemia como marcador de desnutrición y fragilidad42. De los marcadores séricos específicos de proceso inflamatorio/infeccioso, los más usados son lactato, procalcitonina y proteína C reactiva. Su utilidad no está bien definida debido a la heterogeneidad de las poblaciones estudiadas y a los pocos pacientes incluidos en los ensayos clínicos publicados53. La procalcitonina (valor >0,5ng/ml) es un marcador más útil y precoz que la proteína C reactiva (valor ≥90mg/dl), especialmente en el diagnóstico de bacteriemia, ya que no se eleva en infecciones víricas, y en la predicción de la gravedad y complicaciones de la NF. La adición de procalcitonina a escalas clínicas de riesgo podría aumentar la sensibilidad y el valor predictivo negativo para detectar bacteriemia y fallo del tratamiento antibiótico54. Interleucina 6, 8 y 10 podrían ser mejores predictores de gravedad y complicaciones, pero se usan menos por su elevado coste, falta de disponibilidad y baja especificidad. La proteína de unión de lipopolisacárido, interleucina 2, factor de necrosis tumoral entre otros no tienen en la actualidad una aplicación en el contexto de la NF del paciente con cáncer.
Medidas de precaución específicasEl objetivo de estas medidas es evitar la transmisión de determinados patógenos desde un paciente colonizado o con una infección activa al resto de los pacientes o personal sanitario. Un aspecto clave es que la aplicación de tales medidas no debe afectar a la calidad asistencial recibida por el paciente, y que estas medidas se deben añadir a las precauciones denominadas estándar, como son la higiene y descontaminación de las manos, el uso de guantes, de bata y/o mascarilla según casos, situaciones e indicaciones y que se muestran en la tabla 6.
Aplicación de precauciones estándar y tipos de precauciones específicas a adoptar según enfermedad infecciosa o microorganismo, y su periodo de transmisibilidad
| Procedimiento | Ejemplos | Higiene de manosa | Guantesb | Bata adicionalc | Mascarillad |
|---|---|---|---|---|---|
| No contacto | Hablar al paciente | No | No | No | No |
| Contacto piel intacta o ropa no manchada | Exploración física, toma de constantes | Antes y después | No | No | No |
| Contacto (o posibilidad) con piel no intacta, mucosas, fluidos, secreciones, excreciones | Extracciones, curas, manipulación catéteres, sondaje, drenajes, etc. | Antes y después | Síb | Nod | Nod |
| Secreciones respiratorias | Aspiración, terapia respiratoria Cura traqueotomía | Antes y después | Síb | Sí | Sí |
| Enfermedad o microorganismos | Tipos de precauciones o medidas de aislamiento | Periodo de transmisión posible |
|---|---|---|
| Patógenos bacterianos multirresistentes (SARM, ERV, Enterobacterias-BLEE+, Acinetobacter baumannii, Pseudomonas aeruginosa MDR) | Contacto | Transmisión cruzada mientras exista colonización o infección por el microorganismo correspondiente. Si ingreso de larga duración, realizar cultivos epidemiológicos de vigilancia semanales tres semanas consecutivas, si son negativos, levantar precauciones. Ingresos de corta duración: durante todo el ingreso. |
| Adenovirus | Gotas y contacto | Las infecciones por adenovirus pueden ser transmisibles hasta 14 días después de su comienzo. |
| Gripe (Influenza) | Gotas | De 3 a 5 días desde la aparición del cuadro clínico en adultos. En niños puede llegar a 7 días. |
| Virus sincital respitatorio | Contacto | Abarca el lapso inmediatamente anterior a la enfermedad activa y toda la duración de la misma. |
| Parainfluenza | Gotas- fomites | Desde antes del inicio de los síntomas hasta la mejora clínica (se puede transmitir por portadores asintomáticos). |
| Sarampión | Aéreas | Desde 4 días antes del exantema, hasta 4 días después (contagio mínimo después del 2° día de exantema). |
| Rubeola (congénita) | Contacto | Puede arrojar virus durante meses en los lactantes. |
| Rubeola | Gotas | Desde 1 semana antes del exantema a 7 días después. |
| Parotiditis | Gotas | El virus se aísla en la saliva desde 7 días antes hasta 9 días después del inicio del cuadro manifiesto. El máximo riesgo de contagio abarca desde 2 días antes del comienzo de la enfermedad hasta 4 días después. |
| Hepatitis A | Contacto (Fecal - oral) | Período de infectividad: Desde 2 ó 3 semanas previas al inicio de los síntomas y una semana después del comienzo de los mismos. |
| Rotavirus | Contacto (Fecal - oral) | Durante la fase aguda y mientras persista la excreción de virus. |
| Parvovirus B19 | Gotas | Si el paciente presenta sólo exantema, la transmisibilidad es máxima antes de la erupción e improbable después del exantema. Si existe crisis aplásica, el período de transmisibilidad abarca hasta 1 semana después de su aparición. |
| Varicela –Zóster | Aéreas y de contacto | 4 a 5 días antes de la erupción y hasta que las lesiones están en costra (unos 7 días). |
| Salmonella | Contacto (Fecal - Oral) | Desde la primera semana hasta el final de la convalecencia (1-2 semanas). En S. Typhi, valorar portadores crónicos. |
| Tuberculosis | Aéreas | Duran todo el tiempo en el que se expulsan bacilos tuberculosos en esputo. La quimioterapia antimicrobiana eficaz elimina la transmisibilidad en el término de 2 a 4 semanas. |
| Impétigo | Contacto | Hasta que las lesiones estén completamente curadas (suele ser 1-2 semanas). |
| Mycoplasma (Neumonía Atípica Primaria) | Gotas - (fomites recién contaminados o secreciones respiratorias) | Duración de menos de 20 días. El Tratamiento no erradica el microorganismo de las vías respiratorias donde puede persistir hasta 13 semanas. |
| Tosferina | Gotas | Persiste hasta 5 días después de tratamiento eficaz. |
| H. influenzae tipo B | Gotas | Deja de ser transmisible en las 24-48 horas siguientes al comienzo de tratamiento eficaz con antibióticos. |
| Neisseria meningitidis | Gotas | Persisten hasta que los meningococos vivos desaparecen de las secreciones de nariz y boca, o sea, 24 horas después de iniciar tratamiento adecuado. |
| Escarlatina | Gotas | Persiste hasta 24 horas después de tratamiento eficaz. |
| Clostridium difficile | Contacto | Puede persistir durante semanas y meses en las formas no vegetativas o esporas. |
| Escabiosis (sarna) | Contacto | Muy persistente hasta que no se destruyan los ácaros y huevos. No hay transmisión 24 horas después de tratamiento eficaz (Permetrina al 5%). |
BLEE: beta-lactamasas de espectro extendido; ERV: enterococos resistentes a la vancomicina; MDR: multirresistencia; SARM: Staphylococcus aureus resistente a meticilina
Las medidas de precaución específicas se clasifican en función de las formas de transmisión de los microorganismos en: (1) precauciones respiratorias, cuyo objetivo es evitar la diseminación aérea de partículas menores a 5μ, que pueden permanecer suspendidas en el aire durante periodos prolongados de tiempo como en los casos de TBC respiratoria, VVZ diseminados, sarampión, etc.; (2) precauciones de gotas, dirigidas a evitar la transmisión de microorganismos patógenos a través de gotas de mayor tamaño y que requiere de un contacto cercano entre la fuente de exposición y el huésped susceptible, como en la infección meningocócica, gripe, etc.; y (3) precauciones de contacto, que pretenden evitar la transmisión por contacto directo o indirecto mediante objetos o superficies contaminadas. En la tabla 6 se recogen las recomendaciones y medidas específicas a adoptar según la enfermedad infecciosa o microorganismo de que se trate.
Las precauciones de contacto son las que con más frecuencia se necesitan en los pacientes con cáncer y están indicadas en las siguientes situaciones: (1) infecciones respiratorias, gastrointestinales, cutáneas y/o de heridas colonizadas o infectadas por patógenos multirresistentes; (2) infecciones diarreicas, incluyendo la infección por Clostridium difficile; (3) infecciones por virus respiratorios; y (4) infecciones cutáneas o de mucosas.
En relación con los microorganismos multirresistentes, la Comisión de Infecciones o el Equipo de Control de Infecciones de cada centro debe decidir cuáles de ellos son más importantes y susceptibles de ser sometidos a la implantación de precauciones de contacto, basándose en las recomendaciones existentes, y considerando siempre la propia epidemiología local y la capacidad de transmisión entre pacientes de cada uno de los patógenos multirresistentes valorados. Para ello, puede ser necesaria la realización de cultivos de vigilancia epidemiológica.
En la mayoría de los hospitales se recomienda la aplicación de precauciones de contacto en los siguientes escenarios: (1) todos los casos de S. aureus resistentes a la meticilina; (2) Enterococcus resistentes a la vancomicina; (3) Enterobacterias productoras de beta-lactamasas de espectro extendido; (4) Enterobacterias productoras de carbapenemasas; (5) bacilos gram-negativos no fermentadores, como Pseudomonas aeruginosa o Acinetobacter baumannii con patrones de multirresistencia o panrresistencia.
Las medidas de aislamiento inverso estarían indicadas solo en aquellos pacientes con cáncer sólido que reciben esquemas de quimioterapia que conducen a neutropenias profundas y prolongadas. Las habitaciones con aislamiento inverso deben reunir una serie de características especiales que permitan reducir la contaminación ambiental impulsando aire desprovisto de microorganismos e impidiendo la penetración de microorganismos en el interior mediante presión positiva.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Las Juntas Directivas de la SEIMC y de la SEOM han aprobado la redacción final y contenidos de este Documento.
Miembros todos ellos de la Sociedad Española de Enfermedades Infecciosas y de la #Sociedad Española de Oncología Médica.