Las infecciones de transmisión sexual (ITS) son uno de los problemas de Salud Pública más importantes. Su elevada morbilidad y la posibilidad de secuelas tanto a medio, como a largo plazo, hacen que debamos tener los conocimientos suficientes para un manejo correcto de las mismas, tanto en prevención como en diagnóstico y tratamiento. La infección por el VIH está claramente interrelacionada con las ITS, no sólo por compartir vía de transmisión sino, también por el aumento de riesgo de transmisión del VIH. En este artículo, se resumen las guías actualizadas de práctica clínica sobre la evaluación, manejo y prevención de las ITS más relevantes en pacientes infectados por el VIH por un panel de expertos en VIH, dermatólogos, cirujanos proctólogos y microbiólogos de Panel de expertos del Grupo de Estudio de Sida (GESIDA) y del Plan Nacional sobre el Sida (PNS).
Sexually transmitted infections (STI) are a major public health problem. Considering their high morbidity and potential short and long term after effects, physicians must have enough knowledge on the management of these infections for a correct prevention, diagnosis and treatment. HIV infection is associated with STI, not only because they share route of transmission, but also because they lead to an increased risk of HIV transmission. In this article, we summarise the updated clinical practice guidelines, for the evaluation, management and prevention of STI in HIV-infected patients, from a panel of experts in HIV, dermatologists, proctologic surgeons, and microbiologists on behalf of the Spanish AIDS Study Group (GESIDA) and the National AIDS Plan (PNS).
Las infecciones de transmisión sexual (ITS) son uno de los problemas de Salud Pública más importantes. Su elevada morbilidad y la posibilidad de secuelas tanto a medio como a largo plazo hacen que debamos tener los conocimientos suficientes para un manejo correcto de las mismas, tanto en prevención como en diagnóstico y tratamiento. La infección por el VIH está claramente interrelacionada con las ITS, no sólo por compartir vía de transmisión sino también por el aumento de riesgo de transmisión del VIH que puede servir de indicador de los cambios en las prácticas sexuales de riesgo1-3.
El objetivo de este documento es dar a conocer a la comunidad científica y a los profesionales la situación actual y el manejo de aquellas ITS que por su relevancia en el paciente con infección por el VIH necesitan una mayor atención.
Para su elaboración, realizada por un grupo de expertos designados por la Junta Directiva del Grupo de Estudio del Sida (GESIDA) y la Secretaría del Plan Nacional del Sida (PNS), se han revisado los datos más relevantes de las publicaciones científicas o comunicaciones a congresos.
Para la clasificación de la fuerza y la calidad de las recomendaciones se ha aplicado el sistema utilizado por la Sociedad Americana de Enfermedades Infecciosas y el Servicio de Salud Pública de EE.UU. (tabla 1).
Clasificación de las recomendaciones empleadas en este documento
| Fuerza de la recomendación |
| Nivel A: buen nivel de evidencia para apoyar la recomendación de uso. |
| Nivel B: moderado nivel de evidencia para apoyar la recomendación de uso. |
| Nivel C: escasa evidencia para apoyar la recomendación. |
| Calidad de la recomendación |
| I: evidencia procedente de al menos 1 ensayo clínico aleatorizado. |
| II: evidencia procedente de al menos 1 ensayo no aleatorizado, bien diseñado, o bien de estudios de cohortes, o de estudios analíticos de casos y controles (preferiblemente de más de 1 centro), o de series temporales, o de resultados concluyentes obtenidos en estudios experimentales no controlados. |
| III: evidencia de opiniones de expertos, basadas en la experiencia clínica o en estudios descriptivos. |
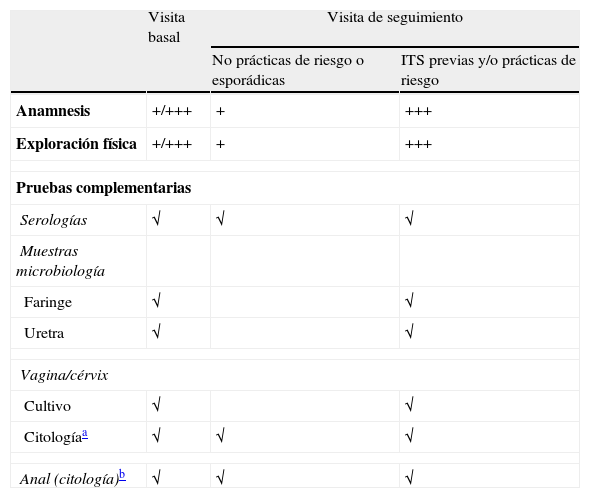
Las ITS son un grupo de infecciones producidas por más de 25 microorganismos, que se transmiten fundamentalmente a través de las relaciones sexuales. La infección por el VIH no es sólo una ITS más; la especial interacción que tiene con otras ITS3-7 hace que la valoración de éstas en el contexto del paciente con infección por el VIH merezca una atención especial. Para su prevención son fundamentales tanto intervenciones dirigidas a concienciar sobre la seguridad en la conducta sexual, como el diagnóstico y tratamiento tempranos. Si tenemos en cuenta que muchas ITS tienen, al menos en su inicio, un comportamiento silente, asintomático o paucisintomático, el diagnóstico precoz de las mismas pasa por realizar un cribado inicial y posterior en pacientes con infección por el VIH asintomáticos. En la tabla 2 se presentan esquemáticamente las pruebas de cribado de ITS en estos pacientes.
Esquema de pruebas de cribado de ITS
| Visita basal | Visita de seguimiento | ||
| No prácticas de riesgo o esporádicas | ITS previas y/o prácticas de riesgo | ||
| Anamnesis | +/+++ | + | +++ |
| Exploración física | +/+++ | + | +++ |
| Pruebas complementarias | |||
| Serologías | √ | √ | √ |
| Muestras microbiología | |||
| Faringe | √ | √ | |
| Uretra | √ | √ | |
| Vagina/cérvix | |||
| Cultivo | √ | √ | |
| Citologíaa | √ | √ | √ |
| Anal (citología)b | √ | √ | √ |
- 1.
El cribado de ITS en pacientes con infección por el VIH debe realizarse mediante una anamnesis detallada y exploración física completa, siendo especialmente exhaustiva en aquellos sujetos que, por su conducta de riesgo, tienen más probabilidad de tener una ITS (A-II).
- 2.
Hay que realizar serología de lúes, VHA, VHB y VHC a todos los pacientes. Los pacientes con serología negativa de VHA y VHB deberán vacunarse frente a ambos virus (A-II).
- 3.
Deben enviarse muestras clínicas al laboratorio de Microbiología para despistaje de ITS de aquellos sujetos que el facultativo considere necesario, por su conducta de riesgo (A-II).
- 4.
Toda mujer infectada por el VIH debe ser remitida a Ginecología (A-III).
- 5.
La evaluación de ITS en los pacientes que no presenten frecuentes situaciones de riesgo se deberá realizar de forma anual y en los pacientes con riesgo elevado cada 3-6 meses (B-III).
- 6.
Se realizarán de forma anual la serología del VHC en los casos con serología previa negativa y de la sífilis (B-III).
La uretritis es un síndrome caracterizado por secreción uretral mucopurulenta o purulenta y/o disuria, aunque puede ser asintomática. Se clasifica en uretritis gonocócica (UG) y uretritis no gonocócica (UNG), aunque también puede tener etiología no infecciosa. La cervicitis es el equivalente femenino, y se caracteriza por la inflamación y secreción de la mucosa endocervical8. Las principlales causas de uretritis y cervicitis así como sus métodos diagnósticos y las distintas opciones terapéuticas de UG y UNG por Chlamydia se detallan en las tabla 3 y 4.8–11
Causas de uretritis y cervicitis
| Agentes etiológicos | Métodos diagnósticos | |
| Gonococica | Neisseria gonorrhoeae | Tinción de Gram: diplococos gramnegativos intraleucocitarios |
| Cultivo de secreción uretral o cervical: método de elección. | ||
| Serología (EIA): puede hacerse en orina. | ||
| Detección de ADN (PCR): si no está disponible el cultivo o se retrasa el transporte de la muestra. | ||
| No gonococica | Chlamydia trachomatis, serotipos D-K (15-55%) | Cultivo de muestra uretral o endocervical: siempre debe incluir células epiteliales. |
| Ureaplasma urealyticum (10-40%) | Serología (inmunofluorescencia directa, EIA). | |
| Mycoplasma genitalium | Detección de ADN (PCR): se recomienda realizar en orina. | |
| Otros (20-40%): Trichomonas vaginalis (4%), Herpes simples, Haemophilus (sobre todo en práctica de coito anal en papel de activo), flora orofaríngea (práctica de sexo oral), causas no infecciosas (traumática, autoinmune, alérgica y agente desconocido hasta un 25%) | ||
EIA: enzimoinmunoanálisis; PCR: reacción en cadena de la polimerasa.
Tratamiento de uretritis y cervicitis
| Etiología gonocócica (todos en monodosis) | Etiología no gonocócica (Chlamydia) |
| - Cefixima: 400mg vía oral | - Azitromicina: 1g vía oral dosis única (A-Ia) |
| - Ceftriaxona: 125-250mg vía intramuscular (A) | - Doxiciclina: 100 mg/12 h vía oral, 7 días (A-Ia) |
| - Cefuroxima axetilo: 1g vía oral | - Eritromicina: 500 mg/6 h, 7 días (A) o 500 mg/12 h, 14 días (A-Ib) o 250 mg/6 h, 14 días |
| - Cirpofloxacino 500mg vía oral (A)a | - Minociclina: 100 mg/24 h vía oral, 9 días (A) |
| - Ofloxacino: 400mg vía oral (A)a | - Ofloxacino: 200 mg/12 h, 7 días (A-Ib) o 400 mg/24 h, 7 días (A-Ib) |
| - Levofloxacino: 250mg vía orala | - Levofloxacino: 500 mg/24 h vía oral, 7 días |
| - Norfloxacino: 800mg vía orala | |
| - Espectinomicina: 2g vía intramuscular (A) | |
| - Amoxicilina: 2-3g + probenecid 1g (B) | |
| - Azitromicina: 1-2g vía oral | |
| - Cefpodoxima proxetilo: 400mg vía oral | |
| - Ceftibuteno: 400mg vía oral |
La alta frecuencia de gonococos resistentes a quinolonas desaconseja el uso de este grupo de fármacos como tratamiento empírico: si el paciente ha seguido el tratamiento prescrito inicialmente y se puede descartar una reexposición, sospecharemos causas infrecuentes de uretritis, siendo el tratamiento aconsejado en estos casos metronidazol o tinidazol: 2g vía oral en dosis única (posibilidad de Trichomonas) junto con eritromicina 500mg cada 6 horas vía oral, 7 días (posibilidad de Ureaplasma urealyticum resistente a tetraciclinas). Ante la persistencia de síntomas tras dos ciclos de tratamiento antibiótico, el retratamiento de la pareja y la eritromicina (500mg cada 6 horas vía oral, 3 semanas) pueden ser de utilidad10,11.
El seguimiento sistemático de los pacientes correctamente tratados para gonococo y Chlamydia cuyos síntomas hayan desaparecido y no hayan vuelto a tener relación con un contacto no tratado sólo es recomendable en embarazadas y en pacientes que hayan seguido tratamiento con eritromicina o amoxicilina y debe hacerse 3 semanas tras finalizar el tratamiento (B-III)10,11.
Recomendaciones para el manejo de uretritis y cervicitis en pacientes con infección por el VIH- 1.
Deben tratarse todos los pacientes sintomáticos incluso cuando la observación al microscopio sea no diagnóstica (C-III).
- 2.
Deben ser estudiadas y se les debe ofrecer tratamiento a todas las parejas sexuales durante los 3 meses anteriores (C-III).
- 3.
Las mujeres que son contactos de un hombre con UG o UNG por Chlamydia deben ser tratadas empíricamente (B-II).
- 4.
A las 3 semanas del tratamiento debe realizarse una entrevista para asegurar el cumplimiento del mismo y la resolución de los síntomas (B-III).
La orquitis es un proceso inflamatorio del testículo causado habitualmente por virus o bacterias, pudiendo ser uni- o bilateral, suele asociarse a la presencia de un proceso infeccioso o inflamatorio a nivel del epidídimo y puede ser causada por ITS, tales como gonococo o Chlamydia.
El diagnóstico suele ser clínico, aunque se puede completar la evaluación con la realización de un análisis de sangre, orina y con la ecografía Doppler testicular12. Habitualmente se indica también la realización de un urocultivo y la toma de muestras uretrales para gonococo y C. trachomatis.
El tratamiento se basa en medidas higiénicas, antiinflamatorios y analgésicos, y antibióticos si la infección es causada por bacterias. Aunque en la mayoría de los casos el tratamiento médico es suficiente8, debe hacerse drenaje quirúrgico en caso de abscesos en el escroto o testículos12. En caso de gonorrea o Chlamydia, las parejas sexuales también deben recibir tratamiento12.
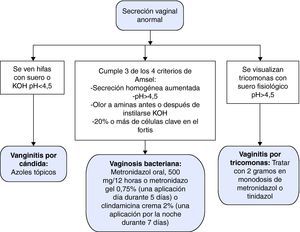
VulvovaginitisConsiste en la inflamación de diferente grado de la vulva, la vagina y el tejido endocervical ectópico y puede ser de origen infeccioso o no, destacando entre las infecciosas las causadas por tricomonas, las candidiasis, la vaginosis bacteriana y por otros microorganismos (herpes, gonococo, clamidias...)8. Aunque las vulvovaginitis por cándida y la vaginosis bacteriana no son ITS, dada la alta incidencia en mujeres VIH se incluyen dentro de este apartado.
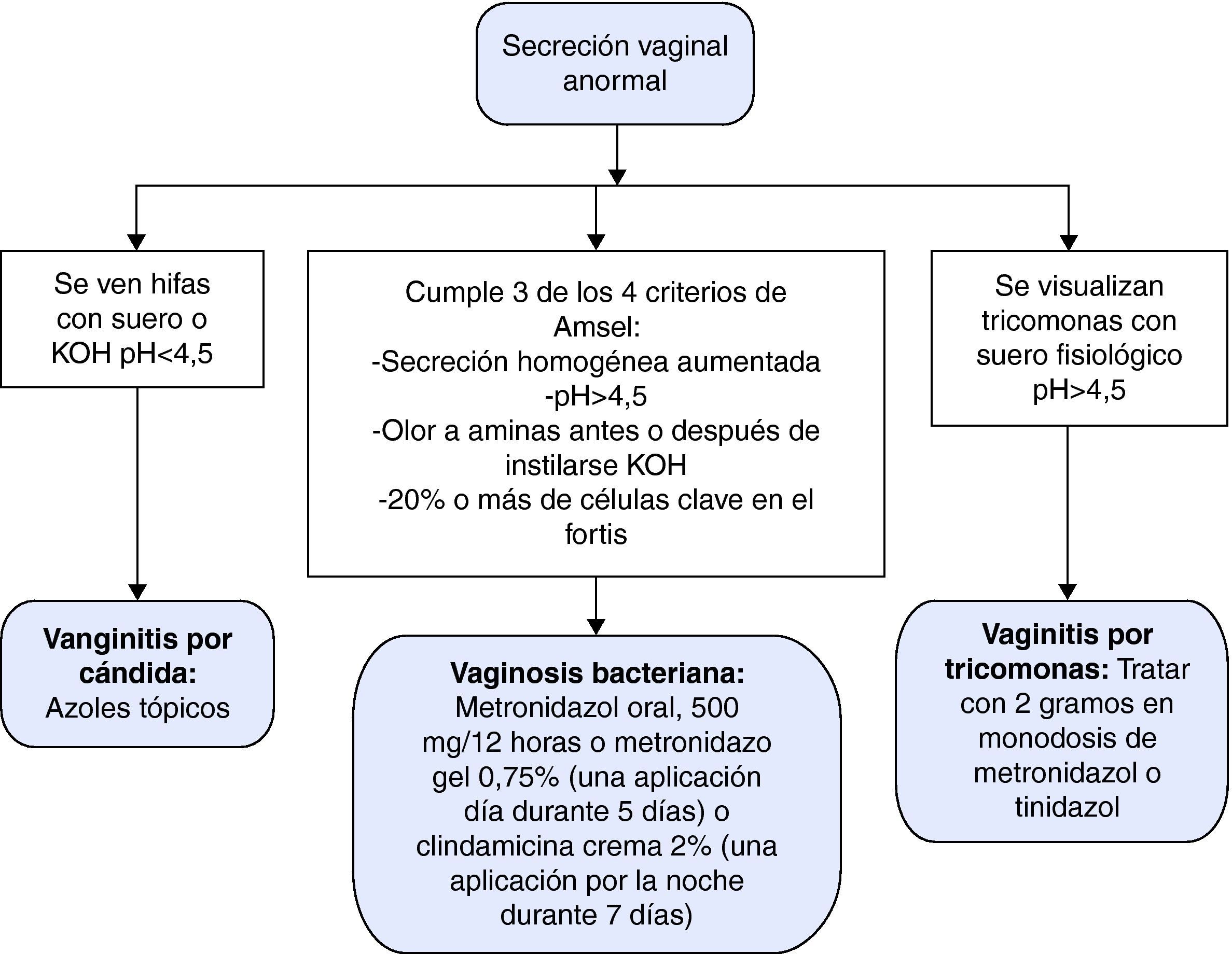
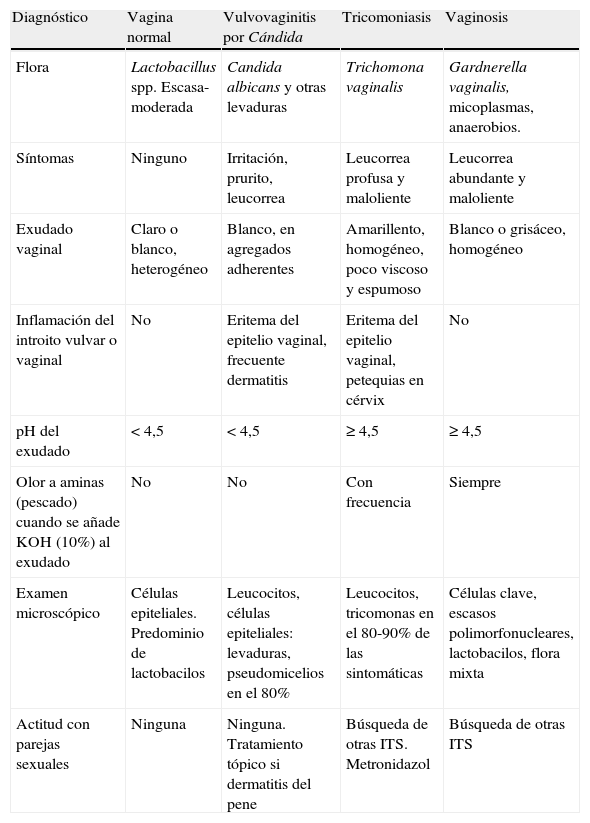
En la tabla 5 se presentan las características diferenciales de las vulvovaginitis más frecuentes en contraste con la vagina normal y la figura 1 representa el algoritmo diagnóstico de la secreción vaginal anormal. El tratamiento de elección, alternativas terapéuticas, en embarazo y recurrencias se resumen en la tabla 6.
Vulvovaginitis
| Diagnóstico | Vagina normal | Vulvovaginitis por Cándida | Tricomoniasis | Vaginosis |
| Flora | Lactobacillus spp. Escasa-moderada | Candida albicans y otras levaduras | Trichomona vaginalis | Gardnerella vaginalis, micoplasmas, anaerobios. |
| Síntomas | Ninguno | Irritación, prurito, leucorrea | Leucorrea profusa y maloliente | Leucorrea abundante y maloliente |
| Exudado vaginal | Claro o blanco, heterogéneo | Blanco, en agregados adherentes | Amarillento, homogéneo, poco viscoso y espumoso | Blanco o grisáceo, homogéneo |
| Inflamación del introito vulvar o vaginal | No | Eritema del epitelio vaginal, frecuente dermatitis | Eritema del epitelio vaginal, petequias en cérvix | No |
| pH del exudado | < 4,5 | < 4,5 | ≥ 4,5 | ≥ 4,5 |
| Olor a aminas (pescado) cuando se añade KOH (10%) al exudado | No | No | Con frecuencia | Siempre |
| Examen microscópico | Células epiteliales. Predominio de lactobacilos | Leucocitos, células epiteliales: levaduras, pseudomicelios en el 80% | Leucocitos, tricomonas en el 80-90% de las sintomáticas | Células clave, escasos polimorfonucleares, lactobacilos, flora mixta |
| Actitud con parejas sexuales | Ninguna | Ninguna. Tratamiento tópico si dermatitis del pene | Búsqueda de otras ITS. Metronidazol | Búsqueda de otras ITS |
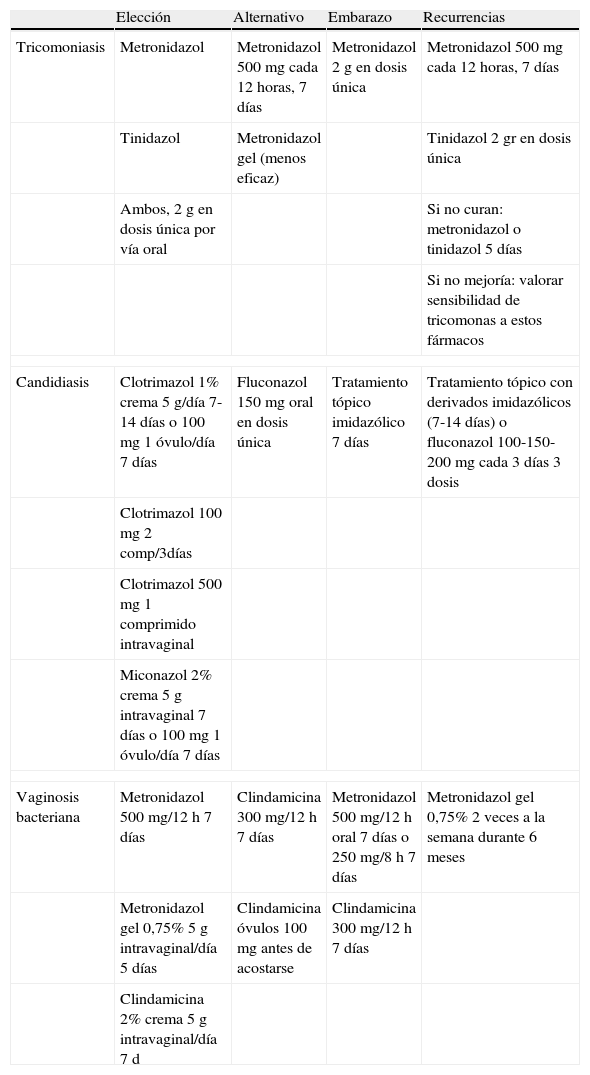
Tratamiento de tricomoniasis, candidiasis y vaginosis bacteriana
| Elección | Alternativo | Embarazo | Recurrencias | |
| Tricomoniasis | Metronidazol | Metronidazol 500mg cada 12 horas, 7 días | Metronidazol 2g en dosis única | Metronidazol 500mg cada 12 horas, 7 días |
| Tinidazol | Metronidazol gel (menos eficaz) | Tinidazol 2 gr en dosis única | ||
| Ambos, 2g en dosis única por vía oral | Si no curan: metronidazol o tinidazol 5 días | |||
| Si no mejoría: valorar sensibilidad de tricomonas a estos fármacos | ||||
| Candidiasis | Clotrimazol 1% crema 5 g/día 7-14 días o 100mg 1 óvulo/día 7 días | Fluconazol 150mg oral en dosis única | Tratamiento tópico imidazólico 7 días | Tratamiento tópico con derivados imidazólicos (7-14 días) o fluconazol 100-150-200mg cada 3 días 3 dosis |
| Clotrimazol 100mg 2 comp/3días | ||||
| Clotrimazol 500mg 1 comprimido intravaginal | ||||
| Miconazol 2% crema 5g intravaginal 7 días o 100mg 1 óvulo/día 7 días | ||||
| Vaginosis bacteriana | Metronidazol 500 mg/12 h 7 días | Clindamicina 300 mg/12 h 7 días | Metronidazol 500 mg/12 h oral 7 días o 250 mg/8 h 7 días | Metronidazol gel 0,75% 2 veces a la semana durante 6 meses |
| Metronidazol gel 0,75% 5g intravaginal/día 5 días | Clindamicina óvulos 100mg antes de acostarse | Clindamicina 300 mg/12 h 7 días | ||
| Clindamicina 2% crema 5g intravaginal/día 7 d | ||||
Si se administra metronidazol o tinidazol a mujeres que estén dando la lactancia materna, ésta debe ser suspendida mientras dure el tratamiento y de 12 a 24 horas después de la última dosis de metronidazol y de 3 días después de la última dosis de tinidazol8. En caso de alergia a los nitroimidazoles, se recomienda desensibilización con metronidazol. Se puede intentar terapia con tratamientos tópicos pero la tasa de curación es menor.
El seguimiento es innecesario en la tricomoniasis para pacientes asintomáticas inicialmente o después del tratamiento, así como en la vaginosis bacteriana si los síntomas desaparecen; en el caso de la candidiasis sólo es necesario si persisten los síntomas o existen recurrencias a los 2 meses de terminado el tratamiento.
El tratamiento de la pareja y abstención de relaciones sexuales se recomienda en la tricomoniasis hasta que finalice el tratamiento y la pareja esté asintomática. En la vulvovaginitis por cándida sólo hay que considerarlo si la mujer tiene infecciones recurrentes y no está recomendado en la vaginosis bacteriana.
Enfermedad inflamatoria pélvicaEs la infección del tracto genital superior, generalmente como consecuencia de una infección ascendente desde el cérvix por una ITS, por una infección polimicrobiana en relación con vaginosis o interacciones oportunistas de flora comensal perineal/vaginal sobre una ITS primaria13.
El diagnóstico es fundamentalmente clínico junto a la confirmación microbiológica con tinción de Gram y cultivo en medio de Thayer-Martin o similar de frotis cervical y estudio para C. trachomatis con detección de antígeno o material genético o cultivo específico13. Las técnicas de imagen permiten detectar la presencia de masas, colecciones, hidro- o piosalpinx o líquido en Douglas y la laparoscopia permite el drenaje de colecciones, obtención de muestras, visualización de pelvis y anejos y permite establecer el diagnóstico diferencial con otras entidades.
Ante la sospecha de enfermedad inflamatoria pélvica (EIP) se debe instaurar tratamiento antimicrobiano empírico precozmente (A-Ib)13, debiendo cubrir gonococo, Chlamydia y anaerobios (B- III)13. La pauta de elección es ceftriaxona 250mg intramuscular+doxiciclina 100mg/12 horas vía oral durante 14 días, añadiendo opcionalmente metronidazol 500mg/12 horas vía oral (A-Ib) y la pauta alternativa levofloxacino 500mg/24 horas vía oral+metronidazol 500mg/12 horas vía oral 14 días (A-Ib). Ante la presencia de un absceso tubo-ovárico deberá drenarse mediante laparoscopia, cirugía o culdocentesis si está en el fondo de saco de Douglas en las siguientes circunstancias: si es mayor de 8cm, si no hay mejoría tras 72 horas de tratamiento antibiótico parenteral o si ha aumentado de tamaño.
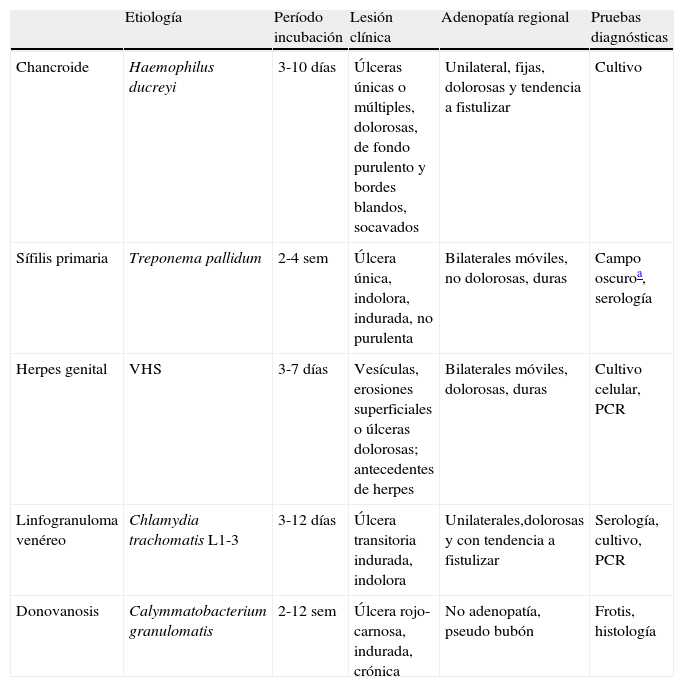
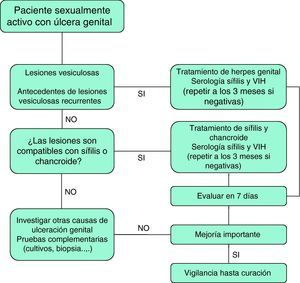
Úlceras genitalesEl término úlcera se refiere a toda lesión que ocasiona una pérdida de sustancia y continuidad de la piel y/o de la mucosa. La etiología de las úlceras genitales es muy variada e incluye desde procesos infecciosos hasta toxicodermias o patología tumoral14. Sin embargo, la mayoría de los casos en pacientes jóvenes sexualmente activos son debidos a ITS, fundamentalmente a herpes genital, sífilis primaria o chancroide15. En la tabla 7 se presentan las ITS causantes de enfermedad ulcerosa genital (EUG), con sus características diferenciales.
Infecciones de transmisión sexual causantes de enfermedad ulcerosa genital
| Etiología | Período incubación | Lesión clínica | Adenopatía regional | Pruebas diagnósticas | |
| Chancroide | Haemophilus ducreyi | 3-10 días | Úlceras únicas o múltiples, dolorosas, de fondo purulento y bordes blandos, socavados | Unilateral, fijas, dolorosas y tendencia a fistulizar | Cultivo |
| Sífilis primaria | Treponema pallidum | 2-4 sem | Úlcera única, indolora, indurada, no purulenta | Bilaterales móviles, no dolorosas, duras | Campo oscuroa, serología |
| Herpes genital | VHS | 3-7 días | Vesículas, erosiones superficiales o úlceras dolorosas; antecedentes de herpes | Bilaterales móviles, dolorosas, duras | Cultivo celular, PCR |
| Linfogranuloma venéreo | Chlamydia trachomatis L1-3 | 3-12 días | Úlcera transitoria indurada, indolora | Unilaterales,dolorosas y con tendencia a fistulizar | Serología, cultivo, PCR |
| Donovanosis | Calymmatobacterium granulomatis | 2-12 sem | Úlcera rojo-carnosa, indurada, crónica | No adenopatía, pseudo bubón | Frotis, histología |
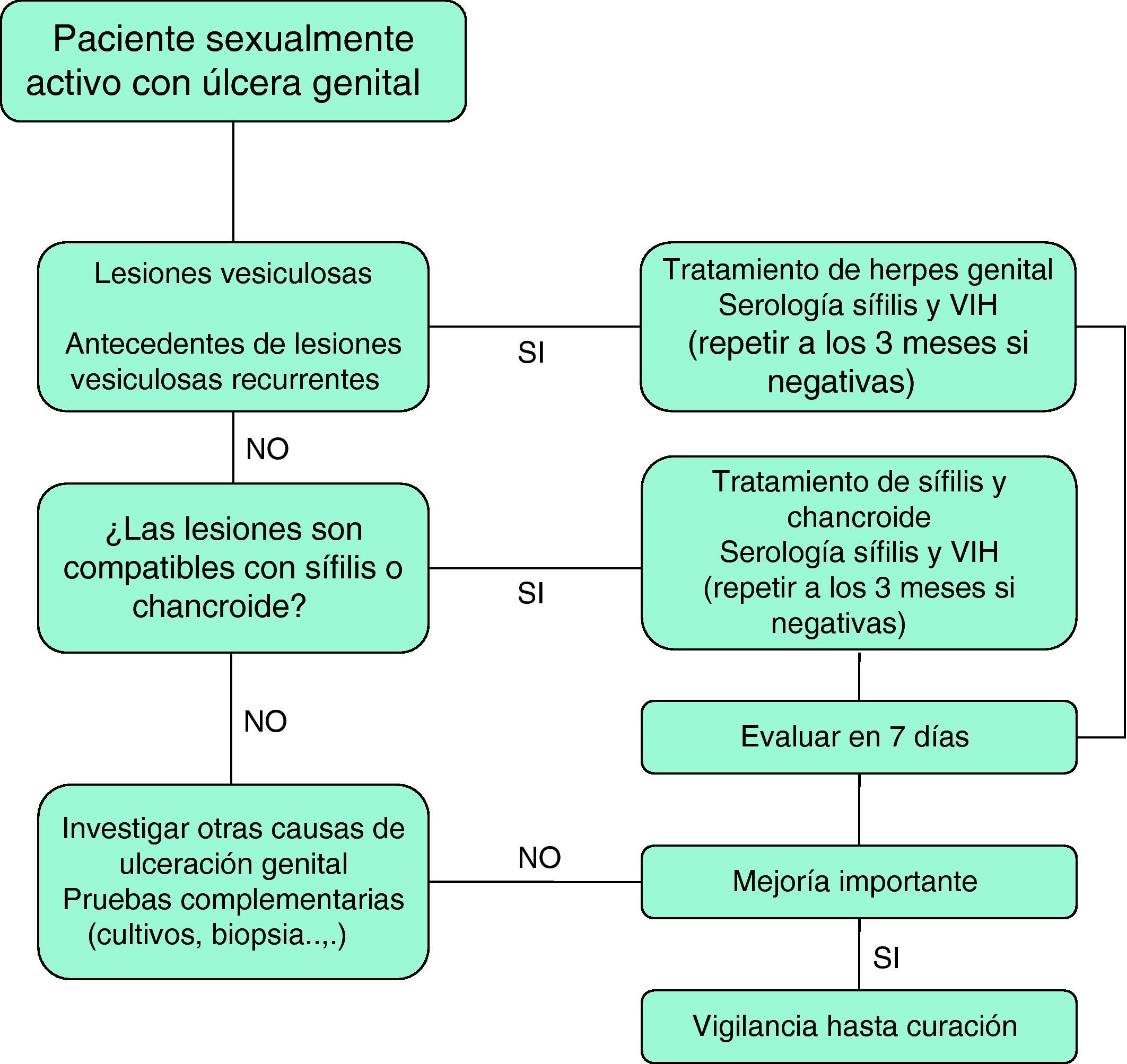
Los protocolos terapéuticos para la EUG en pacientes con infección por el VIH son similares a los utilizados en la población general, aunque es posible un mayor número de fracasos terapéuticos que aconsejan mantener la vigilancia de estos casos hasta su curación total8. En la figura 2 se presenta un algoritmo de tratamiento empírico de la EUG.
Recomendaciones para el manejo de la EUG en pacientes con infección por el VIH- 1.
Todo paciente sexualmente activo con EUG debe ser testado frente al VIH (III-A).
- 2.
Ante una úlcera genital, se recomienda establecer un diagnóstico etiológico a partir de los exámenes microbiológicos adecuados a cada situación epidemiológica y localización geográfica (III-A).
- 3.
En caso de que no sea posible aplicar las técnicas microbiológicas estándar, se recomienda acudir a algoritmos de diagnóstico y tratamiento sencillos. Se debe garantizar en lo posible el seguimiento de la respuesta terapéutica en cada paciente (III-A).
- 4.
En caso de úlceras genitales de características atípicas o sin respuesta al tratamiento en un período de dos semanas se recomienda considerar la biopsia para estudio histopatológico y el resto de pruebas complementarias que se consideren adecuadas (III-A).
- 5.
Se debe mantener la abstinencia sexual hasta la curación total de la ulceración genital. Esta recomendación incluye los casos tratados con pautas de monodosis (III-A).
La sífilis es una enfermedad infecciosa sistémica producida por la espiroqueta Treponema pallidum que constituye un problema de Salud Pública a nivel mundial. El colectivo más afectado por la sífilis es el de hombres que tienen sexo con hombres (HSH)16,17 y su coincidencia con el VIH en un mismo individuo puede tener una transcendencia epidemiológica y clínica de gran importancia18.
ClasificaciónLa sífilis se clasifica en congénita o adquirida. La sífilis congénita es transmitida de la madre al hijo in útero y se divide en sífilis congénita precoz (primeros 2 años de vida) y sífilis congénita tardía, que incluye los estigmas de la sífilis congénita. La sífilis adquirida, ya sea a través de contagio sexual o por vía transfusional, se divide en sífilis precoz (primaria, secundaria y latente precoz), adquirida en el año o dos años previos19,20 y sífilis tardía (latente tardía y terciaria), de más de uno o dos años de evolución19,20.
ClínicaLa sífilis primaria se caracteriza por el desarrollo de una úlcera o chancro en el sitio de la infección o inoculación, tras un período de incubación de 10-90 días. Aunque generalmente se trata de una lesión única, indolora, en la región anogenital, en pacientes con infección por el VIH la presentación puede ser atípica, con múltiples lesiones, dolorosas, destructivas y con localización extragenital (labios y boca). La sífilis secundaria se desarrolla 3-6 semanas después de la aparición del chancro de inoculación y se manifiesta por un exantema cutáneo no pruriginoso con afectación palmoplantar, junto con condilomas planos, lesiones mucocutáneas y linfadenopatía generalizada; puede cursar también con alopecia en parches, uveítis, otitis, meningitis, parálisis de pares craneales, hepatitis, esplenomegalia, periostitis y glomerulonefritis. La sífilis latente no presenta manifestaciones clínicas. La sífilis tardía incluye la sífilis gomatosa, la neurosífilis y la sífilis cardiovascular.
DiagnósticoEn la sífilis precoz el diagnóstico se realiza por la demostración de la presencia del T. pallidum en las lesiones o en los ganglios linfáticos mediante observación en campo oscuro, fluorescencia directa con anticuerpos monoclonales o PCR21. La PCR es el método de elección en la sífilis tardía, especialmente la terciaria y en los casos de sífilis congénita.
Pruebas de diagnóstico serológico de la sífilisExisten dos métodos serológicos frente a antígenos no treponémicos (referidos como antígeno cardiolipina o métodos reagínicos): el RPR (Rapid Plasma Reagin test) y el VDRL (Venereal Disease Research Laboratory). Las pruebas frente a antígenos treponémicos son el TPHA (T .pallidum hemagglutination assay), el TTPA (T. pallidum particle agglutination test), el test FTA-abs (Fluorescent Treponemal absorption test) y el EIA (Treponemal Enzyme Immunoassay). La mayoría de estos métodos utilizan antígenos recombinantes que detectan tanto IgG como IgM. También existen tests de anticuerpos IgM anti-T. pallidum.
Como método único de cribado diagnóstico se recomienda utilizar la prueba EIA22. Si la sospecha de sífilis primaria es elevada, se recomienda solicitar una prueba IgM anti-treponémica y repetirla una o dos semanas más tarde si es negativa. La prueba de RPR/VDRL puede ser utilizada como cribado en personas con bajo riesgo de infección, sin embargo, en personas con alto riesgo no es útil como cribado ya que puede resultar negativa debido al fenómeno de prozona. Si hay sospecha, se puede detectar el efecto prozona haciendo diluciones de la muestra. En caso de utilizar RPR/VDRL se recomienda realizarlo con suero no diluido y suero diluido para evitar los falsos negativos, junto a un método de cribado recomendado. En caso de obtener un método de cribado positivo se recomienda llevar a cabo como prueba de confirmación una prueba treponémica utilizando un antígeno de diferente tipo al usado en el cribado. Cuando resulta positivo un método de confirmación se recomienda realizar un RPR/VDRL con cuantificación. Cuando el RPR/VDRL sea negativo y la sospecha de infección sea elevada se recomienda llevar a cabo un método específico anti-treponémico tipo IgM EIA. En caso de ser positivo el IgM EIA indica infección activa, en caso de ser negativo no se descarta una infección activa, especialmente en la sífilis tardía.
Recomendaciones para la realización de punción lumbar en pacientes con infección por el VIH con serología positiva para sífilis (B-II)Se recomienda la realización de punción lumbar para examen del LCR en pacientes con serología positiva de sífilis que presentan además alguno de los siguientes datos:
- -
Clínica neurológica posiblemente causada por neurosífilis.
- -
Trastornos oculares causados posiblemente por sífilis ocular.
- -
Síntomas otológicos causados posiblemente por sífilis.
- -
Recuento de linfocitos CD4 inferior a 350 células/mm3 y/o título de RPR en suero > 1:3222-24.
- -
Fracaso del tratamiento.
En pacientes con infección por el VIH la neurosífilis ocurre con mayor frecuencia, progresa más rápidamente y cursa con formas más atípicas25. En un contexto clínico adecuado, la presencia de > 5 células mononucleares/mm3 en el LCR es sugestiva de neurosífilis. Desafortunadamente el 40-60% de los pacientes con infección por el VIH pueden presentar pleocitosis o hiperproteinorraquia en el LCR en ausencia de sífilis25. Un recuento de > 20 células mononucleares/mm3 se asocia con más frecuencia a infección por espiroquetas que a la propia infección por el VIH. El test serológico considerado de referencia para el diagnóstico de neurosífilis es el VDRL en LCR, su sensibilidad puede ser tan baja como un 30%23.
TratamientoLos pacientes con infección por el VIH deben ser tratados con el mismo régimen terapéutico que los pacientes seronegativos8,23,26. La penicilina es el tratamiento de elección si bien la pauta varía con el estadio de la sífilis8,26.
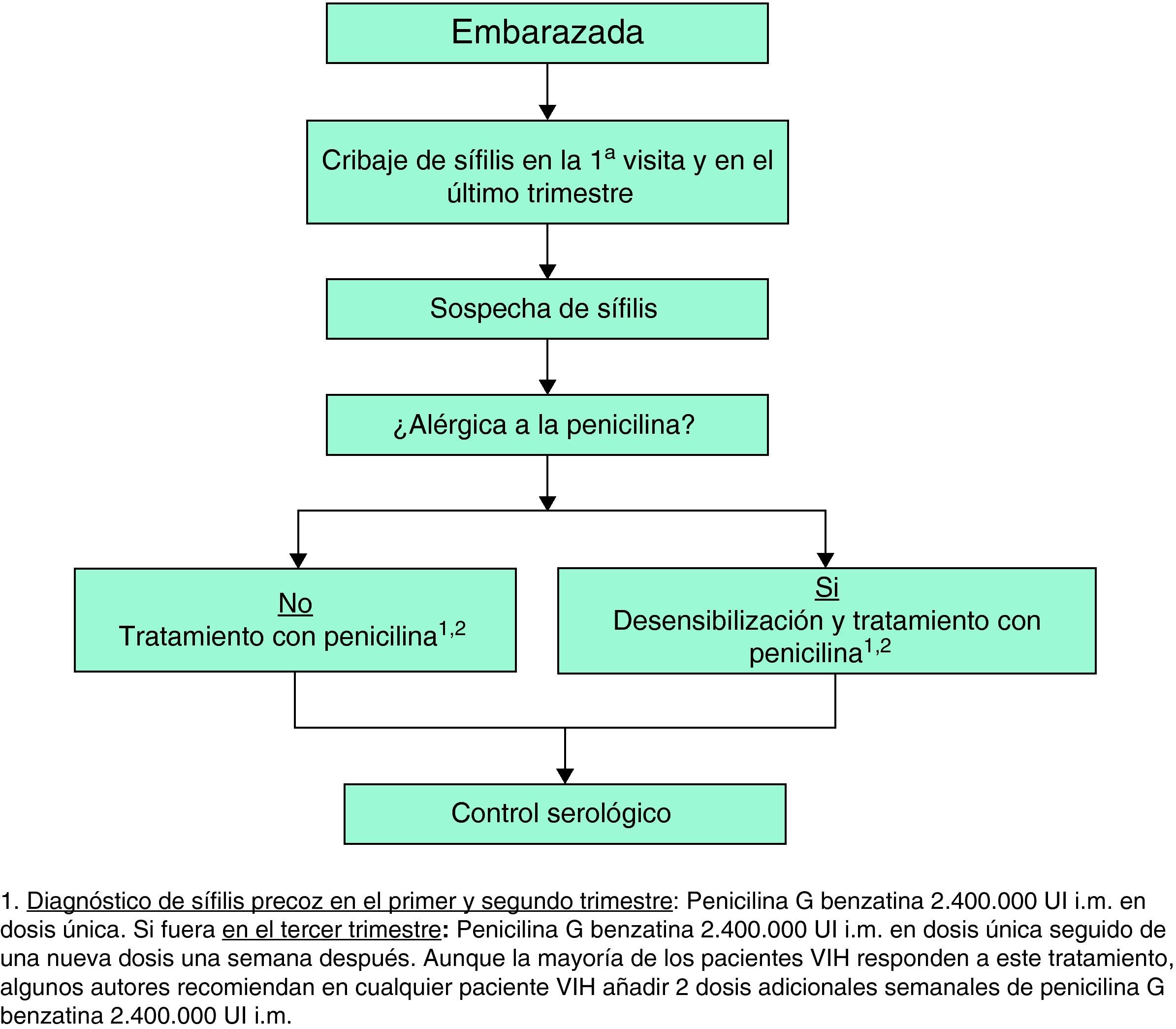
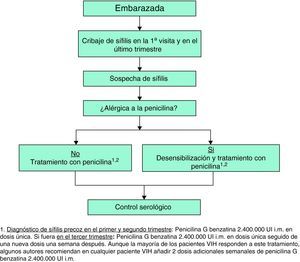
Sífilis en el embarazoTodas las mujeres embarazadas deben ser sometidas a pruebas de detección de sífilis en la primera visita26. El tratamiento que deben recibir las gestantes es el que corresponda a su estadio de la sífilis. La penicilina es el tratamiento de elección, incluso en las alérgicas, por lo que si fuera éste el caso sería preciso hacer una desensibilización y tratamiento con penicilina8,26. Tras el tratamiento se deben realizar nuevas serologías en el tercer trimestre y tras el parto.
Tratamiento de las parejas sexualesTodos los contactos sexuales (vía oral, vaginal o anal) de una persona diagnosticada de sífilis, en cualquiera de sus estadios, deben ser evaluados clínica y serológicamente8,23,27. Si se trata de una sífilis 1ª habrá que investigar a los contactos de los últimos 3 meses; en la sífilis 2ª a los de los últimos 6 meses y en le caso de la sífilis latente precoz a los del último año.
En el caso de aquellos pacientes con sífilis latente tardía será preciso investigar a las parejas de hace más de 1 año. El control serológico se realizará el día de la visita y si fuera negativo, se debe repetir a las 6 semanas y a los 3 meses27. Se desconoce el período de abstinencia sexual recomendada en estos pacientes23.
SeguimientoExisten datos controvertidos sobre si la infección por el VIH condiciona la respuesta terapéutica y serológica de los pacientes con sífilis. Si bien algunos estudios sugieren que la respuesta serológica al tratamiento es menos favorable en los pacientes infectados por el VIH28,29, se desconoce su significado clínico dado que puede deberse a un menor aclaramiento de las pruebas no treponémicas más que a una menor eficacia terapéutica28. Los criterios de curación no están claramente establecidos. Hay que tener en cuenta, que aunque las pruebas no treponémicas usualmente se negativizan, en algunos pacientes pueden persistir positivas a títulos bajos durante un largo período de tiempo e incluso de por vida (serofast reaction)28.
Sífilis primaria, secundaria y latente precozSe acepta que tras un tratamiento efectivo se produce una reducción de al menos 4 veces en el título de las pruebas no treponémicas en los primeros 12 meses tras el tratamiento. Si el título no disminuye 4 veces a los 12 meses, si aumenta en su transcurso o si persisten o reaparecen los síntomas y/o signos, hay que realizar un estudio en el LCR para descartar la existencia de una neurosífilis27. En todos estos casos se hace preciso realizar un nuevo tratamiento con 3 dosis semanales de penicilina G, a no ser que el estudio del LCR indique que se trata de una neurosífilis8.
Sífilis latente tardíaSi a los 12-24 meses no se ha producido una reducción del título en 4 veces se recomienda el análisis del LCR.
NeurosífilisEn los pacientes con neurosífilis que presentan una pleocitosis previa al inicio del tratamiento, se debe realizar una evaluación del LCR cada 6 meses hasta lograr la total normalidad del mismo8. La normalización de la linfocitosis en LCR parece ser el marcador más precoz de respuesta al tratamiento26. La normalización de los títulos de VDRL es más lenta, en especial en los pacientes con CD4<200 cél/mm3 y en aquellos sin tratamiento antirretroviral (TARV)18. Los pacientes con infección por el VIH tienen 2,5 veces menos probabilidades de normalizar los niveles de VDRL en LCR que los pacientes no infectados por el VIH18. Se desconoce si la falta de normalización en los niveles de VDRL en LCR traduce un fracaso terapéutico18.
Sífilis en el embarazoEn estas pacientes los controles serológicos se deben repetir en las semanas 28-32 de gestación y en el momento del parto8. En las mujeres con un alto riesgo de reinfección los controles deben ser mensuales8.
Fracaso terapéuticoSe entiende por fracaso terapéutico la recurrencia o persistencia de las manifestaciones clínicas, la ausencia de una caída ≥ 4 veces el título de las pruebas no treponémicas a los 24 meses tras el tratamiento de la sífilis latente o un incremento ≥ 4 veces en el título de dichas pruebas en cualquier momento del tratamiento26. En los pacientes con neurosífilis el retratamiento debe realizarse si no se normaliza la cifra de leucocitos en el LCR 6 meses después de haber completado el tratamiento o si los títulos del VDRL en LCR continúan reactivos 2 años después del tratamiento26.
Sífilis, infección por el VIH y tratamiento antirretroviralA pesar de que la respuesta serológica es más lenta en los pacientes infectados por el VIH, ésta mejora en los pacientes en TARV, en los que además, el riesgo de desarrollar una neurosífilis se reduce en un 65%30.
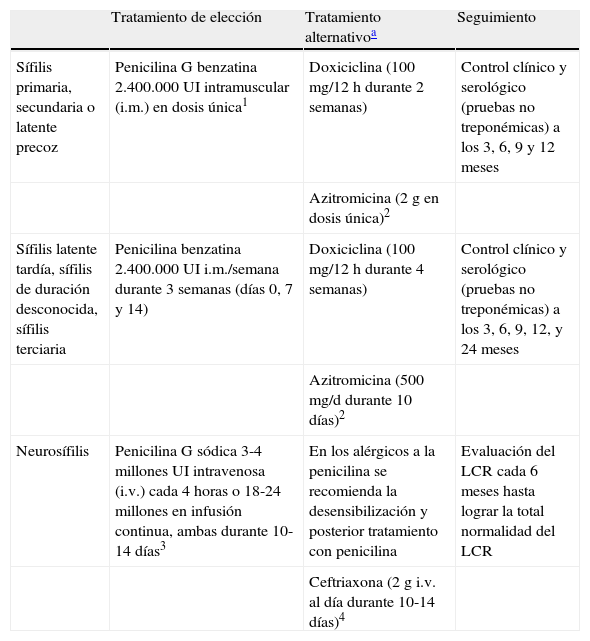
En la tabla 8 se presentan las recomendaciones para el tratamiento y seguimiento de la sífilis en los pacientes con infección por el VIH y en la figura 3 el manejo diagnóstico, terapéutico y de seguimiento de la paciente embarazada.
Recomendaciones terapéuticas y de seguimiento de la sífilis en los pacientes con infección por el VIH
| Tratamiento de elección | Tratamiento alternativoa | Seguimiento | |
| Sífilis primaria, secundaria o latente precoz | Penicilina G benzatina 2.400.000 UI intramuscular (i.m.) en dosis única1 | Doxiciclina (100 mg/12 h durante 2 semanas) | Control clínico y serológico (pruebas no treponémicas) a los 3, 6, 9 y 12 meses |
| Azitromicina (2g en dosis única)2 | |||
| Sífilis latente tardía, sífilis de duración desconocida, sífilis terciaria | Penicilina benzatina 2.400.000 UI i.m./semana durante 3 semanas (días 0, 7 y 14) | Doxiciclina (100 mg/12 h durante 4 semanas) | Control clínico y serológico (pruebas no treponémicas) a los 3, 6, 9, 12, y 24 meses |
| Azitromicina (500 mg/d durante 10 días)2 | |||
| Neurosífilis | Penicilina G sódica 3-4 millones UI intravenosa (i.v.) cada 4 horas o 18-24 millones en infusión continua, ambas durante 10-14 días3 | En los alérgicos a la penicilina se recomienda la desensibilización y posterior tratamiento con penicilina | Evaluación del LCR cada 6 meses hasta lograr la total normalidad del LCR |
| Ceftriaxona (2g i.v. al día durante 10-14 días)4 |
En los pacientes alérgicos a la penicilina las alternativas no han sido evaluadas como para poder posicionarlas en primera línea:
1. Aunque la mayoría de los pacientes VIH responden a este tratamiento, algunos autores recomiendan añadir 2 dosis adicionales semanales de penicilina G benzatina 2.400.000 UI i.m.
2. La azitromicina puede ser una opción terapéutica útil para el tratamiento de la sífilis primaria y secundaria. No obstante, se está comunicando un aumento de las resistencias intrínsecas a este antibiótico y la existencia de fracasos.
3. Algunos autores recomiendan, una vez finalizado el anterior tratamiento, administrar una dosis semanal de penicilina benzatina 2.400.000 UI i.m. durante 3 semanas.
4. Pueden existir reacciones de hierpesensibilidad cruzadas entre ambas.
- 1.
Los pacientes con infección por el VIH deben ser tratados con el mismo régimen terapéutico que los pacientes seronegativos siendo la penicilina el tratamiento de elección (A-II).
- 2.
En las embarazadas la penicilina es el tratamiento de elección, incluso en las alérgicas, en quien habría que hacer una desensibilización y tratamiento con penicilina (A-III).
- 3.
En todo paciente con clínica neurológica y/o fracaso terapéutico está indicada la realización de una punción lumbar para descartar la posibilidad de neurosífilis (A-III).
El VPH pertenece al género Papillomavirus dentro de la familia Papillomaviridae. Existen más de 100 genotipos del VPH, de los cuales 40 pueden infectar al ser humano por vía sexual mediante contacto directo con piel o mucosas, vertical, en el canal del parto, o a través de fómites. Estos virus se clasifican por su localización en virus de la piel y de las mucosas y por su capacidad de oncogénesis en VPH de bajo, medio y alto riesgo oncogénico.
La infección genital por el VPH es la ITS más frecuente, estimándose que cerca del 80% de la población se infectará al menos en una ocasión a lo largo de su vida31, adquiriéndose durante los primeros meses después de la primera relación sexual.
La infección por VPH puede ser sintomática o asintomática y se ha relacionado con distintas patologías benignas y malignas como verrugas/condilomas, papilomatosis respiratoria recurrente (transmisión materno-fetal) y carcinomas de células escamosas. El cáncer de cuello uterino es el mayor problema de Salud Pública que puede provocar la infección por VPH. A pesar de que con los programas de cribado citológico ha disminuido el número de casos de cáncer cervical, la incidencia continúa siendo elevada32.
EpidemiologíaEl papel oncogénico de los VPH en el cáncer anal (CA) y de cérvix no tiene discusión33-36. Los pacientes seropositivos para el VIH tienen una frecuencia 2 a 6 veces mayor de estar infectados por el VPH con independencia de sus prácticas sexuales y una frecuencia 7 veces mayor de que la infección sea persistente dado que la inmunosupresión les impide eliminar el virus37.
En pacientes con infección por el VIH se ha descrito una incidencia de neoplasia cervical intraepitelial (CIN) mayor que en las mujeres no infectadas por el VIH38. Como resultado de las observaciones que relacionaban el cáncer cervical con la infección por VPH en pacientes seropositivas para el VIH, en 1993 los CDC definieron como categoría B la presencia de CIN 2-3 y al cáncer cervical invasivo como categoría C39. El carcinoma de células escamosas representa el 85-90% de los cánceres de cérvix y en casi el 100% de los casos se halla ADN del VPH, siendo los genotipos más prevalentes el 16, 18 y 3133-36,40.
El CA corresponde a menos del 5% de todos los cánceres de las vías digestivas en la población general y es el cuarto cáncer en frecuencia en la población de pacientes con infección por el VIH32,41. Clásicamente, las poblaciones con el mayor riesgo de desarrollar CA eran las mujeres y los ancianos, pero tan pronto como se asoció con el VPH y con las relaciones sexuales de riesgo, se empezaron a hacer estudios en HSH y se encontró una incidencia anual de 35 casos por 100.000 hombres, cifra muy similar a lo que era el cáncer cervical antes de utilizar el cribado con citología vaginal42. Al igual que para el cérvix, las mujeres y varones VIH respecto a la población general tienen una mayor prevalencia de infección anal por VPH y de lesiones cito/histológicas anales, una mayor incidencia de infección anal, con una mayor persistencia de la infección y más rápida progresión de las lesiones cito/histológicas hacia cáncer33,41,43-45. El genotipo 16 es el más frecuente en estas lesiones y se encuentran infecciones simultáneas por varios tipos en el 73% de los HSH VIH positivos y en el 23% de los HSH VIH negativos; a pesar de esto, el CA no se considera una entidad definitoria de SIDA.
El VPH se relacionó por primera vez con los carcinomas escamosos orofaríngeos en 198346 y desde entonces diversos estudios47-49 han ido confirmando el papel etiológico/oncogénico de algunos tipos de VPH en un subgrupo de neoplasias de cabeza y cuello. El carcinoma escamoso orofaríngeo relacionado con la infección por VPH se caracteriza por afectar a pacientes a edades más tempranas y tener menor relación con los factores de riesgo clásicos. Así mismo, se ha visto que el número de parejas sexuales desde el inicio de las mismas, la práctica de sexo oral, la presencia de alteraciones anales por VPH en el mismo paciente y el tener una pareja sexual con CIN son factores de riesgo asociados49-51. Aunque la infección de la cavidad oral por el VPH en pacientes con infección por el VIH es relativamente frecuente47,51-54, no se ha descrito un aumento de cánceres de cabeza y cuello en esta población, pero la mayor esperanza de vida conseguida con el TARV podría cambiar su incidencia y prevalencia.
Por último, el VPH se ha establecido en las últimas décadas como agente etiológico de al menos un 40% de los carcinomas escamosos de pene55. La prevalencia de VPH en el carcinoma escamoso de pene oscila entre un 30-80%, superior en población VIH que en población general53,55,56. El carcinoma escamoso de pene asociado al VPH se ha relacionado con diferentes factores de riesgo tales como no estar circuncidado, número de parejas sexuales, tener una pareja sexual con displasia de cérvix y la infección por el VIH56-61.
PatogeniaEl VPH es un virus ADN que infecta la piel o epitelio de las mucosas. El genoma del virus codifica las proteínas de la cápside (L1 y L2) y seis proteínas denominadas tempranas (E1, E2, E4 hasta E7) que permiten la replicación viral y la formación de partículas virales62.
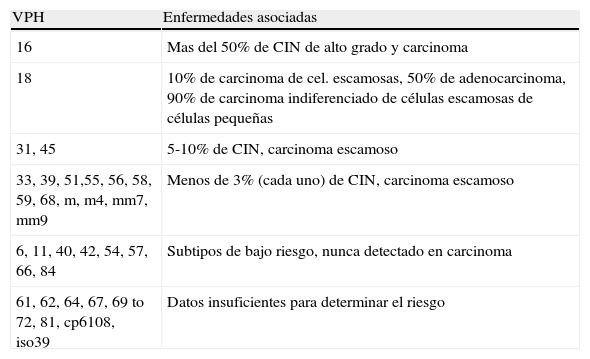
Los VPH de bajo riesgo (VPH-BR), VPH 6 y 11, causan más del 90% de los condilomas y papilomatosis respiratoria recurrente. La infección por VPH-AR causa el 100% de los cánceres de cuello uterino, el 50% de los de vulva, vagina y pene, y el 12% de orofaringe (tablas 9 y 10).
Tipos de VPH y enfermedades asociadas
| VPH | Enfermedades asociadas |
| 16 | Mas del 50% de CIN de alto grado y carcinoma |
| 18 | 10% de carcinoma de cel. escamosas, 50% de adenocarcinoma, 90% de carcinoma indiferenciado de células escamosas de células pequeñas |
| 31, 45 | 5-10% de CIN, carcinoma escamoso |
| 33, 39, 51,55, 56, 58, 59, 68, m, m4, mm7, mm9 | Menos de 3% (cada uno) de CIN, carcinoma escamoso |
| 6, 11, 40, 42, 54, 57, 66, 84 | Subtipos de bajo riesgo, nunca detectado en carcinoma |
| 61, 62, 64, 67, 69 to 72, 81, cp6108, iso39 | Datos insuficientes para determinar el riesgo |
El ciclo de vida del VPH ocurre en los queratinocitos. Los papilomavirus tienen 2 tipos de replicación. La primera se da en las células basales de la epidermis, donde el ADN se mantiene como un plásmido, hablándose de infección no permisiva, porque no tiene lugar el ciclo completo de replicación vírica. El genoma viral se replica una vez por ciclo celular sincrónicamente con el cromosoma de la célula huésped. Este tipo de replicación mantiene una infección latente y persistente en las células madre de la epidermis. La segunda, o replicación vegetativa, tiene lugar en las células más diferenciadas de la epidermis, los queratinocitos, donde se producen grandes cantidades de ADN vírico, que luego será empaquetado para formar las nuevas partículas víricas. En la mayoría de los casos, la infección ocurre sin una transformación maligna. En tales casos, el ADN viral se mantiene separado del ADN del huésped en forma de episoma. En el subgrupo de infecciones por VPH que progresan a un proceso maligno, el ADN viral se integra en el genoma del huésped durante la progresión hacia el cáncer. El proceso de la carcinogénesis se asocia con la expresión de las proteínas E6 y E7, las cuales inactivan respectivamente a la proteína p53 supresora tumoral y a la proteína del retinoblastoma62.
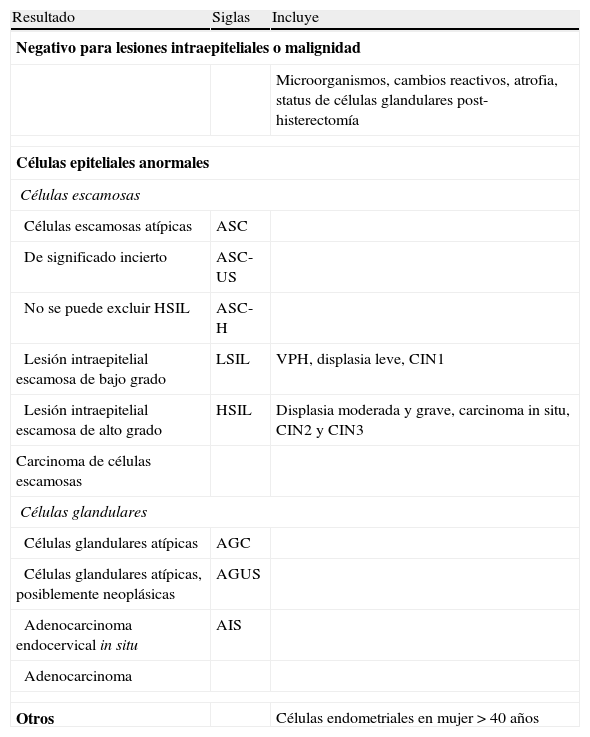
Clasificación cito/histológicaLa progresión de la infección por VPH a cáncer cervical se acompaña de una secuencia de cambios histológicos. Ha habido frecuentes modificaciones en la nomenclatura para la clasificación de las alteraciones citológicas e histológicas asociadas con la infección por el VPH en cérvix, aceptándose actualmente los criterios del sistema Bethesda63 que se presentan en la tabla 11.
Sistema Bethesda 2001
| Resultado | Siglas | Incluye |
| Negativo para lesiones intraepiteliales o malignidad | ||
| Microorganismos, cambios reactivos, atrofia, status de células glandulares post-histerectomía | ||
| Células epiteliales anormales | ||
| Células escamosas | ||
| Células escamosas atípicas | ASC | |
| De significado incierto | ASC-US | |
| No se puede excluir HSIL | ASC-H | |
| Lesión intraepitelial escamosa de bajo grado | LSIL | VPH, displasia leve, CIN1 |
| Lesión intraepitelial escamosa de alto grado | HSIL | Displasia moderada y grave, carcinoma in situ, CIN2 y CIN3 |
| Carcinoma de células escamosas | ||
| Células glandulares | ||
| Células glandulares atípicas | AGC | |
| Células glandulares atípicas, posiblemente neoplásicas | AGUS | |
| Adenocarcinoma endocervical in situ | AIS | |
| Adenocarcinoma | ||
| Otros | Células endometriales en mujer > 40 años | |
CIN: neoplasia intraepitelial cervical.
En cuanto a las neoplasias intraepiteliales de ano (AIN), de forma similar a lo empleado en la patología cervical, se clasifican en AIN 1 (involucra el tercio inferior de la epidermis), AIN 2 (afecta a los dos tercios inferiores de la epidermis) y AIN 3 (afecta a toda la epidermis). Igualmente, usando los criterios del sistema Bethesda63, se puede clasificar el CA según los hallazgos de la citología anal (tabla 12).
Criterios de Bethesda para la evaluación y clasificación de la citología y biopsia anal
| 1. Normal. |
| 2. Lesión intraepitelial escamosa de bajo grado (LSIL), que corresponde histopatológicamente a una AIN 1. |
| 3. Lesión intraepitelial escamosa de alto grado (HSIL) que puede ser AIN 2, AIN 3 o (carcinoma in situ). |
| 4. Células escamosas atípicas de significado indeterminado (ASCUS, por sus siglas en inglés). |
| 5. Células escamosas atípicas en las que no se puede descartar una lesión de alto grado (ASC-H). |
| 6. Muestra insuficiente, menos de 200 células nucleadas en el cristal. |
| AIN 1/LSIL son lesiones benignas cuya tendencia es a la regresión, mientras que las AIN 2-3 son lesiones potencialmente precursoras de CA. |
De los diferentes tipos de neoplasia de pene, un 90% aproximadamente corresponden a los escamosos, de los que hay 3 subtipos: verrugoso, condilomatoso y basaloide. Al igual que en cérvix y ano, el carcinoma escamoso invasivo de pene tiene unas lesiones precursoras, conocidas como neoplasia intraepitelial de pene (NIP) que también se pueden clasificar en NIP 1 (displasia leve), NIP 2 (displasia moderada) y NIP 3 (displasia severa y carcinoma in situ). De la NIP 3 existen a su vez 3 variantes: papulosis bowenoide, enfermedad de Bowen y eritroplasia de Queyrat.
Pruebas diagnósticas de la infección por VPH y de la patología relacionadaEn la tabla 13 se presenta un resumen de todas las pruebas diagnósticas de la infección por VPH y patología relacionada8,9.
Pruebas diagnósticas
| Citología |
| Sensibilidad: 30-87% (51% para CIN 3). |
| Especificidad: 86-100%. |
| Muestras: retirar previamente el exceso de mucosidad |
| Exudado de endo y exocérvix conjunta o separadamente. |
| Exudado vaginal: sólo cuando no sea posible visualizar o alcanzar el cérvix. |
| Exudado perianal. |
| Exudado del canal anal. |
| Informe: según el sistema de Bethesda. |
| Calidad de la muestra: |
| Adecuada. |
| Procesada y examinada pero inadecuada para evaluación. |
| Inadecuada y rechazada. |
| Resultado estudio citológico: ver tabla 12. |
| Convencional (Papanicolau): primera técnica aprobada por la FDA para el cribado poblacional del cáncer de cérvix. |
| Muestras: tomar con escobillón, rotándolo tres veces en sentido contrario a las agujas del reloj o con cepillo cervical rotando tres veces más espátula rotada una vez por el os cervical. Extender la muestra sobre un portaobjetos en una sola dirección para no alterar la morfología celular; si se usa cepillo más espátula, extender ambas sobre el mismo porta. |
| Elevado porcentaje de muestras insatisfactorias: 8%. |
| Tiempo de observación del experto, aunque es automatizable (AutoPap 300, NeoPath Inc.). |
| Bajo coste. |
| Líquida o en monocapa (ThinPrep): introducir la muestra en la solución conservante. |
| La toma de muestra con cepillo duplica el número de células. |
| En el proceso de preparación se eliminan artefactos y contaminantes. |
| Reduce significativamente las muestras insatisfactorias. |
| Reduce el tiempo de observación. |
| Faltan evidencias sobre la sensibilidad comparada con el Papanicolau. |
| Sobre la misma muestra se pueden realizar otras técnicas diagnósticas, como captura híbrida o PCR. |
| Coste elevado (4 veces el de Pap por carcinoma detectado). |
| Colposcopia: observación del cuello uterino con espéculo, lente de aumento e iluminación |
| Debe realizarse en caso de citología anormal o siempre que existan signos o síntomas sugestivos de cáncer. |
| Anoscopia: observación del margen y canal anal, línea dentada y porción distal del recto con proctoscopio, lente de aumento e iluminación. |
| Debe realizarse en toda persona con verrugas anales. |
| Para ambas técnicas (colposcopia y anoscopia): |
| Conjuntamente con citología, VPN cercano al 100%. |
| Informe: según Comité de Nomenclatura de la Federación Internacional de Patología Cervical, Barcelona 2002, que se incluye como tabla 16. |
| Aplicación de ácido acético al 3%: epitelio aceto-blanco y patrones vasculares son sugestivos de displasia o carcinoma. |
| Aplicación de lugol: |
| Epitelio color caoba: normal. |
| Epitelio amarillento: displasia. |
| No permite identificar invasión, por lo que ante imágenes sugestivas de lesión de alto grado o de cáncer invasivo, es preceptiva la biopsia. |
| Histología (biopsia): es el “patrón oro” para el diagnóstico de lesiones causadas por VPH. Se realizará siempre tras identificación de lesión sospechosa en colposcopia o anoscopia. |
| Identificación del VPH |
| La ausencia de un panel de estándares impide medir y comparar la sensibilidad y especificidad de las diferentes técnicas comerciales para identificación del VPH. |
| Toma de muestras para identificación de VPH: |
| Después de tomar las muestras para citología. |
| Antes de aplicar ácido acético ni lugol. |
| Con escobillón de algodón o alginato con o sin suero fisiológico o con el dispositivo propio de cada sistema cuando se incluya. |
| No emplear cepillos para las técnicas de amplificación. |
| Mujeres: |
| Tras haber retirado el exceso de mucosidad, rotar el escobillón sobre la lesión. |
| Hombres |
| Frotado o rotado con escobillón de dacrón tras raspado con lima o papel de filtro para descamar las células. |
| En ausencia de lesión, muestra combinada de las diferentes regiones anatómicas genitales. |
| Con los dispositivos específicos si los hubiera, si no, con escobillón de algodón o alginato con o sin suero fisiológico. |
| No usar cepillo, el exceso de material puede inhibir la reacción. |
| Conservación a temperatura ambiente 24-48h (las muestras en medio conservante, hasta 2-3 semanas), refrigeradas varias semanas y para períodos más prolongados, a -20°C. |
| Hibridación (captura híbrida, HC2, Digene): hibridación del ADN del VPH con sondas ARN específicas, captura del híbrido con anticuerpos y amplificación de señal. |
| Emplea dos juegos de sondas, uno para 13 VPH-AR y otro para 5 VPH de bajo riesgo: |
| VPH-AR: 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59 y 68. |
| VPH-BR: 6, 11, 42, 43 y 44. |
| No identifica los genotipos específicos. |
| Muestras: exudados recogidos con el dispositivo específico, biopsias en medio de transporte o cepillados en medio conservante y preparaciones de citología líquida. |
| Automatizable. |
| Sensibilidad: 1 pg de ADN o 100.000 copias del genoma viral. |
| Tinción inmunohistoquímica con sondas de ADN marcadas con fluoresceína. |
| El sistema Benchmark Inform (Ventana Medical Systems, Tucson, Ariz.) realiza de forma automática este proceso. |
| Identifica los VPH mediante dos juegos de sondas, de alto y bajo riesgo. |
| Muestras: tejidos, citología convencional o líquida. |
| PCR con iniciadores de consenso sobre la región L1, que codifica una proteína de la cápside viral |
| Sensibilidad: 10 copias de ADN/millón de células. |
| Identifican los genotipos de forma individual. |
| Iniciadores MY09/11: cebadores degenerados que amplifican un fragmento de 450 pb |
| Poco sensibles para ADN degradado o mal conservado. |
| No detectan el genotipo 35. |
| La variante PGMY09/11 mejora la sensibilidad y el espectro. |
| Iniciadores GP5/GP6 o GP5+/GP6+: amplifican un fragmento de 150 pb. |
| Más sensibles. |
| No detectan el genotipo 52, 2.ª causa de carcinoma de cérvix en algunos países. |
| La visualización e identificación de los genotipos mediante hibridación con sondas específicas (arrays): |
| Linear Array HPV, Roche Molecular Systems, que identifica 37 genotipos de alto y bajo riesgo hibridando con sondas inmovilizadas sobre fase sólida: |
| AR: 16, 18, 26, 31, 33, 35, 39, 45, 51, 52, 53, 56, 58, 59, 64, 66, 67, 68, 69, 70, 73, 82, 83, 84 e IS39. |
| BR: 6, 11, 40, 42, 54, 55, 61, 62, 71, 72, 81 y CP6108. |
| CLART HPV2, Genomica SAU que identifica 35 genotipos con arrays de baja densidad. |
| AR: 16, 18, 26, 31, 33, 35, 39, 43, 45, 51, 52, 53, 56, 58, 59, 66, 68, 70, 73, 85 y 89. |
| BR: 6, 11, 40, 42, 44, 54, 61, 62, 71, 72, 81, 83 y 84. |
| PCR específica: emplea iniciadores para identificar un genotipo específico o los oncogenes E6 y E7. |
| Sensibilidad de femtogramos y especificidad cercana al 100%. |
| Estudios de integración viral. |
| Detección de variantes. |
| Cuantificación relativa. |
| Templex HPV, Genaco Medical Products, detecta, identifica y semicuantifica en un solo tubo 25 genotipos de VPH, 21 de AR y 4 de BR, mediante iniciadores específicos de los oncogenes E6 y E7 con sensibilidades que oscilan entre 20 y 100 copias/reacción. |
| VPH-AR: 16, 18, 26, 31, 33, 35, 39, 45, 51, 52, 53, 56, 58, 59, 66, 67, 68, 69, 70, 73 y 82. |
| VPH-BR: 11, 6, 42 y 44. |
| Amplificación enzimática isotérmica con lectura fluorescente sobre la monocapa de la citología líquida: |
| Cervista HPV HR, Hologic, detecta 14 VPH de AR de forma conjunta: 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 66 y 68. |
| Cervista HPV 16/18, Hologic, que permite identificar estos dos genotipos en las muestras positivas. |
| Hibridación inversa en fase sólida: una mezcla de iniciadores amplifica un fragmento de 65 pb de la región L1 e identifica los genotipos por hibridación en tiras de celulosa: |
| SPF10-INNO LiPA HPV, Labo Bio-Medical Products. |
| Gran sensibilidad para tejidos parafinados y fijados. |
| El exceso de sensibilidad trae problemas de contaminación, por lo que se suelen sustituir los iniciadores por otros de consenso, con pérdida de sensibilidad. |
| Amplificación del ARNm de los oncogenes E6/E7 |
| La expresión de estos oncogenes es un factor pronóstico independiente de evolución: a mayor expresión, menor supervivencia. |
| Muestras: tejidos, citología convencional o líquida. |
| In-Cell, Invirion, automatizable. |
Los condilomas vulvovaginales se asocian fundamentalmente con los VPH-BR 6 y/u 1164, su prevalencia es más alta en pacientes con infección por el VIH, que con frecuencia tienen más de un tipo de VPH65.
La indicación del tratamiento de los condilomas vulvovaginales es el alivio sintomático y/o razones psicológicas. Cuando el aspecto de los condilomas sugiera la existencia de neoplasia intraepitelial subyacente o cáncer, así como en el caso de lesiones refractarias al tratamiento médico, se debería indicar la biopsia previa al inicio del tratamiento66. En las mujeres VIH, la identificación de condilomas vulvares obliga a realizar biopsia debido a la mayor prevalencia de neoplasias de alto grado67.
Existen dos tipos de “tratamiento médico”:
- -
Terapia citodestructiva (destruye el tejido del condiloma): tratamientos tópicos con crioterapia con nitrógeno líquido o con ácido tricloroacético.
- -
Terapia inmuno-mediada (ayuda al sistema inmune a aclarar el condiloma): tratamiento tópico con imiquimod, interferón administrado de forma tópica o inyectable y el uso tópico de sinecatequinas.
El “tratamiento quirúrgico” (escisión o ablación) se reserva para:
- -
No respuesta al tratamiento médico.
- -
Enfermedad extensa o voluminosa.
- -
Enfermedad multicéntrica que afecta a vagina, vulva o ano.
- -
Enfermedad asociada a neoplasia intraepitelial.
En las mujeres con inmunosupresión por VIH37 el tratamiento de elección es el imiquimod al 5% tópico.
En el embarazo se prefiere la utilización de tricloroacético por la ausencia de absorción sistémica y la inexistencia de efectos secundarios fetales documentados. La recurrencia disminuye cuando el tratamiento se realiza en la segunda mitad de la gestación.
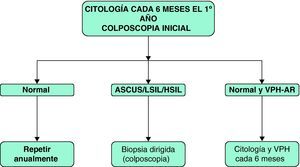
Cáncer de cérvixCribado de cáncer cervical en mujeres infectadas por VIHEn toda mujer diagnosticada de infección por el VIH es esencial un control ginecológico periódico, que debe incluir una inspección externa, una toma de muestra para estudio citológico y la biopsia de cualquier lesión sospechosa tanto de vulva, vagina o cérvix68.
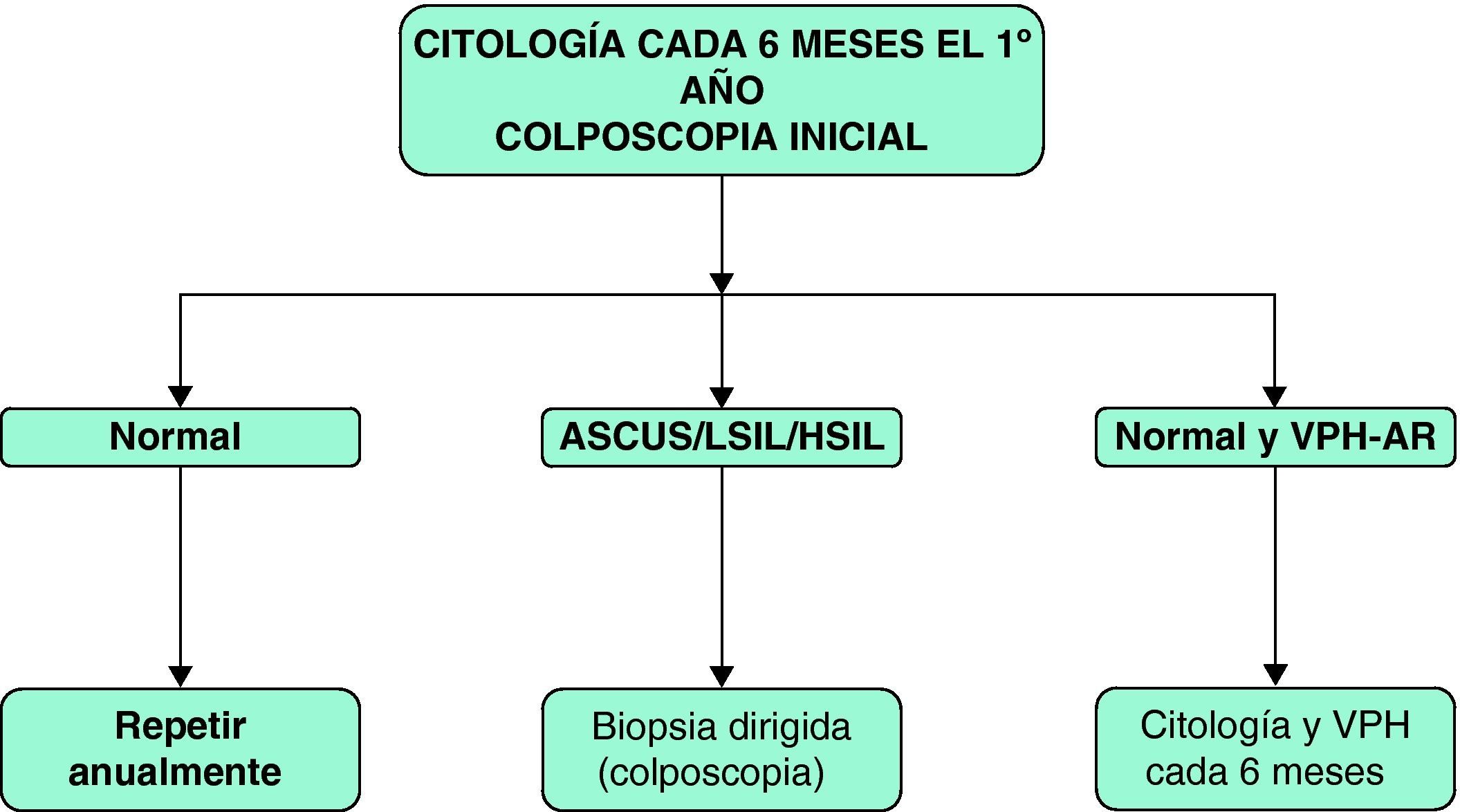
La utilidad de la prueba diagnóstica de determinación de PCR para VPH va encaminada a determinar la periodicidad de la realización de la citología, de modo que si se detecta VPH-AR se debe aconsejar la realización de citología semestral.
Se recomienda la colposcopia inicial tanto de la vagina, como de la vulva y el cérvix debido al alto riesgo de enfermedad multifocal en las mujeres con infección VIH69. La necesidad de posteriores colposcopias se basa en los resultados de la citología.
En la figura 4 se presenta el algoritmo de cribado de cáncer de cérvix en las pacientes con infección por el VIH.
El uso combinado de citología y PCR de VPH en población de riesgo como la infectada por el VIH, aumenta la eficacia del cribado de la enfermedad cervical por VPH. El uso de técnicas moleculares debería estar recomendado, pero si no estuviesen disponibles en nuestro medio, se deberían realizar al menos en las siguientes situaciones:
- -
Pacientes con infección por el VIH con citología normal, pero historia clínica de riesgo para adquirir la infección por el VPH.
- -
Citología compatible con AS-CUS.
- -
Control post-conización.
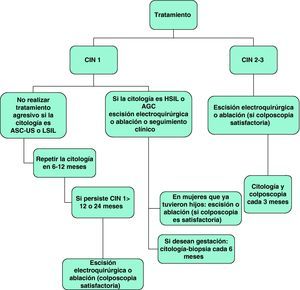
El tratamiento de CIN se basa en la correlación entre los hallazgos de la citología, la impresión de la colposcopia y los resultados de la biopsia, además de las características del paciente como la edad, gestación y la posibilidad del cumplimiento terapéutico70. Si la colposcopia no es satisfactoria, la ablación no es una opción terapéutica debido a que se requiere el examen histológico del tejido no visualizado para poder excluir la presencia de un cáncer oculto. En estos casos se recomienda un procedimiento escisional. También está indicada la escisión en la enfermedad recurrente tras el tratamiento con ablación71.
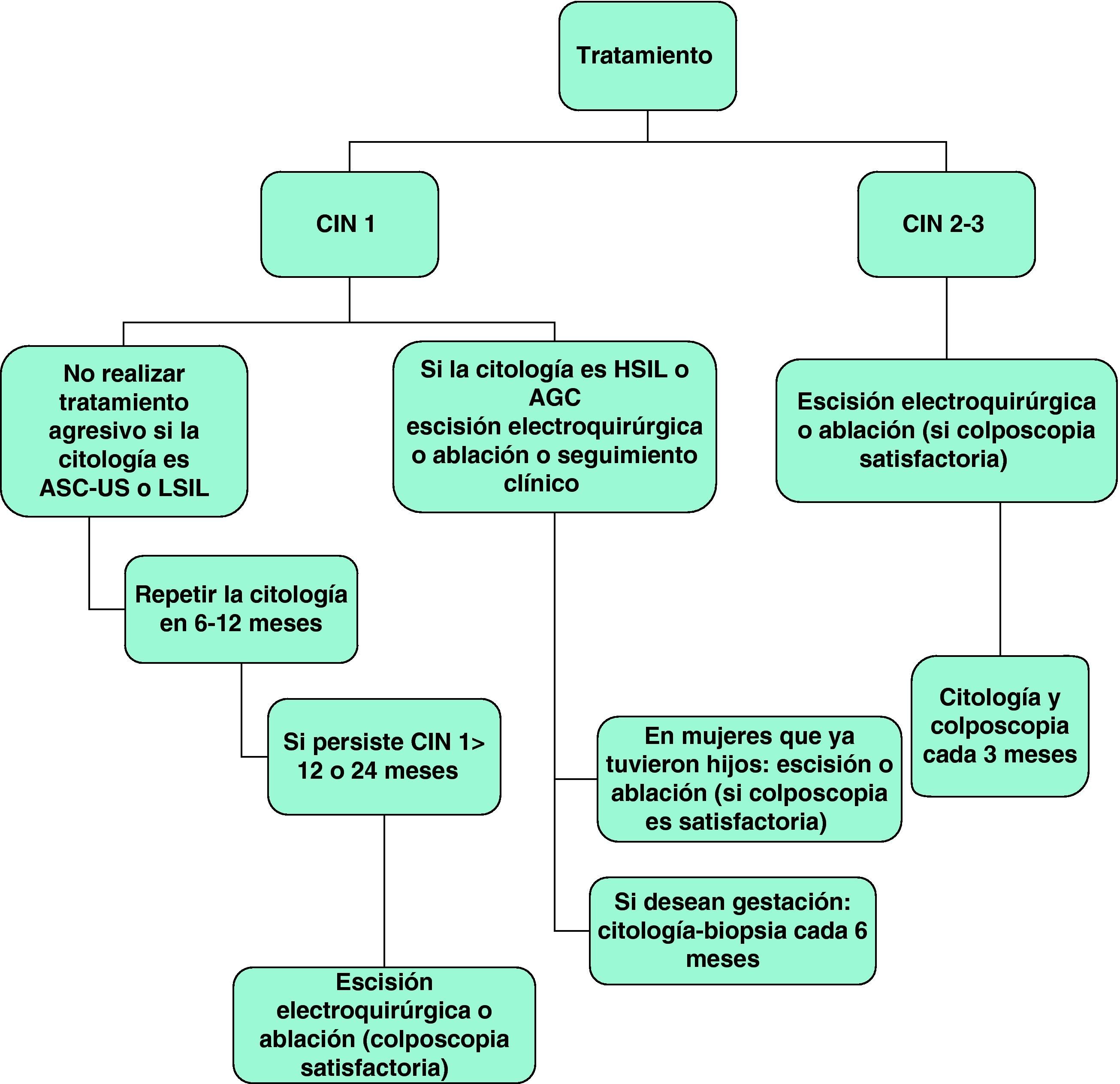
La figura 5 presenta el algoritmo terapéutico y seguimiento de la CIN72.
Embarazo y lesiones cervicales por VPHLa evaluación y el tratamiento de las lesiones cervicales precancerosas por VPH en mujeres embarazadas son diferentes al realizado en mujeres no embarazadas debido al riesgo de que el trauma en el cuello uterino provoque un adelanto del parto:
- 1.
Cuando la citología es compatible con ASC-US, se puede realizar la colposcopia durante el embarazo o retrasarlo hasta al menos 6 semanas después del parto.
- 2.
En el caso de ASC-H y de LSIL, se debería realizar una colposcopia.
La actitud terapéutica después de la colposcopia es la siguiente:
- 1.
CIN 1: se aconseja diferir la evaluación y el tratamiento hasta 6 semanas después del parto.
- 2.
CIN 2, 3: se deberían realizar colposcopia y citología cada 3 o 4 meses durante el embarazo, o diferirse al menos 6 semanas después del parto. No se recomienda la extirpación del área anormal durante el embarazo.
El tratamiento es el mismo que el indicado para mujeres sin infección por el VIH que consiste en cirugía con/sin radioterapia73.
TARV y cáncer de cérvixLa información de mayor calidad sobre el efecto de TARV en CIN procede del estudio observacional prospectivo multicéntrico (WHIS)74 que analiza la tasa de regresión de CIN incidente, demostrando una tasa de regresión del 12,5% por año de TARV, siendo mayor en pacientes con mayor recuento de CD4 y lesiones de bajo grado. Estas evidencias ponen de manifiesto que, en la actualidad, las lesiones de CIN son una indicación de inicio de TARV75.
Recomendaciones para el manejo de lesiones cervicales relacionadas con el VPH- 1.
Imiquimod es el tratamiento de elección para los condilomas genitales seguido de tratamiento quirúrgico en los fracasos. En las lesiones extensas o voluminosas el tratamiento debe ser la escisión quirúrgica “(C-II)”. Siempre se debe realizar biopsia para descartar neoplasia intraepitelial de cualquier localización
- 2.
En el primer año tras el diagnóstico de la infección por el VIH se recomienda realizar dos citologías cervicales (una cada seis meses) y si ambas son normales, se repetirá una citología anual, incluyendo inspección del ano, vulva y vagina “(C-II)”.
- 3.
Es recomendable realizar una colposcopia inicial “(C-II)”.
- 4.
En el caso de que se realice la prueba diagnóstica de PCR para VPH, la detección de un subtipo de alto riesgo oncogénico obligaría a realizar citología y determinación de VPH cada 6 meses “(C-II)”.
- 5.
La escisión electroquirúrgica y la ablación son las opciones terapéuticas de elección en pacientes con CIN 2-3 o CIN 1 persistente “(C-II)”. La escisión es el tratamiento de elección en los casos en que la colposcopia es insatisfactoria y después de la recurrencia tras la terapia ablativa “(C-II)”.
- 6.
Tras la escisión quirúrgica se recomienda citología cervical, colposcopia y uso liberal de la biopsia cada 3 meses “(C-II)”.
- 7.
El tratamiento del cáncer invasivo sigue las mismas pautas que el que se realiza en mujeres no infectadas por el VIH “(C-II)”.
El objetivo del tratamiento de la condilomatosis es conseguir la destrucción y extirpación del mayor número de lesiones con la mínima morbilidad. Dentro de las alternativas no quirúrgicas debemos contemplar el podofinilo y el imiquimod76. Como entidad aparte debemos mencionar el condiloma acuminado gigante o tumor de Bushke-Löwenstein, el cual se asocia más frecuentemente a carcinoma in situ o incluso a cáncer invasivo76. Los pacientes con esta entidad deben ser derivados al coloproctólogo para su extirpación, en la que es necesario asociar la mayoría de las veces plastias cutáneas.
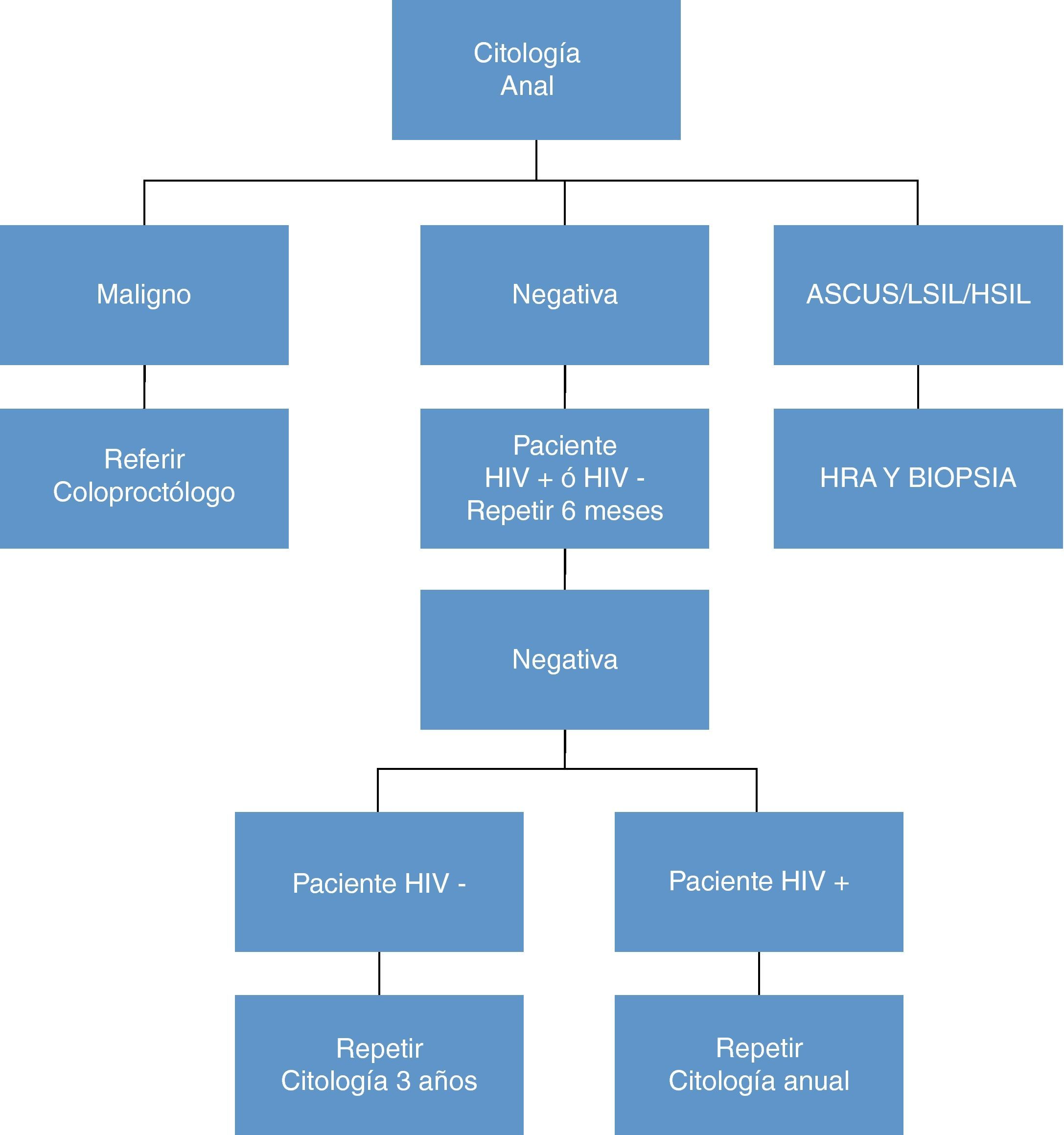
Cáncer de anoEn un intento de obtener los mismos resultados conseguidos con el cribado del cáncer cervical en la mujer, en los últimos años se han llevado a cabo multitud de estudios dirigidos a demostrar una utilidad semejante de la citología anal para detectar lesiones sugestivas de CA. Aún con la evidencia existente en la actualidad, continúa siendo controvertida la indicación de una técnica de cribado41,43,77,78. Así, por ejemplo, las guías publicadas por otras sociedades, como la inglesa, no recomiendan su práctica generalizada79.
Recomendaciones sobre el cribado del CA en pacientes con infección por el VIH (B-II)- 1.
El cribado se recomienda anualmente en:
- -
HSH con infección por el VIH.
- -
Mujeres con infección por el VIH con diagnóstico previo de cáncer de cérvix o CIN 3.
- -
- 2.
El cribado sería deseable en otros grupos de riesgo con potencial beneficio, cada 2-3 años:
- -
Mujeres con infección por el VIH.
- -
Hombres con infección por el VIH independiente de su historia sexual.
- -
HSH sin infección por el VIH.
- -
Mujeres sin infección por el VIH con cáncer vulvar o cervical.
- -
Pacientes inmunodeprimidos por otras razones independientes al VIH, como trasplantados.
Teniendo en cuenta la escasa disponibilidad en la mayoría de nuestros centros de la citología y aún más de la posterior anoscopia de alta resolución (HRA), así como de equipos de cirujanos formados sobre el problema, la inclusión de algoritmos de diagnóstico y tratamiento quizás sólo pueda establecerse en los centros con experiencia. En el resto, el tacto rectal puede ser el método más aceptable y rentable para hacer cribado en la población de alto riesgo44.
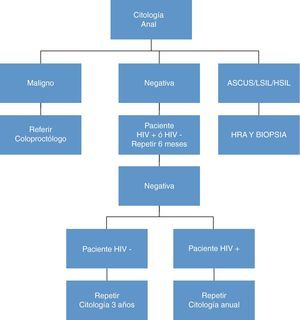
- -
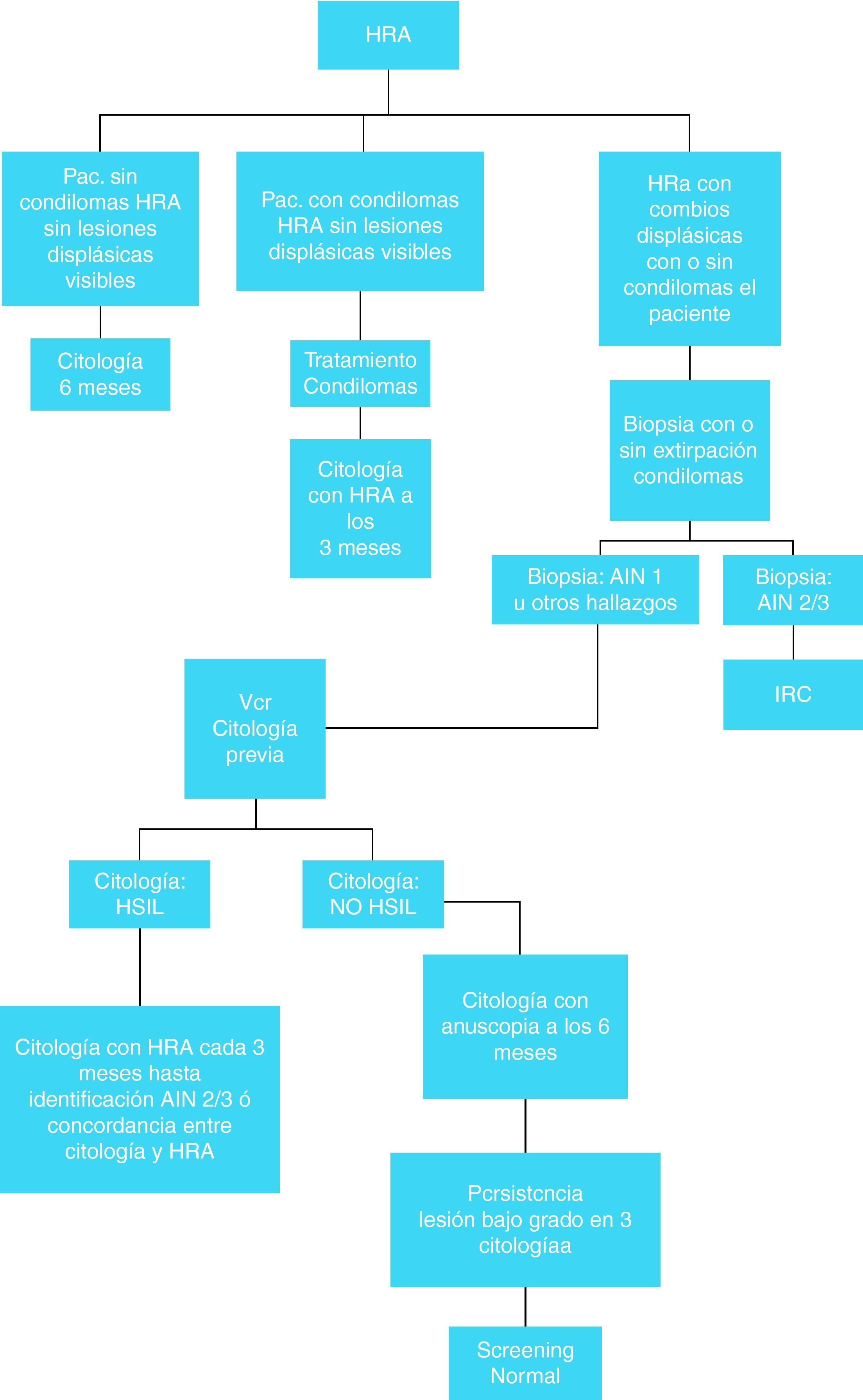
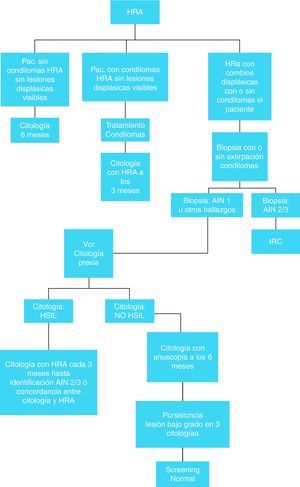
Las figuras 6 y 7 presentan el algoritmo de actuación en base a los hallazgos de la citología anal, HRA y biopsia anal80. No está claro que sea útil determinar la presencia de ADN de VPH en el momento de la citología ya que sólo hay estudios contradictorios de pequeñas cohortes, (tanto a favor como en contra)81.
Tratamiento de las lesiones de alto gradoEn la tabla 14 se resumen las opciones terapéuticas de las lesiones anales de alto grado76,80,82.
Resumen de tratamientos de lesiones anales de alto grado
| Tratamiento | Indicación | Ventajas | Inconvenientes | |||
| Condiloma perianal | AIN 2-3 perianal | Condiloma intra-anal | AIN 2-3 intra-anal | |||
| Nitrógeno líquido | X | X | X | Barato | Dolor, varias visitas | |
| Procedimiento consulta | Enfermedad limitada | |||||
| Ácido tricloroacético al 85%a | X | X | X | X | Barato | Dolor, varias visitas |
| Procedimiento consulta | Enfermedad limitada | |||||
| Podofilino | X | Aplicado por el paciente | Dolor/irritación | |||
| Varias visitas | ||||||
| Puede el paciente dejarse sin tratar pequeñas lesiones | ||||||
| Imiquimod | X | X | X | X | Aplicado por el paciente | Dolor/irritación |
| Varias visitas | ||||||
| Puede el paciente dejarse sin tratar pequeñas lesiones | ||||||
| Menos efectivo en hombres que en mujeres | ||||||
| Menos efectivo en VIH positivos | ||||||
| Coagulación Infrarrojos | X | X | X | X | Procedimiento en consultas | Dolor |
| Enfermedad medianamente extensa | Sangrado | |||||
| Relativamente barato | Infección | |||||
| Electrocauterio | X | X | X | X | Podría hacerse en consultas | Dolor, sangrado, infección |
| Enfermedad extensa | ||||||
| Escisión con bisturí frío | X | X | X | X | Enfermedad extensa | Dolor, sangrado, infección |
Existen pocos estudios sobre el impacto que el TARV puede tener en la AIN, pero los resultados de algunos de ellos hacen pensar que esta terapia tiene poco o ningún efecto en su evolución. Los pacientes que reciben TARV sobreviven más tiempo lo que conlleva la prolongación del período de exposición del epitelio anal al riesgo oncogénico (VPH-AR, displasia anal y cáncer)77,83.
Recomendaciones sobre el cribado y tratamiento del CA en pacientes con infección por el VIH- 1.
Debe practicarse inspección anal y tacto rectal al menos una vez al año, a los pacientes con infección por el VIH con síntomas, mujeres en que se esté realizando una técnica de cribado de cáncer de cérvix y en HSH infectados por el VIH “(C- III)”.
- 2.
Se recomienda cribado de cáncer anal, mediante inspección y citología anal en los siguientes casos “(B-II)”:
- -
De forma anual en HSH VIH positivos.
- -
Deseablemente, cada 2-3 años en: mujeres VIH positivas, varones VIH positivos independientemente de su historia sexual, HSH no VIH, mujeres VIH negativas con cáncer vulvar o cervical y pacientes inmunodeprimidos por otras razones independientes al VIH como trasplantados.
- -
- 3.
Todo paciente con citologías anales con displasia (LSIL y HSIL) deben someterse a una HRA, con toma múltiple de biopsias anales “(C-II)”.
- 4.
Se recomienda un seguimiento periódico con HRA y tomas citológicas-histológicas tras una ablación “(B-II)”.
De todos los tumores de cabeza y cuello, el que se ha asociado con mayor frecuencia al VPH es el carcinoma escamoso de amígdala seguido de lejos por el de base de la lengua46.
Las fases iniciales del carcinoma orofaríngeo suelen ser asintomáticas. Cuando aparecen síntomas suele tratarse de estadíos ya avanzados. La realización de citologías orofaríngeas como método de cribado no ha demostrado su utilidad por lo que no disponemos en la actualidad de una herramienta diagnóstica precoz para el carcinoma orofaríngeo.
Dada la escasa evidencia científica a este nivel, no se pueden realizar por el momento recomendaciones de cara al diagnóstico precoz del carcinoma de orofaringe.
PeneEl cáncer de pene más frecuente es el escamoso y un porcentaje no desdeñable está relacionado con el VPH y específicamente con los tipos 16 y 1855,84.
El diagnóstico se realiza mediante biopsia cuando han aparecido lesiones macroscópicas evidentes. Escasos estudios han propuesto la realización de citologías de pene para la detección precoz de lesiones incipientes54,85. El examen del pene en busca de lesiones subclínicas se puede realizar mediante tinción con ácido acético al 3 o 5% y posterior examen visual en busca de lesiones blanquecinas o eritematosas. En cualquier caso, ni la citología ni la tinción con ácido acético están en la actualidad establecidas como pruebas diagnósticas ni de seguimiento.
Debido a la escasa evidencia científica, no se pueden emitir unas recomendaciones basadas en la evidencia. Sin embargo, en grupos de riesgo bien definidos como son HSH VIH positivos, pacientes con antecedentes de neoplasia/displasia anal y varones pareja de mujeres con displasia/neoplasia de cérvix, se podría recomendar exploración visual tras tinción del pene con ácido acético al 3 o 5%. No existen evidencias suficientes para recomendar la práctica de citologías.
Vacuna frente al VPHVacunas profilácticasEn la actualidad hay disponibles dos vacunas preventivas de la infección por el VPH, con partículas “virus like”, que inducen una respuesta de anticuerpos neutralizantes frente al virus 60 veces mayor que la infección natural: la vacuna Gardasil® es una vacuna cuadrivalente, que contiene antígenos de los VPH 6, 11,16 y 18 y la Cervarix® es una vacuna bivalente, que contiene antígenos de VPH 16 y 18.
Diversos ensayos clínicos han demostrado la eficacia de ambas vacunas frente a la infección por VPH y frente al desarrollo de lesiones precancerosas86-91. En términos de eficacia clínica, no se ha evaluado el impacto de las vacunas en la incidencia de cáncer invasivo cervical ni de muerte. Aunque la prevención de ambos sea el objetivo último habrá que esperar muchos años hasta conocer si previene el desarrollo del cáncer.
La vacuna cuadrivalente fue aprobada por la FDA en junio de 2006 y la indicación para su uso fue ampliada en septiembre de 200892,93.
La vacuna está indicada para la administración en las mujeres que tienen entre 9 y 26 años para la prevención de: cáncer cervical, vulvar y vaginal causado por VPH 16 o VPH 16 o 18, verrugas genitales causadas por VPH 6 u 11, y las lesiones causadas por VPH 6, 11, 16 o 18 (CIN 1-3, adenocarcinoma cervical in situ y VIN y VAIN grados 2 y 3).
Las jóvenes deberían ser vacunadas antes de que tengan la primera relación sexual ya que a menudo adquieren la infección por VPH unos meses después. La vacuna no debe administrarse en mujeres embarazadas; La FDA la clasifica dentro de la categoría B (los estudios animales no demuestran un peligro en el feto, pero no hay estudios controlados en mujeres embarazadas)94.
Las vacunas no son eficaces en la prevención de la enfermedad cervical si la mujer está infectada con algún genotipo portador de la vacuna, no obstante, no es necesario hacer una PCR previa dado que pocas mujeres están infectadas con VPH 16 y 18 a la vez95. Las mujeres con antecedentes de condilomas genitales y/o citología de cérvix anormal pueden también vacunarse dado que es infrecuente que estén infectadas por todos los tipos que contiene la vacuna.
La EMEA aprobó por el procedimiento centralizado la vacuna contra el VPH Gardasil® en octubre de 2006. En nuestro país, el Consejo Interterritorial del Sistema Nacional de Salud (SNS) acordó en octubre de 2007 la inclusión de la vacuna en el calendario de vacunaciones recomendándose la vacunación de las niñas entre 11 y 14 años.
Vacunas profilácticas VPH y VIHUn ensayo clínico ha demostrado la eficacia y seguridad de la vacuna cuadrivalente en varones VIH con buena situación inmunológica y en TARV96. La cifra de linfocitos CD4 tanto nadir como tras la administración de la vacuna será determinante en la consecución y mantenimiento de niveles de anticuerpos protectores.
Así mismo, en población pediátrica VIH se ha demostrado una eficacia similar de la vacuna cuadrivalente que en niños no infectados por el VIH97.
Vacunas terapéuticasLos estudios clínicos indican que las vacunas profilácticas no tienen ningún efecto terapéutico por lo que no pueden ser aplicadas a mujeres con la infección persistente de VPH que están en riesgo de desarrollar cáncer cervical. Las vacunas profilácticas no proporcionan protección contra la progresión a CIN de un serotipo presente previo a la vacunación. Por lo tanto, los millones de mujeres ya infectadas por VPH-AR precisarían de tratamientos que ayuden a su sistema inmunológico a controlar la infección como podrían ser las vacunas terapéuticas.
Los resultados de los ensayos con vacunas terapéuticas han sido generalmente modestos, en unos no hay respuesta terapéutica y en otros la regresión de las lesiones es parcial98.
Vacuna terapéutica VPH y VIHUn ensayo clínico recientemente publicado que evaluaba la eficacia, tolerabilidad y respuesta inmunógena de la vacuna terapéutica en hombres VIH con antecedentes de sexo con hombres, infección y lesión anal por VPH, demostró buena tolerancia y elevación de anticuerpos frente a VPH 16 durante 24 semanas; no observó una mejoría de la citología ni de la histología anal, pero ningún paciente evolucionó a cáncer invasivo99.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.
A los doctores M. Jesús Barberá, Josefina López de Muniain, Jorge del Romero y a la Federación Estatal de Lesbianas, Gays, Transexuales y Bisexuales (FELGTB).
.
Todos los miembros de este panel son autores del artículo
Rosario Palacios. Hospital Virgen de la Victoria, Málaga.
Rosa Polo. Secretaría del PNS, Ministerio de Sanidad y Política Social, Madrid.
José Luis Blanco. Hospital Clinic, Barcelona.
José Ramón Blanco. Hospital San Pedro-CIBIR, Logroño, La Rioja.
Xavier Camino. Hospital Donostia, San Sebastián.
Miguel Cervero. Hospital Severo Ochoa, Leganés, Madrid.
Fernando de la Portilla. Hospital Virgen del Rocío, Sevilla.
Javier Ena. Hospital Marina Baixa, Villajoyosa, Alicante.
Clotilde Fernández. Hospital Puerta del Mar, Cádiz.
Pedro Herranz. Hospital La Paz, Madrid.
Sara Villar. Hospital Vall d’Hebron, Barcelona.
Francisco Bru. Instituto de Salud Pública. Ayuntamiento de Madrid, Madrid.
Pere Domingo. Hospital de la Santa Cruz y San Pablo, Barcelona.
Nuria Margall. Hospital de la Santa Cruz y San Pablo, Barcelona.
Guillem Sirera. Hospital German Trias, Barcelona.
Raúl Soriano. Secretaría del PNS, Ministerio de Sanidad y Política Social, Madrid.
Pompeyo Viciana. Hospital Virgen del Rocío, Sevilla.
El listado de los miembros del Grupo GESIDA y PNS se presentan en el Anexo 1.