El diagnóstico de la infección por el virus de la hepatitis C en un solo paso (anticuerpos y carga viral en una misma muestra) disminuiría el tiempo de acceso al tratamiento. Se desconoce el proceso del diagnóstico de la hepatitis C en los hospitales españoles.
ObjetivoDescribir los recursos diagnósticos disponibles y el proceso del diagnóstico de la infección por virus de la hepatitis C en España.
MétodosEncuesta dirigida a hospitales españoles, públicos o privados con acreditación docente, de 200 camas o más.
ResultadosDe los 160 hospitales con criterios de inclusión, respondieron 90 (tasa de respuesta del 56,3%). Dos centros (2,2%) no disponen de ningún recurso diagnóstico, 15 (16,7%) solo pueden realizar determinación de anticuerpos (Ac), 9 (10%) de Ac y carga viral (CV), 47 (52,2%) de Ac, CV y genotipo, 2 (2,2%) de Ac, CV y antígeno core, y 15 (16,7%) de Ac, antígeno core, CV y genotipo. Ante un resultado de Ac positivo, 28 (31,1%) hospitales hacen diagnóstico virológico en la misma muestra. Cuando hay una infección activa, se utiliza alguna estrategia de comunicación en 62 (68,9%) hospitales. El 44,2% de los respondedores cree que las determinaciones para llegar a un diagnóstico definitivo se deben hacer con una muestra única de sangre.
ConclusionesAunque el 81% de los hospitales dispone de medios para realizar el diagnóstico de la infección por virus de la hepatitis C en un solo paso, únicamente lo hace el 31%. Menos de la mitad de los encuestados cree que el diagnóstico definitivo se debe hacer con una única muestra.
Reflex testing of antibodies and viral load in the same sample for diagnosing hepatitis C virus infection speeds up access to treatment. However, how hepatitis C is diagnosed in Spanish hospitals is unknown.
ObjectiveTo describe the available resources and procedures for the diagnosis of hepatitis C virus infection in Spain.
MethodsSurvey sent to public and private Spanish hospitals with teaching accreditation with at least 200 beds.
ResultsOf the 160 hospitals that met the inclusion criteria, 90 centres (response rate 56.3%) completed the survey. Two hospitals (2.2%) have no diagnostic resources, 15 (16.7%) can only test for anti-hepatitis C virus(Ab), 9 (10.0%) for Ab and viral load, 47 (52.2%) for Ab, viral load and genotype, 2 (2.2%) for Ab, viral load and core antigen, and 15 (16.7%) can perform Ab, core antigen, viral load and genotype tests. When an Ab test is positive, 28 (31.1%) hospitals perform reflex testing. When an active infection is diagnosed, some communication strategy is used in 62 (68.9%) hospitals. Approximately 44.2% of the respondents believe that all determinations needed to reach a definitive diagnosis should be done on a single blood sample.
ConclusionAlthough 81% of Spanish hospitals have the resources to perform reflex hepatitis C virus infection testing, it is only done in 31%, and less than a half of respondents believe that the definitive diagnosis should be performed on a single sample.
La hepatitis C es la enfermedad hepática crónica más frecuente. El 55-85% de los casos de infección por el virus de la hepatitis C (VHC) evoluciona a la cronicidad, y el 15-30% desarrolla cirrosis y sus complicaciones1,2. La seroprevalencia estimada en la población general española es del 1,1%, y la prevalencia de viremia oscila entre el 0,3 y el 0,5%3,4.
Actualmente, el tratamiento con agentes antivirales de acción directa permite la curación de la mayoría de los pacientes5–7, por lo que se ha postulado eliminar la enfermedad8–13. Pero para que un paciente sea tratado, primero tiene que haber sido diagnosticado. Desafortunadamente, hay pacientes sin diagnosticar, y menos de la mitad de los que tienen viremia positiva detectada sabe que padece la enfermedad3,14. Esto implica que muchos pacientes no reciben tratamiento o lo hacen con un retraso innecesario. El diagnóstico en un solo paso (DUSP) consiste en efectuar todas las determinaciones necesarias para un diagnóstico definitivo de hepatitis C en una misma muestra15–17. La estrategia de DUSP, seguida de una comunicación efectiva de los resultados, permitiría que todos los pacientes diagnosticados accedan al tratamiento, y ha demostrado ser coste/efectiva respecto a la práctica clínica habitual18,19.
En España, se desconocen los recursos diagnósticos disponibles y el proceso diagnóstico de la hepatitis C. Por estas razones, se ha realizado este estudio con los objetivos de conocer los recursos diagnósticos disponibles para el diagnóstico de la infección por el VHC en los hospitales españoles, conocer la implantación del DUSP, y conocer las estrategias de comunicación de resultados.
MetodologíaSe trata de un estudio observacional, transversal, con obtención de datos mediante encuesta dirigida a hospitales del Catálogo Nacional de Hospitales (CNH)20 con los siguientes criterios de inclusión: 1) ser un hospital general (se excluyen los hospitales monográficos psiquiátricos, traumatológicos...); 2) con al menos 200 camas; y 3) que sea público o, si es privado, que tenga acreditación docente.
Al responsable del diagnóstico de hepatitis C de cada hospital seleccionado se le invitó a participar mediante correo electrónico en el que se explicaba el proyecto, y se adjuntaba el cuestionario en formato Excel que recoge las variables de interés: servicio que realiza el diagnóstico, pasos en el diagnóstico, proceso de comunicación de resultados, y número anual de determinaciones analíticas (15/09/2016-15/9/2017).
En el análisis estadístico, las variables categóricas se describen como proporción (%). Las variables continuas con distribución normal se describen con la media y la desviación estándar (DE); y las que no tienen distribución normal, con la mediana y el rango intercuartílico (RIQ). Las asociaciones estudiadas han sido entre variables categóricas, por lo que se utilizó el test de la Chi-cuadrado de Pearson o el test exacto de Fisher. Se empleó el contraste de hipótesis a 2 colas (α=0,05; β=0,2). Los análisis estadísticos han sido realizados con el paquete estadístico SPSS Versión 20®.
ResultadosHospitales participantesReunían criterios de inclusión 160 hospitales. Se realizó la encuesta del 20 de septiembre al 20 de octubre de 2017. Respondieron 90 centros (tasa de respuesta: 56,25%). La lista de hospitales participantes se muestra en el anexo (material adicional).
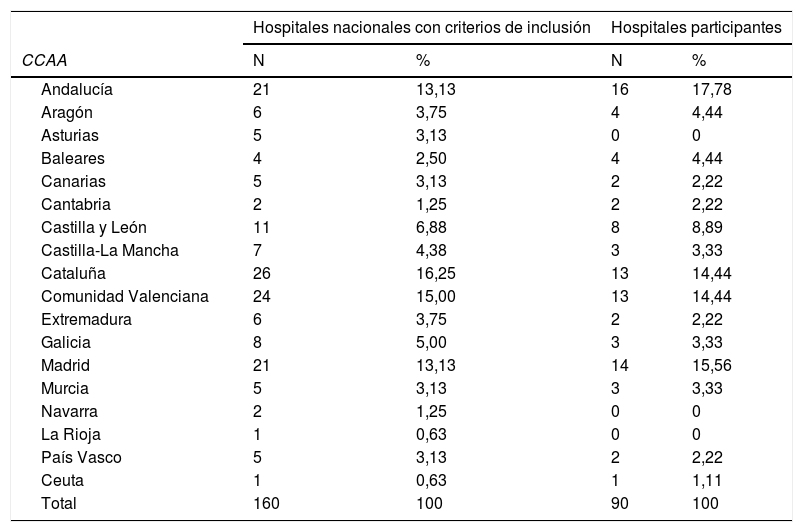
La tabla 1 muestra la distribución por comunidades autónomas de los hospitales participantes. No respondió ningún hospital de Albacete, Asturias, Guadalajara, Guipúzcoa, La Rioja, Lleida, Lugo, Navarra, Palencia, Salamanca, Segovia y Teruel.
Distribución de hospitales por CCAA y número de camas
| Hospitales nacionales con criterios de inclusión | Hospitales participantes | |||
|---|---|---|---|---|
| CCAA | N | % | N | % |
| Andalucía | 21 | 13,13 | 16 | 17,78 |
| Aragón | 6 | 3,75 | 4 | 4,44 |
| Asturias | 5 | 3,13 | 0 | 0 |
| Baleares | 4 | 2,50 | 4 | 4,44 |
| Canarias | 5 | 3,13 | 2 | 2,22 |
| Cantabria | 2 | 1,25 | 2 | 2,22 |
| Castilla y León | 11 | 6,88 | 8 | 8,89 |
| Castilla-La Mancha | 7 | 4,38 | 3 | 3,33 |
| Cataluña | 26 | 16,25 | 13 | 14,44 |
| Comunidad Valenciana | 24 | 15,00 | 13 | 14,44 |
| Extremadura | 6 | 3,75 | 2 | 2,22 |
| Galicia | 8 | 5,00 | 3 | 3,33 |
| Madrid | 21 | 13,13 | 14 | 15,56 |
| Murcia | 5 | 3,13 | 3 | 3,33 |
| Navarra | 2 | 1,25 | 0 | 0 |
| La Rioja | 1 | 0,63 | 0 | 0 |
| País Vasco | 5 | 3,13 | 2 | 2,22 |
| Ceuta | 1 | 0,63 | 1 | 1,11 |
| Total | 160 | 100 | 90 | 100 |
| Número de camas* | ||||
|---|---|---|---|---|
| 200-499 | 90 | 56,25 | 47 | 52,22 |
| 500-749 | 26 | 16,25 | 16 | 17,78 |
| >749 | 44 | 27,50 | 27 | 30 |
| Total | 160 | 100 | 90 | 100 |
CCAA: comunidades autónomas; N: número de hospitales.
Los hospitales tienen una mediana de 400 camas (RIQ: 283-800), el menor tiene 200 camas, y el mayor 1.395. No existen diferencias en la distribución según el número de camas entre los hospitales participantes y los hospitales con criterios de inclusión (tabla 1). Entre los 90 hospitales participantes, 86 (95,6%) tienen dependencia patrimonial pública, y 85 (94,4%) tienen docencia MIR.
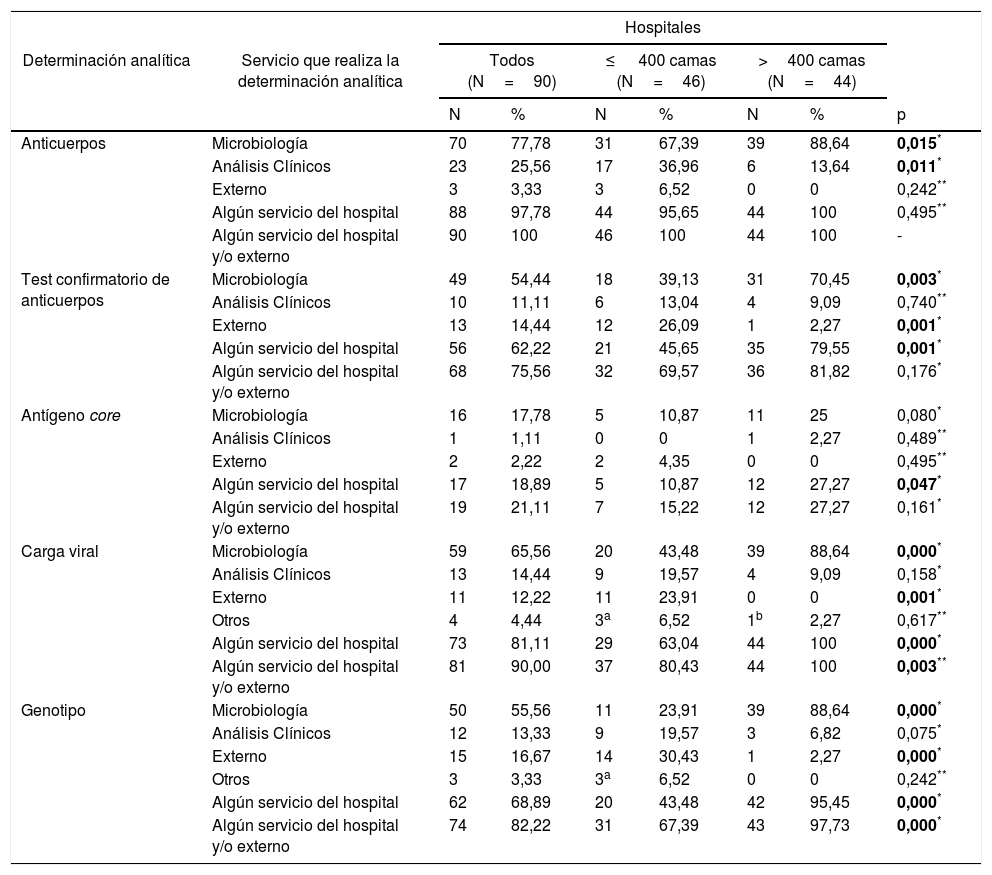
Determinación de anticuerpos para el diagnóstico de la hepatitis CLos 90 hospitales realizan determinación de anticuerpos (Ac) para el VHC en sus propios servicios y/o en servicios externos. El servicio de Microbiología la realiza en 70 (77,8%) hospitales, el servicio de Análisis Clínicos en 23 (25,6%), y 3 (3,3%) centros lo solicitan a servicios externos al hospital (tabla 2). Estas proporciones según tamaño del hospital, se comparan en la tabla 2.
Servicios que realizan las determinaciones analíticas en el diagnóstico del VHC y su asociación con el número de camas del hospital
| Hospitales | ||||||||
|---|---|---|---|---|---|---|---|---|
| Determinación analítica | Servicio que realiza la determinación analítica | Todos (N=90) | ≤ 400 camas (N=46) | >400 camas (N=44) | ||||
| N | % | N | % | N | % | p | ||
| Anticuerpos | Microbiología | 70 | 77,78 | 31 | 67,39 | 39 | 88,64 | 0,015* |
| Análisis Clínicos | 23 | 25,56 | 17 | 36,96 | 6 | 13,64 | 0,011* | |
| Externo | 3 | 3,33 | 3 | 6,52 | 0 | 0 | 0,242** | |
| Algún servicio del hospital | 88 | 97,78 | 44 | 95,65 | 44 | 100 | 0,495** | |
| Algún servicio del hospital y/o externo | 90 | 100 | 46 | 100 | 44 | 100 | - | |
| Test confirmatorio de anticuerpos | Microbiología | 49 | 54,44 | 18 | 39,13 | 31 | 70,45 | 0,003* |
| Análisis Clínicos | 10 | 11,11 | 6 | 13,04 | 4 | 9,09 | 0,740** | |
| Externo | 13 | 14,44 | 12 | 26,09 | 1 | 2,27 | 0,001* | |
| Algún servicio del hospital | 56 | 62,22 | 21 | 45,65 | 35 | 79,55 | 0,001* | |
| Algún servicio del hospital y/o externo | 68 | 75,56 | 32 | 69,57 | 36 | 81,82 | 0,176* | |
| Antígeno core | Microbiología | 16 | 17,78 | 5 | 10,87 | 11 | 25 | 0,080* |
| Análisis Clínicos | 1 | 1,11 | 0 | 0 | 1 | 2,27 | 0,489** | |
| Externo | 2 | 2,22 | 2 | 4,35 | 0 | 0 | 0,495** | |
| Algún servicio del hospital | 17 | 18,89 | 5 | 10,87 | 12 | 27,27 | 0,047* | |
| Algún servicio del hospital y/o externo | 19 | 21,11 | 7 | 15,22 | 12 | 27,27 | 0,161* | |
| Carga viral | Microbiología | 59 | 65,56 | 20 | 43,48 | 39 | 88,64 | 0,000* |
| Análisis Clínicos | 13 | 14,44 | 9 | 19,57 | 4 | 9,09 | 0,158* | |
| Externo | 11 | 12,22 | 11 | 23,91 | 0 | 0 | 0,001* | |
| Otros | 4 | 4,44 | 3a | 6,52 | 1b | 2,27 | 0,617** | |
| Algún servicio del hospital | 73 | 81,11 | 29 | 63,04 | 44 | 100 | 0,000* | |
| Algún servicio del hospital y/o externo | 81 | 90,00 | 37 | 80,43 | 44 | 100 | 0,003** | |
| Genotipo | Microbiología | 50 | 55,56 | 11 | 23,91 | 39 | 88,64 | 0,000* |
| Análisis Clínicos | 12 | 13,33 | 9 | 19,57 | 3 | 6,82 | 0,075* | |
| Externo | 15 | 16,67 | 14 | 30,43 | 1 | 2,27 | 0,000* | |
| Otros | 3 | 3,33 | 3a | 6,52 | 0 | 0 | 0,242** | |
| Algún servicio del hospital | 62 | 68,89 | 20 | 43,48 | 42 | 95,45 | 0,000* | |
| Algún servicio del hospital y/o externo | 74 | 82,22 | 31 | 67,39 | 43 | 97,73 | 0,000* | |
N: número de hospitales; VHC: virus de la hepatitis C.
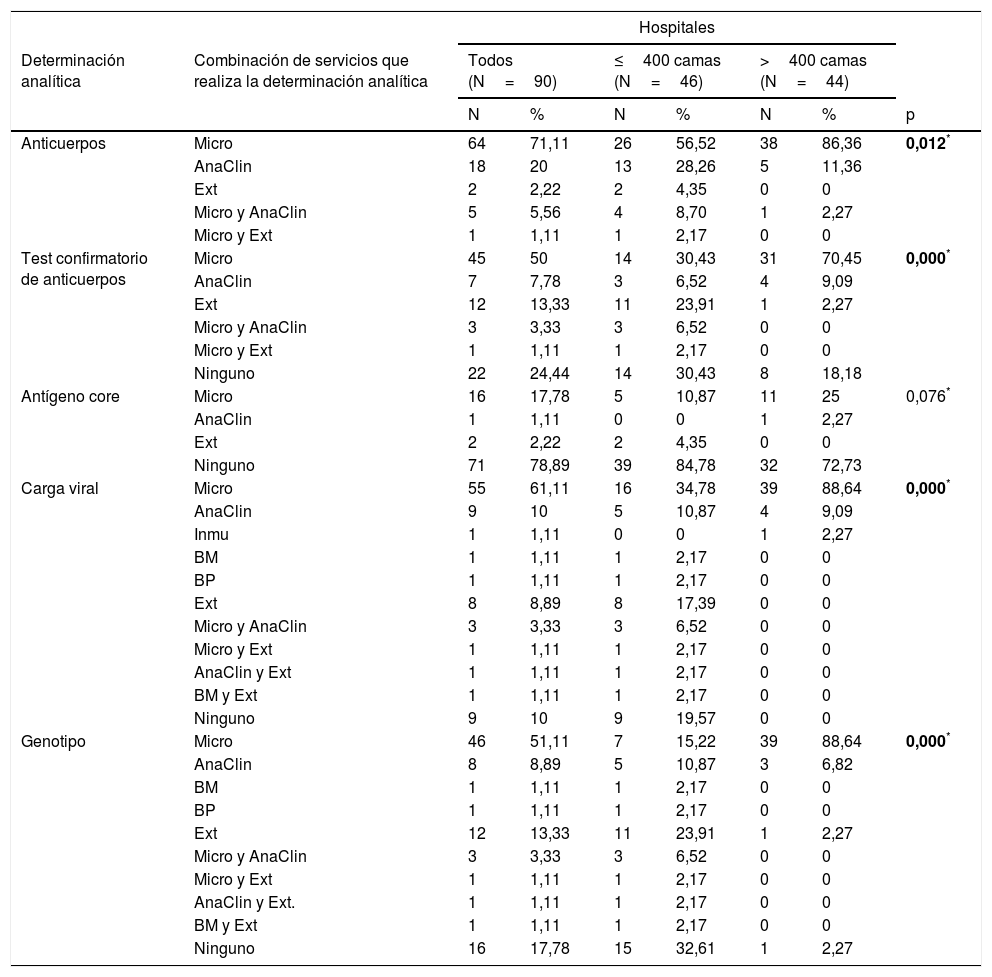
En 64 (71,1%) centros solo el servicio de Microbiología realiza la determinación de Ac, en 18 (20,0%) solo el servicio de Análisis Clínicos, y 2 (2,2%) centros no disponen de determinación de Ac y lo solicitan a servicios externos. En algunos centros, la determinación de Ac la hace más de un servicio. La distribución de servicios que realizan la determinación de Ac es estadísticamente diferente entre hospitales grandes y pequeños (tabla 3).
Combinaciones de servicios que realizan las determinaciones analíticas en el diagnóstico del VHC y su asociación con el número de camas del hospital
| Hospitales | ||||||||
|---|---|---|---|---|---|---|---|---|
| Determinación analítica | Combinación de servicios que realiza la determinación analítica | Todos (N=90) | ≤400 camas (N=46) | >400 camas (N=44) | ||||
| N | % | N | % | N | % | p | ||
| Anticuerpos | Micro | 64 | 71,11 | 26 | 56,52 | 38 | 86,36 | 0,012* |
| AnaClin | 18 | 20 | 13 | 28,26 | 5 | 11,36 | ||
| Ext | 2 | 2,22 | 2 | 4,35 | 0 | 0 | ||
| Micro y AnaClin | 5 | 5,56 | 4 | 8,70 | 1 | 2,27 | ||
| Micro y Ext | 1 | 1,11 | 1 | 2,17 | 0 | 0 | ||
| Test confirmatorio de anticuerpos | Micro | 45 | 50 | 14 | 30,43 | 31 | 70,45 | 0,000* |
| AnaClin | 7 | 7,78 | 3 | 6,52 | 4 | 9,09 | ||
| Ext | 12 | 13,33 | 11 | 23,91 | 1 | 2,27 | ||
| Micro y AnaClin | 3 | 3,33 | 3 | 6,52 | 0 | 0 | ||
| Micro y Ext | 1 | 1,11 | 1 | 2,17 | 0 | 0 | ||
| Ninguno | 22 | 24,44 | 14 | 30,43 | 8 | 18,18 | ||
| Antígeno core | Micro | 16 | 17,78 | 5 | 10,87 | 11 | 25 | 0,076* |
| AnaClin | 1 | 1,11 | 0 | 0 | 1 | 2,27 | ||
| Ext | 2 | 2,22 | 2 | 4,35 | 0 | 0 | ||
| Ninguno | 71 | 78,89 | 39 | 84,78 | 32 | 72,73 | ||
| Carga viral | Micro | 55 | 61,11 | 16 | 34,78 | 39 | 88,64 | 0,000* |
| AnaClin | 9 | 10 | 5 | 10,87 | 4 | 9,09 | ||
| Inmu | 1 | 1,11 | 0 | 0 | 1 | 2,27 | ||
| BM | 1 | 1,11 | 1 | 2,17 | 0 | 0 | ||
| BP | 1 | 1,11 | 1 | 2,17 | 0 | 0 | ||
| Ext | 8 | 8,89 | 8 | 17,39 | 0 | 0 | ||
| Micro y AnaClin | 3 | 3,33 | 3 | 6,52 | 0 | 0 | ||
| Micro y Ext | 1 | 1,11 | 1 | 2,17 | 0 | 0 | ||
| AnaClin y Ext | 1 | 1,11 | 1 | 2,17 | 0 | 0 | ||
| BM y Ext | 1 | 1,11 | 1 | 2,17 | 0 | 0 | ||
| Ninguno | 9 | 10 | 9 | 19,57 | 0 | 0 | ||
| Genotipo | Micro | 46 | 51,11 | 7 | 15,22 | 39 | 88,64 | 0,000* |
| AnaClin | 8 | 8,89 | 5 | 10,87 | 3 | 6,82 | ||
| BM | 1 | 1,11 | 1 | 2,17 | 0 | 0 | ||
| BP | 1 | 1,11 | 1 | 2,17 | 0 | 0 | ||
| Ext | 12 | 13,33 | 11 | 23,91 | 1 | 2,27 | ||
| Micro y AnaClin | 3 | 3,33 | 3 | 6,52 | 0 | 0 | ||
| Micro y Ext | 1 | 1,11 | 1 | 2,17 | 0 | 0 | ||
| AnaClin y Ext. | 1 | 1,11 | 1 | 2,17 | 0 | 0 | ||
| BM y Ext | 1 | 1,11 | 1 | 2,17 | 0 | 0 | ||
| Ninguno | 16 | 17,78 | 15 | 32,61 | 1 | 2,27 | ||
AnaClin: Análisis Clínicos; BM: Biología Molecular; BP: Biopatología; Ext: externo; Inmu: Inmunología; Micro: Microbiología; N: número de hospitales; VHC: virus de la hepatitis C.
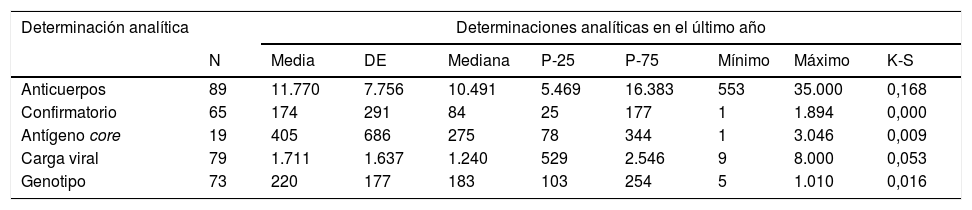
Los centros hicieron una media de 11.770 (DE: 7.756) determinaciones de Ac, un mínimo de 553, y un máximo de 35.000 al año (tabla 4).
Número anual de determinaciones analíticas realizadas
| Determinación analítica | Determinaciones analíticas en el último año | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| N | Media | DE | Mediana | P-25 | P-75 | Mínimo | Máximo | K-S | |
| Anticuerpos | 89 | 11.770 | 7.756 | 10.491 | 5.469 | 16.383 | 553 | 35.000 | 0,168 |
| Confirmatorio | 65 | 174 | 291 | 84 | 25 | 177 | 1 | 1.894 | 0,000 |
| Antígeno core | 19 | 405 | 686 | 275 | 78 | 344 | 1 | 3.046 | 0,009 |
| Carga viral | 79 | 1.711 | 1.637 | 1.240 | 529 | 2.546 | 9 | 8.000 | 0,053 |
| Genotipo | 73 | 220 | 177 | 183 | 103 | 254 | 5 | 1.010 | 0,016 |
DE: desviación estándar; K-S: test de Kolmogórov-Smirnov; N: Número de hospitales que dieron cifras de determinaciones; P-25: percentil 25; P-75: percentil 75.
El test confirmatorio de Ac lo realizan 68 (75,6%) centros, en sus propios servicios y/o en servicios externos. El servicio de Microbiología lo hace en 49 (54,4%) hospitales, el servicio de Análisis Clínicos en 10 (11,1%), algún servicio del hospital en 56 (62,2%), y 13 (14,4%) hospitales lo solicitan a servicios externos (tabla 2). Estas proporciones según tamaño del hospital, se comparan en la tabla 2.
En 45 (50,0%) centros solo el servicio de Microbiología realiza el test confirmatorio, en 7 (7,8%) solo el servicio de Análisis Clínicos, y 12 (13,3%) centros solo realizan el test confirmatorio en servicios externos. En 3 (3,3%) centros el diagnóstico confirmatorio es realizado por los servicios de Microbiología y Análisis Clínicos, y en un (1,1%) centro por Microbiología y servicios externos. La distribución de servicios que realizan el test confirmatorio de Ac es estadísticamente diferente entre hospitales grandes y pequeños (tabla 3).
El número anual de determinaciones de diagnóstico confirmatorio tuvo una mediana de 84,0 (RIQ: 25-177), un mínimo de 1, y un máximo de 1.894 (tabla 4).
Determinación del antígeno core para el diagnóstico de la hepatitis CDiecinueve hospitales (21,1%) realizan determinación de antígeno core (Ag) en sus propios servicios y/o en servicios externos. El servicio de Microbiología la realiza en 16 (17,8%) hospitales, el servicio de Análisis Clínicos en 1 (1,1%), y 2 (2,2%) hospitales lo solicitan a servicios externos (tabla 2). Estas proporciones según tamaño del hospital se comparan en la tabla 2.
En ningún hospital la determinación de Ag la realiza más de un servicio. Hay 73 (81,1%) hospitales que no disponen de determinación de Ag, pero 2 (2,2%) de ellos lo solicitan a servicios externos (tabla 3). La distribución de servicios que realizan determinación de Ag no es estadísticamente diferente entre hospitales grandes y pequeños (tabla 3).
El número anual de determinaciones de Ag realizadas tuvo una mediana de 275 (RIQ: 78-344), un mínimo de 1, y un máximo de 3.046 (tabla 4).
Determinación de carga viral para el diagnóstico de la hepatitis CLa determinación de carga viral (CV) la realizan 81 (90,0%) hospitales en sus propios servicios y/o en servicios externos. El servicio de Microbiología la realiza en 59 (65,6%) hospitales, el servicio de Análisis Clínicos en 13 (14,4%), otros servicios en 4 (4,4%), y 11 (12,2%) hospitales lo solicitan a servicios externos (tabla 2). Estas proporciones según tamaño del hospital se comparan en la tabla 2.
En 55 (61,1%) centros solo el servicio de Microbiología realiza la determinación de CV, en 9 (10,0%) solo el servicio de Análisis Clínicos, en 3 (1,1%) solo otro servicio, y 8 (8,9%) centros solo piden la determinación de CV a servicios externos. En 3 (3,3%) centros, la CV puede ser realizada por los servicios de Microbiología y Análisis Clínicos, en un (1,1%) centro por Microbiología y servicios externos, en un (1,1%) centro por Análisis Clínicos y servicios externos, y en un (1,1%) centro el servicio de Biología Molecular y servicios externos. Hay 17 (18,9%) hospitales que no disponen en su centro de determinación de CV (todos pequeños), pero 8 (8,9%) de ellos lo solicitan a servicios externos (tabla 3). La distribución de servicios que realizan determinación de CV es estadísticamente diferente entre hospitales pequeños y grandes (tabla 3).
El médico de atención primaria puede solicitar la determinación de CV en 35 (38,9%) hospitales: 8 de la Comunidad Valenciana, 6 de Cataluña, 5 de Andalucía, 4 de Castilla y León, 2 de Canarias, 2 de Cantabria, 2 de Extremadura, 2 de Galicia, 2 de Madrid, uno de Castilla-La Mancha y uno de Ceuta.
El número anual de determinaciones de CV tuvo una media de 1.711 (DE:1.637), un mínimo de 9 y un máximo de 8.000 (tabla 4).
Determinación del genotipo para el diagnóstico de la hepatitis CLa determinación del genotipo (GT) la realizan 74 (82,2%) centros en sus propios servicios y/o en servicios externos. El servicio de Microbiología la realiza en 50 (55,5%) hospitales, el servicio de Análisis Clínicos en 12 (13,3%), otros en 3 (3,3%), y 15 (16,7%) hospitales lo solicitan a servicios externos (tabla 2). Estas proporciones según tamaño del hospital se comparan en la tabla 2.
En 46 (61,1%) centros el servicio de Microbiología es el único que realiza la determinación del GT, en 8 (8,9%) solo el servicio de Análisis Clínicos, en 2 (2,2%) solo otro servicio, y 12 (31,1%) centros solo determinan el GT en servicios externos. Hay 28 (18,9%) hospitales que no disponen de determinación del GT, de los que 12 (13,3%) lo solicitan a servicios externos. En 3 (3,3%) centros, la determinación del GT es realizada por los servicios de Microbiología y Análisis Clínicos, en un (1,1%) centro por Microbiología y servicios externos, en un (1,1%) centro por Análisis Clínicos y servicios externos, y en un (1,1%) centro el servicio de Biología Molecular y servicios externos. La distribución de servicios que realizan determinación del GT es estadísticamente diferente entre hospitales grandes y pequeños (tabla 3).
El médico de atención primaria puede solicitar la determinación del GT en 24 (26,7%) hospitales: 7 de la Comunidad Valenciana, 6 de Cataluña, 3 de Andalucía, 2 de Castilla y León, 2 de Canarias, 2 de Extremadura, uno de Cantabria y uno de Galicia.
El número anual de determinaciones del GT tuvo una mediana de 183 (RIQ: 103-254), un mínimo de 5 y un máximo de 1.010 (tabla 4).
Diagnóstico en un solo pasoEl DUSP puede ser realizado en 73 (81,1%) centros. Sin embargo, ante un resultado de Ac positivo para VHC, solo 28 (31,1%) hospitales hacen DUSP, lo que significa que lo hacen el 38,4% de los hospitales que lo podrían hacer.
De los 28 hospitales que realizan DUSP, 4 (14,3%) determinan solo Ag, 3 (10,7%) Ag+CV; 2 (7,1%) Ag+CV+GT; uno (3,6%) Ag+GT; 5 (17,9%) solo CV y 13 (46,4%) CV+GT.
No hubo diferencias estadísticamente significativas en la proporción de hospitales que realizan DUSP entre los hospitales>400 camas (34,1%) y ≤400 camas (28,3%) (p=0,55).
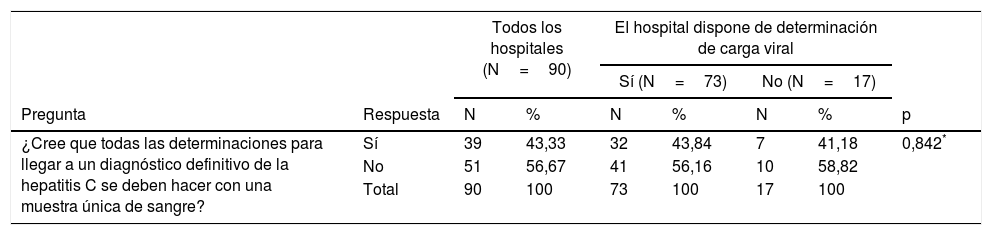
A la pregunta sobre si cree que debe realizarse DUSP, 39 (43,3%) hospitales respondieron afirmativamente, sin diferencias entre hospitales que disponen de determinación de CV en el propio hospital y los que no disponen de ella (tabla 5). Sin embargo, respondieron afirmativamente 20 (71,4%) hospitales que hacen DUSP y 19 (30,6%) hospitales que no hacen DUSP (p=0,000) (tabla 5).
Asociación entre opiniones del encuestado y disponibilidad de medios diagnósticos en el propio hospital
| Todos los hospitales (N=90) | El hospital dispone de determinación de carga viral | |||||||
|---|---|---|---|---|---|---|---|---|
| Sí (N=73) | No (N=17) | |||||||
| Pregunta | Respuesta | N | % | N | % | N | % | p |
| ¿Cree que todas las determinaciones para llegar a un diagnóstico definitivo de la hepatitis C se deben hacer con una muestra única de sangre? | Sí | 39 | 43,33 | 32 | 43,84 | 7 | 41,18 | 0,842* |
| No | 51 | 56,67 | 41 | 56,16 | 10 | 58,82 | ||
| Total | 90 | 100 | 73 | 100 | 17 | 100 | ||
| Todos los hospitales (N=90) | El hospital hace diagnóstico virológico en la misma muestra | |||||||
|---|---|---|---|---|---|---|---|---|
| Sí (N=28) | No (N=62) | |||||||
| Pregunta | Respuesta | N | % | N | % | N | % | p |
| ¿Cree que todas las determinaciones para llegar a un diagnóstico definitivo de la hepatitis C se deben hacer con una muestra única de sangre? | Sí | 39 | 43,33 | 20 | 71,43 | 19 | 30,65 | 0,000* |
| No | 51 | 56,67 | 8 | 28,57 | 43 | 69,35 | ||
| Total | 90 | 100 | 28 | 100 | 62 | 100 | ||
| Todos los hospitales (N=90) | El hospital utiliza alguna estrategia de comunicación | |||||||
|---|---|---|---|---|---|---|---|---|
| Sí (N=62) | No (N=28) | |||||||
| Pregunta | Respuesta | N | % | N | % | N | % | p |
| ¿Cree que debe existir algún tipo de alerta ante el diagnóstico de una infección activa por el VHC? | Sí | 80 | 88,89 | 61 | 98,39 | 19 | 67,86 | 0,018* |
| No | 10 | 11,11 | 1 | 1,61 | 9 | 32,14 | ||
| Total | 90 | 100 | 62 | 100 | 28 | 100 | ||
N: Número de hospitales; VHC: virus de la hepatitis C.
De los 62 hospitales que ante un resultado de Ac positivo no realizan DUSP, 56 han ofrecido información sobre lo que hacen. En 22 (39,3%) se recomienda una segunda muestra, y en 34 (60,7%) no se hace nada, simplemente se espera una segunda petición. El tiempo de retraso desde la positividad del Ac hasta la determinación de la CV (respondieron 53 hospitales) tiene una mediana de 4 (RIQ: 2-5) semanas, un mínimo de una semana y un máximo de 20 semanas.
Estrategias de comunicación de resultadosCuando hay una infección activa por VHC, en 62 (68,9%) hospitales se utiliza alguna estrategia de comunicación (25 usan más de una), mientras que en 28 (31,1%) no se utiliza ninguna. Las estrategias de comunicación utilizadas son: contacto directo con el médico solicitante en 39 (43,3%) hospitales, alerta en el informe en 32 (35,6%), contacto con otros médicos en 9 (10,0%) y otra estrategia en 11 (12,2%). Estas otras estrategias fueron: «alerta automática en historia del paciente», «ante un primer resultado positivo, se solicita una segunda muestra para confirmación del resultado», «correo electrónico», «durante un tiempo hemos enviado a gastroenterología el listado de pruebas confirmatorias positivas para VHC», «en caso de médicos de primaria reunión semanal con los médicos demandantes para remitir al paciente lo antes posible a atención especializada», «los resultados positivos nuevos son captados por Salud Pública a través de alertas mediante la red de vigilancia epidemiológica RedMiva», «notificación por mail o teléfono», «se declara al Sistema de Información Microbiológica», «se informa al Servicio de Preventiva del Hospital», y «se notifica al médico peticionario y al servicio de medicina preventiva para su declaración».
Los hospitales pequeños utilizan el contacto directo con el médico solicitante como estrategia de comunicación más que los grandes (54,3% vs. 31,8%; p=0,031).
A la pregunta «¿Cree que debe existir algún tipo de alerta ante el diagnóstico de una infección activa por el VHC?», 80 (88,9%) hospitales respondieron afirmativamente, pero esta proporción fue mayor (98,4%) en los hospitales que utilizan alguna estrategia de comunicación que en los que no usan ninguna (67,9%) (p=0,018) (tabla 5).
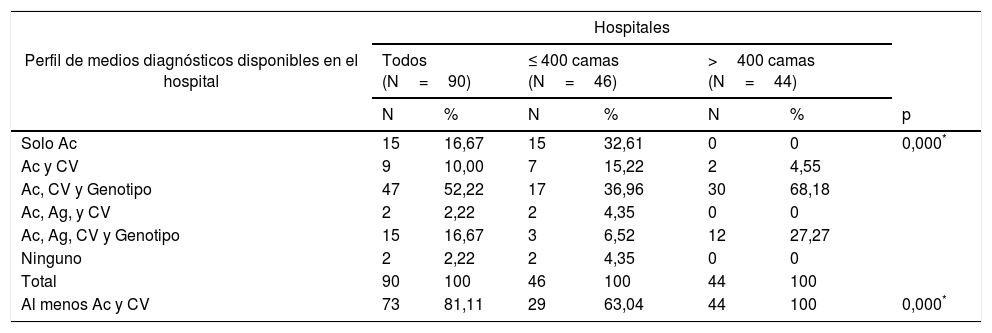
Perfiles diagnósticos según los medios disponiblesSegún los test diagnósticos disponibles en los propios servicios de los hospitales, se identificaron 6 perfiles diagnósticos, según dispongan de determinación de: 1) solo Ac; 2) Ac y CV, 9; 3) Ac, CV y GT; 4) Ac, Ag y CV; 5) Ac, Ag, CV y GT; y 6) ninguna. El número de hospitales de cada perfil fue respectivamente: 15 (16,7%); 9 (10%); 47 (52,2%); 2 (2,2%); 5 (16,7%); y 2 (2,2%). La distribución de estos perfiles es estadísticamente diferente entre los hospitales grandes y pequeños (tabla 6).
Asociación entre el número de camas del hospital y perfiles de medios diagnósticos disponibles en el hospital
| Hospitales | |||||||
|---|---|---|---|---|---|---|---|
| Perfil de medios diagnósticos disponibles en el hospital | Todos (N=90) | ≤ 400 camas (N=46) | >400 camas (N=44) | ||||
| N | % | N | % | N | % | p | |
| Solo Ac | 15 | 16,67 | 15 | 32,61 | 0 | 0 | 0,000* |
| Ac y CV | 9 | 10,00 | 7 | 15,22 | 2 | 4,55 | |
| Ac, CV y Genotipo | 47 | 52,22 | 17 | 36,96 | 30 | 68,18 | |
| Ac, Ag, y CV | 2 | 2,22 | 2 | 4,35 | 0 | 0 | |
| Ac, Ag, CV y Genotipo | 15 | 16,67 | 3 | 6,52 | 12 | 27,27 | |
| Ninguno | 2 | 2,22 | 2 | 4,35 | 0 | 0 | |
| Total | 90 | 100 | 46 | 100 | 44 | 100 | |
| Al menos Ac y CV | 73 | 81,11 | 29 | 63,04 | 44 | 100 | 0,000* |
Ac: Anticuerpos; Ag: antígeno core; CV: carga viral; N: número de hospitales.
Para que un hospital pueda realizar DUSP debe disponer de determinación de Ac y CV o de Ac y Ag. En consecuencia, 73 (81,1%) hospitales pueden realizarlo (el 63% de los pequeños y el 100% de los grandes) (tabla 6).
DiscusiónEl presente estudio muestra una alta variabilidad en el diagnóstico de la hepatitis C. Esta variabilidad afecta al servicio encargado de la determinación de CV (Microbiología en 2 tercios de los hospitales y servicios muy dispares en el resto), a la utilización del test confirmatorio, a la utilización del DUSP y a la forma de comunicar los resultados. Probablemente esta variabilidad se explica por la ausencia de guías clínicas que detallen el proceso diagnóstico, una formación continuada poco adecuada, la disparidad de profesionales implicados en el diagnóstico, y la variabilidad de recursos entre centros hospitalarios.
Algunos estudios muestran que existe retraso entre el diagnóstico de la infección por el VHC y el tratamiento21–24, especialmente en poblaciones vulnerables25,26. La discontinuidad asistencial entre la detección de Ac y la confirmación de la infección activa mediante CV constituye una barrera para el diagnóstico y tratamiento27. Nuestro estudio también muestra retrasos innecesarios. Por ejemplo, solo el 31% de los hospitales realiza DUSP y solo el 43% cree que debe hacerse. Sin embargo, el 81% de los hospitales tiene recursos diagnósticos para hacer DUSP. Esto constituye una buena base para implementar estrategias de DUSP que podrían desarrollarse con recomendaciones de las sociedades científicas implicadas. La implantación del DUSP mejoraría la eficiencia18,19 y evitaría duplicidades e infrautilización de recursos, e.g., hospitales que externalizan pruebas pudiendo realizarlas el propio hospital. No hacer DUSP supone un retraso diagnóstico, que puede llegar a 20 semanas. Además, en el 61% de los hospitales que no realizan DUSP no se hace nada, simplemente se espera a recibir una segunda petición.
Otro resultado de este trabajo es que el 75% de los hospitales realiza test confirmatorio. En la actualidad, con una sensibilidad y especificidad de la serología cercanas al 100%2,28, realizar pruebas confirmatorias de Ac carece de interés y sustrae tiempo y recursos para implantar el DUSP.
La estrategia de comunicación de resultados también es altamente variable. Cuando hay una infección activa por VHC, casi un tercio de los hospitales no utilizan ninguna estrategia de comunicación. La abigarrada variedad de estrategias de comunicación encontradas indica la conveniencia de desarrollar recomendaciones para establecer estrategias de comunicación efectivas que contribuyan a disminuir el tiempo entre el resultado diagnóstico y el inicio del tratamiento. Es razonable pensar que implantar estrategias de comunicación sería bien aceptado por los profesionales, dado que el 89% de los respondedores cree que debe existir algún tipo de alerta ante el diagnóstico de una infección activa por el VHC.
Una limitación del presente estudio podría ser la tasa de respuesta del 56%, aparentemente baja, pero similar a la de estudios de este tipo29,30. Otra posible limitación asociada a la falta de respuesta es que no están representadas algunas provincias. Sin embargo, las características de los hospitales no son diferentes entre la población y muestra, por lo que es razonable pensar que no hay sesgos de selección relevantes y que la muestra de hospitales es aceptablemente representativa para las variables exploradas en este estudio. Una fortaleza del estudio es que la población de hospitales utilizada para la encuesta es la de los hospitales españoles del CNH, y no de registros o bases de datos que no abarquen el ámbito nacional. Esta fortaleza minimiza la probabilidad de sesgos de selección.
Este estudio corrobora hallazgos previos de un estudio similar en Andalucía31, y supone una aproximación al conocimiento de la realidad del diagnóstico de la hepatitis C con datos de 2017. Sus hallazgos muestran que existe una gran variabilidad en las estrategias utilizadas para el diagnóstico de la infección, que el DUSP se realiza en menor proporción de la que es técnicamente posible y clínicamente deseable, y que la comunicación de resultados diagnósticos debería ser mejor. Pero también muestra que los recursos diagnósticos disponibles constituyen una base muy sólida para una eficiente implementación del pretendido DUSP con el objetivo de mejorar la salud de los pacientes y eliminar la enfermedad.
FinanciaciónEl presente trabajo ha sido financiado por la Fundación Española del Aparato Digestivo.
Conflicto de interesesJavier Crespo: Grants, Advisory y Speaker bureaus de Abbvie, Gilead, MSD y Janssen.
Antonio Aguilera: Grants y Speaker bureaus de Gilead.
Javier García-Samaniego: Lectures y Consultant: Abbvie, BMS, Gilead, Janssen, y MSD. Grants: BMS, Gilead.
José María Eiros: Ha realizado trabajos de asesoría para las compañías Abbvie y Gilead
José Luis Calleja: Consultor y speaker: Gilead, Abbvie, MSD.
Federico García: Grants, Advisory y Speaker bureaus de Roche, Hologic, Werfen, ViiV, Abbvie, Janssen, MSD, y Gilead.
Antonio Javier Blasco y Pablo Lázaro han recibido financiación de la Fundación Española del Aparato Digestivo para el desarrollo metodológico del proyecto y redacción del manuscrito.
Agradecemos a los hospitales e investigadores de cada centro que han respondido a la encuesta (ver anexo) su participación en el estudio aportando los datos con los que ha sido posible realizar el presente estudio.