La aparición de equivalentes genéricos de alguno de los fármacos incluidos en combinaciones de antirretrovirales a dosis fijas (CADF) plantea el riesgo potencial de romper estas combinaciones y administrar los componentes por separado para incorporar así la administración del nuevo genérico, con precio de venta más competitivo. Esto puede representar un paso atrás en los avances conseguidos en simplicidad y adherencia al tratamiento, comportando un incremento en el riesgo de incumplimiento selectivo de alguno de los fármacos administrados por separado. Debido al mecanismo de acción de los antirretrovirales actualmente disponibles, el tratamiento antirretroviral debe administrarse de por vida a los individuos infectados, tanto niños como adultos.
Las CADF constituyen un avance significativo en la simplificación del tratamiento antirretroviral, facilitando el cumplimiento de tratamientos crónicos complejos y redundando en una mejora cuantificable en la calidad de vida del paciente. Reducen el riesgo de errores en el tratamiento y pueden reducir la posibilidad de realizar una monoterapia encubierta en incumplimientos selectivos. Por ello pueden contribuir a reducir el riesgo de selección de resistencias del VIH-1 a los antirretrovirales, que no solo comprometen las opciones de tratamiento del propio individuo sino que son transmisibles y constituyen un problema de Salud Pública. Exceptuando los casos en que se requiera un ajuste de dosis, debe recomendarse la utilización preferente de CADF en el tratamiento de la infección por VIH-1 en aquellas situaciones en que los fármacos incluidos sean de elección.
The launch of generic forms of some of the drugs included in fixed-dose combinations of antiretrovirals (FDCA) raises the potential risk of breaking these combinations in order to allow the administration of the new cheaper generic drug. This could result in a step back in some major advances achieved in simplicity and treatment adherence, resulting in an increased risk of selective treatment withdrawal of some of the drugs administered separately. Due to the mechanism of action of the currently available antiretroviral treatment administration must be life-long in infected individuals, both children and adults.
FDCA are a significant advance in antiretroviral treatment simplification, contributing to increase compliance of complex chronic therapies, thus increasing the patient's quality of life. They reduce the risk of treatment errors and can also reduce the possibility of unprescribed monotherapy with selective non-compliance. Hence, they contribute to reduce the risk of selection of HIV-1 clones with antiretroviral resistance, a situation that not only compromises future treatment options of the infected individual, but can also be transmitted and are a situation of Public Health concern. Excluding those cases that require a particular dose adjustment, FDCA are a preferred treatment option and their use must be strongly recommended in all scenarios where the components included in the combination are preferred drugs.
Reemplazar a nivel individual un fármaco por su equivalente genérico, en general menos costoso, es una práctica generalmente admitida. Sin embargo, la aparición de equivalentes genéricos de alguno de los fármacos incluidos en combinaciones de antirretrovirales a dosis fijas (CADF), o de equivalentes genéricos a los que se supone unas características similares a alguno de los fármacos incluidos en CADF, plantea en el mundo occidental el riesgo potencial de romper estas combinaciones y administrar los componentes por separado para poder incorporar así la administración del nuevo genérico, con precio de venta más competitivo. Esto puede representar un paso atrás en los avances conseguidos en simplicidad y adherencia al tratamiento, comportando un incremento en el riesgo de incumplimiento selectivo de alguno de los fármacos administrados por separado, fracaso terapéutico y selección de variantes del VIH-1 resistentes a antirretrovirales.
Por otra parte, la aprobación a nivel local en determinados centros o comunidades autónomas de la opción de romper estas CADF puede comportar el acceso a distintos niveles de excelencia en el tratamiento antirretroviral (TAR) administrado por criterios economicistas según el área geográfica de residencia en un mismo país, o incluso según el hospital donde se realice el tratamiento, a pesar de disponer de un Sistema Nacional de Salud común.
El presente documento pretende revisar el conocimiento disponible sobre la importancia de las CADF en el TAR.
IntroducciónLa infección por el VIH-1 provoca una progresiva destrucción de la inmunidad celular, una activación persistente de todo el sistema inmunitario y de mecanismos inflamatorios inespecíficos asociados, e irremediablemente la muerte por acumulación de patología oportunista que el deteriorado sistema inmunitario del individuo infectado es incapaz de contener1–3. Se trata de una pandemia mundial y uno de los principales problemas de salud pública global desde finales del siglo xx.
El descubrimiento de fármacos con actividad antirretroviral ha demostrado que cuando estos se administran en combinaciones eficaces, pueden suprimir por completo y de forma duradera la replicación del VIH-1, permitir una restauración progresiva de los recuentos de células T CD4+, y reducir la morbilidad y mortalidad de los afectados4–6. Finalmente estos tratamientos permiten revertir el pronóstico ominoso de la infección y restaurar una vida con duración y calidad parecida a la de los individuos no infectados, cambiando radicalmente el espectro clínico de la enfermedad7. Constituyen uno de los mayores avances científicos conseguidos en la era de la medicina moderna.
Asimismo, el control de la replicación del VIH-1 mediante TAR reduce drásticamente el riesgo de transmisión a la población general por parte de los individuos tratados, y evita la transmisión materno-infantil a los hijos de madres infectadas8–13.
Los TAR constituyen una de las estrategias terapéuticas con mejor relación coste-eficacia de los sistemas sanitarios en el mundo occidental14–19. Continuamente se revisan las guías de consenso sobre TAR redactadas en los distintos países por organismos gubernamentales y por Sociedades científicas nacionales e internacionales, actualizando y optimizando el momento idóneo de inicio del tratamiento, las combinaciones óptimas de primera elección, y todos los aspectos relacionados con el TAR3,20–23.
Actualmente se puede afirmar con rotundidad que en países con cobertura universal de la sanidad y acceso libre al TAR, la infección por VIH-1 detectada a tiempo es una enfermedad crónica tratable que permite realizar una vida próxima en todos los aspectos, incluyendo la actividad laboral, a la de personas no infectadas.
Tratamiento antirretroviral indefinido con los fármacos actualmente disponiblesDebido al mecanismo de acción de todos los antirretrovirales actualmente disponibles, el TAR debe administrarse de por vida a los individuos infectados, tanto niños como adultos24. Ello requiere un cumplimiento terapéutico constante de pautas a menudo complejas y con posibles efectos adversos a corto y largo plazo.
La evaluación de distintas estrategias de interrupción controlada del tratamiento fracasó en el objetivo de demostrar beneficio alguno para el paciente, asociándose además a un incremento inesperado de enfermedades oportunistas y otra patología asociada al estado proinflamatorio derivado de la replicación no controlada del VIH-12,25–27. Por tanto, no es posible tampoco reducir el costo económico o toxicidad del TAR administrándolo solo de manera intermitente durante determinados períodos de tiempo a lo largo de la vida del paciente28,29.
A diferencia de otras enfermedades crónicas tratables (p.e. hipertensión arterial, diabetes mellitus tipo 2, hipercolesterolemia) en las que el control final tras varios años de tratamiento dependerá del período total de tiempo que el individuo haya estado bajo tratamiento correcto, en la infección por VIH-1 un cumplimiento irregular del tratamiento de solo unos meses puede conllevar la pérdida definitiva de eficacia de ese régimen terapéutico, la selección de resistencias a los fármacos que recibe el paciente, e incluso resistencias cruzadas a otros fármacos que ni tan solo ha recibido10,30. Por este motivo, la morbilidad y mortalidad a largo plazo de la infección por VIH-1 no dependen de la adherencia media durante todo el TAR, sino de la resistencia seleccionada durante los períodos de incumplimiento31. Este constituye uno de los aspectos más difíciles de comprender y controlar en el tratamiento crónico de esta enfermedad.
La infección por VIH-1 con resistencia adquirida a antirretrovirales conlleva la pérdida de opciones terapéuticas, requiere regímenes de rescate más complejos, caros, y tóxicos, y puede transmitirse al resto de la población infectada por VIH o no30,32. Actualmente un 10–14% de la población tratada en España y Europa se infecta por cepas de VIH-1 con resistencia a algún antirretroviral33–35.
El mejor control virológico de la población infectada por VIH-1 revierte pues finalmente en un menor riesgo de transmisión de virus resistentes y por tanto, mejores tasas de respuesta en la población recientemente infectada que inicia su TAR32. Por este motivo, una vez disponible un TAR eficaz de manera libre y gratuita, la adherencia mantenida del paciente a este TAR constituye el pilar principal para evitar su fracaso.
Factores relacionados con la adherencia al TARLa adherencia al TAR y los factores que influyen en ella han sido extensamente investigados desde hace años. La presencia de patología psiquiátrica, toxicomanías activas, pobreza, bajo nivel educativo del paciente, comorbilidades, número de tomas de tratamiento, número de comprimidos, y la toxicidad del TAR a corto o largo plazo, son factores relacionados de manera significativa con la adherencia o cumplimiento inadecuados del tratamiento3,21.
Debe destacarse que no solo es importante el porcentaje de dosis omitidas sino también los patrones de adhesión subóptima. Las interrupciones de tratamiento (más de dos días sin tomar ningún fármaco) presentan mayor repercusión en la respuesta virológica que la omisión ocasional de dosis dependiendo del tipo de régimen utilizado31,36. Por otra parte, una mejor adherencia al tratamiento redunda en un menor coste económico global asociado16.
Por este motivo, todas las unidades de VIH de nuestro país se han volcado en destinar recursos a mejorar la adherencia al TAR, involucrando en ello al personal de enfermería, psicólogos y farmacéuticos de los centros. Asimismo, en los distintos documentos de consenso sobre el TAR el capítulo destinado a optimizar la adherencia ha cobrado especial importancia3,21,22.
El uso de combinaciones de fármacos a dosis fijas. El modelo de otras enfermedades crónicas tratablesLa reducción del número de envases y medicamentos distintos que el paciente debe controlar, del número de tomas, y del número de comprimidos, redunda en un mejor cumplimiento terapéutico en enfermedades crónicas que requieren un tratamiento combinado37. Se reduce el riesgo de errores y la posibilidad de seguimiento incompleto de las pautas de tratamiento por un incumplimiento selectivo.
La mayoría de pacientes con hipertensión arterial, por ejemplo, requiere un tratamiento combinado con varios fármacos. Por ello, sociedades científicas como la American Society of Hypertension se han posicionado favoreciendo el uso de combinaciones a dosis fijas (CDF), una necesidad práctica para mejorar el cumplimiento de los tratamientos crónicos, reduciendo el riesgo de errores en el seguimiento del tratamiento37.
Sin embargo, una enfermedad infecciosa que requiera un tratamiento prolongado o crónico es un ejemplo mucho más parecido a la infección por VIH-1, y la tuberculosis ha sido el modelo más próximo. En este modelo, el uso de una CDF no solo reporta comodidad y mejora la adherencia, sino que impide que el paciente pueda realizar una monoterapia con cualquiera de los fármacos, evitando así la selección de resistencias38. Desde hace muchos años, las sociedades científicas implicadas en el tratamiento de la tuberculosis han promovido activamente el uso de CDF de antituberculosos, solicitando asimismo a la administración y estimulando incluso a las compañías farmacéuticas hacia una mayor fabricación y difusión de estas pautas39,40. Incluso en aquellas situaciones en que pueda requerirse un ajuste de dosis debido al peso del paciente, se recomienda el uso de una CDF asociada al suplemento necesario para ajustar dosis de un fármaco, para evitar la monoterapia encubierta y la selección de resistencias, que constituye un verdadero problema de salud pública. De este modo, la propia Organización Mundial de la Salud (OMS) y la Unión Internacional contra la Tuberculosis y las Enfermedades Pulmonares (IUATLD) recomiendan hoy el uso de CDF como medida adicional para garantizar un tratamiento idóneo y principal medida para evitar la selección y propagación de las variantes farmacorresistentes de Mycobacterium tuberculosis41, diseñando programas específicos para que estas CDF sean de alta calidad en su fabricación.
Un metanálisis reciente ha evaluado la eficacia de las CDF en 9 estudios aleatorizados en el tratamiento de distintas enfermedades como la hipertensión (4), tuberculosis (2), diabetes mellitus (2) y la infección por VIH-1 (1). Finalmente, el uso de CDF redujo en un 26% el riesgo de incumplimiento terapéutico respecto a la administración de los mismos fármacos por separado (RR: 0,74; IC95% 0,69–0,80, p<0,0001)42. No existe por tanto duda alguna de que las CDF mejoran el cumplimiento del tratamiento en enfermedades crónicas que requieran tratamientos combinados, aunque existe aún incertidumbre respecto a la magnitud de la cuantía de esta mejoría y su traslación en la eficacia terapéutica43.
El uso de combinaciones de antirretrovirales a dosis fijas (CADF)La investigación de la industria farmacéutica ha contribuido a la mejora de la adherencia al TAR desarrollando fármacos cuyas características farmacocinéticas y farmacodinámicas permiten su administración una sola vez al día, así como en CADF.
Diversos estudios demuestran sin lugar a dudas la preferencia de los pacientes con infección por VIH-1 por pautas de tratamiento de una sola administración diaria y con el menor número posible de comprimidos44,45. Un metaanálisis reciente de 11 ensayos clínicos aleatorizados y controlados (con un número total de 3.029 pacientes) ha confirmado que la adherencia es mayor con pautas de una sola administración diaria respecto a las de administración dos veces al día (p=0,003)44. Múltiples estudios han demostrado asimismo una mejor calidad de vida global y mejor adherencia al tratamiento en pacientes que pueden simplificar su TAR a un solo comprimido al día, manteniendo la misma eficacia virológica e inmunológica que otras pautas más complejas44,46–48. Esta mejoría se ha documentado en un estudio aleatorizado con suficiente potencia estadística, e independientemente de que los pacientes estuvieran recibiendo una pauta basada en inhibidores de la transcriptasa inversa no análogos de nucleósidos, o en inhibidores de la proteasa48. Se ha documentado incluso en pacientes que recibían en una sola administración diaria exactamente los mismos fármacos (efavirenz, tenofovir y emtricitabina) pero de manera separada, y que cambiaron a un solo comprimido coformulado a dosis fija de los mismos compuestos46. Por otra parte, la adherencia al TAR y el porcentaje de respuesta virológica fueron también superiores con una pauta de un solo comprimido administrado una vez al día en una cohorte de pacientes con factores basales que condicionaban una adherencia especialmente dificultosa49. Todos estos análisis demuestran que la simplicidad del TAR es un valor añadido que favorece la adherencia y puede mejorar el éxito terapéutico a largo plazo.
De hecho, el uso masivo de CADF se ha correlacionado estadísticamente en análisis multivariante con un descenso en la prevalencia de mutaciones de resistencia a antirretrovirales en el período 2003–2008, así como de las mutaciones más específicamente relacionadas con los fármacos incluidos en esas combinaciones (K65R y M184V/I)50.
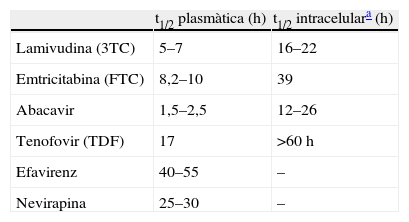
Parejas de análogos de nucleós/tido coformuladas a dosis fijas en el TAR. Importancia de la homogeneidad farmacocinética de los fármacos incluidosCuando se diseña una CADF deben cumplirse una serie de premisas para asegurar su eficacia a largo plazo. No deben presentar toxicidades similares o aditivas, no deben requerir ajustes individuales de dosis, y deben presentar características farmacocinéticas concordantes. Esto último se refiere no solo a su frecuencia de administración, sino a la semivida (t1/2) de eliminación, muy importante cuando el paciente omite alguna dosis o interrumpe el TAR. La eficacia de los ITIAN se correlaciona con los niveles intracelulares de los fármacos (tabla 1)3,21,51. La t1/2 plasmática e intracelular de FTC son significativamente más prolongadas que las de 3TC, y más concordantes con las de TDF y efavirenz en la coformulación existente. Este dato es de extrema importancia para evitar la selección de mutantes resistentes cuando se interrumpe el TAR con esta coformulación, pues la t1/2 de los 3 fármacos incluidos es totalmente paralela, evitando la monoterapia secuencial cuando las concentraciones de cualquiera de los 3 fármacos van descendiendo a niveles por debajo de la IC50 del VIH-1, donde se seleccionan las mutantes resistentes.
Semivida de eliminación plasmática (t1/2) e intracelular de los análogos y no análogos inhibidores de la transcriptasa inversa del VIH-13,21
| t1/2 plasmàtica (h) | t1/2 intracelulara (h) | |
| Lamivudina (3TC) | 5–7 | 16–22 |
| Emtricitabina (FTC) | 8,2–10 | 39 |
| Abacavir | 1,5–2,5 | 12–26 |
| Tenofovir (TDF) | 17 | >60h |
| Efavirenz | 40–55 | – |
| Nevirapina | 25–30 | – |
FTC y 3TC comparten estructuras químicas similares, se administran una vez al día, actúan en la misma diana, seleccionan las mismas vías de resistencia, y poseen una eficacia similar en el tratamiento de pacientes naïve, por lo que ambos fármacos son considerados como intercambiables indistintamente en algunas guías de TAR21,22. No obstante, la IC50 del VIH-1 suele ser unas 11 veces mayor para 3TC que para FTC, aunque la relevancia clínica de este dato no ha sido confirmada al encontrarse por debajo de los niveles plasmáticos o intracelulares de fármaco52,53. FTC-trifosfato tiene mayor eficiencia que 3TC-trifosfato (unas 9 veces mayor) en la incorporación durante la síntesis del DNA viral dependiente del RNA catalizado por la transcriptasa inversa54. Todo ello resultaría en una tasa máxima de polimerización mayor y una superior afinidad de FTC. De hecho, in vitro, la aparición de la mutante M184V/I es más temprana en cultivos con 3TC que con FTC55.
Comprobar la relevancia clínica de esta pequeña diferencia in vivo en pautas de tratamiento triple no es sencillo. Sin embargo, en un estudio aleatorizado y doble-ciego que comparó 3TC con FTC junto a nevirapina (o efavirenz) y estavudina (estudio FTC-302) y que incluyó 468 pacientes naïve, la tasa de aparición de la mutación M184V/I (asociada con alta resistencia a ambos) fue menor con FTC que con 3TC (30 vs 65% de los fracasos virológicos con genotipo disponible, p=0,01)53, aunque la tasa de fracaso virológico fue en cambio mayor con FTC que con 3TC (12,8 vs 7,3%, p=0,046)56.
En un estudio in vitro con cepas de VIH-1 con resistencia a antirretrovirales sin la mutación M184V/I pero con TAM (mutaciones asociadas a ITIAN timidínicos), K65R, Q151M, o L74I/V se documentó que la resistencia cruzada a ambos fármacos era similar cuando existían las mutaciones K65R, Q151M, o L74I/V, pero que en presencia de TAM el impacto sobre la resistencia fenotípica de FTC era mayor que sobre 3TC (p<0,001)57. Sin embargo, no es frecuente en clínica encontrar estas mutaciones sin que se haya seleccionado M184V/I.
Por otra parte, un análisis retrospectivo de 859 episodios de fracaso virológico, ha encontrado una tasa de resistencias significativamente superior en pautas con TDF/3TC que con TDF/FTC58.
La sustitución de 3TC por FTC ha demostrado ser no inferior en un ensayo clínico, mientras que a la inversa, la sustitución de FTC por 3TC no ha sido evaluada59.
Por tanto, a pesar de tratarse de moléculas similares, 3TC y FTC presentan características farmacocinéticas diferenciales, no puede descartarse que presenten tasas de resistencia distintas en caso de fracaso virológico, y la sustitución de FTC (máxime en el contexto de una CADF) por 3TC no ha sido evaluada. Por todo ello, hasta disponer de estudios adecuados debería evitarse realizar esta sustitución de manera sistemática debido al riesgo que pudiera comportar.
Posicionamiento de las Sociedades Científicas y Organismos Oficiales en los documentos de consenso respecto al uso de las combinaciones a dosis fijas de antirretroviralesActualmente se dispone de las siguientes CADF: zidovudina/3TC, zidovudina/3TC/ABC, TDF/FTC, efavirenz/TDF/FTC, ABC/3TC, y lopinavir/ritonavir.
En las guías norteamericanas de TAR, los Centers for Disease Control and Prevention (CDC), la propia Food and Drug Administration (FDA), y los National Institutes of Health (NIH) consideran la coformulación a dosis fijas una ventaja destacable y que, entre otros factores, el número de comprimidos y la frecuencia de las dosis de administración son elementos en los que debe basarse la elección del TAR21. Asimismo, recomiendan específicamente el uso de las parejas de análogos de nucleós/tidos inhibidores de la transcriptasa inversa (ITIAN) en coformulaciones (TDF/FTC o ABC/3TC). También la European AIDS Clinical Society (EACS) recomienda específicamente el uso de estas coformulaciones22, al igual que la British HIV Association en las guías británicas60. Las guías españolas redactadas por GESIDA y el Plan Nacional del Sida incluyen un importante capítulo sobre la simplificación del TAR3. En él se recomienda pasar a pautas administradas una sola vez diaria siempre que sea posible (nivel A, máximo nivel de evidencia procedente de estudios aleatorizados). Asimismo se recomienda, siempre que sea posible, el uso de nucleósidos coformulados (nivel A) como pauta preferente. También la International AIDS Society – USA recomienda el uso de las parejas de ITIAN coformuladas (TDF/FTC o ABC/3TC) en el tratamiento de inicio23.
ConclusionesLas CADF constituyen un avance significativo en la simplificación del TAR, facilitando el cumplimiento de tratamientos crónicos complejos y redundando en una mejora cuantificable en la calidad de vida del paciente. Reducen el riesgo de errores en el tratamiento y pueden reducir la posibilidad de realizar una monoterapia en incumplimientos selectivos. Por ello pueden contribuir a reducir el riesgo de desarrollo de resistencias del VIH-1 a los antirretrovirales. El desarrollo de estas resistencias no solo compromete las opciones de tratamiento del propio individuo sino que son transmisibles y constituyen un problema de salud pública. Exceptuando los casos en que se requiera un ajuste de dosis, debe recomendarse la utilización preferente de CADF en el tratamiento de la infección por VIH-1 en aquellas situaciones en que los fármacos incluidos sean de elección. Por ello, tanto la administración pública como la industria farmacéutica deben realizar el máximo esfuerzo posible para preservar el uso de las CADF cuando la aparición del equivalente genérico de alguno de sus componentes plantee el riesgo de la ruptura de la combinación fija y su administración por separado.
Conflicto de interesesJosep M. Llibre ha recibido fondos para investigación, conferencias, o asesoría de Abbott, Boehringer-Ingelheim, Bristol-Myers Squibb, Gilead Sciences, GlaxoSmithKline, Jansen-Cilag, Merck Sharp & Dohme, Pfizer, Roche, Tibotec y ViiV Healthcare.
Antonio Antela ha recibido fondos para la investigación, y pago por conferencias o por participación en reuniones de asesoría o ensayos clínicos de Abbott, Bristol-Myers Squibb, Boehringer-Ingelheim, Gilead Sciences, GlaxoSmithKline, Merck Sharp & Dohme, Pfizer, Roche, Tibotec-Janssen Cilag y ViiV Healthcare.
José R. Arribas ha recibido pagos por asesoría, becas de investigación o pagos como conferenciante de Abbott, Tibotec, Johnson and Johnson, Bristol-Myers Squibb, ViiV, GlaxoSmithKline , Avexa, Roche, Gilead y Schering-Plough.
Pere Domingo ha recibido fondos para investigación o por conferencias o participación en reuniones de asesoría de: Abbott Laboratories, Bristol-Myers Squibb, Boehringer Ingelheim, Gilead Sciences, GlaxoSmithKline, Janssen Cilag, Merck Sharp & Dohme, Pfizer, Roche y ViiV Healthcare.
Josep M. Gatell ha recibido honorarios por conferencias o por «advisory boards» o becas de investigacion de Boehringer-Ingelheim, Merck Sharp & Dohme, Janssen, Tibotec, Abbott, Tobira, Gilead y ViiV Healthcare.
José López Aldeguer ha recibido fondos para investigación, conferencias, o participación en «advisory boards» de Abbott, Boehringer-Ingelheim, Gilead Sciences, GlaxoSmithKline, Merck Sharp & Dohme, Pfizer, Roche, Tibotec y ViiV Healthcare.
Fernando Lozano ha recibido fondos para investigación o por conferencias o participación en reuniones de asesoría de: Abbott Laboratories, Bristol-Myers Squibb, Boehringer Ingelheim, Gilead Sciences, GlaxoSmithKline, Janssen Cilag, Merck Sharp & Dohme, Pfizer, Roche y ViiV Healthcare.
Celia Miralles ha recibido fondos para investigación, conferencias, o participación en «advisory boards» de Abbott, Bristol-Myers Squibb, Boehringer-Ingelheim, Gilead Sciences, GlaxoSmithKline, Merck Sharp & Dohme, Pfizer, Roche, Tibotec y ViiV Healthcare.
José Moltó ha recibido fondos para investigación, conferencias, o participación en «advisory boards» de Abbott, Bristol-Myers Squibb, Boehringer-Ingelheim, Gilead Sciences, GlaxoSmithKline, Merck Sharp & Dohme, Pfizer, Roche, Tibotec y ViiV Healthcare.
Santiago Moreno ha recibido fondos para investigación, conferencias, o asesoría de Abbott, Boehringer-Ingelheim, Bristol-Myers Squibb, Gilead Sciences, GlaxoSmithKline, Jansen-Cilag, Merck Sharp & Dohme, Pfizer, Roche, Tibotec y ViiV Healthcare.
Enrique Ortega ha recibido fondos para investigación, conferencias, o participación en «advisory boards» de Abbott, Bristol-Myers Squibb , Boehringer-Ingelheim, Gilead Sciences, GlaxoSmithKline, Merck Sharp & Dohme, Pfizer, Roche, Tibotec y ViiV Healthcare.
Melcior Riera ha recibido fondos para investigación, conferencias, o participación en «advisory boards» de Abbott, Bristol-Myers Squibb, Gilead Sciences y Pfizer.
Concepción Villalonga ha recibido fondos para investigación, conferencias, o partcipación en «advisory boards» de Abbott, Bristol-Myers Squibb, Gilead Sciences y Jansen.
Bonaventura Clotet ha recibido fondos para investigación, consultoría o conferencias de Abbott, Boehringer-Ingelheim, Gilead Sciences, GlaxoSmithKline, Janssen-Cilag, Merck Sharp & Dohme, Panacos, Pfizer, Roche, y Tibotec.
Este documento cuenta con el aval científico del Grupo de Estudio de Sida de SEIMC (GESIDA). Las opiniones expresadas por los autores no reflejan necesariamente la posición de GESIDA.
Este documento ha recibido el aval de la Sociedad Española Interdisciplinaria del SIDA (SEISIDA).
Agradecemos la colaboración de Piedad Arazo en la revisión del manuscrito.