En Colombia, entre 2012 y 2013 se identificaron 19 aislamientos con NDM, de los cuales 14 correspondían a Providencia rettgeri.
MétodosLos aislamientos se identificaron con Vitek-2, y la sensibilidad antimicrobiana se evaluó por microdilución en caldo. Las carbapenemasas se determinaron fenotípicamente con test de Hodge modificado y pruebas de sinergia con EDTA/SMA y APB, genotípicamente por PCR usando iniciadores específicos para KPC, GES, IMP, VIM, OXA-48 y NDM, y las relaciones genéticas se establecieron con Diversilab.
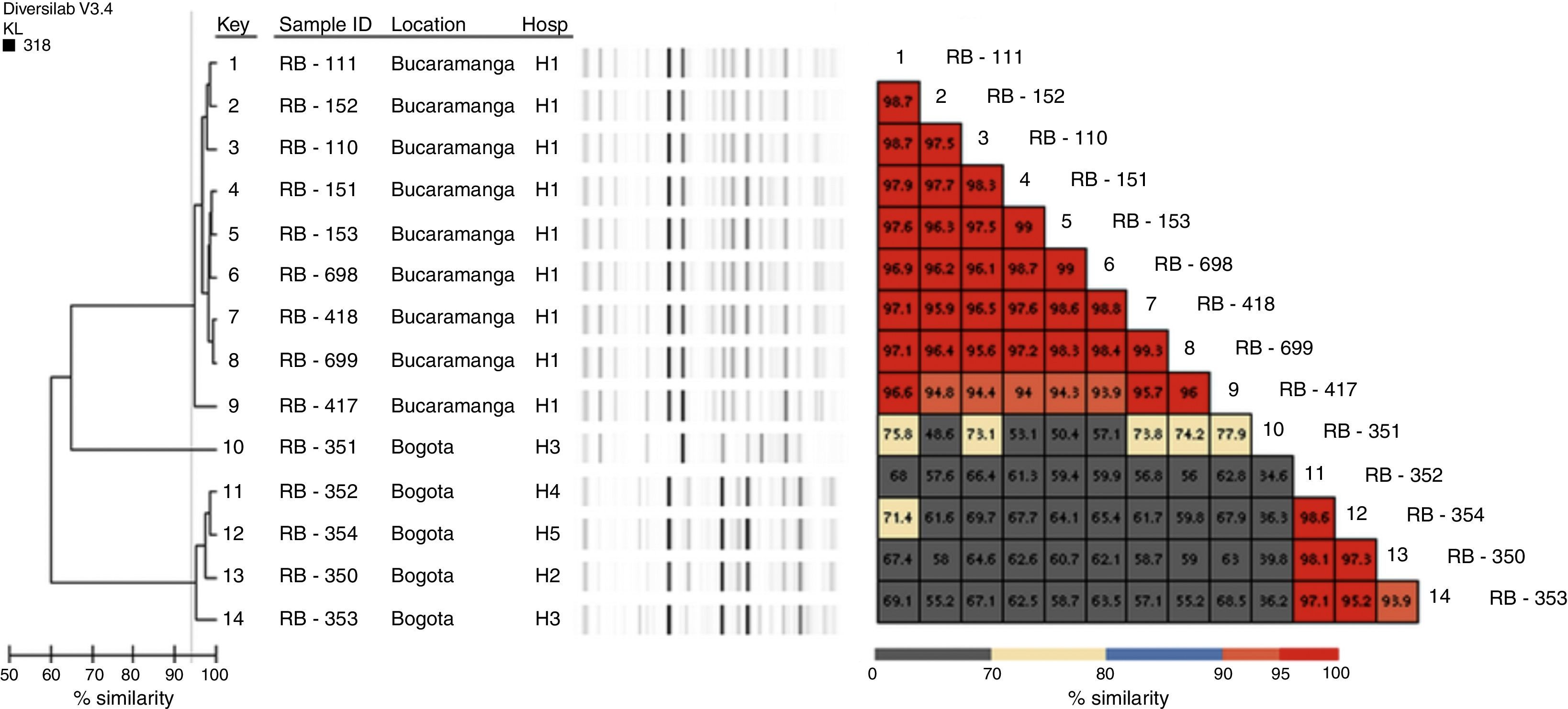
ResultadosLos aislamientos fueron resistentes a carbapenémicos, cefalosporinas de tercera generación, piperacilina-tazobactam, amicacina, gentamicina y tigeciclina, excepto a aztreonam. Todos los aislamientos fueron positivos para EDTA/SMA y NDM-1 y negativos para APB y otras carbapenemasas. Se definieron 2 grupos genéticos: grupo 1 (n=9 aislamientos), grupo 2 (n=4 aislamientos), y un aislamiento no relacionado genéticamente.
ConclusiónEste trabajo describe la circulación de grupos de P. rettgeri productores de NDM-1 en Colombia.
In Colombia, between 2012 and 2013, 19 isolates with NDM were identified, of which 14 corresponded to Providencia rettgeri.
MethodsThe isolates were identified by Vitek-2, and antimicrobial susceptibility was evaluated by broth microdilution. The carbapenemase phenotypes were determined with Modified Hodge Test and synergy tests with EDTA/SMA and APB, the genotypes by PCR using specific primers for KPC, GES, IMP, VIM, OXA-48 and NDM, and genetic relationships were established with DiversiLab.
ResultsThe isolates were resistant to carbapenems, third-generation cephalosporins, piperacillin-tazobactam, amikacin, gentamicin and tigecycline, except aztreonam. All isolates were positive for EDTA/SMA and NDM-1, and negative for APB and other carbapenemases. Two genetic groups, group 1 (n=9 isolates), group 2 (n=4 isolates) and an isolate defined as not genetically related.
ConclusionThis work describes the circulating of NDM-1-producing P. rettgeri in Colombia.
Providencia rettgeri es una de las especies del género Providencia spp. más relevantes a nivel clínico. Este patógeno oportunista es causante de múltiples infecciones, como: infecciones urinarias, gastrointestinales y bacteriemias, entre otras1. NDM fue descrita por primera vez en enero de 2008, y esta enzima se ha propagado rápidamente a nivel mundial, detectándose principalmente en enterobacterias y, en menor proporción, en Acinetobacter spp. y Pseudomonas spp.2.
En Colombia, NDM se describió por primera vez en 2012, en aislamientos de Klebsiella pneumoniae causantes de un brote3. Desde este reporte hasta diciembre de 2013, el programa de vigilancia de resistencia antimicrobiana en microorganismos causantes de Infecciones Asociadas a la Atención en Salud (IAAS) del Instituto Nacional de Salud (INS), a través del Grupo de Microbiología (Laboratorio Nacional de Referencia), ha confirmado 19 casos nuevos de aislamientos productores de NDM (14 P. rettgeri, 3 Acinetobacter baumannii, uno Pseudomonas aeruginosa y uno K. pneumoniae, este último co-productor de NDM y KPC), observándose que P. rettgeri NDM equivale a más del 70% de aislamientos productores de NDM en Colombia.
Teniendo en cuenta lo anterior, el objetivo de este reporte es describir las características microbiológicas y moleculares de aislamientos de P. rettgeri NDM identificados entre 2012 y 2013 en Colombia.
Materiales y métodosAntecedentesEl programa de vigilancia de resistencia antimicrobiana en microorganismos causantes de IAAS del INS vigila diversos eventos de interés en salud pública, e incluye la vigilancia nacional por laboratorio de resistencia a carbapenémicos, que inició en septiembre de 2012. Desde esta fecha hasta diciembre de 2013 se han recibido 749 aislamientos (483 enterobacterias, 211 Pseudomonas spp. y 55 Acinetobacter spp.) para confirmación de carbapenemasas, detectándose estas enzimas en 529 (70,6%) aislamientos (343 enterobacterias, 136 Pseudomonas spp. y 50 Acinetobacter spp.). La carbapenemasa más detectada en enterobacterias fue KPC (90,1%; n=309 aislamientos), en Pseudomonas spp. fue VIM, seguido de KPC (VIM: 70,6%; n=96 aislamientos, y KPC: 22,1%; n=30 aislamientos), y en Acinetobacter spp. fue OXA-23 (86%; n=43 aislamientos); los casos de NDM en este periodo fueron 3,6% (n=19), y de estos el 73,7% (n=14) fueron P. rettgeri.
Aislamientos bacterianosEl Grupo de Microbiología del INS recibió 14 aislamientos de P. rettgeri, recuperados en 5 hospitales de 3 ciudades localizadas en 2 departamentos: hospital H1 (Bucaramanga-Santander), hospital H2 «centro ambulatorio» (Madrid-Cundinamarca) y hospitales H3-H5 (Bogotá D.C.-Cundinamarca).
Caracterización fenotípicaLa identificación a nivel de género y especie se confirmó usando Vitek-2 (bioMérieux, Marcy l’Etoile, Francia) y la sensibilidad antimicrobiana se evaluó usando microdilución en caldo (Sensititre panels; TREK Diagnostic Systems, Westlake, Ohio, EE.UU.). Los resultados obtenidos se interpretaron según los parámetros establecidos por el CLSI4, excepto para tigeciclina, para la cual se usaron los criterios EUCAST (puntos de corte disponibles en http://www.eucast.org/clinical_breakpoints/versión 5.0). La detección fenotípica de carbapenemasas se realizó utilizando: a)test de Hodge modificado (THM) (4), y b)pruebas de sinergia de doble disco usando inhibidores específicos para carbapenemasas claseB (ácido etilendiaminotetraacético/ácido mercaptoacético [EDTA/SMA]) y para carbapenemasas claseA (ácido fenil borónico [APB])
Caracterización genotípicaLa detección de genes codificantes de betalactamasas se realizó por PCR convencional, para blaKPC, blaGES, blaVIM5, blaNDM6, blaIMP7, blaOXA-488, blaCTX-M, blaTEM y blaSHV9; ambas cadenas de los productos de amplificación de carbapenemasas fueron secuenciadas usando un secuenciador automático (servicio de secuenciación Macrogen, Corea, ABI PRISM® 3730XL de Applied Biosystem). La genotipificación se realizó con Diversilab (bioMérieux, Marcy l’Etoile, Francia) usando el kit bacterial, y los resultados se analizaron con la correlación de Kullback Leibler (basado en la presencia y ausencia de bandas más que en la intensidad); los aislamientos con similitud >95% fueron considerados indistinguibles; con similitud de 93-95%, cercanamente relacionados, y con similitud <93%, diferentes.
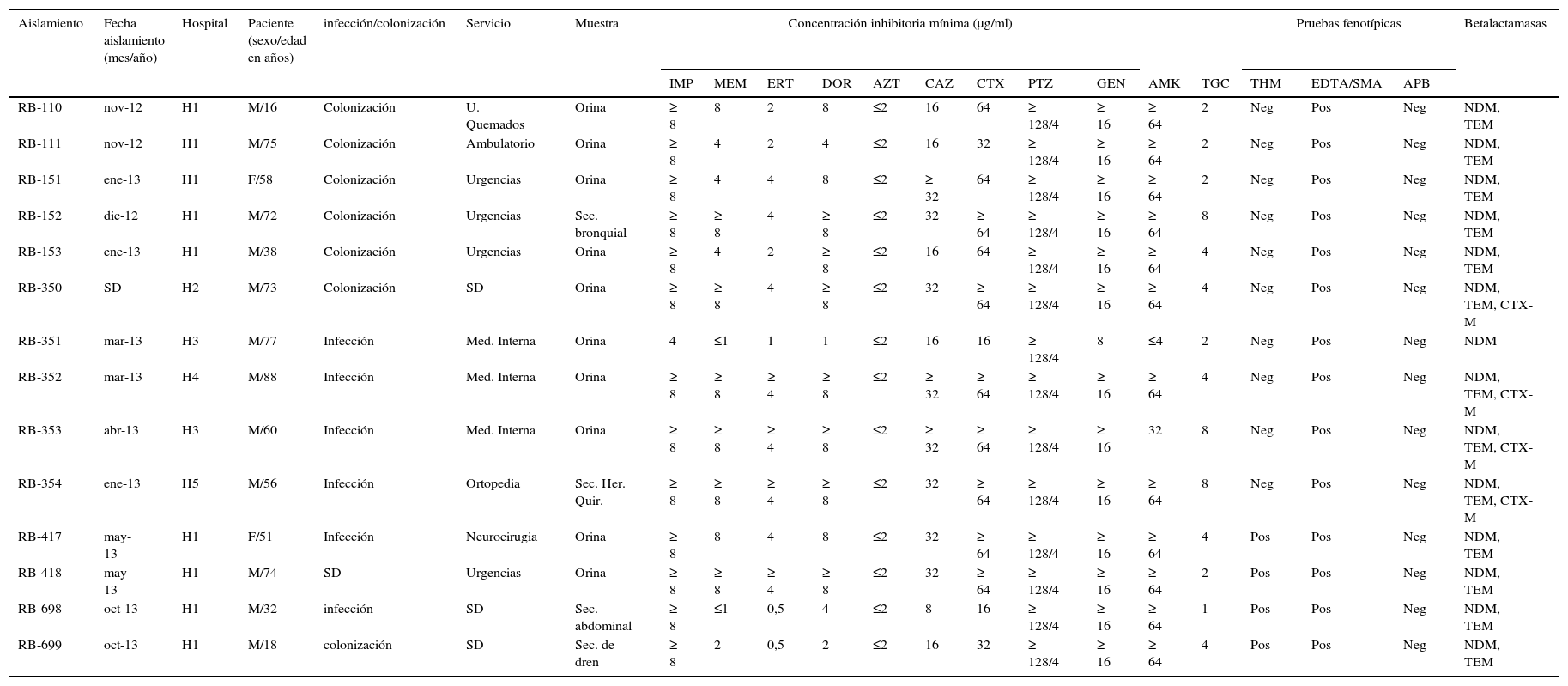
ResultadosAislamientos bacterianosP. rettgeri fue recuperado en pacientes con rango de edad entre 16 a 88años, recuperándose principalmente en hombres (85,7%; n=12) y en muestras de orina (71,4%; n=10) asociadas tanto a infección como a colonización (tabla 1). Nueve aislamientos provenían del hospital H1, en su mayoría clasificados como colonización (n=6), aislados en diferentes servicios de la institución, entre 2012 y 2013 (tabla 1). Los 5 aislamientos restantes se aislaron en 2013, en los hospitales H2 a H5, con un aislamiento por institución, excepto en H3, que presentó 2 aislamientos (tabla 1).
Características clínicas, fenotípicas y genotípicas de los aislamientos
| Aislamiento | Fecha aislamiento (mes/año) | Hospital | Paciente (sexo/edad en años) | infección/colonización | Servicio | Muestra | Concentración inhibitoria mínima (μg/ml) | Pruebas fenotípicas | Betalactamasas | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| IMP | MEM | ERT | DOR | AZT | CAZ | CTX | PTZ | GEN | AMK | TGC | THM | EDTA/SMA | APB | ||||||||
| RB-110 | nov-12 | H1 | M/16 | Colonización | U. Quemados | Orina | ≥ 8 | 8 | 2 | 8 | ≤2 | 16 | 64 | ≥ 128/4 | ≥ 16 | ≥ 64 | 2 | Neg | Pos | Neg | NDM, TEM |
| RB-111 | nov-12 | H1 | M/75 | Colonización | Ambulatorio | Orina | ≥ 8 | 4 | 2 | 4 | ≤2 | 16 | 32 | ≥ 128/4 | ≥ 16 | ≥ 64 | 2 | Neg | Pos | Neg | NDM, TEM |
| RB-151 | ene-13 | H1 | F/58 | Colonización | Urgencias | Orina | ≥ 8 | 4 | 4 | 8 | ≤2 | ≥ 32 | 64 | ≥ 128/4 | ≥ 16 | ≥ 64 | 2 | Neg | Pos | Neg | NDM, TEM |
| RB-152 | dic-12 | H1 | M/72 | Colonización | Urgencias | Sec. bronquial | ≥ 8 | ≥ 8 | 4 | ≥ 8 | ≤2 | 32 | ≥ 64 | ≥ 128/4 | ≥ 16 | ≥ 64 | 8 | Neg | Pos | Neg | NDM, TEM |
| RB-153 | ene-13 | H1 | M/38 | Colonización | Urgencias | Orina | ≥ 8 | 4 | 2 | ≥ 8 | ≤2 | 16 | 64 | ≥ 128/4 | ≥ 16 | ≥ 64 | 4 | Neg | Pos | Neg | NDM, TEM |
| RB-350 | SD | H2 | M/73 | Colonización | SD | Orina | ≥ 8 | ≥ 8 | 4 | ≥ 8 | ≤2 | 32 | ≥ 64 | ≥ 128/4 | ≥ 16 | ≥ 64 | 4 | Neg | Pos | Neg | NDM, TEM, CTX-M |
| RB-351 | mar-13 | H3 | M/77 | Infección | Med. Interna | Orina | 4 | ≤1 | 1 | 1 | ≤2 | 16 | 16 | ≥ 128/4 | 8 | ≤4 | 2 | Neg | Pos | Neg | NDM |
| RB-352 | mar-13 | H4 | M/88 | Infección | Med. Interna | Orina | ≥ 8 | ≥ 8 | ≥ 4 | ≥ 8 | ≤2 | ≥ 32 | ≥ 64 | ≥ 128/4 | ≥ 16 | ≥ 64 | 4 | Neg | Pos | Neg | NDM, TEM, CTX-M |
| RB-353 | abr-13 | H3 | M/60 | Infección | Med. Interna | Orina | ≥ 8 | ≥ 8 | ≥ 4 | ≥ 8 | ≤2 | ≥ 32 | ≥ 64 | ≥ 128/4 | ≥ 16 | 32 | 8 | Neg | Pos | Neg | NDM, TEM, CTX-M |
| RB-354 | ene-13 | H5 | M/56 | Infección | Ortopedia | Sec. Her. Quir. | ≥ 8 | ≥ 8 | ≥ 4 | ≥ 8 | ≤2 | 32 | ≥ 64 | ≥ 128/4 | ≥ 16 | ≥ 64 | 8 | Neg | Pos | Neg | NDM, TEM, CTX-M |
| RB-417 | may-13 | H1 | F/51 | Infección | Neurocirugia | Orina | ≥ 8 | 8 | 4 | 8 | ≤2 | 32 | ≥ 64 | ≥ 128/4 | ≥ 16 | ≥ 64 | 4 | Pos | Pos | Neg | NDM, TEM |
| RB-418 | may-13 | H1 | M/74 | SD | Urgencias | Orina | ≥ 8 | ≥ 8 | ≥ 4 | ≥ 8 | ≤2 | 32 | ≥ 64 | ≥ 128/4 | ≥ 16 | ≥ 64 | 2 | Pos | Pos | Neg | NDM, TEM |
| RB-698 | oct-13 | H1 | M/32 | infección | SD | Sec. abdominal | ≥ 8 | ≤1 | 0,5 | 4 | ≤2 | 8 | 16 | ≥ 128/4 | ≥ 16 | ≥ 64 | 1 | Pos | Pos | Neg | NDM, TEM |
| RB-699 | oct-13 | H1 | M/18 | colonización | SD | Sec. de dren | ≥ 8 | 2 | 0,5 | 2 | ≤2 | 16 | 32 | ≥ 128/4 | ≥ 16 | ≥ 64 | 4 | Pos | Pos | Neg | NDM, TEM |
AMK: amicacina; APB: prueba de sinergia con inhibidor ácido fenil borónico; CAZ: ceftazidima; CTX: cefotaxima; DOR: doripenem; EDTA/SMA: prueba de sinergia con inhibidor (ácido etilendiaminotetraacético/ácido mercaptoacético EDTA/SMA; ERT: ertapenem; F: femenino; GEN: gentamicina; IMP: imipenem; M: masculino; Med. Interna: medicina interna; MEM: meropenem; Neg: negativo; Pos: positivo; PTZ: piperacilina-tazobactam; SD: sin datos; Sec. Her. Quir: Secreción herida quirúrgica; Sec: secreción; TGC: tigeciclina; THM: test de Hodge modificado; U. Quemados: unidad de quemados.
Los aislamientos fueron resistentes a todos los antimicrobianos evaluados carbapenémicos, cefalosporinas de tercera generación, piperacilina-tazobactam, amicacina, gentamicina y tigeciclina, excepto a aztreonam (tabla 1). Todos los aislamientos fueron positivos para EDTA/SMA, negativos para APB, y únicamente 4 aislamientos fueron positivos para THM (tabla 1).
Caracterización genotípicaTodos los aislamientos fueron positivos para NDM-1, 13 para TEM y 4 para CTX-M (tabla 1). Ningún aislamiento amplificó KPC, GES, IMP, VIM, OXA-48 ni SHV. La tipificación con Diversilab permitió definir 2 grupos clonales de 9 (grupo1) y 4 (grupo2) aislamientos, respectivamente (fig. 1), y un aislamiento que no está genéticamente relacionado con el resto. El grupo1 está conformado por 9 aislamientos (8 indistinguibles y uno cercanamente relacionado), todos del hospital H1, mientras que el grupo2 lo componen 3 aislamientos indistinguibles y uno cercanamente relacionado de los hospitales H2 al H5 (fig. 1). Todos los aislamientos del grupo2 fueron positivos para CTX-M.
DiscusiónEn Colombia, circulan diversos tipos de carbapenemasas, y es considerada una región endémica para carbapenemasas tipo KPC, detectadas principalmente en enterobacterias y Pseudomonas spp.10,11, VIM principalmente identificada en Pseudomonas spp11, y OXA-23 en Acinetobacter baumannii12, y aunque en Colombia NDM se detectó hace menos de 5años3, actualmente su identificación se ha incrementado a nivel nacional de acuerdo con los datos de vigilancia del INS (estos datos no se muestran), siendo esta situación de gran preocupación por la rapidez con que se ha diseminado esta carbapenemasa a nivel mundial y la posibilidad de que en nuestro país este mecanismo de resistencia se vuelva de alta prevalencia, como ha ocurrido con otras carbapenemasas.
En Latinoamérica, NDM se detectó por primera vez en aislamientos de Klebsiella pneumoniae en Guatemala13 y Colombia3; actualmente esta enzima se ha aislado en diferentes microorganismos gramnegativos en la región, incluyendo P. rettgeri, que se ha identificado en Argentina, Brasil, México y Uruguay13, siendo este el primer reporte en Colombia. La detección temprana de carbapenemasas en el laboratorio de microbiología a través del uso de pruebas de tamizaje es importante para prevenir la diseminación de estos determinantes de resistencia en el ambiente hospitalario. En este estudio se observó que la identificación de carbapenemasas claseB (tipo NDM) usando la prueba con EDTA/SMA fue 100% sensible y específica, mientras que el THM solo logró detectar menos del 30% de estos aislamientos, lo cual es acorde con lo reportado por la literatura2,4.
La mayoría de microrganismos productores de carbapenemasas presentan perfil de multirresistencia, limitando las opciones de tratamiento, por lo cual la colistina se ha convertido en uno de los antimicrobianos de elección para tratar estas infecciones2. Sin embargo, en el caso de P. rettgeri con NDM, colistina no puede ser considerado como tratamiento por la resistencia natural de este microorganismo14. En este estudio, la mayoría de aislamientos presentaron fenotipo de multirresistencia y únicamente fueron sensibles a aztreonam; esta característica está siendo estudiada como una posible estrategia para tratar estos pacientes mediante el uso de una combinación de aztreonam y avibactam (inhibidor de betalactamasas NXL104)2,15.
Este estudio describe la diseminación de 2 grupos clonales, uno a nivel intrahospitalario de P. rettgeri NDM ocurrido en una institución de Bucaramanga (H1) y otro interhospitalario de P. rettgeri NDM y CTX-M identificado en 4 instituciones (3 de Bogotá y una de Madrid [ciudad ubicada a 28km de Bogotá]). En Colombia previamente se había descrito la ocurrencia de un brote por aislamientos con NDM3. Sin embargo, esta es la primera vez que se describe la propagación de un grupo clonal en varias instituciones, y aunque no se estableció relación entre los pacientes, es importante establecer una vigilancia epidemiológica y de laboratorio permanente y articulada con el fin de tomar medidas de control adecuadas para prevenir diseminación de aislamientos con NDM en instituciones de estas áreas geográficas.
En conclusión, en Colombia se observa la circulación de 2 grupos genéticos de P. rettgeri NDM-1. Por lo tanto, es importante fortalecer la vigilancia a nivel de laboratorio para detectar estas enzimas, lo cual permitirá tomar medidas necesarias para controlar la propagación de estos determinantes de resistencia a nivel hospitalario.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A los Laboratorios Departamentales de Salud Pública (LDSP) de Cundinamarca (Amparo Leonor Génecco Rodríguez), LDSP de Santander (Leonor Chacón de Mendieta) y Secretaria Distrital de Salud de Bogotá (María del Socorro Chala). Al Equipo IAAS (Infecciones Asociadas a la Atención en Salud). Subdirección de vigilancia y Control. Dirección vigilancia y análisis del riesgo. Instituto Nacional de Salud. A las instituciones, Hospital Universitario de Santander E.S.E., Hospital El Tunal E.S.E., Hospital la Victoria E.S.E., Hospital Simón Bolívar E.S.E. y Centro Ambulatorio Gustavo Escallón Cayzedo - Fundación Santa Fe de Bogotá.