Aunque los enterococos ocupan el tercer lugar entre los microorganismos que más frecuentemente provocan endocarditis infecciosa (EI), tras los estreptococos y Staphylococcus aureus, hay pocos estudios multicéntricos que proporcionen un análisis en profundidad de la EI enterocócica.
MétodosDescripción de las características de los 76 casos de endocarditis infecciosa izquierda (EII) enterocócica (59 nativas y 17 protésicas) de la base de datos del Grupo para el Estudio de las Infecciones Cardiovasculares de la Sociedad Andaluza de Enfermedades Infecciosas. Además, se hace hincapié en la comparación con la EII no enterocócica.
ResultadosEl enterococo fue el causante de 76 de 696 episodios de EII (11%). Comparada con la EII no enterocócica, la EII enterocócica fue más frecuentemente observada en pacientes mayores de 65 años (el 47,4 frente al 27,6%; p<0,0005), con enfermedades crónicas (el 75 frente al 54,6%; p<0,001), válvulas calcificadas (el 18,6 frente al 10%; p<0,05), foco infeccioso previo urinario (el 30,3 frente al 2,1%; p<0,00001) o abdominal (el 10,5 frente al 3,1%; p<0,01) y produjo una mayor tasa de recidivas (el 6,6 frente al 2,3%; p<0,05). La EII enterocócica produjo menos manifestaciones cutáneas o vasculares periféricas (el 14,5 frente al 27,1%; p<0,05) y menos fenómenos inmunológicos (el 10,5 frente al 24%; p<0,01). Un 36,8% de los pacientes con EII enterocócica fueron sometidos a cirugía valvular durante el ingreso. La mortalidad durante el ingreso hospitalario de los pacientes con EII enterocócica fue del 32,9%, de los pacientes con EII por estreptococos del grupo viridans (EGV) fue del 9,3% y de los pacientes con S. aureus fue del 48,6% (enterococo frente a EGV: p<0,0001; enterococo frente a S. aureus: p=0,02). Los pacientes con EII enterocócica tratados con la combinación de una penicilina o vancomicina asociada a un aminoglucósido (n=60) y aquellos pacientes tratados con ampicilina más ceftriaxona (n=6) tuvieron una mortalidad similar durante el ingreso (el 26,7 frente al 33,3%; p=0,66). La resistencia de alto valor a gentamicina se detectó en 5 de 38 episodios de EII enterocócica (13,1%).
ConclusionesLa EII enterocócica aparece en pacientes con unas características clínicas bien definidas y produce pocas manifestaciones cutáneas o vasculares periféricas y pocos fenómenos inmunológicos. Su tasa de recidivas es más alta que la de la EII no enterocócica. Aunque la mortalidad de la EII enterocócica es inferior a la de la EII por S. aureus, esta mortalidad es muy superior a la de la EII por EGV. La mortalidad de los pacientes con EII enterocócica tratados con ampicilina más ceftriaxona fue similar a la de los pacientes tratados con la combinación de una penicilina o vancomicina más un aminoglucósido. La resistencia de alto nivel a gentamicina es aún poco frecuente en los enterococos que causan EII.
Although enterococci occupy the third position among microorganisms producing infectious endocarditis (IE) following streptococci and Staphylococcus aureus, few multicenter studies have provided an in-depth analysis of enterococcal IE.
MethodsDescription of the characteristics of 76 cases of enterococcal left-sided infectious endocarditis (LSIE) (native: 59, prosthetic: 17) retrieved from the database of the Cardiovascular Infections Study Group of the Andalusian Society of Infectious Diseases, with emphasis on the comparison with non-enterococcal LSIE.
ResultsEnterococci were the causal agent in 76 of the 696 episodes of LSIE (11%). Compared with non-enterococcal LSIE, enterococcal LSIE was more commonly seen in patients older than 65 (47.4% vs. 27.6%, P<0.0005), and those with chronic diseases (75% vs. 54.6%, P<0.001), calcified valves (18.6% vs. 10%, P<0.05), and previous urinary (30.3% vs. 2.1%, P<0.00001) or abdominal (10.5% vs. 3.1%, P<0.01) infections, and produced a higher rate of relapses (6.6% vs. 2.3%, P<0.05). Enterococcal LSIE was associated with fewer peripheral vascular or skin manifestations (14.5% vs. 27.1%, P<0.05) and fewer immunological phenomena (10.5% vs. 24%, P<0.01). Among the total of patients with enterococcal LSIE, 36.8% underwent valve surgery during hospitalization. In-hospital mortality was 32.9% for enterococcal LSIE, 9.3% for viridans group streptococci (VGS) LSIE and 48.6% for S. aureus LSIE (enterococci vs VGS: P<0.0001; enterococci vs S. aureus: P=0.02). Enterococcal LSIE patients treated with the combination of a penicillin or vancomycin plus an aminoglycoside (n=60) and those treated with ampicillin plus ceftriaxone (n=6) showed similar in-hospital mortality (26.7% vs 33.3%, P=0.66). High-level resistance to gentamicin was detected in 5 of 38 episodes of enterococcal LSIE (13.1%).
ConclusionsEnterococcal LSIE appears in patients with well-defined clinical characteristics, and causes few peripheral vascular or skin manifestations and few immunological phenomena. The relapse rate is higher than in non-enterococcal LSIE. Mortality due to enterococcal LSIE is lower than that of S. aureus LSIE, and much higher than that of VGS LSIE. Mortality due to enterococcal LSIE is similar in patients treated with ampicillin plus ceftriaxone or with a combination of penicillin or vancomycin plus an aminoglycoside. High-level resistance to gentamicin remains uncommon in enterococci causing LSIE.
Los enterococos ocupan el tercer lugar entre los microorganismos que más frecuentemente provocan endocarditis infecciosa (EI), tras los estreptococos y Staphylococcus aureus1–5, y son los causantes del 8 al 11% aproximadamente de todos los casos de EI1–4,6–10. A pesar de esto, la EI enterocócica no está estudiada en profundidad en la literatura médica, dado que la mayoría de los estudios publicados tienen alguna de las siguientes limitaciones: pequeño número de pacientes7,11–16, no son estudios multicéntricos7,17,18 o no han realizado una comparación directa con la endocarditis producida por otros microorganismos7,17–21.
Incluso los 3 estudios con mayor número de pacientes y que han intentado subsanar estas limitaciones ofrecen poca información sobre algunos aspectos, como el posible origen de la bacteriemia causante de la EI enterocócica6,9, la comorbilidad de los pacientes6, sus manifestaciones clínicas6,9,22, sus complicaciones6, el tratamiento antimicrobiano recibido por los pacientes9, la resistencia a los antimicrobianos de los aislamientos de enterococo6,9,22 y la recidiva de la EI enterocócica9,22.
Sobre la base del registro de pacientes del Grupo para el Estudio de las Infecciones Cardiovasculares de la Sociedad Andaluza de Enfermedades Infecciosas (GEICV-SAEI), el objetivo de este trabajo fue contribuir con la mejora del conocimiento sobre la EI enterocócica, mediante una descripción detallada de los factores de riesgo, las características clínicas y las características ecocardiográficas, las complicaciones, el tratamiento y el pronóstico en el ingreso y tras el alta hospitalaria de la endocarditis infecciosa izquierda (EII) producida por enterococo. Además, se hizo hincapié en la comparación de esta entidad con la EII producida por otros microorganismos.
MétodosBase de datos. El GEICV-SAEI está formado por 7 hospitales del Servicio Andaluz de Salud. La cohorte de pacientes con EII está formada por los casos de esta entidad en pacientes mayores de 18 años atendidos en estos hospitales, los cuales se han recogido de forma prospectiva, desde enero de 1984 hasta la actualidad, en una base de datos electrónica común en la que se registran datos epidemiológicos, clínicos, diagnósticos, terapéuticos y de pronóstico.
Pacientes incluidos. Para este estudio se analizaron todos los episodios de EII monomicrobiana causados por enterococo desde enero de 1984 a diciembre de 2006. Los pacientes con EII enterocócica se compararon con el grupo formado por el resto de EII. Para este análisis se excluyeron los episodios de EII polimicrobiana donde participara enterococo. Las recidivas no se analizaron como episodios de EII.
Definiciones. La EI se definió como definitiva o posible según los criterios de Duke23. La existencia de enfermedad crónica debilitante se definió como la presencia de cualquiera de las siguientes: diabetes mellitus, déficit neurológico o demencia, neoplasia, enfermedades crónicas cardíacas, respiratorias, hepáticas o renales, inmunodepresión o cualquier condición crónica que afectara al estado general del enfermo previo al diagnóstico de endocarditis. La comorbilidad de los pacientes se valoró además con la puntuación obtenida con el índice de Charlson relacionado con la edad24. La presencia de enfermedad valvular previa se definió como la existencia de valvulopatía reumática, valvulopatía congénita, degeneración mixoide valvular o prolapso mitral, degeneración o calcificación valvular, endocarditis previa o prótesis valvular. La endocarditis protésica se definió como precoz si aparecía en los 12 meses siguientes a la intervención o como tardía si aparecía con posterioridad. Se consideró un origen relacionado con la asistencia sanitaria cuando en los 6 meses precedentes al diagnóstico se había producido bien una hospitalización, o bien una manipulación diagnosticoterapéutica con capacidad potencial de producir bacteriemia llevada a cabo en el entorno hospitalario8.
La variable «manipulación o foco infeccioso conocido» se definió como la existencia previa a la EI de procedimientos diagnosticoterapéuticos o de focos infecciosos que, a juicio del investigador, fueran sospechosos de haber producido la bacteriemia causante de la endocarditis. La extensión perivalvular se definió como la presencia de absceso perianular o fístula o seudoaneurisma sobre la base de hallazgos ecocardiográficos, quirúrgicos o de la autopsia25. Las manifestaciones cutáneas y vasculares periféricas incluyeron manchas de Roth, hemorragias conjuntivales, nódulos de Osler, manchas de Janeway, hemorragias en astilla y petequias. La definición de los fenómenos inmunológicos y de los fenómenos vasculares se ajustó a los criterios de Duke23. La embolia séptica o foco infeccioso metastásico se definió como la embolización a cualquier órgano (excepto la piel), e incluyó la aparición de artritis purulenta u osteomielitis vertebral. Las manifestaciones neurológicas incluyeron el infarto cerebral embólico (con o sin hemorragia), aneurismas micóticos, encefalopatía, síndrome meníngeo y arteritis infecciosa.
El diagnóstico de fallo ventricular izquierdo se realizó mediante valoración clínica y radiológica. El fallo ventricular izquierdo grave se definió como aquel con necesidad de ingreso en la unidad de cuidados intensivos (UCI), ventilación mecánica no invasiva o necesidad de aminas. El desarrollo de insuficiencia renal se definió como la elevación de la creatinina por encima de 1,5mg/dl para los pacientes sin insuficiencia renal previa o como un incremento de más de 0,5mg/dl sobre la creatinina basal para los pacientes con insuficiencia renal previa. La mortalidad relacionada se definió como la mortalidad al final del seguimiento provocada por una causa relacionada con la EII (shock séptico, insuficiencia cardíaca o complicación neurológica). La recidiva se definió por la aparición de un nuevo episodio de endocarditis por el mismo microorganismo en los 6 meses siguientes a la finalización del tratamiento, tras haber confirmado previamente la curación de ésta por la evolución clínica y la negatividad de los hemocultivos realizados al mes de la finalización del tratamiento. La reinfección se definió como el desarrollo de un nuevo episodio de endocarditis, bien por otro microorganismo, o bien por el mismo microorganismo, pero tras un tiempo superior a los 6 meses tras la finalización del tratamiento.
En la EII enterocócica, las pautas de tratamiento antimicrobiano consideradas inapropiadas fueron aquellas que no incluyeron o bien la combinación de una penicilina o vancomicina con aminoglucósido o bien la combinación de ampicilina con ceftriaxona. La resistencia de los enterococos a ampicilina y a vancomicina se correspondió con una concentración mínima inhibitoria (CMI) superior o igual a 16μg/ml y con una CMI superior o igual a 32μg/ml, respectivamente; la resistencia de alto nivel a estreptomicina y a gentamicina se correspondió con una CMI superior o igual a 2.000μg/ml y con una CMI superior o igual a 500μg/ml, respectivamente.
Análisis estadístico. Se realizó el test de la χ2 (y el test de Fisher cuando procedía) para la comparación de las variables cualitativas y el test de la t de Student para la comparación de las variables cuantitativas. Se consideró que había significación estadística cuando se encontraba un valor de p<0,05. Los datos se analizaron con el programa estadístico SPSS versión 12.0 (Chicago, Illinois, EE. UU.).
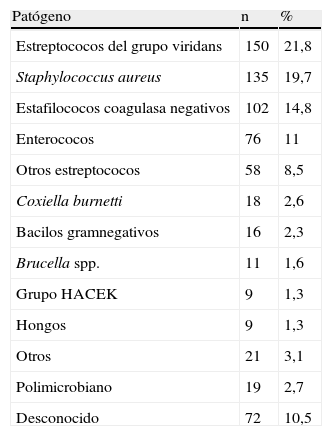
ResultadosDesde enero de 1984 hasta diciembre de 2006 se recogieron 696 episodios de EII en la base de datos del GEICV-SAEI. Los patógenos causantes de estos episodios se muestran en la tabla 1. De estos episodios, el enterococo fue el microorganismo causante como único agente aislado en 76 de éstos (11%). Además, el enterococo participó en 8 episodios de EII polimicrobiana, que se excluyeron del análisis.
Patógenos causantes de 696 episodios de endocarditis infecciosa izquierda
| Patógeno | n | % |
| Estreptococos del grupo viridans | 150 | 21,8 |
| Staphylococcus aureus | 135 | 19,7 |
| Estafilococos coagulasa negativos | 102 | 14,8 |
| Enterococos | 76 | 11 |
| Otros estreptococos | 58 | 8,5 |
| Coxiella burnetti | 18 | 2,6 |
| Bacilos gramnegativos | 16 | 2,3 |
| Brucella spp. | 11 | 1,6 |
| Grupo HACEK | 9 | 1,3 |
| Hongos | 9 | 1,3 |
| Otros | 21 | 3,1 |
| Polimicrobiano | 19 | 2,7 |
| Desconocido | 72 | 10,5 |
El grupo HACEK incluye Haemophilus influenzae, H. parainfluenzae, Aggregatibacter actinomycetemcomitans, A. aphrophilus, A. paraphrophilus, Cardiobacterium hominis, Eikenella corrodens, Kingella kingae y K. denitrificans.
El porcentaje de casos de EII por enterococo respecto al total de EII pasó de un 8,6% en el período de 1984 a 1995 a un 11,9% en el período de 1996 a 2006, lo que supuso un incremento del 38,3%. Al diferenciar entre la EII nativa y la EII protésica, el enterococo produjo el 11,2% de los episodios de EII sobre válvula nativa y el 10,1% de los episodios de EII sobre válvula protésica. El diagnóstico de EII por enterococo fue definitivo en 69 de los 76 episodios (90,8%) y posible en 7 episodios (9,2%). En todos, excepto en un caso en el que el diagnóstico fue por autopsia, se realizó al menos una ecocardiografía. En 39 casos (51,3%) fue transtorácica, en 3 casos (3,9%) fue exclusivamente transesofágica, mientras que en 33 casos (43,4%) se realizaron ambas modalidades. Las especies de enterococo causantes de los 76 episodios de EII fueron: Enterococcus faecalis (n=73; 96%), E. faecalis con Enterococcus durans (n=2; 2,6%) y Enterococcus faecium (n=1; 1,3%).
La localización de la endocarditis por enterococo fue aórtica (n=39; 51,3%), mitral (n=27; 35,5%), mitral más aórtica (n=8; 10,5%), mitral más tricúspide (n=1; 1,3%) y mitral más aórtica más tricúspide (n=1; 1,3%).
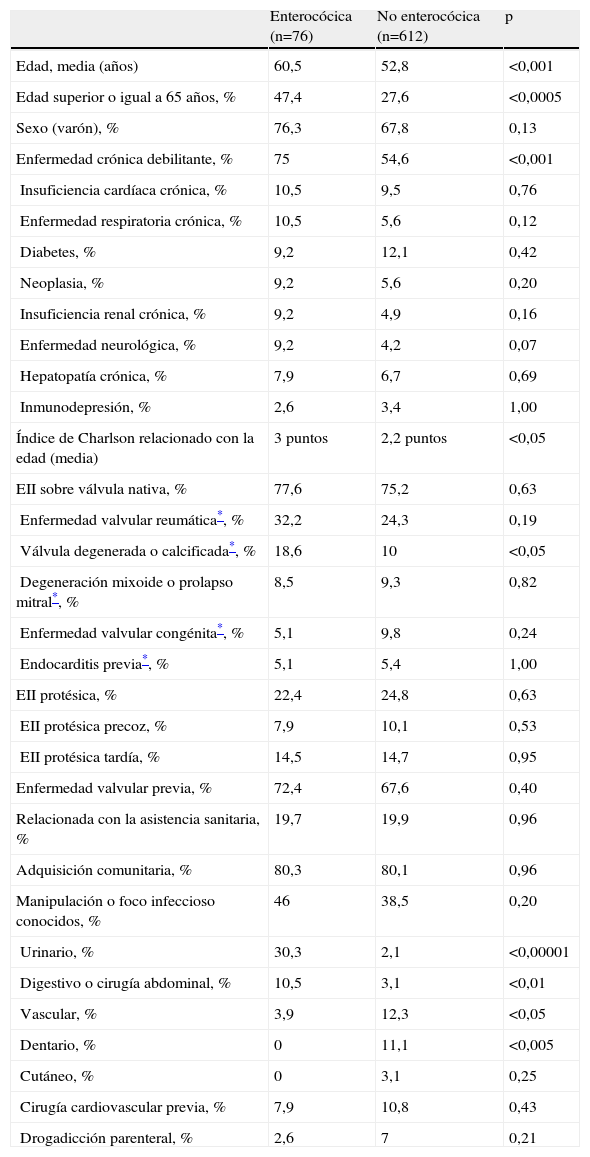
Las principales características epidemiológicas, clínicas, ecocardiográficas y pronóstico de la EII por enterococo se recogen en las tablas 2–4, en las que se muestra además la comparación de la EII por enterococo con la producida por el resto de los microorganismos. Como se muestra en las tablas, las características que distinguen a la EII por enterococo de la producida por otros microorganismos son la mayor edad (con un alto porcentaje de pacientes con edad superior o igual a 65 años) y el mayor porcentaje de enfermedad crónica debilitante, con la consiguiente mayor puntuación en el índice de Charlson, la mayor frecuencia de valvulopatía degenerativa o calcificada, el mayor porcentaje de manipulación o foco infeccioso a nivel urinario o digestivo (y menor a nivel vascular), el menor porcentaje de manifestaciones cutáneas o vasculares periféricas, de nódulos de Osler y de manchas de Janeway, el menor porcentaje de cirugía valvular tras el alta y la mayor tasa de recidivas.
Características demográficas, enfermedades concomitantes, tipo de enfermedad valvular previa y origen posible en la endocarditis infecciosa izquierda por enterococo comparada con la endocarditis infecciosa izquierda no enterocócica
| Enterocócica (n=76) | No enterocócica (n=612) | p | |
| Edad, media (años) | 60,5 | 52,8 | <0,001 |
| Edad superior o igual a 65 años, % | 47,4 | 27,6 | <0,0005 |
| Sexo (varón), % | 76,3 | 67,8 | 0,13 |
| Enfermedad crónica debilitante, % | 75 | 54,6 | <0,001 |
| Insuficiencia cardíaca crónica, % | 10,5 | 9,5 | 0,76 |
| Enfermedad respiratoria crónica, % | 10,5 | 5,6 | 0,12 |
| Diabetes, % | 9,2 | 12,1 | 0,42 |
| Neoplasia, % | 9,2 | 5,6 | 0,20 |
| Insuficiencia renal crónica, % | 9,2 | 4,9 | 0,16 |
| Enfermedad neurológica, % | 9,2 | 4,2 | 0,07 |
| Hepatopatía crónica, % | 7,9 | 6,7 | 0,69 |
| Inmunodepresión, % | 2,6 | 3,4 | 1,00 |
| Índice de Charlson relacionado con la edad (media) | 3 puntos | 2,2 puntos | <0,05 |
| EII sobre válvula nativa, % | 77,6 | 75,2 | 0,63 |
| Enfermedad valvular reumática*, % | 32,2 | 24,3 | 0,19 |
| Válvula degenerada o calcificada*, % | 18,6 | 10 | <0,05 |
| Degeneración mixoide o prolapso mitral*, % | 8,5 | 9,3 | 0,82 |
| Enfermedad valvular congénita*, % | 5,1 | 9,8 | 0,24 |
| Endocarditis previa*, % | 5,1 | 5,4 | 1,00 |
| EII protésica, % | 22,4 | 24,8 | 0,63 |
| EII protésica precoz, % | 7,9 | 10,1 | 0,53 |
| EII protésica tardía, % | 14,5 | 14,7 | 0,95 |
| Enfermedad valvular previa, % | 72,4 | 67,6 | 0,40 |
| Relacionada con la asistencia sanitaria, % | 19,7 | 19,9 | 0,96 |
| Adquisición comunitaria, % | 80,3 | 80,1 | 0,96 |
| Manipulación o foco infeccioso conocidos, % | 46 | 38,5 | 0,20 |
| Urinario, % | 30,3 | 2,1 | <0,00001 |
| Digestivo o cirugía abdominal, % | 10,5 | 3,1 | <0,01 |
| Vascular, % | 3,9 | 12,3 | <0,05 |
| Dentario, % | 0 | 11,1 | <0,005 |
| Cutáneo, % | 0 | 3,1 | 0,25 |
| Cirugía cardiovascular previa, % | 7,9 | 10,8 | 0,43 |
| Drogadicción parenteral, % | 2,6 | 7 | 0,21 |
EII: endocarditis infecciosa izquierda.
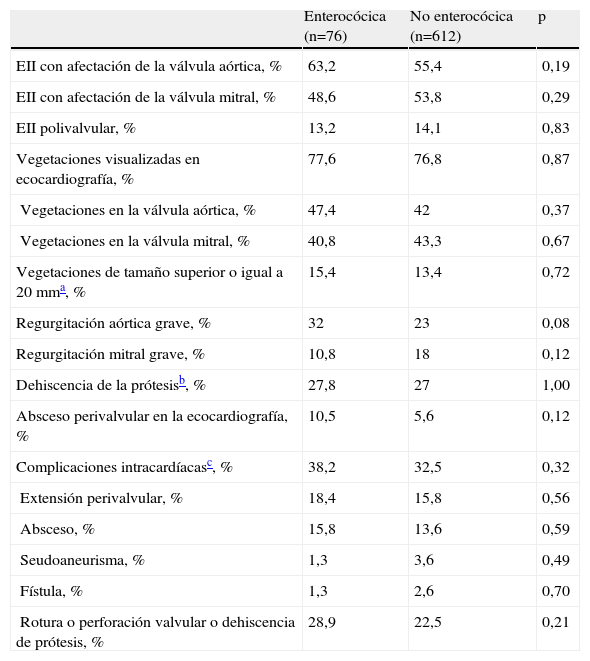
Características ecocardiográficas y complicaciones intracardíacas de la endocarditis infecciosa izquierda por enterococo comparada con la endocarditis infecciosa izquierda no enterocócica
| Enterocócica (n=76) | No enterocócica (n=612) | p | |
| EII con afectación de la válvula aórtica, % | 63,2 | 55,4 | 0,19 |
| EII con afectación de la válvula mitral, % | 48,6 | 53,8 | 0,29 |
| EII polivalvular, % | 13,2 | 14,1 | 0,83 |
| Vegetaciones visualizadas en ecocardiografía, % | 77,6 | 76,8 | 0,87 |
| Vegetaciones en la válvula aórtica, % | 47,4 | 42 | 0,37 |
| Vegetaciones en la válvula mitral, % | 40,8 | 43,3 | 0,67 |
| Vegetaciones de tamaño superior o igual a 20mma, % | 15,4 | 13,4 | 0,72 |
| Regurgitación aórtica grave, % | 32 | 23 | 0,08 |
| Regurgitación mitral grave, % | 10,8 | 18 | 0,12 |
| Dehiscencia de la prótesisb, % | 27,8 | 27 | 1,00 |
| Absceso perivalvular en la ecocardiografía, % | 10,5 | 5,6 | 0,12 |
| Complicaciones intracardíacasc, % | 38,2 | 32,5 | 0,32 |
| Extensión perivalvular, % | 18,4 | 15,8 | 0,56 |
| Absceso, % | 15,8 | 13,6 | 0,59 |
| Seudoaneurisma, % | 1,3 | 3,6 | 0,49 |
| Fístula, % | 1,3 | 2,6 | 0,70 |
| Rotura o perforación valvular o dehiscencia de prótesis, % | 28,9 | 22,5 | 0,21 |
EII: endocarditis infecciosa izquierda.
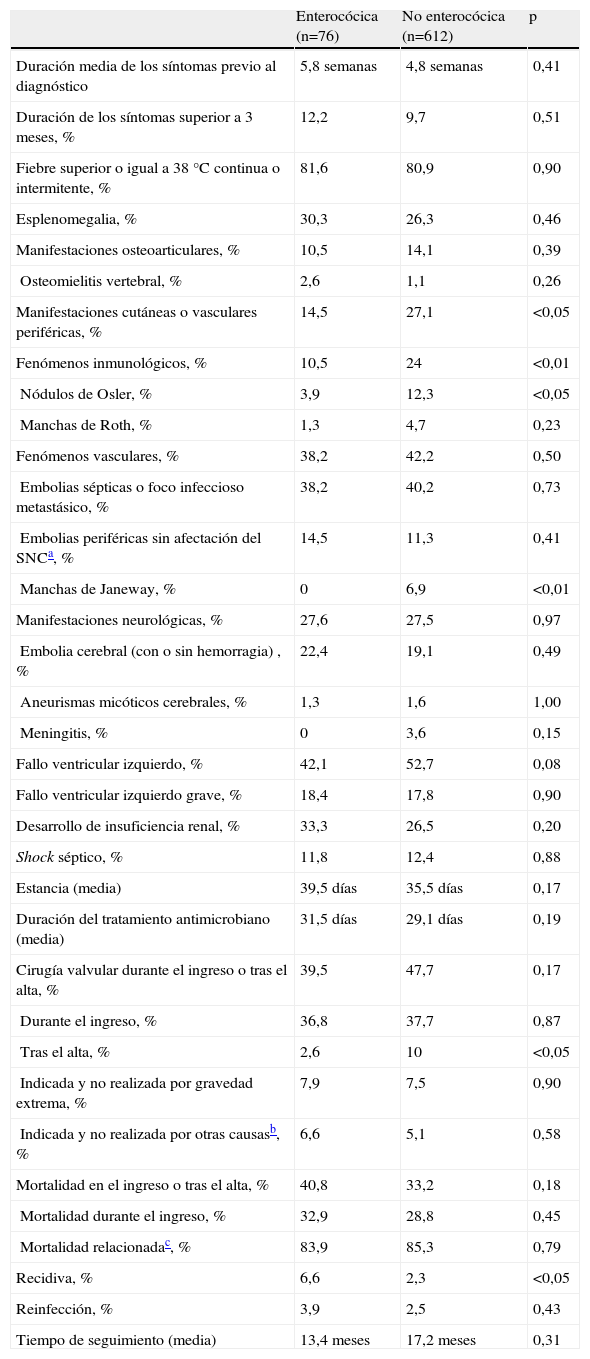
Manifestaciones clínicas, complicaciones, evolución y pronóstico de la endocarditis infecciosa izquierda por enterococo comparada con la endocarditis infecciosa izquierda no enterocócica
| Enterocócica (n=76) | No enterocócica (n=612) | p | |
| Duración media de los síntomas previo al diagnóstico | 5,8 semanas | 4,8 semanas | 0,41 |
| Duración de los síntomas superior a 3 meses, % | 12,2 | 9,7 | 0,51 |
| Fiebre superior o igual a 38°C continua o intermitente, % | 81,6 | 80,9 | 0,90 |
| Esplenomegalia, % | 30,3 | 26,3 | 0,46 |
| Manifestaciones osteoarticulares, % | 10,5 | 14,1 | 0,39 |
| Osteomielitis vertebral, % | 2,6 | 1,1 | 0,26 |
| Manifestaciones cutáneas o vasculares periféricas, % | 14,5 | 27,1 | <0,05 |
| Fenómenos inmunológicos, % | 10,5 | 24 | <0,01 |
| Nódulos de Osler, % | 3,9 | 12,3 | <0,05 |
| Manchas de Roth, % | 1,3 | 4,7 | 0,23 |
| Fenómenos vasculares, % | 38,2 | 42,2 | 0,50 |
| Embolias sépticas o foco infeccioso metastásico, % | 38,2 | 40,2 | 0,73 |
| Embolias periféricas sin afectación del SNCa, % | 14,5 | 11,3 | 0,41 |
| Manchas de Janeway, % | 0 | 6,9 | <0,01 |
| Manifestaciones neurológicas, % | 27,6 | 27,5 | 0,97 |
| Embolia cerebral (con o sin hemorragia) , % | 22,4 | 19,1 | 0,49 |
| Aneurismas micóticos cerebrales, % | 1,3 | 1,6 | 1,00 |
| Meningitis, % | 0 | 3,6 | 0,15 |
| Fallo ventricular izquierdo, % | 42,1 | 52,7 | 0,08 |
| Fallo ventricular izquierdo grave, % | 18,4 | 17,8 | 0,90 |
| Desarrollo de insuficiencia renal, % | 33,3 | 26,5 | 0,20 |
| Shock séptico, % | 11,8 | 12,4 | 0,88 |
| Estancia (media) | 39,5 días | 35,5 días | 0,17 |
| Duración del tratamiento antimicrobiano (media) | 31,5 días | 29,1 días | 0,19 |
| Cirugía valvular durante el ingreso o tras el alta, % | 39,5 | 47,7 | 0,17 |
| Durante el ingreso, % | 36,8 | 37,7 | 0,87 |
| Tras el alta, % | 2,6 | 10 | <0,05 |
| Indicada y no realizada por gravedad extrema, % | 7,9 | 7,5 | 0,90 |
| Indicada y no realizada por otras causasb, % | 6,6 | 5,1 | 0,58 |
| Mortalidad en el ingreso o tras el alta, % | 40,8 | 33,2 | 0,18 |
| Mortalidad durante el ingreso, % | 32,9 | 28,8 | 0,45 |
| Mortalidad relacionadac, % | 83,9 | 85,3 | 0,79 |
| Recidiva, % | 6,6 | 2,3 | <0,05 |
| Reinfección, % | 3,9 | 2,5 | 0,43 |
| Tiempo de seguimiento (media) | 13,4 meses | 17,2 meses | 0,31 |
SNC: sistema nervioso central.
En 23 de los 76 casos (30,3%) de EII enterocócica se registró el antecedente de manipulación instrumental o un foco infeccioso de las vías urinarias como posible origen de la bacteriemia productora de la EI (sondaje vesical en 11 casos, infección del tracto urinario de repetición en 6 casos y un caso respectivamente de cistoscopia, uretrotomía, ureterolitotomía, implantación de prótesis de pene, prostatectomía abierta y resección transuretral de la próstata). Las manipulaciones o focos digestivos se registraron en 8 de los 76 pacientes (10,5%) y fueron: colonoscopia con toma de biopsias en 2 casos y un caso respectivamente de cáncer de colon invasivo, diverticulitis, colangitis, endoscopia oral con electrocoagulación, punción con aguja fina hepática y cirugía de colon con necesidad de reintervención.
La mortalidad durante el ingreso de la EII enterocócica fue del 32,9%. Se evidenció una disminución (no estadísticamente significativa) de este porcentaje en los últimos años: el 25% en los 36 episodios correspondientes a los años 2002 a 2006 frente al 40% en los 40 episodios correspondientes a los años 1984 a 2001 (p=0,16).
La mortalidad al final del seguimiento de la EII enterocócica fue del 40,8%. Los pacientes que murieron tras el alta hospitalaria lo hicieron tras una media de 11,5 meses (rango de 6 a 25 meses tras el alta).
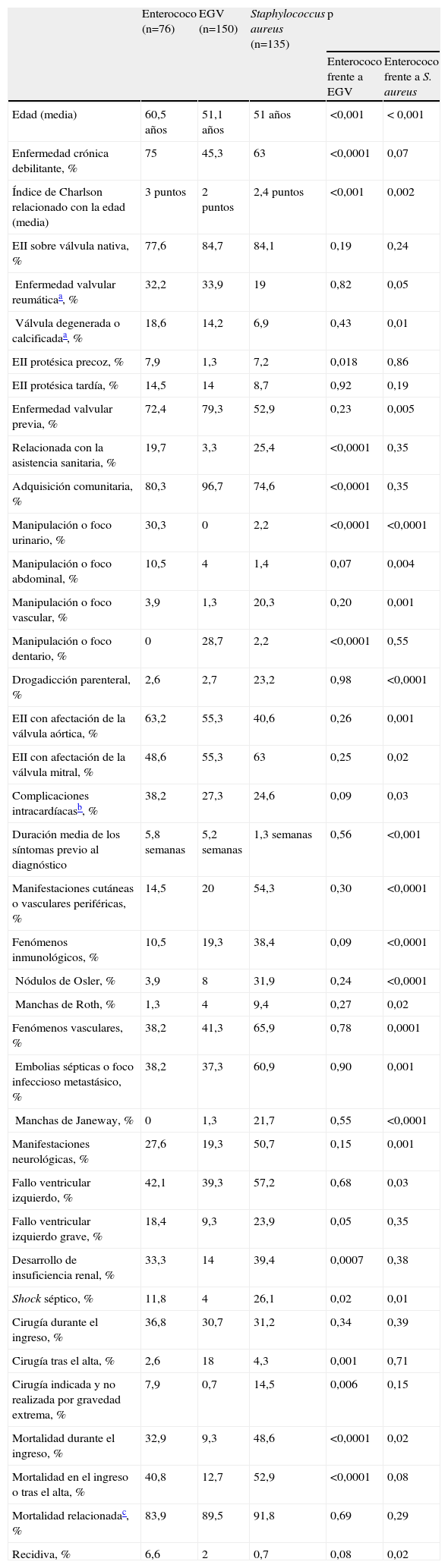
En la tabla 5 se compara la EII enterocócica con la producida por estreptococos del grupo viridans (EGV) y por S. aureus. Con respecto a la EII por EGV, los pacientes con EII enterocócica tuvieron mayor edad y mayor porcentaje de enfermedad crónica debilitante, adquisición relacionada con la asistencia sanitaria, manipulación o foco infeccioso en la zona urinaria o digestiva, desarrollo de insuficiencia renal, shock séptico y mortalidad. Con respecto a la EII por S. aureus, los pacientes con EII enterocócica tuvieron mayor edad, mayor puntuación en el índice de Charlson, mayor duración de los síntomas previo al diagnóstico y mayor porcentaje de enfermedad valvular previa (sobre todo degeneración y calcificación valvular previa), manipulación o foco infeccioso en la zona urinaria o digestiva, afectación de la válvula aórtica, complicaciones intracardíacas y recidivas. Los pacientes con EII por S. aureus tuvieron mayor porcentaje de manipulación o foco infeccioso vascular, drogadicción parenteral, afectación de la válvula mitral, fenómenos inmunológicos, embolias sépticas, manifestaciones neurológicas, fallo ventricular izquierdo, shock séptico y mortalidad durante el ingreso que los pacientes con EII enterocócica.
Características clínicas y pronóstico de la endocarditis infecciosa izquierda enterocócica comparada con la producida por estreptococos del grupo viridans y por Staphylococcus aureus
| Enterococo (n=76) | EGV (n=150) | Staphylococcus aureus (n=135) | p | ||
| Enterococo frente a EGV | Enterococo frente a S. aureus | ||||
| Edad (media) | 60,5 años | 51,1 años | 51 años | <0,001 | < 0,001 |
| Enfermedad crónica debilitante, % | 75 | 45,3 | 63 | <0,0001 | 0,07 |
| Índice de Charlson relacionado con la edad (media) | 3 puntos | 2 puntos | 2,4 puntos | <0,001 | 0,002 |
| EII sobre válvula nativa, % | 77,6 | 84,7 | 84,1 | 0,19 | 0,24 |
| Enfermedad valvular reumáticaa, % | 32,2 | 33,9 | 19 | 0,82 | 0,05 |
| Válvula degenerada o calcificadaa, % | 18,6 | 14,2 | 6,9 | 0,43 | 0,01 |
| EII protésica precoz, % | 7,9 | 1,3 | 7,2 | 0,018 | 0,86 |
| EII protésica tardía, % | 14,5 | 14 | 8,7 | 0,92 | 0,19 |
| Enfermedad valvular previa, % | 72,4 | 79,3 | 52,9 | 0,23 | 0,005 |
| Relacionada con la asistencia sanitaria, % | 19,7 | 3,3 | 25,4 | <0,0001 | 0,35 |
| Adquisición comunitaria, % | 80,3 | 96,7 | 74,6 | <0,0001 | 0,35 |
| Manipulación o foco urinario, % | 30,3 | 0 | 2,2 | <0,0001 | <0,0001 |
| Manipulación o foco abdominal, % | 10,5 | 4 | 1,4 | 0,07 | 0,004 |
| Manipulación o foco vascular, % | 3,9 | 1,3 | 20,3 | 0,20 | 0,001 |
| Manipulación o foco dentario, % | 0 | 28,7 | 2,2 | <0,0001 | 0,55 |
| Drogadicción parenteral, % | 2,6 | 2,7 | 23,2 | 0,98 | <0,0001 |
| EII con afectación de la válvula aórtica, % | 63,2 | 55,3 | 40,6 | 0,26 | 0,001 |
| EII con afectación de la válvula mitral, % | 48,6 | 55,3 | 63 | 0,25 | 0,02 |
| Complicaciones intracardíacasb, % | 38,2 | 27,3 | 24,6 | 0,09 | 0,03 |
| Duración media de los síntomas previo al diagnóstico | 5,8 semanas | 5,2 semanas | 1,3 semanas | 0,56 | <0,001 |
| Manifestaciones cutáneas o vasculares periféricas, % | 14,5 | 20 | 54,3 | 0,30 | <0,0001 |
| Fenómenos inmunológicos, % | 10,5 | 19,3 | 38,4 | 0,09 | <0,0001 |
| Nódulos de Osler, % | 3,9 | 8 | 31,9 | 0,24 | <0,0001 |
| Manchas de Roth, % | 1,3 | 4 | 9,4 | 0,27 | 0,02 |
| Fenómenos vasculares, % | 38,2 | 41,3 | 65,9 | 0,78 | 0,0001 |
| Embolias sépticas o foco infeccioso metastásico, % | 38,2 | 37,3 | 60,9 | 0,90 | 0,001 |
| Manchas de Janeway, % | 0 | 1,3 | 21,7 | 0,55 | <0,0001 |
| Manifestaciones neurológicas, % | 27,6 | 19,3 | 50,7 | 0,15 | 0,001 |
| Fallo ventricular izquierdo, % | 42,1 | 39,3 | 57,2 | 0,68 | 0,03 |
| Fallo ventricular izquierdo grave, % | 18,4 | 9,3 | 23,9 | 0,05 | 0,35 |
| Desarrollo de insuficiencia renal, % | 33,3 | 14 | 39,4 | 0,0007 | 0,38 |
| Shock séptico, % | 11,8 | 4 | 26,1 | 0,02 | 0,01 |
| Cirugía durante el ingreso, % | 36,8 | 30,7 | 31,2 | 0,34 | 0,39 |
| Cirugía tras el alta, % | 2,6 | 18 | 4,3 | 0,001 | 0,71 |
| Cirugía indicada y no realizada por gravedad extrema, % | 7,9 | 0,7 | 14,5 | 0,006 | 0,15 |
| Mortalidad durante el ingreso, % | 32,9 | 9,3 | 48,6 | <0,0001 | 0,02 |
| Mortalidad en el ingreso o tras el alta, % | 40,8 | 12,7 | 52,9 | <0,0001 | 0,08 |
| Mortalidad relacionadac, % | 83,9 | 89,5 | 91,8 | 0,69 | 0,29 |
| Recidiva, % | 6,6 | 2 | 0,7 | 0,08 | 0,02 |
EGV: estreptococos del grupo viridans; EII: endocarditis infecciosa izquierda.
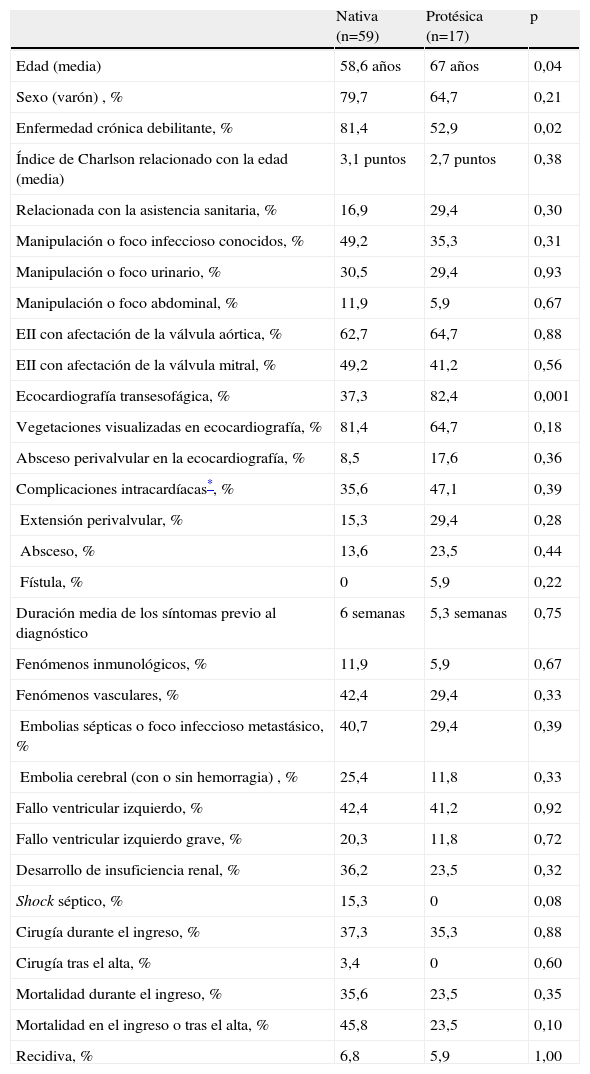
La EII enterocócica se produjo sobre válvula nativa en 59 de los 76 casos (77,6%) y sobre válvula protésica en los 17 casos restantes (22,4%). Comparados con los pacientes con EII enterocócica sobre válvula nativa, los pacientes con EII enterocócica sobre válvula protésica tenían mayor edad y menor porcentaje de enfermedad crónica debilitante previa (tabla 6). A pesar de no encontrar significación estadística, la adquisición de la EI en relación con la asistencia sanitaria y la extensión perivalvular de la infección fue más frecuente (aproximadamente el doble) en la EII enterocócica protésica que en la nativa, mientras que el antecedente de manipulación o foco infeccioso abdominal previo, la presencia de fenómenos inmunológicos, la embolia cerebral y el desarrollo de fallo ventricular izquierdo grave fue más frecuente en la nativa (aproximadamente el doble). No se evidenció shock séptico en los pacientes con EII enterocócica protésica. Aunque las mortalidades durante el ingreso fueron similares (el 35,6% para nativas y el 23,5% para protésicas; p=0,35), la mortalidad al final del seguimiento fue aproximadamente el doble en la nativa con respecto a la protésica (el 45,8 frente al 23,5%; p=0,10).
Comparación de la endocarditis infecciosa izquierda enterocócica sobre válvula nativa con la producida sobre válvula protésica
| Nativa (n=59) | Protésica (n=17) | p | |
| Edad (media) | 58,6 años | 67 años | 0,04 |
| Sexo (varón) , % | 79,7 | 64,7 | 0,21 |
| Enfermedad crónica debilitante, % | 81,4 | 52,9 | 0,02 |
| Índice de Charlson relacionado con la edad (media) | 3,1 puntos | 2,7 puntos | 0,38 |
| Relacionada con la asistencia sanitaria, % | 16,9 | 29,4 | 0,30 |
| Manipulación o foco infeccioso conocidos, % | 49,2 | 35,3 | 0,31 |
| Manipulación o foco urinario, % | 30,5 | 29,4 | 0,93 |
| Manipulación o foco abdominal, % | 11,9 | 5,9 | 0,67 |
| EII con afectación de la válvula aórtica, % | 62,7 | 64,7 | 0,88 |
| EII con afectación de la válvula mitral, % | 49,2 | 41,2 | 0,56 |
| Ecocardiografía transesofágica, % | 37,3 | 82,4 | 0,001 |
| Vegetaciones visualizadas en ecocardiografía, % | 81,4 | 64,7 | 0,18 |
| Absceso perivalvular en la ecocardiografía, % | 8,5 | 17,6 | 0,36 |
| Complicaciones intracardíacas*, % | 35,6 | 47,1 | 0,39 |
| Extensión perivalvular, % | 15,3 | 29,4 | 0,28 |
| Absceso, % | 13,6 | 23,5 | 0,44 |
| Fístula, % | 0 | 5,9 | 0,22 |
| Duración media de los síntomas previo al diagnóstico | 6 semanas | 5,3 semanas | 0,75 |
| Fenómenos inmunológicos, % | 11,9 | 5,9 | 0,67 |
| Fenómenos vasculares, % | 42,4 | 29,4 | 0,33 |
| Embolias sépticas o foco infeccioso metastásico, % | 40,7 | 29,4 | 0,39 |
| Embolia cerebral (con o sin hemorragia) , % | 25,4 | 11,8 | 0,33 |
| Fallo ventricular izquierdo, % | 42,4 | 41,2 | 0,92 |
| Fallo ventricular izquierdo grave, % | 20,3 | 11,8 | 0,72 |
| Desarrollo de insuficiencia renal, % | 36,2 | 23,5 | 0,32 |
| Shock séptico, % | 15,3 | 0 | 0,08 |
| Cirugía durante el ingreso, % | 37,3 | 35,3 | 0,88 |
| Cirugía tras el alta, % | 3,4 | 0 | 0,60 |
| Mortalidad durante el ingreso, % | 35,6 | 23,5 | 0,35 |
| Mortalidad en el ingreso o tras el alta, % | 45,8 | 23,5 | 0,10 |
| Recidiva, % | 6,8 | 5,9 | 1,00 |
Los pacientes con EII recibieron tratamiento antimicrobiano durante una media de 31,5 días (rango de 0 a 56 días, mediana de 28 días). De los 76 pacientes, 44 (57,9%) recibieron aminoglucósidos por 5 o más días (rango de 5 a 45 días, media de 26,8 días, mediana de 28 días). De estos 44 pacientes, 29 se trataron durante al menos 4 semanas, 2 pacientes se trataron durante 3 semanas, un paciente se trató durante 2 semanas y 2 pacientes se trataron durante menos de 2 semanas.
Las pautas de tratamiento antibiótico empleadas en la EII enterocócica fueron la pauta clásica de penicilina o vancomicina asociadas a un aminoglucósido (n=60; 78,9%), ampicilina más ceftriaxona (n=6; 7,9%) o pautas consideradas inapropiadas (n=10, 13,2%). Las pautas inapropiadas fueron monoterapia con una penicilina (n=4), monoterapia con penicilina con cambio posterior a vancomicina (n=1), monoterapia con vancomicina (n=1), ceftriaxona más aminoglucósido (n=1), monoterapia con imipenem (n=1), cloxacilina con cambio posterior a linezolid (n=1) y ningún antibiótico (diagnóstico en autopsia, n=1).
La mortalidad durante el ingreso de los pacientes tratados con una pauta considerada apropiada (la combinación clásica de una penicilina o vancomicina asociada a un aminoglucósido o bien la combinación de ampicilina y ceftriaxona) fue del 27,3% (18 pacientes de un total de 66), frente a un 70% (7 pacientes de un total de 10) de los tratados con una pauta inapropiada (p=0,01). No hubo diferencias significativas en la mortalidad durante el ingreso entre los pacientes tratados con la combinación clásica (16 pacientes de un total de 60, 26,7%) y la pauta de ampicilina más ceftriaxona (2 pacientes de un total de 6, 33,3%; p=0,66), ni tampoco en la mortalidad al final del seguimiento (el 36,7 frente al 33,3%; p=0,87). Quince de los 60 pacientes tratados con la pauta clásica (25%) tuvieron efectos secundarios (desarrollo de insuficiencia renal en 14 pacientes y toxicidad vestibular en un paciente) frente a ninguno de los pacientes tratados con la pauta de ampicilina más ceftriaxona.
En 5 pacientes con EII enterocócica (6,6%) se observó recidiva. Dos de estos pacientes se trataron con pautas inadecuadas (ceftriaxona más gentamicina y monoterapia con ampicilina, respectivamente) y 3 de estos pacientes se trataron con ampicilina y gentamicina (10, 14 y 42 días de gentamicina, respectivamente).
En 38 de los 76 pacientes con EII enterocócica se registraron los datos de sensibilidad a los antimicrobianos. No se detectó resistencia a ampicilina (incluido el aislamiento de E. faecium) ni a vancomicina. Se detectó resistencia de alto valor a estreptomicina en 6 de los 38 casos (15,7%), a gentamicina en 5 casos (13,1%), a ambos aminoglucósidos conjuntamente en 3 casos (7,8%) y a alguno de los 2 aminoglucósidos en 8 casos (21%).
DiscusiónEste estudio confirma las observaciones de otros trabajos en los que se describe que la endocarditis enterocócica es una enfermedad típica de pacientes de edad avanzada, con media o mediana de edad superior a 60 años6,7,9,13,17–19,21,22, y con manipulaciones o foco infeccioso en la zona urinaria11–13,16,17,21,26 o digestiva13,15,17–19.
Otras consideraciones que no están bien analizadas en la literatura médica deben comentarse. Estos pacientes tuvieron un porcentaje de enfermedad crónica debilitante previa a la EII enterocócica significativamente mayor que los pacientes con EII producida por otros microorganismos. Este dato, hasta ahora, en una comparación directa con la EII no enterocócica, sólo se había reflejado indirectamente en la literatura médica, al apreciar los investigadores del International Collaboration on Endocarditis que la EII enterocócica fue más frecuente en pacientes con cáncer9. Este hecho, junto con la mayor edad de estos pacientes, se tradujo en una mayor puntuación en el índice de Charlson relacionado con la edad. Como consecuencia de una mayor edad de los pacientes con EII enterocócica, la degeneración y calcificación valvular como valvulopatía predisponente estuvo presente con mayor frecuencia en la EII enterocócica que en la EII no enterocócica.
Al igual que otros autores, no se encontraron diferencias al comparar la EII enterocócica con la no enterocócica en cuanto al porcentaje de enfermedad valvular previa6 ni al porcentaje de EII adquirida en la comunidad o en relación a la asistencia sanitaria9. Aunque en un trabajo previo se describió un mayor porcentaje de endocarditis protésica en la EI enterocócica que en la no enterocócica (el 29 frente al 15%)6, esta diferencia no se apreció en este estudio.
Los hallazgos ecocardiográficos fueron similares en los 2 grupos. El porcentaje de casos con vegetaciones en la EII enterocócica (78%) fue similar al 71 y al 72% descritos en 2 estudios recientes en los que no se observaron diferencias con la endocarditis no enterocócica6,9. En el primero de estos estudios se apreció un porcentaje significativamente menor de valvulopatía congénita y de afectación mitral y un porcentaje mayor de afectación aórtica en la EII enterocócica que en la EII no enterocócica. Estas diferencias se dejaron intuir en este estudio, pero sin significación estadística (el 5 frente al 10% de valvulopatía congénita, el 47 frente al 54% de afectación mitral y el 63 frente al 55% de afectación aórtica).
En las series de endocarditis enterocócicas, la extensión perivalvular no se ha descrito bien. En un estudio focalizado en la detección de la extensión perivalvular de la EII (con ecocardiografía transesofágica en el 100% de los pacientes) en el que se incluían 25 episodios de EII enterocócica, se informó de un 36% de extensión perivalvular en estos 25 episodios de EII enterocócica (absceso o seudoaneurisma o fístula detectados por ecocardiografía, cirugía o autopsia)25. En las series de endocarditis enterocócicas se recogen tan sólo los porcentajes de abscesos perivalvulares detectados en la ecocardiografía. Los autores del International Collaboration on Endocarditis-Merged Database han informado de un 6% de abscesos en nativas y un 20% en protésicas, sin diferencias en ambos valores con respecto a la EII no enterocócica9,22. Un 7% de los abscesos perivalvulares en la EII enterocócica se recogió en otro estudio reciente21. En este trabajo el porcentaje de abscesos fue del 10,5% por ecocardiografía y del 15,8% por ecocardiografía o cirugía o necropsia, sin que se apreciaran diferencias con respecto a la EII no enterocócica en cuanto al porcentaje de extensión perivalvular de la infección ni de las distintas complicaciones intracardíacas.
En cuanto a las manifestaciones clínicas, los pacientes con EII enterocócica tuvieron menor porcentaje de manifestaciones cutáneas o vasculares periféricas (14%) que los pacientes con EII no enterocócica (27%), dato sospechado pero no confirmado hasta ahora12. El menor porcentaje de nódulos de Osler se tradujo en el menor porcentaje de fenómenos inmunológicos observados y la ausencia de manchas de Janeway ya se había descrito previamente11,12,26.
El porcentaje de fallo ventricular izquierdo y el porcentaje de episodios embólicos mayores en las series previas de EII enterocócica han oscilado, respectivamente, entre el 20 y el 47%9,11–13,18,19,21,22 y entre el 15 y el 44%9,12,13,18,19. En este trabajo, los porcentajes fueron del 42 y del 38%, respectivamente. Al igual que otros autores, estos porcentajes fueron similares a los de la EII no enterocócica9. También fue similar en los 2 grupos el porcentaje de desarrollo de insuficiencia renal y el de shock séptico, lo que no se había analizado previamente en la literatura médica.
El porcentaje de pacientes con EI enterocócica que fueron sometidos a cirugía valvular durante el ingreso ha oscilado en la literatura médica entre el 16 y el 43%6,9,15,18,20–22. En este estudio, las tasas de cirugía valvular durante el ingreso fueron similares en la EII enterocócica (37%) y la no enterocócica (38%), al igual que lo comunicado por otros autores (el 31 frente al 39% en nativas y el 31 frente al 41% en protésicas9,22). Sin embargo, tras el alta, menos pacientes con EII enterocócica fueron sometidos a cirugía en comparación a aquellos pacientes con EII no enterocócica (el 2,6 frente al 10%). Cabe destacar que a pesar de la mayor comorbilidad y edad de los pacientes con EII enterocócica, se observa que el porcentaje de episodios con indicación de cirugía donde ésta no pudo realizarse por las condiciones del paciente fue similar que en la EII no enterocócica.
La tasa de mortalidad de la EI enterocócica durante el ingreso ha oscilado ampliamente (entre el 9 y el 47%) en los distintos estudios publicados6,9,13,17–22, y hay pocos datos sobre su mortalidad tardía tras el alta. En esta amplia oscilación de cifras ha influido sin duda el porcentaje de pacientes que recibe en cada estudio un tratamiento antimicrobiano considerado adecuado y el tipo de hospital en el que se realiza el estudio. En este trabajo la mortalidad durante el ingreso fue del 33%, elevándose al 41% al final del período de seguimiento, sin diferencias respecto a la EII no enterocócica. Esta diferencia en un 8% entre la mortalidad al final del seguimiento y la de la fase aguda fue similar al 6% que se encontró en otro trabajo13.
Aunque se produjo una disminución llamativa de la mortalidad durante el ingreso en los últimos 5 años del estudio (del 32,9 al 25%) ambas cifras son muy superiores a las encontradas en las series más amplias de EII enterocócica sobre válvula nativa y protésica (que los investigadores del Internacional Collaboration on Endocarditis han publicado con una mortalidad del 11% para la nativa y del 14% para la protésica)9,22. Hay que tener en cuenta que los hospitales participantes en el Internacional Collaboration on Endocarditis son todos de tercer nivel y con muy amplia experiencia en el manejo diagnóstico-terapéutico de la EI, lo que puede influir sin duda en las diferencias con respecto a la mortalidad durante el ingreso entre esta serie y las otras 2 mencionadas. Otros factores pueden haber influido en la relativa alta tasa de mortalidad durante el ingreso encontrada en esta serie: alto porcentaje de pacientes con enfermedades debilitantes crónicas (75%) y elevado índice de Charlson (media de 3 puntos); retrasos en el diagnóstico (duración media de los síntomas de 5,8 semanas), con un alto porcentaje de complicaciones intracardíacas (38,2%), un alto porcentaje de fallo ventricular izquierdo grave (18%) y relativamente alto de shock séptico (11,8%) cuando se compara con la EII por EGV; empleo de pautas de antimicrobianos consideradas no apropiadas (13,2%) y episodios con indicación de cirugía donde ésta no se llevó a cabo por diversos motivos (14,5%).
Los porcentajes de recidiva en la endocarditis enterocócica recogidos en la literatura médica oscilan entre el 3 y el 12,5%6,17–21. Sólo un estudio previo refleja los porcentajes de recidiva en la EI enterocócica y la no enterocócica (el 3 frente al 1%, sin realizar una comparación estadística)6. En este trabajo, 5 pacientes presentaron recidivas (6,6%), estadísticamente superior al 2,3% de la EII no enterocócica. Es de destacar que en 4 de las 5 recidivas, los pacientes no habían recibido tratamiento con aminoglucósidos o éste había sido de una duración inferior a la clásicamente aconsejada de 4 a 6 semanas27.
De la comparación efectuada entre la EII enterocócica, la producida por EGV y la producida por S. aureus, queda claro que la EII enterocócica tiene un pronóstico que se sitúa entre el de la mucho más benigna EII producida por EGV y el de la más agresiva EII producida por S. aureus, lo que se refleja sobre todo en los porcentajes de mortalidad en el ingreso (el 32,9, el 9,3 y el 48,6%, respectivamente).
En este estudio los pacientes con EII enterocócica protésica, con respecto a aquellos pacientes con EII nativa, tuvieron mayor edad, el doble de extensión perivalvular de la infección y una mortalidad durante el ingreso parecida (el 23,5% para protésicas y el 35,6% para nativas; p=0,35), hallazgos ya descritos por los investigadores del Internacional Collaboration on Endocarditis22. Aunque sin diferencia estadísticamente significativa, es de destacar que la mortalidad al final del seguimiento de la EII enterocócica nativa en este estudio fue aproximadamente el doble que la de la protésica (el 45,8 frente al 23,5%; p=0,10), lo que guarda relación con el mayor porcentaje de enfermedad crónica debilitante previa registrado en estos pacientes (el 81,4 frente al 52,9%; p=0,02).
Una combinación de 2 betalactámicos (ampicilina más ceftriaxona durante 6 semanas) se ha postulado como el tratamiento de elección para los pacientes con EI enterocócica con alto nivel de resistencia a aminoglucósidos o como una alternativa razonable para los pacientes con EI enterocócica sin alto valor de resistencia a aminoglucósidos que tienen un riesgo aumentado de nefrotoxicidad21. En este estudio, 6 pacientes recibieron esta pauta, sin que hubiera diferencia significativa en cuanto a la mortalidad durante el ingreso ni al final del seguimiento entre la pauta de una penicilina o vancomicina asociadas a un aminoglucósido frente a la pauta de ampicilina más ceftriaxona. Esta última pauta además no presentó efectos secundarios frente a un 25% de los efectos secundarios (insuficiencia renal en 14 pacientes y toxicidad vestibular en otro) con la pauta clásica.
El porcentaje de aislamientos microbiológicos de enterococo con alto valor de resistencia a gentamicina varía enormemente de un país a otro28, y en bacteriemias y en infecciones serias enterocócicas está relacionado claramente con la nosocomialidad, la estancia previa en UCI y el empleo de un tratamiento antibiótico previo (glucopéptidos, quinolonas, imipenem y cefalosporinas, por orden decreciente de riesgo)29,30. En series de EI enterocócica, los datos sobre la prevalencia de alto nivel de resistencia a gentamicina son muy escasos. Sólo 2 de los 27 episodios de EI enterocócica en un estudio reciente (un 7,4%) mostraron alto nivel de resistencia a gentamicina31. Esta cifra contrasta con las obtenidas en otro estudio, el cual describió para E. faecalis un 18% de resistencias de alto nivel a gentamicina (6 de 33 bacteriemias asociadas a EI)7. En este estudio, la resistencia de alto nivel a gentamicina se produjo en 5 de 38 episodios de EII enterocócica (13,1%) que tenían disponibles los datos de sensibilidad a los antimicrobianos.
Pese a que este estudio tiene la limitación del largo período de recogida de casos, los autores piensan que contribuye a mejorar los conocimientos sobre la EII enterocócica y sobre las peculiaridades que la hacen diferente al resto de las EII. Estudios con mayor número de pacientes a los publicados hasta ahora son necesarios para dilucidar muchas incógnitas con respecto a la duración óptima del tratamiento antimicrobiano, los factores de riesgo asociados a la recidiva y el pronóstico de la resistencia de alto nivel a gentamicina en la EI enterocócica, donde la pauta de ampicilina más ceftriaxona podría consolidarse como la pauta de elección.
FinanciaciónFinanciado por el Ministerio de Sanidad y Consumo, Instituto de Salud Carlos III-FEDER, Red Española de Investigación en Patología Infecciosa (REIPI RD06/0008).