La incidencia del derrame pleural paraneumónico, incluyendo el empiema, ha sufrido variaciones en las últimas décadas, que se han relacionado con la implantación de distintos tipos de vacuna antineumocócica conjugada.
MétodosSe han revisado retrospectivamente los datos de los 10 hospitales públicos de la provincia de Alicante (España), que abarcan una población de 279.000 niños menores de 15 años, entre 2010 y 2018. Se desglosaron los derrames menores de 10mm (DP−) y los de 10mm o más (DP+).
ResultadosSe han analizado 366 episodios de derrame pleural paraneumónico, 178 DP− (48,6%) y 188 DP+ (51,4%), con una mediana de edad de 4 años (rango intercuartílico: 2-7 años) y una evidente estacionalidad con máximo en invierno y mínimo en verano. Se identificó al agente etiológico por cultivo en 34 pacientes (9,3%), destacando Streptococcus pneumoniae (24 pacientes) seguido por Streptococcus pyogenes (7 pacientes). El serotipo de S. pneumoniae más frecuente fue el 19A (6 pacientes) y se han identificado 3 fallos vacunales. La tasa anual media de incidencia fue de 14,3 casos por 100.000 menores de 15 años (7,0 para DP− y 7,3 para DP+), sin cambios significativos a lo largo del tiempo, aunque sí se apreciaron diferencias marcadas de la incidencia entre los distintos departamentos sanitarios.
ConclusionesNo hemos encontrado variaciones temporales en la incidencia del derrame paraneumónico pese a la implementación de la vacuna antineumocócica conjugada de 13 serotipos. Es destacable la variabilidad de la incidencia entre departamentos vecinos sin motivo aparente.
The reported incidence of parapneumonic pleural effusion, including empyema, has shown fluctuations in the last decades. It has been related to the implementation of different types of conjugate pneumococcal vaccines.
MethodsWe have retrospectively reviewed data from all 10 public hospitals in Alicante Province (Spain) covering a population of 279,000 children under 15 years of age, between 2010 and 2018. Effusions less than 10mm (PE−) and those of 10mm or more (PE+) were separated.
ResultsA total of 366 episodes of parapneumonic pleural effusion have been analyzed, 178 PE− (48.6%) and 188 PE+ (51.4%), with a median age of 4 years (interquartile range: 2-7 years) and marked seasonality with the maximum in winter and the minimum in summer. A culture proven bacterial agent was identified in 34 patients (9.3%), mainly Streptococcus pneumoniae (24 patients) followed by Streptococcus pyogenes (7 patients). The most frequent S. pneumoniae serotype was 19A (6 patients) and 3 vaccine failures were observed. The mean annual incidence rate was 14.3 cases per 100,000 children under 15 years of age (7.0 for PE− and 7.3 for PE+). No significant changes were observed in incidence over time, but noticeable differences in incidence were observed in different health departments.
ConclusionsWe have not found temporal variations in incidence of parapneumonic effusion despite the implementation of the 13-valent pneumococcal conjugate vaccine. The unexplained disparity in incidence between close departments is noteworthy.
El derrame pleural paraneumónico, incluyendo el empiema (DP/E), es la complicación más frecuente de la neumonía en niños, y Streptococcus pneumoniae es su principal agente causal1. Su incidencia no es bien conocida y puede sufrir variaciones de carácter geográfico y temporal. En las últimas décadas se había observado un aparente aumento de la incidencia del empiema, tanto en niños como en adultos, en España y en otros lugares del mundo2–4. Aunque se había especulado con su relación con la introducción de la vacuna antineumocócica conjugada de 7 serotipos (VNC7) a partir del año 2000, por el predominio de infecciones por serotipos no incluidos en esa vacuna, el aumento ya se había observado antes de su introducción, por lo que las causas de ese incremento no están aclaradas. Otros estudios más recientes han observado una disminución de la incidencia del DP/E en la última década, relacionada con la introducción de la vacuna antineumocócica conjugada de 13 serotipos (VNC13)5–8, aunque existen trabajos discordantes9.
Nuestro grupo ha realizado una revisión retrospectiva de todos los pacientes hospitalizados por DP/E en el ámbito bien definido de una provincia entre 2010 y 2018. Algunos aspectos clínicos y terapéuticos han sido publicados previamente10. El objetivo del trabajo actual es conocer las características epidemiológicas de los pacientes y calcular la incidencia de DP/E y su evolución temporal en una cohorte completa de base poblacional. Merece tenerse en cuenta que la vacuna antineumocócica conjugada de 10 serotipos se autorizó en 2009, que la VNC13 se autorizó en 2010 y que esta última se incluyó en el calendario de vacunación sistemática en la Comunidad Valenciana con financiación pública para todos los nacidos a partir del 1 de enero de 2015.
MétodosHospitales participantes y ámbito geográficoParticiparon en el estudio los 10 hospitales del sistema sanitario público de la provincia de Alicante, que sirven de referencia a sus respectivos departamentos sanitarios y que abarcan la totalidad de la población de la provincia. Según los datos del Instituto Nacional de Estadística, la población anual media de la provincia durante el periodo del estudio ha sido de 279.031 menores de 15 años, con un discreto descenso progresivo desde un máximo de 284.640 en 2011 a un mínimo de 272.818 en 2018. Todos los pacientes en edad pediátrica tienen derecho a ser atendidos en los 10 hospitales de la red pública. La hospitalización pediátrica en hospitales privados es infrecuente y los pacientes son trasladados a hospitales públicos cuando padecen enfermedades que requieren atención compleja o prolongada.
Selección de los pacientesLos servicios de admisión de los hospitales participantes elaboraron un listado de los episodios que cumplían los siguientes criterios:
- -
Hospitalización ocurrida entre 2010 y 2018, ambos inclusive.
- -
Pacientes menores de 15 años de edad.
- -
Diagnóstico de derrame pleural o empiema, ya sea como diagnóstico principal o secundario, de causa infecciosa o no. Se seleccionaron los pacientes con los códigos diagnósticos CIE9: 510.0, 510.9, 511.1, 511.81, 511.89, 511.9; o CIE10: J86.0, J86.9, J90, J91, J91.8.
Estos ingresos hospitalarios fueron revisados individualmente para excluir los casos de derrame pleural de causa no infecciosa y los de causa tuberculosa.
VariablesSe registró el sexo, la edad (en años cumplidos), el año y mes del ingreso, y el lugar de residencia. Se consideraron de origen nosocomial los episodios de neumonía que se iniciaron durante un ingreso hospitalario por otro motivo. El tamaño del DP/E se clasificó en 2 grupos, en función del grosor máximo observado en cualquiera de las pruebas de imagen (radiografía de tórax, ecografía o tomografía computarizada) practicadas durante la hospitalización: DP/E menor de 10mm (DP−) y DP/E de 10mm o mayor (DP+). Se registraron los resultados del hemocultivo y del cultivo del líquido pleural. El agente etiológico se consideró fiable cuando se informó del crecimiento de bacterias típicamente patógenas, excluyendo las bacterias posiblemente contaminantes o dudosamente patógenas. Se ha revisado el antibiograma y el serotipado de las cepas de Streptococcus pneumoniae aisladas en los cultivos, así como el estado vacunal de los pacientes en los que se aisló esta bacteria. No se han considerado los resultados de otras pruebas microbiológicas distintas del cultivo por ser realizadas con escasa y distinta frecuencia en los hospitales participantes.
Análisis estadísticoLos datos obtenidos se procesaron mediante el programa SPSS® v22. Se calculó la frecuencia y porcentaje para las variables cualitativas y la mediana y rango intercuartílico para las cuantitativas. Para calcular la tasa anual de incidencia (TAI) se utilizó, en el numerador, el número de pacientes que cumplían los criterios de inclusión cada año y que residían en alguno de los departamentos sanitarios de la provincia de Alicante, excluyendo los pacientes que residían fuera de la provincia. En el denominador se calculó la población anual menor de 15 años de la provincia como la media de la población registrada entre el 1 de enero de ese año y el 1 de enero del año siguiente, con los datos obtenidos del Instituto Nacional de Estadística (www.ine.es). Para calcular la TAI por departamentos se utilizó, en el denominador, la media de los datos mensuales de población menor de 15 años para cada departamento y cada año, obtenidos del Sistema de Información Poblacional del sistema sanitario de la Comunidad Valenciana. Se realizó la prueba χ2 de Pearson para el análisis de las variables cualitativas y la prueba U de Mann-Whitney para las comparaciones entre variables cuantitativas. Para determinar la relación entre las TAI de los DP+ y DP− en los distintos departamentos se calculó el coeficiente de correlación lineal de Pearson (r). Los contrastes de hipótesis fueron bilaterales, con una significación de 0,05.
ÉticaEl estudio fue aprobado por el Comité Ético de Investigación con Medicamentos del Departamento de Salud de Alicante - Hospital General.
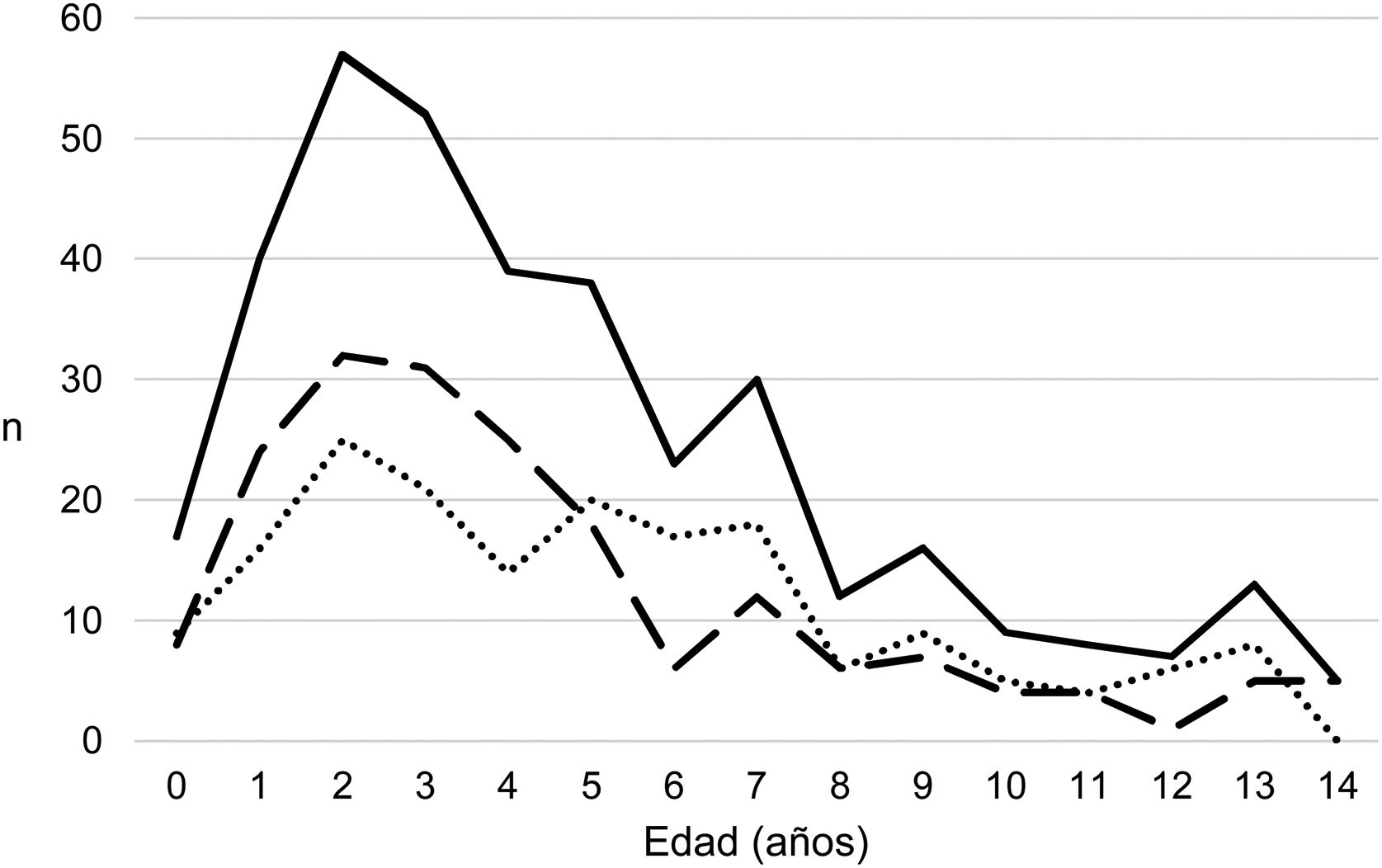
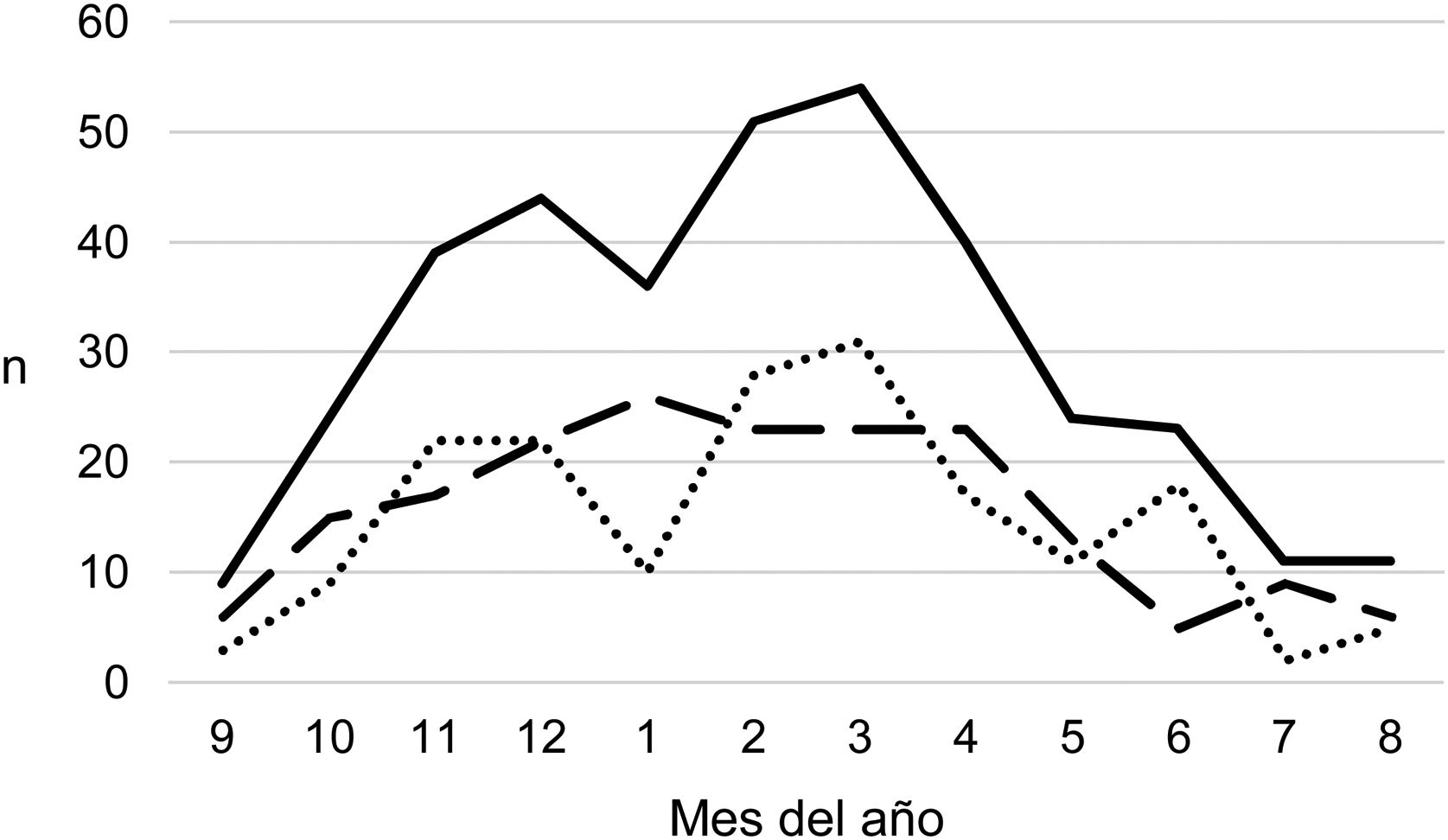
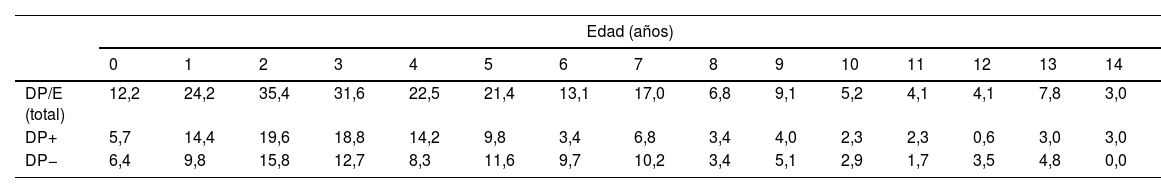
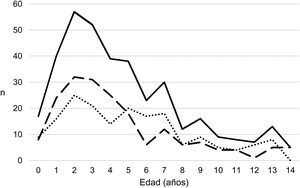
ResultadosSe han recogido 366 episodios de DP/E que cumplían los criterios de inclusión, de los que 361 casos se consideraron comunitarios y 5 (1,4%) de origen nosocomial. Solo un paciente presentó 2 episodios dentro del periodo del estudio, separados por casi 3 años, y sus datos se han analizado como episodios independientes. De los 366 episodios, 178 (48,6%) correspondían a un DP− y 188 (51,4%) a un DP+. Había un discreto predominio de varones (54,6%, p=0,076) y la mediana de edad fue de 4 años (rango intercuartílico: 2-7 años). Como se observa en la figura 1, el 62% de los pacientes tenía entre uno y 5 años de edad y el 76% entre uno y 7 años, siendo menor la edad de los pacientes con DP+ que la de los DP− (mediana de 3 frente a 5 años, p=0,030). No había diferencias en el tamaño de los derrames entre hombres y mujeres (p=0,229). Se observaba una clara estacionalidad de los DP/E, con el máximo en invierno y el mínimo en verano (fig. 2). Se recuperó el resultado del hemocultivo de 296 pacientes, de los que 47 fueron positivos, pero solo 27 (9,1%) se consideraron fiables. Se obtuvo el resultado del cultivo del líquido pleural de 63 pacientes, obteniéndose un crecimiento en 15, de los que 11 (17,5%) se consideraron fiables. Se identificó un agente etiológico fiable en 34 pacientes: 7 con DP− (3,9%) y 27 con DP+ (14,4%) (p=0,001). Los agentes identificados fueron Streptococcus pneumoniae en 24 pacientes (17 por hemocultivo, 5 en líquido pleural y 2 en ambos cultivos), Streptococcus pyogenes en 7 (4 por hemocultivo, uno en líquido pleural y 2 en ambos cultivos), y Staphyloccus aureus (hemocultivo), Haemophilus influenzae (líquido pleural) y Pseudomonas aeruginosa (hemocultivo en paciente afecto de leucemia mieloide) en un paciente cada uno. En otros 22 pacientes se obtuvo el crecimiento de gérmenes de dudosa patogenicidad, posiblemente contaminantes, principalmente Staphylococcus hominis y Staphylococcus epidermidis. Los serotipos de Streptococcus pneumoniae observados fueron: 19A (6 aislamientos), 1 (3 aislamientos), 3 (3 aislamientos), 7F (2 aislamientos), 33F (2 aislamientos), 6A y 6C (un aislamiento cada uno), siendo desconocido en los 6 casos restantes. De los pacientes con aislamiento de Streptococcus pneumoniae, 5 habían recibido la VNC7 (con pauta incompleta en un caso), todos ellos ingresados entre 2010 y 2011, y 8 habían recibido la VNC13 (con pauta incompleta en 2 casos), todos ellos ingresados entre 2013 y 2017. No estaban vacunados frente a Streptococcus pneumoniae 9 pacientes, mientras que se desconocía el dato en 2 pacientes. Tres de los pacientes correctamente vacunados con VNC13 tuvieron una infección por serotipos de Streptococcus pneumoniae teóricamente cubiertos por la vacuna: 3, 7F y 19A, respectivamente. De los 24 aislamientos de Streptococcus pneumoniae, 15 eran sensibles a penicilina, 5 tenían algún grado de resistencia (4 del serotipo 19A y uno de serotipo desconocido) y en 4 este dato era desconocido, mientras que 18 eran sensibles a cefotaxima, uno tenía una resistencia intermedia (serotipo 19A) y en 5 el dato era desconocido.
Distribución del número de casos de derrame pleural paraneumónico y empiema por edades. Con línea continua se representan los casos totales, con línea intermitente se representan los casos con grosor de 10mm o mayor, y con línea de puntos se representan los casos con grosor menor de 10mm.
Distribución del número de casos de derrame pleural paraneumónico y empiema por meses del año, comenzando por el mes 9 (septiembre). Con línea continua se representan los casos totales, con línea intermitente se representan los casos con grosor de 10mm o mayor, y con línea de puntos se representan los casos con grosor menor de 10mm.
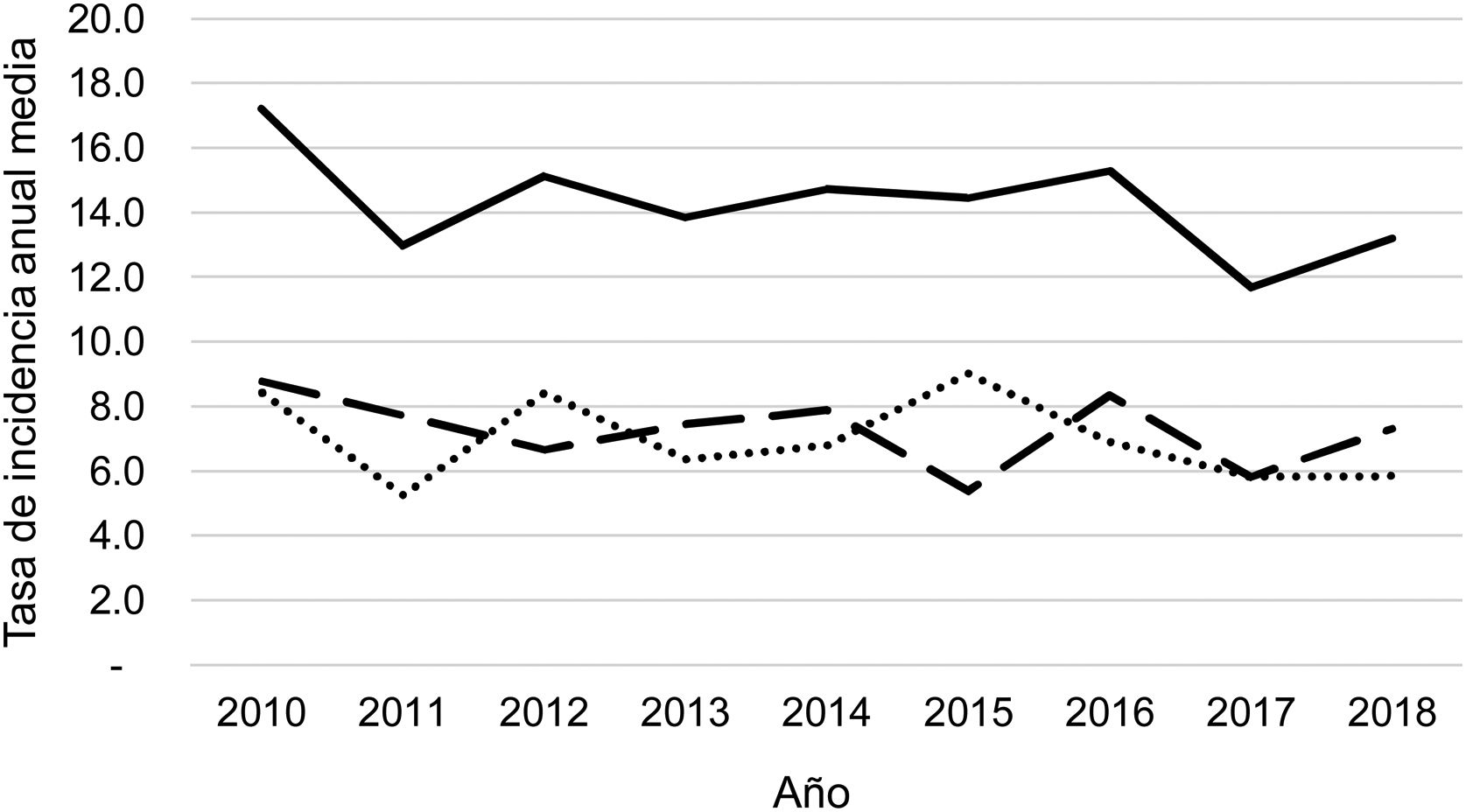
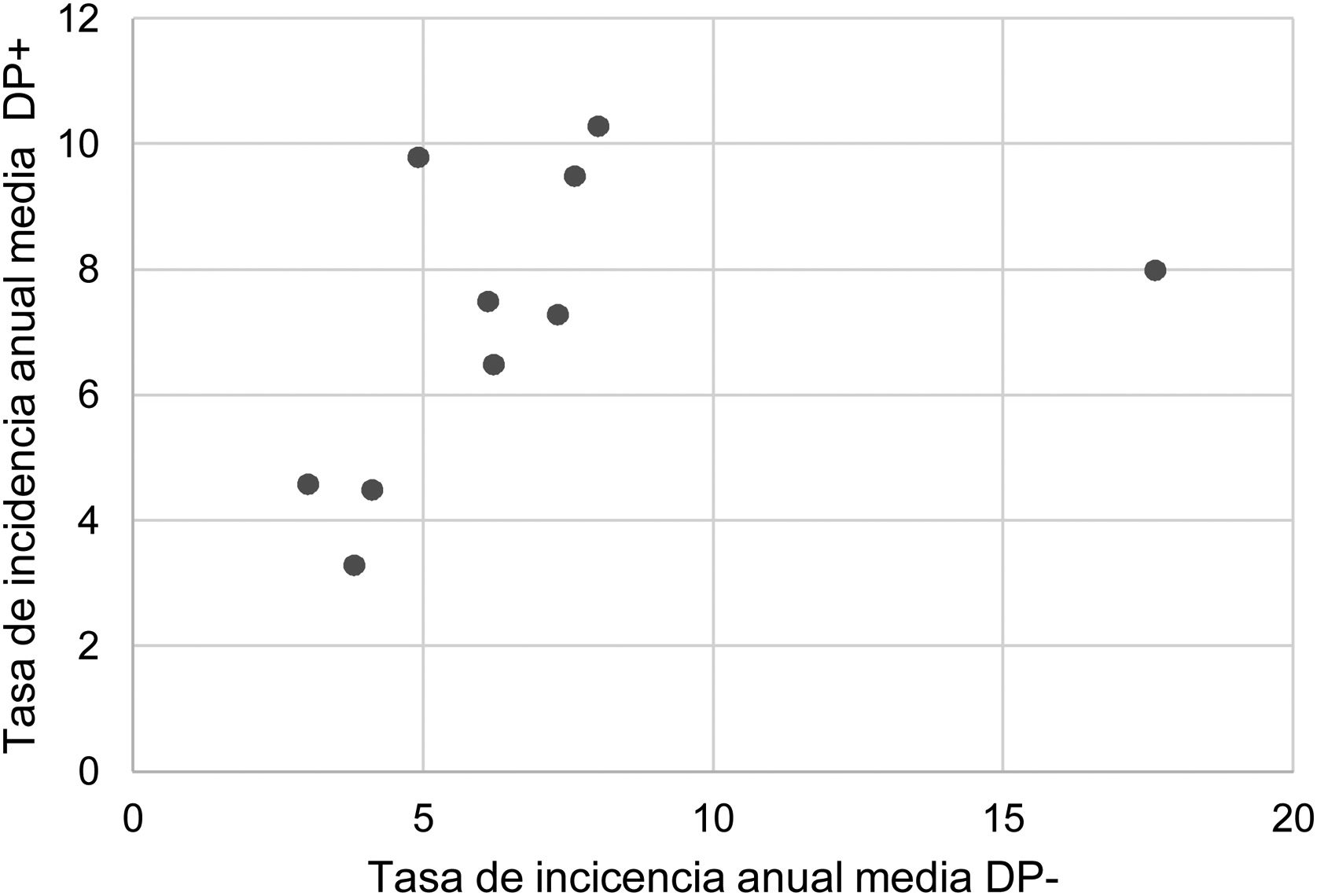
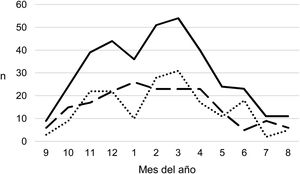
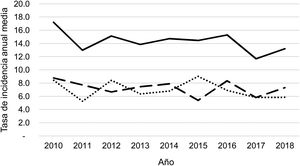
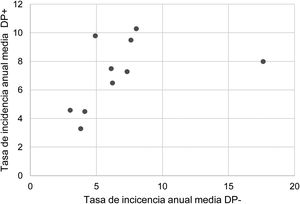
Durante el periodo del estudio ingresaron una media de 41 pacientes con DP/E por año (máximo 50 en 2010 y mínimo 33 en 2017). Para calcular las TAI se han analizado los datos de 359 episodios, tras excluir a 7 pacientes que residían fuera de la provincia de Alicante. La TAI media de DP/E en residentes en la provincia de Alicante entre 2010 y 2018 ha sido de 14,3 casos por 100.000 niños y adolescentes menores de 15 años, correspondiendo 7,0 por 100.000 para DP− y 7,3 por 100.000 para DP+. Como se observa en la figura 3, la TAI se ha mantenido relativamente estable o discretamente descendente a lo largo de los años del estudio, tanto de manera global como al desglosar los derrames pequeños y los grandes. La tasa de incidencia por edades se muestra en la tabla 1, teniendo una distribución algo diferente para DP+ y DP−, superponible a la observada en la figura 1. Se observó una amplia variación de la TAI media en los departamentos sanitarios de la provincia, oscilando entre 7,1 y 25,6 por 100.000 menores de 15 años. En la figura 4 se observa la marcada relación entre las TAI de pacientes con DP− y DP+ en los distintos departamentos sanitarios, excepto en uno de ellos, que mostraba una discordantemente elevada TAI de DP−. Al suprimir los datos de este departamento discordante, se comprobaba la marcada correlación positiva entre las TAI de DP− y DP+ (r=0,769, p=0,015), que desaparecía al incluir también los datos de ese departamento (r=0,429, p=0,216).
Tasa anual de incidencia de derrame pleural paraneumónico y empiema (casos por 100.000 habitantes menores de 15 años) durante los años del estudio, calculada sobre la población residente. Con línea continua se representan los casos totales, con línea intermitente se representan los casos con grosor de 10mm o mayor, y con línea de puntos se representan los casos con grosor menor de 10mm.
Tasa de incidencia anual media (por 100.000) de derrame pleural paraneumónico distribuida por edades
| Edad (años) | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | |
| DP/E (total) | 12,2 | 24,2 | 35,4 | 31,6 | 22,5 | 21,4 | 13,1 | 17,0 | 6,8 | 9,1 | 5,2 | 4,1 | 4,1 | 7,8 | 3,0 |
| DP+ | 5,7 | 14,4 | 19,6 | 18,8 | 14,2 | 9,8 | 3,4 | 6,8 | 3,4 | 4,0 | 2,3 | 2,3 | 0,6 | 3,0 | 3,0 |
| DP− | 6,4 | 9,8 | 15,8 | 12,7 | 8,3 | 11,6 | 9,7 | 10,2 | 3,4 | 5,1 | 2,9 | 1,7 | 3,5 | 4,8 | 0,0 |
DP/E: derrame pleural paraneumónico, incluyendo el empiema; DP+: derrame pleural paraneumónico de grosor igual o superior a 10mm; DP−: derrame pleural paraneumónico de grosor menor de 10mm.
Correlación entre las tasas de incidencia anual media de DP− y DP+ en los 10 departamentos del estudio, expresadas en casos por 100.000 habitantes menores de 15 años. Cada punto representa un departamento sanitario. Se observa la marcada correlación positiva entre la detección de DP− y DP+ excepto en un departamento, donde la tasa de DP− (pero no de DP+) es discordantemente elevada.
Como en la mayoría de las series, hemos observado un discreto predominio del sexo masculino, con mayor incidencia de DP/E en niños en edad preescolar, más acentuada para los DP+5,7,9,11–23. La distribución estacional se mostraba concordante con otros estudios, con un máximo durante el invierno-primavera y un mínimo en verano11,13,15,19,21. Aunque en la mayoría de los pacientes no se pudo identificar el agente causal, Streptococcus pneumoniae fue el germen más frecuentemente aislado, seguido de Streptococcus pyogenes, similar a lo observado en la mayoría de los trabajos1–3,5,7,9,13,14,16,17,20,24–26. Staphylococcus aureus apenas fue detectado en nuestros pacientes, frente a lo encontrado en algunas poblaciones12,15,18,22,23,27. Los serotipos de Streptococcus pneumoniae observados en nuestros pacientes coinciden con los reflejados en muchos trabajos2–9,13–16,24,25,28–31. Aunque la mayoría de los aislamientos fueron sensibles a penicilina, el serotipo 19A, predominante en nuestra serie, estaba claramente asociado a la resistencia a penicilina, como ha sido descrito en otros estudios4,6,24.
La incidencia de DP/E en la provincia de Alicante se ha mantenido relativamente estable durante casi una década interpandémica, tras la pandemia de gripe de 2009 y antes de la de coronavirus de 2020, coincidiendo con el periodo de implementación de la VNC13. Hemos diferenciado los casos de DP−, que suelen ser menos graves y con mayor probabilidad de no ser detectados, de los DP+, que corresponderían en gran medida a derrames complejos y empiemas10. Estos últimos representan el espectro más grave de la enfermedad, por lo que su hospitalización, detección y registro debería estar menos expuesta a sesgos entre hospitales. La TAI se repartió aproximadamente por partes iguales entre los DP+ y DP−, sin observarse cambios en la tendencia en ninguna de las 2.
El efecto de la introducción de las vacunas antineumocócicas conjugadas sobre la incidencia de DP/E durante las últimas 2 décadas es controvertido. Tras la introducción de la VNC7 se observó un aumento de la incidencia del empiema relacionado en parte con el reemplazo de las infecciones neumocócicas por serotipos no incluidos en la vacuna, aunque dicho aumento se había observado también antes de la introducción de la vacuna y podría deberse a otras causas, incluyendo la mejora de los medios de diagnóstico2–5,11,12,20,26–29,32,33. Tras la introducción de la VNC13 la mayoría de los trabajos han observado un descenso de la incidencia del derrame pleural y del empiema, especialmente en los niños de menor edad5–8,22,28,33–35, aunque otros autores presentan resultados discordantes que se han relacionado con una posible baja eficacia frente a algún serotipo cubierto por la VNC13, especialmente el serotipo 37,9,13,15,30,31. En nuestra serie, 3 pacientes correctamente vacunados con la VNC13 han presentado infecciones por serotipos incluidos en la vacuna, como se ha observado en otros estudios5,15,25,28,30,31.
No resulta fácil comparar nuestras tasas de incidencia con la de otros trabajos, realizados en distintos ámbitos geográficos o temporales, debido a diferencias metodológicas, incluyendo diferentes medios diagnósticos, criterios de inclusión o definiciones del DP/E2,3. Nuestra TAI media de DP/E está cercana a la calculada en Navarra entre 1995 y 2014 (16,1 casos por 100.000 menores de 15 años), aunque en Navarra sí se observaron importantes variaciones a lo largo del tiempo, con un aumento de 6,2 a 25,6 por 100.000 tras la introducción de la VNC7 y una caída progresiva hasta 12,01 por 100.000 tras la introducción de la VNC135. Nuestra TAI es algo inferior a los 18,17 casos por 100.000 menores de 18 años encontrados en un estudio realizado entre 2009 y 2018 en Alemania, donde se observó un descenso tras la introducción de la VNC13, seguido de un nuevo aumento en los años siguientes36. Muchos de los estudios seleccionan pacientes con derrames complejos o empiemas, parcialmente asimilables a nuestros pacientes con DP+. Entre 2010 y 2017 la incidencia de este tipo de derrames en Alemania osciló entre 1,4 y 1,8 casos por 100.000, sin cambios significativos en la tendencia13. Tras la implantación de la VNC13 la TAI de empiema se redujo en EE. UU. para estabilizarse en torno a 2 casos por 100.000 niños34, mientras que en Australia la TAI aumentó de 1,4 a 1,8 casos por 100.0009. Un aspecto destacable de nuestro trabajo es el hallazgo de una amplia variabilidad en las tasas de DP/E en los distintos departamentos de la provincia, sin que sea fácil encontrar una explicación. La concordancia observada entre las tasas de DP− y DP+ demuestra que esas diferencias son reales, por el menor riesgo de sesgo de detección de los DP+, mientras que la elevada TAI de los DP− en uno de los departamentos puede deberse al sobrediagnóstico de este tipo de derrames en ese hospital. Pocos estudios han señalado la presencia de diferencias regionales en la incidencia de empiema pleural en niños18,23. En general, los estudios realizados en distintos lugares del mundo muestran las amplias variaciones en la TAI por DP/E6,12,19,22,23,28,33,35.
Nuestro trabajo tiene limitaciones similares a la mayoría de los estudios publicados, por su carácter retrospectivo y por depender de la calidad de los registros hospitalarios. El tamaño del derrame se determinó con distintas técnicas de imagen en cada paciente. Sin embargo, la distinción entre un grosor mayor o menor de 10mm es relativamente sencilla con la radiografía de tórax, que suele ser la única prueba practicada en los derrames más pequeños. Aunque no se dispone de los datos de vacunación de todos los pacientes incluidos, es evidente que la tasa de vacunación con VNC13 ha tenido que aumentar progresivamente durante el periodo del estudio, especialmente tras su introducción en el calendario de vacunas financiadas por el sistema sanitario público. Una limitación importante de nuestro trabajo es el desconocimiento del agente etiológico en la mayoría de nuestros pacientes, por la conocida baja rentabilidad de los hemocultivos y por no ser precisa la obtención de líquido pleural en muchos de nuestros casos7,9,10,13,24–26. Aunque Streptococcus pneumoniae sigue siendo el germen más detectado, la baja tasa de aislamiento bacteriano limita las conclusiones que se puedan extraer en relación con los serotipos predominantes y la resistencia a antibióticos, así como el impacto de la vacunación. A pesar de estas limitaciones, nuestra revisión exhaustiva de todos los pacientes ingresados con cualquier tipo de derrame pleural nos ha permitido minimizar la posibilidad de pérdida de pacientes por errores de codificación en una población completa de cerca de 280.000 niños menores de 15 años de edad durante 9 años. Otros estudios han englobado poblaciones menos delimitadas y han incluido solo los pacientes con código diagnóstico de derrame pleural paraneumónico o de empiema, a pesar de que la distinción entre estas entidades no está bien definida y de que su codificación puede depender de criterios locales o de otros factores como las técnicas de imagen o la obtención de líquido pleural, que no siempre se realizan12.
En conclusión, el DP/E afecta especialmente a niños de corta edad durante los meses de invierno y Streptococcus pneumoniae es el principal agente identificado. La incidencia del DP/E en la población pediátrica de nuestra provincia no ha sufrido variaciones significativas en la última década, pese a la introducción de la VNC13. Es llamativa la amplia variabilidad de la tasa de incidencia entre departamentos cercanos, que no resulta fácil de explicar, pero que es coherente con las diferencias encontradas en otros trabajos en diversos ámbitos geográficos. Nuestros datos pueden servir de referencia para estudios realizados con la misma metodología en otros lugares o momentos, y así conocer la influencia de diversos factores como la introducción de vacunas o los brotes epidémicos o pandémicos por agentes infecciosos.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.