Haemophilus influenzae (Hi) causa infecciones leves e invasivas graves, especialmente en niños menores de 5 años. El serotipo b (Hib) era muy frecuente antes de la introducción de la vacuna, que en Paraguay se introdujo en 2004.
MétodosSe estudiaron por métodos microbiológicos convencionales y técnicas moleculares 523 aislados de H. influenzae obtenidos desde 1999 a 2017 y remitidos al Laboratorio Nacional de Referencia de Paraguay.
ResultadosEl serotipo más frecuente fue el no-tipable (HiNT), en un 51,8% (271/523), seguido de Hib (43%; 225/523), Hia e Hif (1,5%; 8/523, respectivamente), Hic (1%; 5/523), Hie (0,8%; 4/523) y Hid (0,4%; 2/523). El 48,4% de las infecciones invasivas estaban causadas por HiNT y el 46,1% por Hib. El 88,6% de las cepas procedían de casos de meningitis, el 70,8% de sepsis y el 50,9% de neumonías en niños menores de 5 años. El 84% (181/217) de las cepas correspondían a enfermedades invasivas causadas por Hib en menores de 5 años, registrándose la mayor proporción entre 2001-2003. Los biotipos más prevalentes fueron el biotipo I (29%), biotipo II (12%), biotipo III (24%) y biotipo IV (13%). El 13% (68/523) de los aislados fueron resistentes a la ampicilina.
ConclusiónTras de la introducción de la vacuna frente a Hib en Paraguay, los casos de enfermedad invasiva por Hib disminuyeron en niños menores de 5 años y hubo un aumento de HiNT en los mayores de 5 años. Es necesaria una vigilancia continua para monitorizar la eficacia de la vacuna y desarrollar intervenciones preventivas.
Haemophilus influenzae is a cause of mild and severe invasive infections, especially among children under 5 years old. Serotype b (Hib) was very frequent before the introduction of the vaccine, which was introduced in Paraguay in 2004.
MethodsA total of 523 isolates of H. influenzae obtained from 1999 to 2017 and referred to the National Reference Laboratory in Paraguay were studied by conventional microbiological methods and molecular techniques.
ResultsThe most frequent serotype was non-typeable (HiNT) (51.8%; 271/523), followed by Hib (43%; 225/523), Hia and Hif (1.5%; 8/523, respectively), Hic (1%; 5/523), Hie (0.8%; 4/523), and Hid (0.4%; 2/523). A total of 48.4% invasive infections were caused by HiNT, and 46.1% by Hib; 88.6% of isolates corresponded to meningitis, 70.8% to sepsis and 50.9% to pneumonia in children under 5 years. A total of 84% (181/217) of isolates corresponded to invasive infections caused by Hib in children under 5 years, with the highest proportion observed between 2001 and 2003. The most prevalent biotypes were biotype I (29%), biotype II (12%), biotype III (24%), and biotype IV (13%). Among the total of isolates, 13% (68/523) of isolates were resistant to ampicillin.
ConclusionAfter the introduction of the Hib vaccine in Paraguay, the number of invasive Hib cases decreased in children under 5 years old, although we observed an increase of HiNT in children over 5 years. Continuous surveillance is necessary in order to monitor the effectiveness of the vaccine and for the development of preventive interventions.
Haemophilus influenzae (H. influenzae) es un microorganismo gramnegativo comensal de la nasofaringe que puede causar graves enfermedades invasivas como meningitis, neumonías y sepsis en individuos susceptibles. La enfermedad invasiva afecta principalmente a niños menores de 2 años, así como a ancianos e inmunocomprometidos1,2.
Uno de los factores de virulencia más importantes de H. influenzae es la cápsula polisacarídica que es el antígeno involucrado en el serotipado de los aislamientos y en la inmunidad de la vacuna. Este microorganismo se clasifica en 6 serotipos diferentes atendiendo a su cápsula, denominados H. influenzae a (Hia), b (Hib), c (Hic), d (Hid), e (Hie) y f (Hif)3. Algunos aislados que no poseen cápsula son menos virulentos y se les denomina no encapsulados o no tipificables (HiNT)4,5. Además H. influenzae se clasifica en 8 biotipos diferentes (I, II, III, IV, V, VI, VII y VIII) en base a sus propiedades bioquímicas y enzimáticas.
Hib es el serotipo más invasivo y se reconoce como causa importante de neumonía y meningitis6. Antes de la introducción de la vacuna conjugada frente a Hib, se producían aproximadamente 2,2 millones de casos de enfermedad grave por Hib anualmente por este serotipo, la gran mayoría en entornos de bajos ingresos7 y un estimado de 386.000 muertes por año. Asimismo, en el periodo prevacunal, Hib causaba al menos el 95% de las enfermedades invasivas en niños. La vacuna conjugada ha sido muy eficaz, reduciendo las tasas de enfermedad tanto en países desarrollados como en países en vías de desarrollo, con descensos en la enfermedad invasiva por Hib del 90-98%8. En el año 2004 Paraguay introdujo la vacuna pentavalente, que incluye Hib, en el esquema de vacunación nacional para niños de 2, 4 y 6 meses de edad de forma gratuita. Según los datos del Programa Ampliado de Inmunizaciones esta vacuna tiene una cobertura en el país del 73% (2019).
Durante la última década, se ha comunicado un aumento de la prevalencia de infecciones causadas por HiNT en todo el mundo, sugiriendo el reemplazo del serotipo b en la era posvacunal, como nuevo nicho ecológico1 y existiendo una tendencia hacia el aumento en la incidencia de enfermedades graves causadas por HiNT.
Debido a que es necesario un tratamiento precoz en el caso de enfermedad invasiva grave, mientras se obtienen los resultados del cultivo y antibiograma, es necesario instaurar un tratamiento empírico, por lo que es importante conocer la sensibilidad antibiótica local de este patógeno. La resistencia a ampicilina llevó al uso de cefalosporinas de tercera generación como antimicrobianos empíricos9. La resistencia es debida a la producción de betalactamasas y/o a la alteración de las proteínas fijadoras de penicilina (PBP)10.
El objetivo de este estudio fue describir las características fenotípicas, genotípicas y la sensibilidad a antimicrobianos de aislamientos invasivos y no invasivos de H. influenzae recibidos en el Laboratorio Nacional de Referencia de Paraguay durante el periodo 1999 al 2017.
MétodosEstudio observacional descriptivo retrospectivo de corte transversal. Se incluyeron en este estudio tanto aislados invasivos como no invasivos procedentes de líquido cefalorraquídeo, sangre, líquido pleural, secreción ocular y secreción ótica de distintos pacientes de todas las edades, que fueron remitidos al Laboratorio Central de Salud Pública (LCSP) por los diferentes centros centinelas y centros colaboradores de Paraguay desde 1999 a 2017. No se incluyeron en este estudio aislados procedentes de otros orígenes respiratorios.
Aislamiento, identificación y serotipificaciónEl aislamiento e identificación se realizó por métodos microbiológicos convencionales: tinción de Gram, morfología de las colonias en agar chocolate, y requerimiento de factores V y X (Difco, EE. UU.). El serotipado de los aislamientos fue realizado por la técnica de aglutinación en lámina, con antisueros polivalentes y monovalentes (Difco, EE: UU.) y confirmado por reacción en cadena de la polimerasa basado en la detección de genes capsulares específicos del serotipo, como se ha descrito previamente11. Se definieron los biotipos a través de las pruebas de producción de ureasa, ornitina descarboxilasa e indol.
Sensibilidad a antimicrobianosSe determinó la concentración inhibitoria mínima de ampicilina y ceftriaxona utilizando el método epsilométrico E-test (bioMérieux, Francia) y mediante difusión con disco (Kirby Bauer) para trimetoprim-sulfametoxazol, cloranfenicol, cefuroxima y rifampicina en agar Haemophilus test medium (Oxoid, Inglaterra), suplementado con hematina y nicotinamida adenina dinucleótido (Oxoid, Inglaterra). La producción de betalactamasa se determinó por el método de la cefalosporina cromogénica, utilizando discos de nitrocefina (BBL, EE: UU.).
Se utilizaron como cepas de control de calidad H. influenzae ATCC 49247 y H. influenzae ATCC 49766.
Las técnicas se realizaron e interpretaron siguiendo las recomendaciones del Clinical and Laboratory Standards Institute (CLSI)12.
Análisis estadísticoEste estudio se limita a la descripción de los datos y no incluye ningún análisis estadístico inferencial. Se realizaron los cálculos de proporciones de frecuencias absolutas y de porcentaje junto con sus correspondientes intervalos de confianza de 95%. Las variables analizadas fueron grupos de edad (menores de 2 años, de 2 a 9 años, 10 a 19 años, 20 a 29 años, 30 a 39 años, 40 a 49 años, 50 a 59 años y mayores de 60 años), código de identificación de la muestra, tipo de muestra, fecha de toma de muestra, diagnóstico, microorganismo (confirmado fenotípica o genotípicamente como compatible con H. influenzae), serotipo de H. influenzae (a, b, c, d, e, f, HiNT), biotipos (I, II, III, IV, V, VI, VII y VIII), sensibilidad a ampicilina, ceftriaxona, cefuroxima, trimetoprim-sulfametoxazol, cloranfenicol, rifampicina y producción de betalactamasa. Se agruparon los datos en periodo prevacunal (1999-2003) y periodo posvacunal (2004-2017).
El análisis de los datos se realizó con el programa EPI-Info versión 7.2.
Asuntos éticosEste estudio fue aprobado por el Comité de Ética en Investigación del Laboratorio Central de Salud Pública (CEI), dictamen n.o 112/2019. No se obtuvo declaración de consentimiento informado debido a que el estudio es observacional, con riesgo mínimo o nulo para los sujetos y abarcó un periodo muy largo durante el cual fue imposible recoger los consentimientos informados de todos los sujetos del estudio. La confidencialidad de los datos que consignan a la persona, se respetó en todo momento y únicamente los investigadores pudieron acceder a los datos referidos.
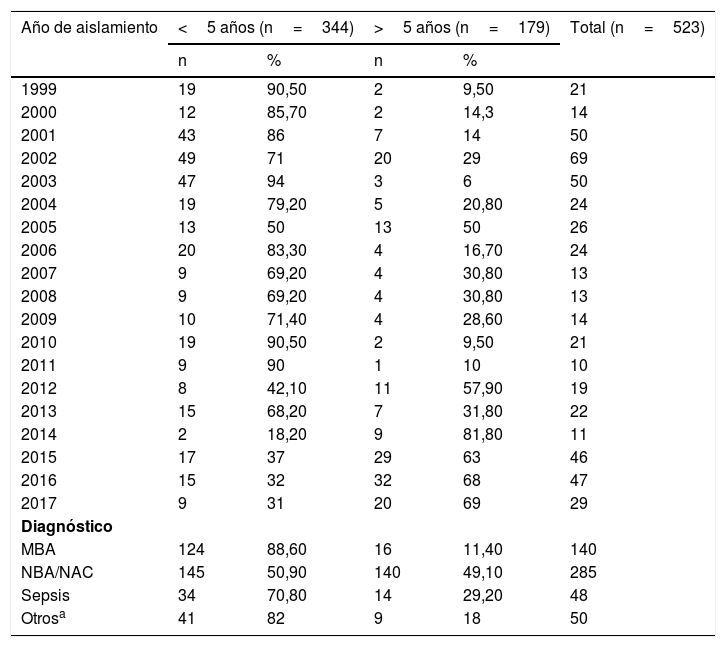
ResultadosDurante el periodo comprendido entre 1999 y 2017 se estudiaron por técnicas microbiológicas convencionales y reacción en cadena de la polimerasa un total de 523 aislados de H. influenzae procedentes de enfermedad invasiva (473/523) y no invasiva (50/523) en todos los grupos de edades. La distribución por grupos de edades fue: 48,4% en menores de 2 años; 24,47% de 2 a 9 años; 3,63% de 10 a 19 años; 2,87% de 30 a 39 años; 2,1% de 40 a 49 años; 4,58% de 50 a 60 años y 10,32% en mayores de 60 años. En general, el 65,77% de los aislados (344/523) correspondieron a niños menores de 5 años y el 34,23% (179/523) a mayores de 5 años. El 88,6% de los casos de meningitis bacteriana aguda, el 70,8% de las sepsis y el 50,9% de las neumonías se produjeron en niños menores de 5 años. Se recogieron también 50/523 (9,56%) casos de enfermedad no invasiva (conjuntivitis y otitis) en el conjunto de la muestra (ver tabla 1).
Distribución de aislados de Haemophilus influenzae por año, diagnóstico y grupo de edad en Paraguay (1999-2017) (n=523)
| Año de aislamiento | <5 años (n=344) | >5 años (n=179) | Total (n=523) | ||
|---|---|---|---|---|---|
| n | % | n | % | ||
| 1999 | 19 | 90,50 | 2 | 9,50 | 21 |
| 2000 | 12 | 85,70 | 2 | 14,3 | 14 |
| 2001 | 43 | 86 | 7 | 14 | 50 |
| 2002 | 49 | 71 | 20 | 29 | 69 |
| 2003 | 47 | 94 | 3 | 6 | 50 |
| 2004 | 19 | 79,20 | 5 | 20,80 | 24 |
| 2005 | 13 | 50 | 13 | 50 | 26 |
| 2006 | 20 | 83,30 | 4 | 16,70 | 24 |
| 2007 | 9 | 69,20 | 4 | 30,80 | 13 |
| 2008 | 9 | 69,20 | 4 | 30,80 | 13 |
| 2009 | 10 | 71,40 | 4 | 28,60 | 14 |
| 2010 | 19 | 90,50 | 2 | 9,50 | 21 |
| 2011 | 9 | 90 | 1 | 10 | 10 |
| 2012 | 8 | 42,10 | 11 | 57,90 | 19 |
| 2013 | 15 | 68,20 | 7 | 31,80 | 22 |
| 2014 | 2 | 18,20 | 9 | 81,80 | 11 |
| 2015 | 17 | 37 | 29 | 63 | 46 |
| 2016 | 15 | 32 | 32 | 68 | 47 |
| 2017 | 9 | 31 | 20 | 69 | 29 |
| Diagnóstico | |||||
| MBA | 124 | 88,60 | 16 | 11,40 | 140 |
| NBA/NAC | 145 | 50,90 | 140 | 49,10 | 285 |
| Sepsis | 34 | 70,80 | 14 | 29,20 | 48 |
| Otrosa | 41 | 82 | 9 | 18 | 50 |
MBA: meningitis bacteriana aguda; NBA/NAC: neumonía bacteriana aguda/neumonía adquirida en la comunidad.
El serotipo que se aisló con mayor frecuencia fue HiNT con 51,8% (271/523), seguido de Hib con 43% (225/523), 1,5% de Hia y Hif (8/523) respectivamente, 1% de Hic (5/523), 0,8% de Hie (4/523) y 0,4% de Hid (2/523).
En referencia a la enfermedad invasiva (meningitis, neumonía y sepsis) el 48,4% (229/473) estuvo causada por aislamientos de HiNT, el 46,1% (218/473) por Hib, el 1,7% (8/473) por Hif, el 1,1% (5/473) por Hic, el 0,6% (3/473) por Hie y el 0,4% (2/473) por Hid. En cuanto a la enfermedad no invasiva (conjuntivitis y otitis), HiNT se halló en el 84% (42/50) de los casos, Hib en el 14% (7/50), Hia en el 1% (8/50) e Hie en el 2% (1/50).
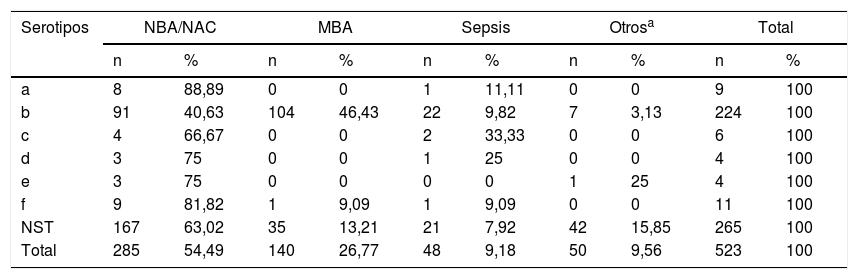
El serotipo a se asoció principalmente con neumonías, en 88,89% (8/9) de los casos, Hib con meningitis en 46,42% (104/224), Hic, Hid, Hie y Hif con neumonías en 66,67% (4/6), 75% (3/4), 75% (3/4) y 81,82% (9/11), respectivamente. El 63,02% (167/265) de los HiNT se aislaron de pacientes con neumonía, el 15,84% (42/265) en otras enfermedades como conjuntivitis y otitis, el 13,2% (35/265) en meningitis bacteriana aguda y el 7,92% (21/265) en sepsis (ver tabla 2).
Distribución de serotipos de Haemophilus influenzae por diagnóstico en Paraguay (1999-217) (n=523)
| Serotipos | NBA/NAC | MBA | Sepsis | Otrosa | Total | |||||
|---|---|---|---|---|---|---|---|---|---|---|
| n | % | n | % | n | % | n | % | n | % | |
| a | 8 | 88,89 | 0 | 0 | 1 | 11,11 | 0 | 0 | 9 | 100 |
| b | 91 | 40,63 | 104 | 46,43 | 22 | 9,82 | 7 | 3,13 | 224 | 100 |
| c | 4 | 66,67 | 0 | 0 | 2 | 33,33 | 0 | 0 | 6 | 100 |
| d | 3 | 75 | 0 | 0 | 1 | 25 | 0 | 0 | 4 | 100 |
| e | 3 | 75 | 0 | 0 | 0 | 0 | 1 | 25 | 4 | 100 |
| f | 9 | 81,82 | 1 | 9,09 | 1 | 9,09 | 0 | 0 | 11 | 100 |
| NST | 167 | 63,02 | 35 | 13,21 | 21 | 7,92 | 42 | 15,85 | 265 | 100 |
| Total | 285 | 54,49 | 140 | 26,77 | 48 | 9,18 | 50 | 9,56 | 523 | 100 |
MBA: meningitis bacteriana aguda; NBA/NAC: neumonía bacteriana aguda/ neumonía adquirida en la comunidad; NST: no serotipable.
Se determinaron los biotipos de 384 cepas de H. influenzae, 350/584 de procesos invasivos y 34/584 de procesos no invasivos, resultando el 29% biotipo I, el 12% biotipo II, el 24% biotipo III, el 13% biotipo IV, el 4% biotipo V, el 7% biotipo VI, el 2% biotipo VII y el 9% biotipo VIII. Las enfermedades invasivas se asociaron con mayor frecuencia al biotipo I (39%) y las enfermedades no invasivas al biotipo III (32%). El biotipo I fue prevalente en el serotipo b en un 70% en enfermedad invasiva y el biotipo iii fue prevalente en un 96% en aislados no tipificables (HiNT) de enfermedad no invasiva.
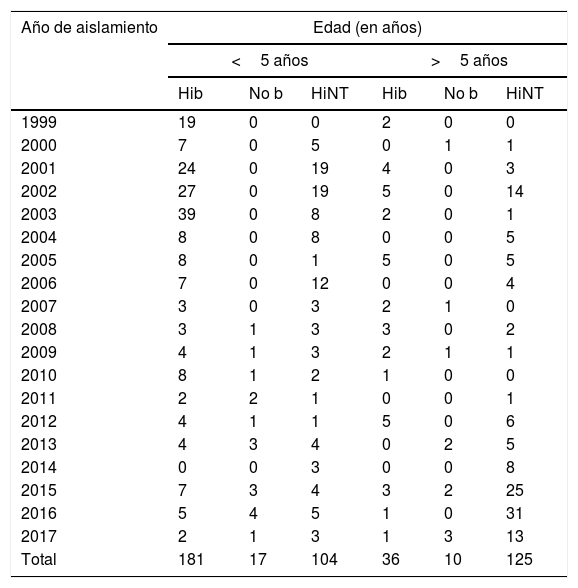
El 84% (181/217) de las cepas incluidas entre 1999 y 2017 correspondió a enfermedades invasivas causadas por el serotipo b en menores de 5 años, y la mayor proporción se registró entre los años 2001 y 2003. No se observaron variaciones en el aislamiento del serotipo b en niños mayores de 5 años.
En menores de 5 años las cepas no tipificables se aislaron principalmente en los años 2001, 2002 y 2006. Sin embargo, en los mayores de 5 años el mayor número de aislados se detectaron en los últimos años del estudio (2015, 2016 y 2017) (ver tabla 3).
Distribución de serotipos de Haemophilus influenzae en enfermedad invasiva, por grupo de edad en Paraguay (1999 a 2017) (n=473)
| Año de aislamiento | Edad (en años) | |||||
|---|---|---|---|---|---|---|
| <5 años | >5 años | |||||
| Hib | No b | HiNT | Hib | No b | HiNT | |
| 1999 | 19 | 0 | 0 | 2 | 0 | 0 |
| 2000 | 7 | 0 | 5 | 0 | 1 | 1 |
| 2001 | 24 | 0 | 19 | 4 | 0 | 3 |
| 2002 | 27 | 0 | 19 | 5 | 0 | 14 |
| 2003 | 39 | 0 | 8 | 2 | 0 | 1 |
| 2004 | 8 | 0 | 8 | 0 | 0 | 5 |
| 2005 | 8 | 0 | 1 | 5 | 0 | 5 |
| 2006 | 7 | 0 | 12 | 0 | 0 | 4 |
| 2007 | 3 | 0 | 3 | 2 | 1 | 0 |
| 2008 | 3 | 1 | 3 | 3 | 0 | 2 |
| 2009 | 4 | 1 | 3 | 2 | 1 | 1 |
| 2010 | 8 | 1 | 2 | 1 | 0 | 0 |
| 2011 | 2 | 2 | 1 | 0 | 0 | 1 |
| 2012 | 4 | 1 | 1 | 5 | 0 | 6 |
| 2013 | 4 | 3 | 4 | 0 | 2 | 5 |
| 2014 | 0 | 0 | 3 | 0 | 0 | 8 |
| 2015 | 7 | 3 | 4 | 3 | 2 | 25 |
| 2016 | 5 | 4 | 5 | 1 | 0 | 31 |
| 2017 | 2 | 1 | 3 | 1 | 3 | 13 |
| Total | 181 | 17 | 104 | 36 | 10 | 125 |
Hib: Haemophilus influenzae serotipo b; HiNT: Haemophilus influenzae no-tipable; No b: Haemophilus influenzae serotipo a, c, d, e, f.
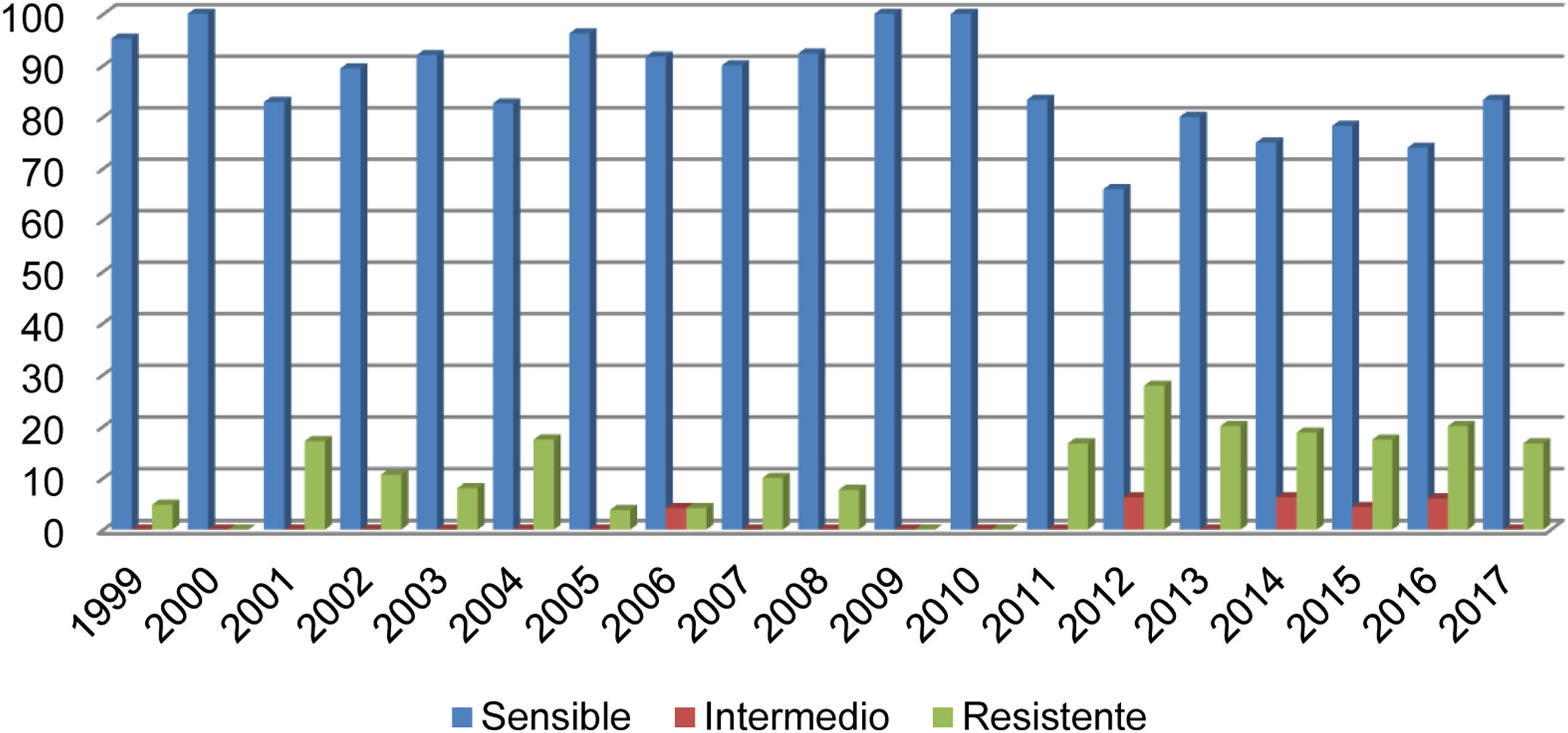
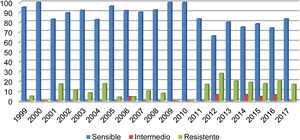
Del total de los aislados estudiados, el 13% (68/523) fueron betalactamasa positivos y resistentes a la ampicilina, de ellos 36/68 correspondieron a neumonías, 16/68 a meningitis, 9/68 a sepsis y 7/68 a otros casos (conjuntivitis u otitis) y un caso de H. influenzae no productor de betalactamasa y ampicilina resistente. En el año 2012 se registró la resistencia más alta (27,80%) (fig. 1). El 17% de los aislados fueron resistentes a trimetoprim-sulfametoxazol y 7,83% a cloranfenicol, mientras que todos los aislados fueron sensibles a ceftriaxona, cefuroxima y a rifampicina.
DiscusiónEn este estudio se caracterizaron 523 H. influenzae procedentes de enfermedad invasiva y no invasiva. Teniendo en cuenta el diagnóstico, las neumonías y las meningitis fueron las más comunes en niños menores de 5 años y causadas predominantemente por el serotipo b.
La incidencia de Hib en enfermedades invasivas y en portadores sanos ha disminuido drásticamente en los países donde se ha implementado el programa de inmunización nacional13. Se conoce muy poco sobre la epidemiología y la importancia clínica de infección por H. influenzae invasiva tras la introducción de las vacunas conjugadas frente a Hib. La vacuna conjugada frente a Hib se introdujo en 1987 en Estados Unidos y durante el periodo 1999-2000 la incidencia anual de enfermedad invasiva por Hib en niños menores de 5 años disminuyó en un 99%, lo que corresponde a menos de un caso por 100.000 niños14, por lo que, el aumento en la enfermedad causada por los serotipos a, c, d, e y f es ínfimo en comparación con la reducción de la enfermedad causada por Hib. Diversos estudios realizados en Estados Unidos, Canadá, Inglaterra y Gales han mostrado una incidencia creciente de Hif con el tiempo. Hie también ha aumentado en Inglaterra y Gales, siendo el tercer serotipo capsular más común después de Hif y Hib en esos países15.
En Paraguay, con la introducción de la vacuna Hib en el año 2004, se observó una reducción de Hib en los casos de enfermedad invasiva en niños menores de 5 años; en cambio para el HiNT, se evidenció un incremento en la frecuencia relativa en el grupo de mayores de 5 años en el año 2016. En otros países de América se han comunicado cambios similares16,17.
En la era previa a la vacunación, HiNT no era una causa común conocida de infección invasiva, sin embargo, actualmente es la causa principal de la enfermedad invasiva en todos los grupos de edad18. Si bien los HiNT son una causa bien reconocida de neumonía en adultos, los datos sobre neumonía infantil son limitados19. Un estudio realizado en Inglaterra y Gales encontró entre el año 2000 y 2013, 1.585 casos de infección invasiva por H. influenzae en niños de 1 mes a 10 años, donde HiNT causó 31–51 casos por año (0,53–0,92/100.000)20. HiNT se reconoce cada vez más como patógeno emergente. La inmunización de rutina de los bebés con vacunas conjugadas frente a Hib ha producido un marcado cambio en el serotipo invasivo predominante de Hib a HiNT21.
Los otros serotipos de H. influenzae (a, c, d, e y f) se aislaron con menor frecuencia. El serotipo f fue el tercero en importancia y el serotipo e resultó ser el menos frecuente. Según algunos estudios, los serotipos e y f no han aumentado después de las campañas de vacunación, más bien aparecen como infecciones oportunistas en adultos con alguna enfermedad de base22. El serotipo a se aisló con una frecuencia del 1,72%. Como la mayoría de los casos de Hia corresponden a enfermedades esporádicas, los informes publicados no siempre son consistentes en sus hallazgos. Las tasas de incidencia más altas de enfermedades invasivas por Hia se han encontrado en algunas poblaciones indígenas, como los indios norteamericanos e inuit de Alaska y norte de Canadá, llegando al orden de magnitud de las tasas de incidencia de Hib en la era prevacunal1. En Brasil, la vigilancia pasiva mostró que Hib representó el 59% de los aislamientos por meningitis, Hia el 14%, Hif el 2,90% y HiNT aumentó del 2% a 22% en el periodo posvacunal23.
Durante el periodo de este estudio se evidenció una prevalencia del biotipo i en el serotipo b. En niños, el biotipo i y el serotipo b se asocian comúnmente con meningitis, los biotipos II y III se asocian comúnmente con infecciones del tracto respiratorio y los HiNT con biotipo IV4. Estudios previos realizados en Dinamarca, Noruega, Europa Occidental y Estados Unidos habían demostrado que el biotipo i explica la mayoría de las meningitis por H. influenzae (96%) y predominó en niños menores de 10 años24. En Estados Unidos, el 95% de los aislados de H. influenzae invasivos son del serotipo b y biotipo I. En Europa Occidental, solo los biotipos I y II prevalecen en la mayoría de los países, aunque también se han detectado biotipos III, IV y V. Los serotipos a y c están asociados con biotipos I y IV, respectivamente, mientras que en los aislados de HiNT, predominan los biotipos II y III. En Brasil se demostró que el 51% de las cepas pertenecían al biotipo I, el 2% al biotipo III, el 31% al biotipo IV, el 2% al biotipo V, el 7% al biotipo VI y el 7% al biotipo VIII25. En Argentina, se determinó el biotipo en 306 aislados, de los cuales todos los aislamientos de tipo Hia correspondieron al biotipo II, y el 66,7% de Hib pertenecieron al biotipo I26. En Cuba, un estudio encontró constante la presencia de los biotipos I y II en los periodos pre- y posvacunal y la aparición de aislados de Hib biotipo VIII, no notificado en el periodo prevacunal27.
La resistencia a ampicilina encontrada en este estudio fue del 13%. Se han observado datos similares en América Latina y en el Caribe28. La resistencia en Europa y América del Norte varían del 8% al 30%, llegando a más del 50% en algunos países del este de Asia29. Los aislados resistentes a ampicilina betalactamasa negativos con modificaciones en la PBP3 pueden mostrar una sensibilidad disminuida tanto a las aminopenicilinas como a algunas cefalosporinas30. En este estudio no se encontró resistencia a las cefalosporinas evaluadas.
Una limitación de este estudio se debe a que como es una revisión retrospectiva, se encontraron algunos datos incompletos. Sin embargo, su fortaleza es que estos datos se recopilaron durante un periodo de tiempo prolongado en el Laboratorio de Referencia Nacional, donde se reciben con frecuencia estos aislados para su análisis y confirmación.
Podemos concluir que es necesaria una vigilancia continua para monitorizar la eficacia de la vacuna frente a Hib y para detectar cualquier tipo capsular invasivo emergente en todos los grupos de edad y presentaciones clínicas para así poder desarrollar intervenciones preventivas.
FinanciaciónLa presente investigación no ha recibido ninguna beca específica de agencias de los sectores público, comercial, o sin ánimo de lucro.
Conflicto de interesesNinguno.
La realización de este trabajo fue apoyada por subvenciones del Fondo para la convergencia estructural del Mercosur (FOCEM)-Mercosur, convenio FOCEM N.o 03/11 Proyecto «Investigación, Educación y Biotecnologías Aplicadas a la Salud» (COF 03/11).