El objetivo principal del estudio ha sido valorar si la penetración de antibióticos se ve influenciada por la perfusión tisular disminuida en pacientes con isquemia de miembros, reduciendo la concentración alcanzada en tejidos por debajo de los puntos de corte (breakpoints) de la concentración mínima inhibitoria (CMI) de los antimicrobianos utilizados para diferentes patógenos.
MétodosEstudio prospectivo. Se incluyeron candidatos a amputación mayor con isquemia crítica de miembro inferior e infección en tratamiento antibiótico. Se determinaron 3 niveles de perfusión en el miembro inferior, midiendo la presión transcutánea de oxígeno (TcPO2). Se extrajo una muestra de sangre de vía central así como biopsias de piel, músculo y hueso de cada uno de los niveles de perfusión. Se determinó la concentración del antibiótico mediante HPLC.
ResultadosEl número total de casos es de 61 (46 pacientes): 6 clindamicina, 9 vancomicina, 8 linezolid, 18 levofloxacino, 9 ceftazidima y 11 meropenem. Se encuentran diferencias estadísticamente significativas entre todos los niveles de TcPO2 (ANOVA, p=0,000). La concentración en piel de vancomicina, levofloxacino y ceftazidima depende del nivel de perfusión. Vancomicina y levofloxacino difunden peor en hueso que en el resto de tejidos. La concentración de ceftazidima no supera el punto de corte de Pseudomonas aeruginosa en tejidos isquémicos.
ConclusionesLinezolid y meropenem difunden en todos los tejidos independientemente de la perfusión, alcanzando concentraciones superiores a la CMI de los microrganismos diana, asegurando su efectividad en tejidos isquémicos.
The aim of the study was to assess whether the penetration of antibiotics is affected by decreased tissue perfusion in patients with limb ischaemia, thus reducing its concentration in tissues below the minimum inhibitory concentration (MIC) breakpoints of antibiotics for different microorganisms.
MethodsProspective study. Candidates for major amputation with critical lower limb ischaemia and an infection on antibiotic treatment, were included. Three levels of perfusion in the lower limb were determined by measuring the transcutaneous oxygen pressure (TcPO2). A central line blood specimen, as well as biopsies of the skin, muscle, and bone, were taken at each perfusion level. The antibiotic concentration was determined using HPLC.
ResultsThe total number of cases was 61 (46 patients): 6 clindamycin, 9 vancomycin, 8 linezolid, 18 levofloxacin, 9 ceftazidime, and 11 meropenem. Statistically significant differences were found in TcPO2 at all levels (ANOVA, P=.000). The vancomycin, levofloxacin and ceftazidime skin concentration depends on perfusion. Vancomycin and levofloxacin diffusion in bone is worse than in other tissues. Ceftazidime concentration does not exceed the MIC breakpoint of Pseudomonas aeruginosa in ischaemic tissues.
ConclusionsMeropenem and linezolid diffuse in all tissues, regardless of perfusion, reaching concentrations above the MIC of the target microorganisms, ensuring its effectiveness in ischaemic tissues.
La enfermedad arterial periférica (EAP), sola o en combinación con la diabetes, es la responsable de más de la mitad de las amputaciones realizadas. Se ha documentado una incidencia de amputaciones mayores debidas a EAP de 12 a 50 por 100.000 habitantes y año1.
Los factores que predicen la necesidad de amputación en pacientes con isquemia de miembros son la presencia de úlceras, insuficiencia renal crónica (IRC) terminal, estado funcional disminuido y diabetes. Los pacientes con diabetes tienen 10 veces más riesgo de amputación que la población general2. Las úlceras en pacientes diabéticos se acompañan de isquemia (49%), de infección (58%) o de ambas (31%)3.
La osteomielitis suele ser secundaria a la extensión por contigüidad de infecciones de piel y partes blandas4 y acontece en el 20-60% de las ulceraciones del pie diabético5, empeorando el pronóstico al aumentar el riesgo de amputación mayor6.
En las guías de práctica clínica la elección del antibiótico y la necesidad de cirugía de desbridamiento se basan en la gravedad de la infección, es decir, en la extensión y la profundidad de la lesión en el pie, en la existencia de afectación sistémica y en la presencia de isquemia o necrosis7-9.
Inicialmente la pauta de antibióticos que se utiliza es de amplio espectro, y posteriormente la terapia empírica inicial se modifica en función de los cultivos obtenidos. La elección del tratamiento antibiótico dirigido se realiza en función de los datos de sensibilidad in vitro y expresados en forma de concentración mínima inhibitoria (CMI).
El problema fundamental radica en que la concentración que alcanzan los diferentes antibióticos en la zona de infección está relacionada con las propias características farmacocinéticas y farmacodinámicas del antibiótico, pero también con la perfusión tisular, lo cual puede producir que las concentraciones de antibiótico que se alcancen en el foco infeccioso se encuentren por debajo del punto de corte de la CMI del microorganismo.
Esto es lo que nos ha movido a analizar la penetración tisular de diferentes antibióticos en función del grado de isquemia y, secundariamente, comprobar la influencia de otros factores relacionados, como la diabetes o la insuficiencia renal crónica, determinando si la concentración en los tejidos, incluyendo el hueso, es adecuada.
MétodosSelección de pacientesSe ha llevado a cabo un estudio prospectivo en pacientes candidatos a amputación mayor de miembro inferior que cumplan los siguientes criterios de inclusión:
- •
Isquemia de miembros: pacientes con criterios de isquemia crítica1 en los que se indica amputación mayor primaria de miembro inferior por no ser candidatos a revascularización10 o porque esta ha fracasado (amputación secundaria).
- •
Lesiones tróficas con infección local o sistémica que precisen tratamiento antibiótico.
Y no cumplan ningún criterio de exclusión:
- •
Pacientes con pie diabético neuropático (presentan infección de pie diabético pero no asocian isquemia de miembros).
- •
Pacientes que rechazaron participar en el estudio o que no estaban capacitados para otorgar la debida autorización.
- •
Pacientes en estado clínico de shock séptico.
- •
Pacientes que precisaron amputación urgente.
El estudio ha sido aprobado por el Comité Ético de Investigación del centro hospitalario y todos los pacientes han firmado el consentimiento informado específico del estudio.
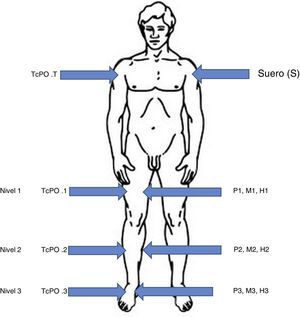
Determinación del grado de isquemiaSe hace previamente a la cirugía, midiendo la presión transcutánea de oxígeno (TcPO2) con el sistema de monitorización TCM-400 (Radiometer®).
Se realizan 4 mediciones: en tórax (TcPO2T), considerada la zona mejor oxigenada, y 3 en el miembro inferior afectado11:
- •
El nivel 1, en el muslo, con buena perfusión, será la zona elegida para la realización de la amputación, con TcPO2 mayor de 40mmHg.
- •
El nivel 2, en la pantorrilla, se ha definido como una zona de isquemia parcial, con TcPO2 de 40-30mmHg.
- •
El nivel 3 es la zona más distal del pie. Se ha definido como zona de isquemia crítica, con TcPO2 menor de 30mmHg. Se han evitado las zonas ulceradas con tejido desvitalizado12.
Los pacientes han recibido al menos 4 dosis del antibiótico que se estudia para estar seguros de haber alcanzado el estado de equilibrio. Se han adecuado los antibióticos a las necesidades de cada paciente en cuanto a alergias, incompatibilidades o interacciones con otros fármacos y se ha ajustado la dosis según aclaramiento de creatinina. Los antibióticos se han administrado con la siguiente dosificación, si no existía contraindicación: vancomicina 1g cada 12h (no se hizo la dosificación según niveles plasmáticos), linezolid 600mg cada 12h, clindamicina 600mg cada 8h, levofloxacino 500mg cada 24h, meropenem 1g cada 8h y ceftazidima 2g cada 8h. Una hora antes de la amputación se ha administrado una dosis del antibiótico en estudio.
Toma de muestrasUna vez anestesiado el paciente y antes de realizarse la amputación se han extraído las siguientes muestras: muestra de sangre de la vía central y biopsias de piel, músculo y hueso de cada uno de los 3 niveles de perfusión diferenciados previamente.
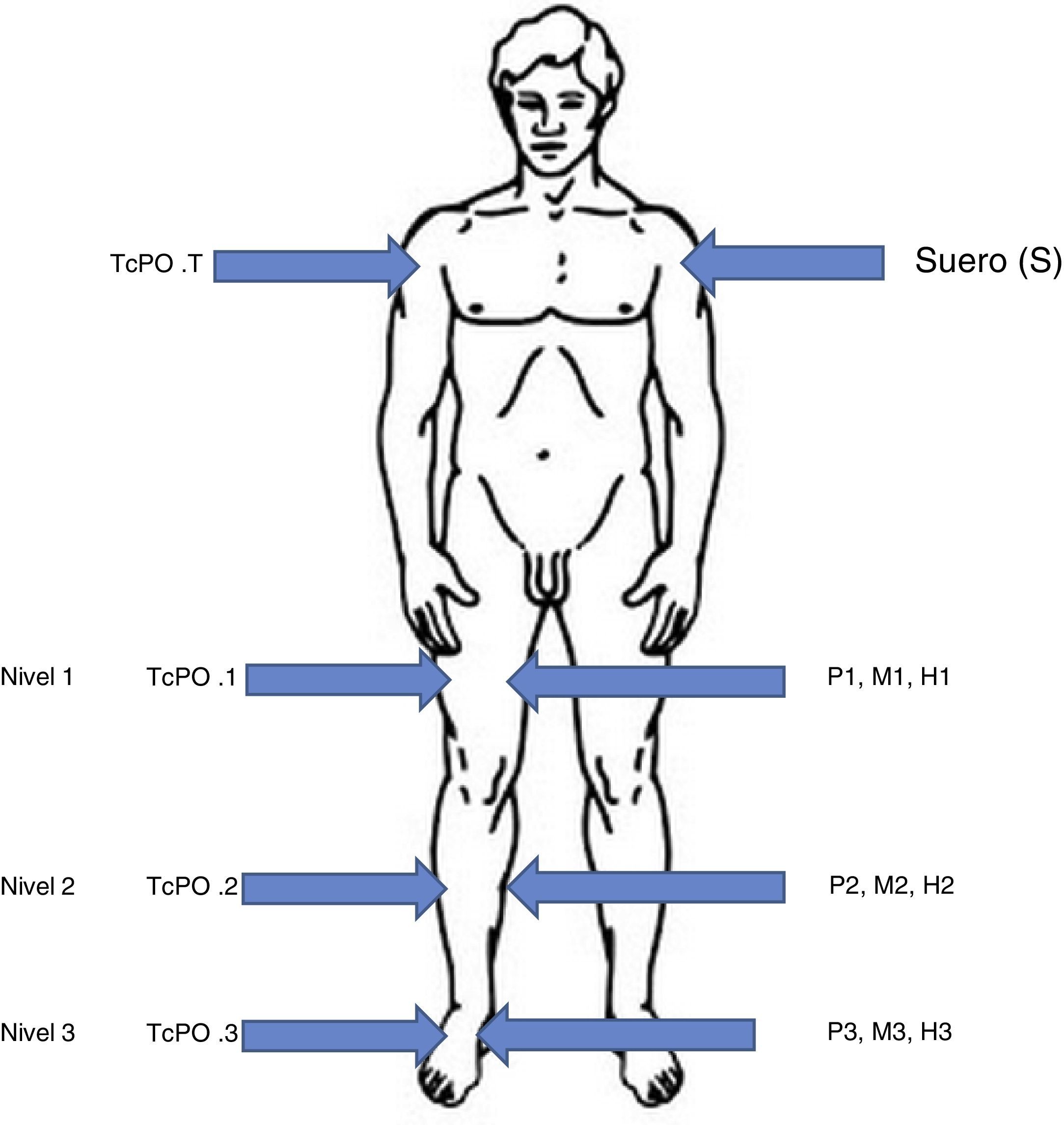
Todas las muestras se han limpiado meticulosamente, retirado la sangre visible adherida, y se han conservado a −80°C hasta la determinación de la concentración del antibiótico. Igualmente el suero se ha conservado a −80°C (fig. 1).
Esquema del método. Las flechas de la izquierda señalan cada nivel de perfusión (nivel 1, 2 y 3) y el control en tórax (TcPO2T). Las flechas a la derecha señalan el lugar donde se toman las muestras de tejidos coincidiendo con cada nivel de perfusión: piel (P), músculo (M) y hueso (H).
Se ha realizado mediante high performance liquid chromatography (HPLC) usando HPLC Waters Alliance 2690®), según los protocolos descritos13-16.
La prueba tiene un límite de sensibilidad de 0,1μl/ml con unos coeficientes de variación intradía e interdía de menos del 5% en un rango de concentración de 0.1-100μl/ml.
VariablesLas variables predictoras son la TcPO2 en los diferentes niveles, la insuficiencia renal crónica (IRC) expresada como aclaramiento de creatinina (según la fórmula de Cokcroft-Gault)17 inferior a 60ml/min/1,73m2 y la existencia de diabetes.
La concentración en suero expresada en μg/ml y la TcPO2 en tórax (mmHg) son los controles.
Los puntos de corte de la CMI para cada antibiótico son los establecidos en EUCAST18 y CLSI M100-S2519.
Estudio estadísticoSe ha realizado análisis de la varianza (ANOVA) de 2 vías de Friedman por rangos para muestras relacionadas para identificar las diferencias en las concentraciones según nivel de perfusión. Se ha empleado regresión lineal y t de Student para análisis de las variables predictoras. Se han considerado diferencias estadísticamente significativas para un valor de p menor de 0,05.
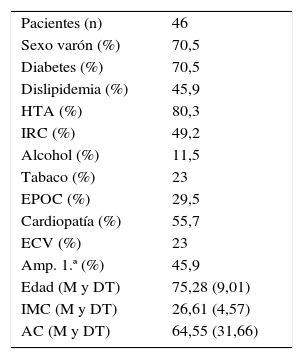
ResultadosEn la tabla 1 se detallan las características basales de los pacientes.
Características basales
| Pacientes (n) | 46 |
| Sexo varón (%) | 70,5 |
| Diabetes (%) | 70,5 |
| Dislipidemia (%) | 45,9 |
| HTA (%) | 80,3 |
| IRC (%) | 49,2 |
| Alcohol (%) | 11,5 |
| Tabaco (%) | 23 |
| EPOC (%) | 29,5 |
| Cardiopatía (%) | 55,7 |
| ECV (%) | 23 |
| Amp. 1.ª (%) | 45,9 |
| Edad (M y DT) | 75,28 (9,01) |
| IMC (M y DT) | 26,61 (4,57) |
| AC (M y DT) | 64,55 (31,66) |
AC: aclaramiento de creatinina; Amp. 1.ª: amputación primaria; DT: desviación típica; EPOC: enfermedad pulmonar obstructiva crónica; HTA: hipertensión arterial; IMC: índice de masa corporal; IRC: insuficiencia renal crónica; M: media.
El número total de pacientes incluidos es de 46. En algunos de ellos se ha analizado más de un antibiótico, por lo que el número de casos es de 61, con la siguiente distribución: 6 clindamicina, 9 vancomicina, 8 linezolid, 18 levofloxacino, 9 ceftazidima y 11 meropenem.
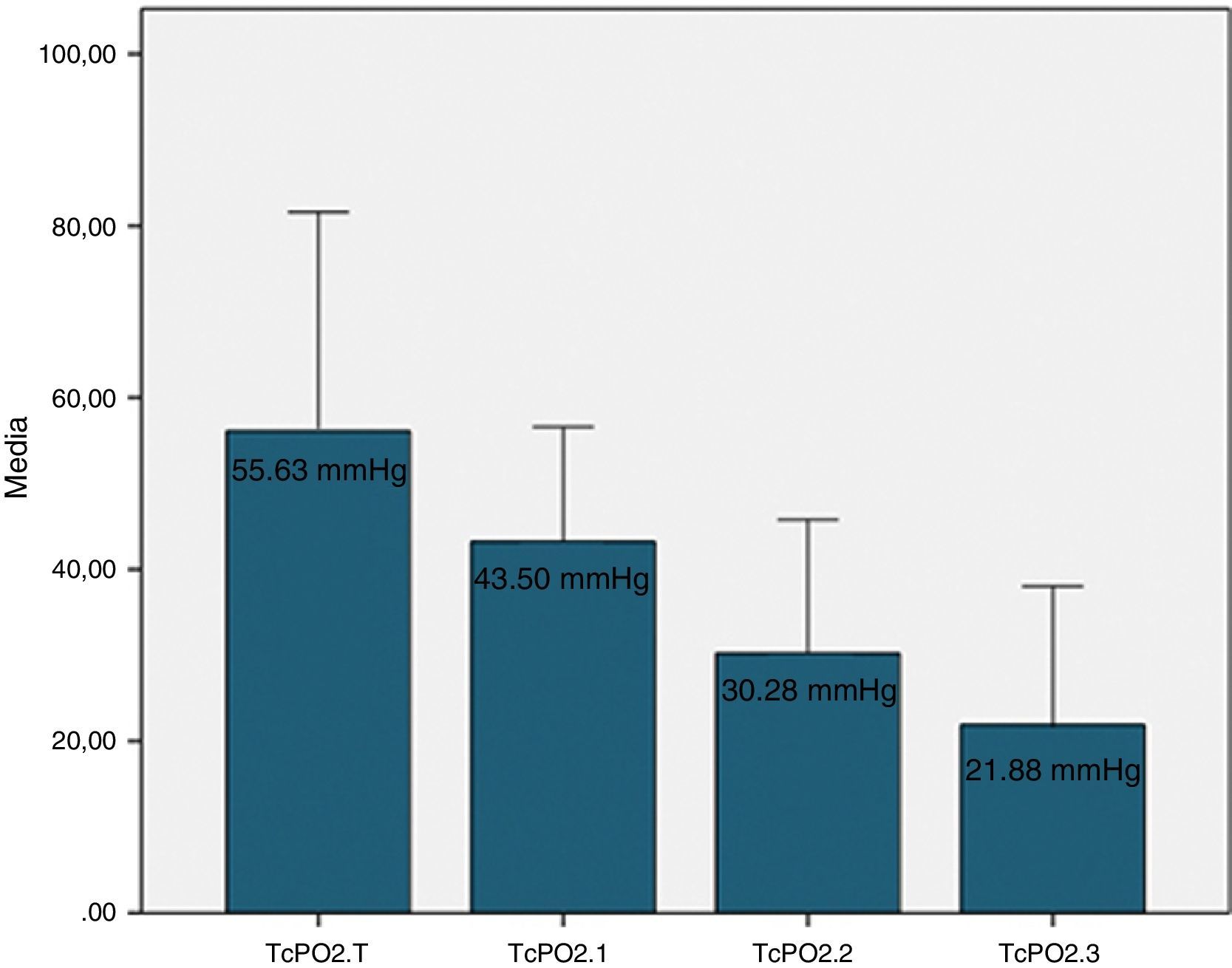
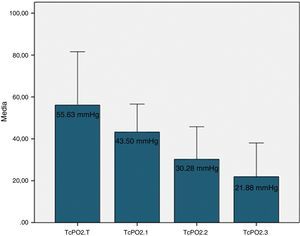
Los valores de la TcPO2 se representan en la figura 2, encontrándose diferencias estadísticamente significativas entre los valores de todos los niveles (ANOVA, p=0,000), como era de esperar.
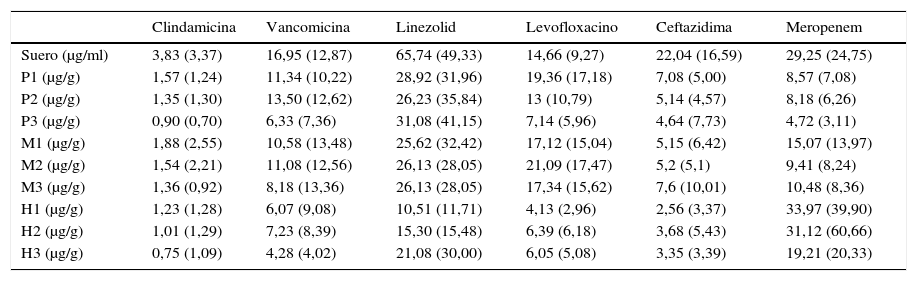
Las concentraciones de antibióticos en tejido y suero se detallan en la tabla 2 y en las figuras 3 y 4.
Concentraciones de antibióticos en suero y tejidos
| Clindamicina | Vancomicina | Linezolid | Levofloxacino | Ceftazidima | Meropenem | |
|---|---|---|---|---|---|---|
| Suero (μg/ml) | 3,83 (3,37) | 16,95 (12,87) | 65,74 (49,33) | 14,66 (9,27) | 22,04 (16,59) | 29,25 (24,75) |
| P1 (μg/g) | 1,57 (1,24) | 11,34 (10,22) | 28,92 (31,96) | 19,36 (17,18) | 7,08 (5,00) | 8,57 (7,08) |
| P2 (μg/g) | 1,35 (1,30) | 13,50 (12,62) | 26,23 (35,84) | 13 (10,79) | 5,14 (4,57) | 8,18 (6,26) |
| P3 (μg/g) | 0,90 (0,70) | 6,33 (7,36) | 31,08 (41,15) | 7,14 (5,96) | 4,64 (7,73) | 4,72 (3,11) |
| M1 (μg/g) | 1,88 (2,55) | 10,58 (13,48) | 25,62 (32,42) | 17,12 (15,04) | 5,15 (6,42) | 15,07 (13,97) |
| M2 (μg/g) | 1,54 (2,21) | 11,08 (12,56) | 26,13 (28,05) | 21,09 (17,47) | 5,2 (5,1) | 9,41 (8,24) |
| M3 (μg/g) | 1,36 (0,92) | 8,18 (13,36) | 26,13 (28,05) | 17,34 (15,62) | 7,6 (10,01) | 10,48 (8,36) |
| H1 (μg/g) | 1,23 (1,28) | 6,07 (9,08) | 10,51 (11,71) | 4,13 (2,96) | 2,56 (3,37) | 33,97 (39,90) |
| H2 (μg/g) | 1,01 (1,29) | 7,23 (8,39) | 15,30 (15,48) | 6,39 (6,18) | 3,68 (5,43) | 31,12 (60,66) |
| H3 (μg/g) | 0,75 (1,09) | 4,28 (4,02) | 21,08 (30,00) | 6,05 (5,08) | 3,35 (3,39) | 19,21 (20,33) |
H: hueso; M: músculo; P: piel.
1, 2 y 3 indican el nivel de perfusión.
Media y desviación típica (entre paréntesis) de concentraciones expresada en μg/ml (suero) y μg/g (tejidos).
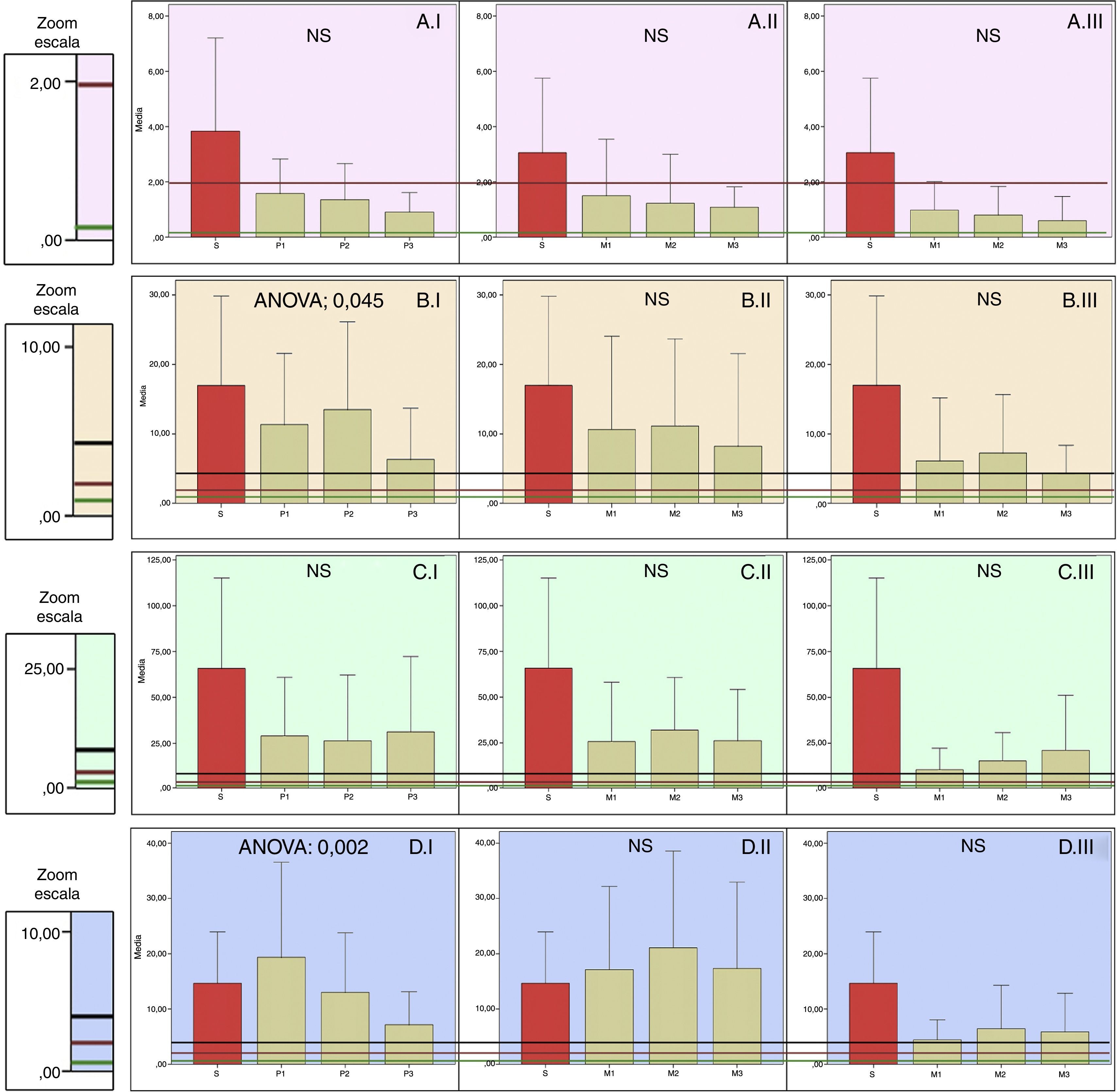
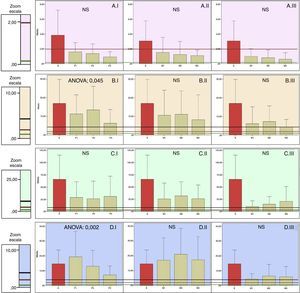
Distribución de las concentraciones de antibióticos frente a cocos grampositivos. Las columnas representan las medias de las concentraciones y las barras de error±la desviación típica (H: hueso; M: músculo; P: piel; S: suero). El número 1, 2 o 3 que acompaña a estas iniciales representa el nivel de perfusión. ANOVA representa el nivel de p para los casos en que existen diferencias estadísticamente significativas entre los niveles de perfusión (NS: no significativo). Las líneas horizontales representan la CMI de diferentes microrganismos.
CLINDAMICINA. A.I. Piel. A.II. Músculo. A.III. Hueso.
B. fragilis19.
S. aureus19.
VANCOMICINA. B.I. Piel. B.II. Músculo. B.III. Hueso.
E. faecalis, E. faecium, S. epidermidis, S. coagulasa negativo18,19.
S. aureus18,19.
S. agalactiae, S. pyogenes18,19.
LINEZOLID. C.I. Piel. C.II. Músculo. C.III. Hueso.
B. fragilis18,19.
S. aureus, E. faecalis, E. faecium, C. difficile18,19.
S. epidermidis, S. coagulasa negativo, S. agalactiae, S. pyogenes18,19.
LEVOFLOXACINO. A.I. Piel. A.II. Músculo. A.III. Hueso.
P. aeruginosa19, E. faecalis, E. faecium18.
S. pyogenes18.
Acinetobacter spp., E. coli, Klebsiella spp., Proteus spp., S. aureus, S. coagulasa negativo18.
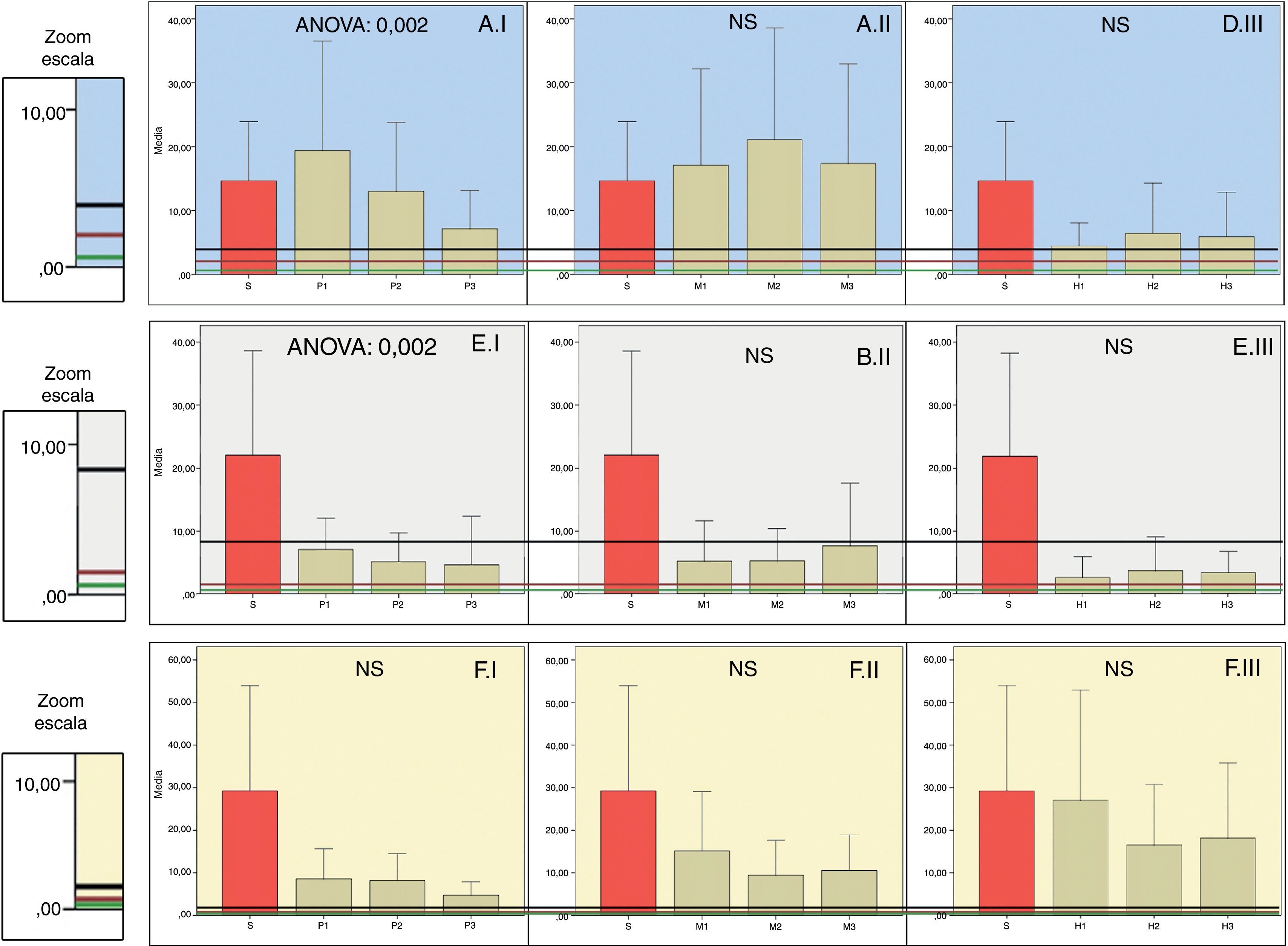
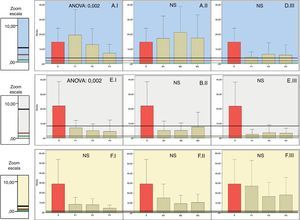
Distribución de las concentraciones de antibióticos frente a bacilos gram negativos. Las columnas representan las medias de las concentraciones y las barras de error±la desviación típica (H: hueso; M: músculo; P: piel; S: suero). El número 1, 2 o 3 que acompaña a estas iniciales representa el nivel de perfusión. ANOVA representa el nivel de p para los casos en que existen diferencias estadísticamente significativas entre los niveles de perfusión (NS: no significativo). Las líneas horizontales representan la CMI de diferentes microrganismos.
LEVOFLOXACINO. A.I. Piel. A.II. Músculo. A.III. Hueso.
P. aeruginosa19, E. faecalis, E. faecium18.
S. pyogenes18.
Acinetobacter spp., E. coli, Klebsiella spp., Proteus spp., S. aureus, S. coagulasa negativo18.
CEFTAZIDIMA. B.I. Piel. B.II. Músculo. B.III. Hueso.
P. aeruginosa18.
E. cloacae18.
E. coli18,19, Klebsiella spp., Serratia spp., M. morganii, P. mirabilis18.
MEROPENEM. C.I. Piel. C.II. Músculo. C.III. Hueso.
P. aeruginosa, A. baumannii18.
B. fragilis18,19, M. morganii, P. mirabilis, Serratia spp.18.
E. cloacae, E. coli, Klebsiella spp.18.
El análisis de las variables predictoras, como la diabetes y la IRC, en cada uno de los grupos no mostró relación con el grado de difusión tisular de ningún antibiótico.
DiscusiónSe han evaluado 3 tejidos diferentes en cada paciente: piel, músculo y hueso. A su vez en cada paciente se han establecido 3 niveles distintos de perfusión, siendo la TcPO2T el control de las determinaciones en los miembros inferiores. Todos los pacientes incluidos en el estudio tenían un déficit de perfusión por isquemia crónica de miembros inferiores, como se demuestra en la figura 2. La oximetría es un método reproducible y aplicable a todo tipo de pacientes para determinar el grado de isquemia, a diferencia de la clínica, que es subjetiva; los pulsos, que no son siempre evaluables, y el ITB, que es poco fiable en los diabéticos por la calcinosis arterial20.
Con un tamaño muestral entre 6 y 10 individuos se obvia el sesgo de la variabilidad biológica. No hay estudios piloto previos en la literatura para poder estimar el tamaño muestral.
A pesar de la importancia de conocer la concentración tisular de los antibióticos en tejidos isquémicos, pocos trabajos la han evaluado y prácticamente todos se refieren a las cefalosporinas de tercera generación.
Así, Raymakers et al.21 establecieron un protocolo de estudio en 16 pacientes con isquemia crónica, en el que trataron de comprobar los determinantes de la difusión tisular de la ceftazidima, encontrando que el principal era el grado de isquemia, no viéndose influenciada por la existencia o no de diabetes.
En otro trabajo, Kerin et al.22 concluyen que la penetración de metronidazol y cefradina en tejidos isquémicos alcanza el nivel de la CMI-50 para la mayoría de los microorganismos, y que el grado de isquemia no altera dichas concentraciones; sin embargo, en el momento actual no son antibióticos de elección, especialmente cefradina, para los microorganismos presentes en este tipo de patología.
En este sentido, otro trabajo sobre fleroxacino23 en tejidos isquémicos concluye que la concentración es similar en tejidos isquémicos y en los que no lo son.
Respecto al comportamiento de clindamicina en nuestro trabajo, se ha podido comprobar que la concentración en los tejidos no depende de la perfusión y que la difusión es similar en piel, músculo y hueso. Sin embargo, las concentraciones alcanzadas no serían eficaces para todos los microorganismos, en concreto para algunas cepas de Bacteroides fragilis (CMI: 0,5-2)19. Deberíamos evitar su uso si sospechamos infección por dicho Bacteroides.
Aunque se propone en las guías de práctica clínica por su probada eficacia en las infecciones del pie diabético leves y moderadas,7 en base a nuestros resultados las concentraciones alcanzadas podrían ser insuficientes en algunas infecciones.
La concentración de vancomicina en piel depende de la perfusión; sin embargo, la concentración en músculo y hueso se mantiene constante sea cual sea la TcPO2, siendo en hueso inferior a la del resto de tejidos.
No hay otros estudios sobre la influencia de la isquemia en la difusión tisular de vancomicina.
De acuerdo con otros autores, la penetración en hueso de vancomicina es inferior a otros antibióticos, entre ellos clindamicina24.
A pesar de estos hallazgos, las concentraciones alcanzadas son suficientes para tratar las infecciones por la mayoría de cocos grampositivos18,19.
Linezolid difunde igual en todos los tejidos y sin depender de la perfusión, viniendo a apoyar los buenos resultados publicados en infecciones de pie diabético, en los que se concluye que la penetración de linezolid es adecuada en las zonas inflamadas de heridas, similar a las de controles sanos, y constituye un tratamiento eficaz contra las infecciones por Staphylococcus aureus resistente a meticilina (SARM)25,26.
En conclusión, frente a cocos grampositivos la clindamicina puede no ser eficaz frente a algunos anaerobios, vancomicina tiene peor difusión en hueso y en piel mal perfundida, mientras que la difusión tisular de linezolid no se ve influenciada por la perfusión, difundiendo por igual en todos los tejidos, asegurándonos eficacia frente a grampositivos18,19 e incluso anaerobios19, para los que clindamicina sería ineficaz.
La concentración de levofloxacino en la piel se ve influenciada por la perfusión. Sin embargo, la concentración en músculo y hueso no depende de la misma. La difusión en hueso es inferior a la del resto de tejidos.
Oberdorfer et al.27 evaluaron la concentración sérica y tisular de levofloxacino en pacientes diabéticos con infecciones en los pies, encontrando una muy buena penetración de levofloxacino en las heridas, pero no se establece el grado de isquemia, por lo que no se pueden obtener conclusiones a este respecto. En otro trabajo con pacientes sometidos a cirugía ortopédica se encuentran datos concordantes con nuestros resultados, siendo las concentraciones más altas en la piel, seguidas por las del músculo y las más bajas en hueso. Concluyen que levofloxacino es una buena opción en la profilaxis preoperatoria y para el tratamiento de infecciones en hueso, ya que las concentraciones se encuentran por encima de la CMI de los patógenos más relevantes28.
Queda demostrado que la concentración de ceftazidima en piel disminuye en las zonas más isquémicas, pero esto no se constata en músculo ni en hueso.
Ceftazidima había sido previamente estudiada comprobando la influencia de la isquemia en su difusión, siendo el principal determinante para la piel y el hueso21 y evidenciando que la penetración en hueso isquémico era adecuada29.
Sin embargo, en nuestra serie no se alcanza el punto de corte de la CMI de Pseudomonas aeruginosa (CMI: 8)18, por lo que no debe emplearse para este microorganismo.
Según nuestros resultados, si sospechamos que la infección pueda estar causada por P.aeruginosa, una excelente alternativa sería el empleo de meropenem, ya que no depende de la perfusión, y la concentración que alcanza en hueso es superior a la del resto de tejidos.
Una limitación del estudio ha sido la determinación de la perfusión de los tejidos, ya que la TcPO2 es una medida de la presión de oxígeno en la piel, extrapolando que la perfusión del músculo y la del hueso se correlacionan con dicho valor.
Nuestro trabajo aporta información novedosa sobre antibióticos ampliamente utilizados de los que no se conocía su comportamiento en zonas de isquemia, pudiendo con algunos de ellos, como hemos visto, mejorar las probabilidades de curación.
Así, clindamicina en tejidos isquémicos no alcanza el punto de corte de la CMI de algunos anaerobios y cocos grampositivos; vancomicina y levofloxacino disminuyen su concentración en zonas mal perfundidas y en el hueso, aunque se alcanza el punto de corte de la CMI de los microorganismos diana; ceftazidima también disminuye su concentración en las zonas peor perfundidas, y además no sería eficaz en tejidos isquémicos frente a P.aeruginosa. Linezolid y meropenem mantienen su concentración sea cual sea la perfusión y en todos los tejidos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Al Biobanco del Hospital Universitario San Cecilio de Granada (Biobanco del Sistema Sanitario Público de Andalucía) y al Centro de Instrumentación Científica de la Universidad de Granada.