Se ha evaluado el nuevo sistema automatizado cobas 4800 CT/NG test para la detección de Chlamydia trachomatis (C. trachomatis) en muestras urogenitales.
Material y métodosSe analizaron 696 muestras (488 exudados uretrales y cervicales y 208 orinas) para la detección de ADN de C. trachomatis. Los resultados del cobas 4800 CT/NG test (c4800) se compararon con los obtenidos por el Cobas AMPLICOR CT/NG test (CAM). Las discordancias se analizaron mediante PCR convencional y electroforesis en gel de agarosa en microchips, MultiNA.
ResultadosSe realizaron dos análisis simultáneos, el primero de ellos fue comparar los resultados obtenidos con los exudados en el c4800 y en CAM. En este caso, la sensibilidad, la especificidad y los valores predictivos positivo (VPP) y negativo (VPN) fueron del 77,9, el 100, el 100 y 96%, respectivamente. El segundo análisis fue comparar los resultados obtenidos para las muestras de orina con los obtenidos con sus correspondientes exudados en el c4800. Los valores obtenidos para sensibilidad, especificidad, VPP y VPN fueron: 100, 98,9, 92,9 y 100%, respectivamente. Los valores kappa de estas comparaciones fueron: 0,857 exudados en c4800 y CAM y 0,957 para orina frente a exudados en c4800.
ConclusionesLos resultados obtenidos con c4800 demuestran que son equiparables con los obtenidos con CAM. Asimismo, observamos una correlación excelente al comparar las muestras de exudados con su correspondiente muestra de orina en c4800, por lo que se puede emplear dicha muestra de forma sistemática en el diagnóstico de estas infecciones tanto en varón como en mujeres.
To evaluate the new automated system cobas 4800 CT/NG test for detection of Chlamydia trachomatis in urogenital specimens.
Material and methodsWe analyzed 696 specimens (488 swabs from urethral or cervical specimens, and 208 urines) to detect C. trachomatis. The results of the cobas 4800 CT/NG test (c4800) were compared to those obtained with Cobas AMPLICOR CT/NG test (CAM). Discordant results were analyzed with a conventional PCR assay and microchip electrophoresis system in agarose gel, MultiNA.
ResultsWe made two simultaneous analyses. In the first one, we compared the results obtained with swab specimens using the c4800 system and CAM. In this case, the sensitivity, the specifity, the positive and negative predictive values (PPV and NPV) were: 77.9%, 100%, 100% and 96% respectively. In the second one, we compared the results obtained for urine and its corresponding swab specimens on the c4800. The values obtained were: 100%, 98.9%, 92.9% and 100% respectively. The kappa values of these comparisons were: 0.857 for swab specimens on the c4800 and CAM, and 0.957 for urine versus swab specimens on the c4800.
ConclusionsThe results obtained with c4800 system were completely comparable with those obtained with CAM. We also noted an excellent correlation with these results when we compared swab specimens with their urine samples in the c4800 system. Therefore this sample type could be used routinely to diagnose infections in men and women.
El interés epidemiológico de las infecciones producidas por Chlamydia trachomatis (C. trachomatis) ha aumentado en los últimos años ya que se ha convertido en la principal causa de infección de transmisión sexual (ITS)1, estimándose en 90 millones los casos nuevos que aparecen a nivel mundial2. Entre un 50 y un 75% de las infecciones urogenitales por C. trachomatis en varones y mujeres son asintomáticas y, si la infección persiste durante meses sin tratamiento, puede desencadenar severos problemas reproductivos como son enfermedad inflamatoria pélvica (EIP), infertilidad y embarazos ectópicos en mujeres3–5 y epididimitis, uretritis y prostatitis en varones6–8. Además, algunos estudios han sugerido a C. trachomatis como cofactor para el progreso a cáncer cervical entre mujeres infectadas por virus del papiloma humanos (VPH)9–11.
Actualmente, las técnicas de amplificación de ácidos nucleicos (TAN) se consideran la técnica patrón para el diagnóstico de la infecciones urogenitales producidas por la detección rutinaria de C. trachomatis. Las numerosas ventajas de las TAN, como son la buena sensibilidad y la posibilidad de realizarlas en muestras no invasivas como la orina, las hace ideales para este diagnóstico. Sin embargo, algunas técnicas comerciales12–15 presentan problemas en la correcta detección de la denominada variante sueca de C. trachomatis (nvCT), detectada en 2007. Dicha variante se caracteriza por presentar una deleción de 377 pb en el plásmido críptico de C. trachomatis, que es precisamente la diana de amplificación de dichas técnicas. Por ello, las nuevas TAN, como la evaluada en este trabajo (cobas 4800 [c4800], y en general las basadas en PCR a tiempo real) incorporan al menos dos dianas para aumentar la sensibilidad y especificidad y disminuir así los potenciales falsos negativos.
En este estudio, hemos comparado los resultados obtenidos por la técnica c4800 CT/NG (Roche Diagnostics, Mannheim, Alemania) para la detección de C. trachomatis con los obtenidos por el sistema Cobas AMPLICOR CT/NG (CAM) (Roche Diagnostics, Mannheim, Alemania) para la detección de C. trachomatis en muestras cervicales y uretrales. Por otro lado, hemos evaluado la utilidad del sistema c4800 para la detección de C. trachomatis directamente en muestras de orina empleando como referencia el resultado obtenido en su correspondiente muestra pareada de exudado.
Material y métodosMuestras clínicasPara la comparación entre los sistemas c4800 y el CAM se analizaron un total de 495 muestras (280 exudados cervicales y 215 exudados uretrales). Para el segundo estudio se tomaron muestras pareadas de orina y exudados de 208 pacientes (156 exudados cervicales y 52 exudados uretrales frente a 208 orinas). Todas las muestras procedían de pacientes atendidos en el Centro de Infecciones de Transmisión Sexual de Sevilla (CITS) tomadas desde mayo a agosto de 2010. La prevalencia global de esta infección en la población del estudio es 12,3% (60/488 muestras) y específicamente del 11,2% (31/276) en muestras cervicales y un 13,7% (29/212) en muestras uretrales. Esta elevada prevalencia se corresponde a un grupo sesgado (pacientes atendidos en el CITS), y no se refieren a datos de prevalencia de la población general. El estudio incluyó tanto a pacientes sintomáticos (34%) como asintomáticos (grupos control de seguimiento [54%], seguimiento de contactos [8,6%] y control postratamiento [3,4%]).
Preparación de las muestras para cobas 4800 CT/NG test y Cobas AMPLICOR CT/NG testLos exudados, tanto cervicales como uretrales, se recogieron con el sistema STD Swab Specimen Collection and Transport Set (Roche Molecular Systems, Mannheim, Alemania). Para su análisis con el c4800 se tomaron 500μl de la suspensión de la muestra en el medio de transporte y se añadieron al Cobas PCR media contenido en el Swab Sample Kit usado por el sistema c4800 (Roche Molecular Systems, Mannheim, Alemania). Al resto (otros 500μl) se le añadió 1ml de reactivo de lisis CT/NG DIL (Cobas AMPLICOR, Roche Molecular Systems, Barcelona, España) y se mantuvieron 24-48 h a temperatura ambiente antes de ser procesadas por el CAM (Roche Diagnostics, España) según las instrucciones del fabricante.
Las muestras de orina (siempre la primera parte de la micción para obtener por arrastre los microorganismos presentes en uretra) fueron preparadas para su procesamiento en el sistema c4800 añadiendo 750μl de muestra, previamente agitada, al Cobas PCR media contenido en el Urine Sample Kit (Roche Molecular Systems, Barcelona, España).
El CAM realiza una PCR convencional a tiempo final para la detección de CT utilizando los cebadores CP24 y CP27 que definen una región de aproximadamente 207 nucleótidos del plásmido críptico de CT.
Funcionamiento del sistema cobas 4800El c4800 CT/NG test permite realizar por separado la detección de CT, NG o ambos en el mismo ensayo. En este estudio seleccionamos sólo la detección de CT en todas las muestras analizadas. La prueba c4800 utiliza los cebadores CP102 y CP103 para definir una secuencia de aproximadamente 206 nucleótidos dentro del ADN del plásmido críptico de CT que permite la detección de nvCT. Además, se incluyen los cebadores CTMP101 y CTMP102 para definir una secuencia de aproximadamente 182 nucleótidos del ADN genómico del gen ompA de CT.
El sistema se basa en una PCR a tiempo real totalmente automatizada. Las muestras se analizan con sus correspondientes controles y reactivos de extracción y amplificación en el equipo cobas X 480 para la extracción del ADN. A cada muestra se le añade un control interno durante su procesamiento para controlar la correcta extracción, amplificación y posible inhibición de la muestra. El propio sistema carga el ADN extraído de cada muestra, los controles y los reactivos de amplificación en una placa de 96 pocillos. Esta placa se sella manualmente y se coloca en el sistema cobas Z 480 donde se realizará la PCR a tiempo real. Los resultados se describen como positivo, negativo, error (error en la extracción de la muestra) o inválido (el control interno fue negativo) según un algoritmo del software de interpretación del c4800 pudiendo además determinarse el valor umbral (Ct) de cada muestra.
Estudio de las muestras discordantes por el sistema MultiNALas muestras con resultados discordantes entre ambos sistemas, se conservaron a –20°C para su posterior análisis por un método de PCR alternativo que consistió en un amplificación mediante PCR convencional con el kit comercial STD6 ACE Detection (Seegene Inc, Korea) que puede detectar 6 organismos distintos (Trichomonas vaginalis, Mycoplasma hominis, Mycoplasma genitalium, Chlamydia trachomatis, Neisseria gonorrhoeae y Ureaplasma urealyticum)16. La diana molecular para CT de este kit es el gen codificante para la proteína DnaB del plásmido críptico de CT. El kit incluye como control interno (control de la inhibición de la PCR) el gen de la celulosa sintetasa de Arabidopsis spp. (CesA3). La posterior detección de amplicones se realizó mediante una electroforesis en gel de agarosa en microchips con el instrumento MultiNA (Shimadzu Biotech, Korea) y el kit ADN-1000 (Shimadzu Biotech, Korea).
El resultado obtenido con este último sistema unido a los datos de la historia clínica de los pacientes se usaron para determinar la certeza de los datos obtenidos con los sistemas que se comparan en este estudio.
Análisis estadísticoEl análisis estadístico de este estudio se realizó con el programa SPSS Statistics v18 (IBM, España). Los valores de concordancia se obtuvieron determinando el valor kappa (κ) y unos intervalos de confianza del 95%. Los valores de kappa se interpretan como: menor o igual al 20%, escasa concordancia; 21-40% ligera concordancia; 41-60% concordancia moderada; 61-80% buena concordancia, y superior al 80% presenta una excelente concordancia. La extrapolación de los datos se realizó con la prueba no paramétrica de la χ2 de McNemar para determinar que la proporción de muestras clasificadas como positiva por un método y negativa por otro, es igual a la proporción de muestras clasificadas como negativa por un sistema y positivo por el otro.
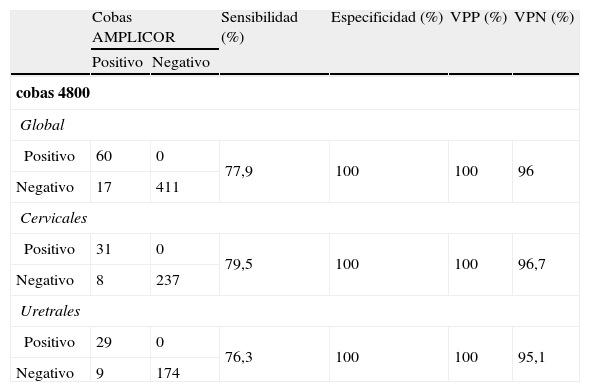
ResultadosLos resultados obtenidos por el ensayo c4800 y CAM se muestran en las tablas 1 y 2. De las 495 muestras de exudados analizados, hubo 7 muestras que en el c4800 se interpretaron como error (presencia de coágulo) o inválido (control interno inhibido). Dichas muestras se excluyeron de los análisis. En total se compararon 488 muestras, de las que 60 fueron positivas para CT por ambos métodos (31 cervicales y 30 uretrales, el rango del valor umbral de los ciclos fue de 27 a 41, con una media de 35 ciclos y mediana de 36 ciclos) y 411 fueron negativas por ambos sistemas.
Comparación de resultados obtenidos para la detección de CT por el sistema Cobas AMPLICOR y cobas 4800 en exudados. Se muestran los resultados globales (cervical y uretral) y cada uno por separado
| Cobas AMPLICOR | Sensibilidad (%) | Especificidad (%) | VPP (%) | VPN (%) | ||
| Positivo | Negativo | |||||
| cobas 4800 | ||||||
| Global | ||||||
| Positivo | 60 | 0 | 77,9 | 100 | 100 | 96 |
| Negativo | 17 | 411 | ||||
| Cervicales | ||||||
| Positivo | 31 | 0 | 79,5 | 100 | 100 | 96,7 |
| Negativo | 8 | 237 | ||||
| Uretrales | ||||||
| Positivo | 29 | 0 | 76,3 | 100 | 100 | 95,1 |
| Negativo | 9 | 174 | ||||
VPN: valor predictivo negativo; VPP: valor predictivo positivo.
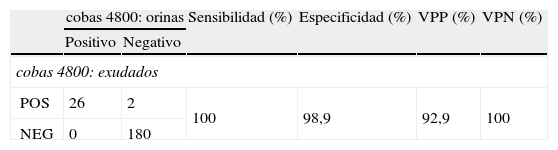
Comparación de resultados obtenidos para la detección de CT por el cobas 4800 en las muestras de exudados y orinas
| cobas 4800: orinas | Sensibilidad (%) | Especificidad (%) | VPP (%) | VPN (%) | ||
| Positivo | Negativo | |||||
| cobas 4800: exudados | ||||||
| POS | 26 | 2 | 100 | 98,9 | 92,9 | 100 |
| NEG | 0 | 180 | ||||
VPN: valor predictivo negativo; VPP: valor predictivo positivo.
Los valores de sensibilidad, especificidad, VPP y VPN se calcularon tomando como referencia los resultados del CAM: 77,9%, 100%, 100% y 96%, respectivamente. Los valores de kappa o grado de concordancia entre ambos sistemas evaluados fue 0,857. Encontramos 17 discordancias (8 cervicales y 9 uretrales), todas correspondientes a muestras positivas por el sistema CAM y negativas por c4800.
En 208 pacientes analizamos en paralelo la muestra de orina y su correspondiente exudado (cervical en mujeres, uretral en varones), de las cuales 26 fueron positivas para CT en ambas muestras (16 cervicales y 10 uretrales, el rango del valor umbral de lo ciclos de las orinas fue de 25 a 36, con una media de 31 ciclos y mediana de 33 ciclos) y en 180 pacientes; las dos muestras fueron negativas, con una concordancia del 99% (206/208 muestras). Obtuvimos 2 muestras discordantes correspondientes a 2 muestras de exudados cervicales que fueron positivas y la orina fue negativa. Para esta comparación, el valor de kappa fue 0,957.
El valor de Ct calculado para los exudados uretrales por el sistema c4800 tenía una media de 33 ciclos (rango 27-40) mientras que los cervicales tenían una media de 36 ciclos (rango 30-41). El valor de Ct calculado para las orinas de pacientes varones tuvieron una media de 29 ciclos (rango 25-31). Las orinas de mujeres presentaban una media de 33 ciclos (rango 27-36).
Las discordancias de ambos estudios, se comprobaron con el sistema MultiNA y todas las muestras fueron negativas, coincidiendo con los resultados obtenidos con el c4800 por lo que podríamos considerarlos como falsos positivos del sistema CAM. Además, al consultar los datos de la historia clínica de estos pacientes, ninguno presentaba sospecha clínica de infección en el momento de la toma de muestras.
DiscusiónEn este estudio, la técnica c4800 CT/NG ha demostrado ser una buena técnica de detección de ADN de C. trachomatis y su sistema automatizado permite realizar de 3 a 4 tandas de 22 o 94 muestras por una única persona durante su jornada laboral. Además, los resultados obtenidos por c4800 con respecto al CAM han mostrado una concordancia con valores de 96,5% (471/488 muestras), 97,1% (268/276 muestras) y 95,8% (203/212 muestras) en resultados globales, exudados cervicales y uretrales respectivamente, considerando a CAM como método de referencia en este estudio ya que es el método actualmente utilizado en nuestro laboratorio en la rutina diaria. Al examinar las muestras discordantes con el sistema MultiNA todas fueron negativas, lo que sumado a la ausencia de sospecha clínica de infección en el momento de la toma de muestra, corroboraría que se tratase de falsos positivos del CAM. Si consideramos esta premisa, al recalcular la sensibilidad entre ambos métodos obtendríamos un valor de 100%, ajustándose al hecho de que c4800 presenta una doble diana frente a C. trachomatis (gen ompA y plásmido críptico) que aumenta la sensibilidad y la especificidad de la técnica en comparación con CAM que solo tiene una diana. Este método de detección de CT se ha utilizado como método alternativo a los dos anteriores por poseer una región diana diferente de CAM y c4800 (no como método de referencia ya que existen pocos datos disponibles sobre su sensibilidad y especificidad).
Destacamos los valores de sensibilidad y especificidad, el 100 y el 98,9% respectivamente, en la comparación de los exudados con su correspondiente orina en el c4800, por lo que podemos considerar que las orinas, al ser una muestra no invasiva y por sus buenos resultados, son una muestra ideal para la detección de C. trachomatis, tanto en varones como mujeres. También destacamos los valores de especificidad y VPP del 100% al comparar los resultados de los exudados analizados por el c4800 y CAM. Estos resultados son similares a los obtenidos en estudios recientes en cuanto a concordancia entre sistemas utilizados, tipo de muestras e índice kappa obtenidos17,18.
Se necesitan más estudios que evalúen la técnica c4800 en otro tipo de muestras como pueden ser exudados rectales y faríngeos para comprobar completamente su utilidad general, ya que para este tipo de muestras el cultivo sigue siendo la técnica más específica (100%) pero presenta una baja sensibilidad (70-85%). Se utilizan habitualmente células McCoy, HeLa229 y BGMK, y generalmente en shell vial. Las inclusiones citoplasmáticas se pueden observar a las 48 o 72 h de incubación, tras tinción de las preparaciones con lugol o Giemsa, o con anticuerpos monoclonales marcados con fluoresceína19. Además, la revisión 5.0 de 10/2004 y la 2.0 de los inserts de CAM y c4800, respectivamente, especifican que estas técnicas no están dirigidas para este tipo de muestras (solo recomiendan el uso de orinas y exudados urogenitales). Otras técnicas comerciales, como son Aptima Combo 2 (Gen-Probe Inc, San Diego, CA) o ProbeTec (Becton Dickinson Co, Sparks, MD), han obtenido buenos resultados de sensibilidad y especificidad con exudados rectales comparados con otras técnicas comerciales y el cultivo20.
En conclusión, nuestros resultados muestran que el nuevo c4800 en cuanto a sensibilidad, especificidad, VPP y VPN en muestras urogenitales y en orinas son equiparables al método usado rutinariamente en nuestro laboratorio, el CAM. Además, al ser una PCR a tiempo real, la obtención de resultados es más rápido (al menos 48 h) que con el sistema CAM. Esto, junto con la comentada presencia de la doble diana de detección hace que el sistema c4800 sea un instrumento eficaz en la práctica rutinaria para el diagnóstico de estas infecciones en varones y mujeres.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Este trabajo ha sido parcialmente financiado por Roche Diagnostics, Barcelona, España.