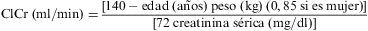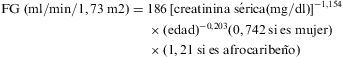la afección renal en el contexto de la infección por VIH-1 y el tratamiento antirretroviral es un episodio de prevalencia creciente que tiene un impacto significativo sobre el tratamiento del paciente con esta infección. En la presente revisión se examinan los datos epidemiológicos de la afección renal en la infección por VIH-1, el espectro de daño renal asociado con ésta y con su tratamiento, y sus diferentes formas de presentación clínica. Como contribución práctica al tratamiento de los pacientes con infección por VIH-1 y disfunción renal, se proporcionan guías para la evaluación de los problemas nefrológicos más frecuentes, así como su tratamiento práctico en la clínica diaria.
Renal dysfunction in the setting of HIV-1 infection and antiretroviral therapy is an increasingly more common event that has a significant impact on the clinical management of HIV-1-infected patients. The present review examines the epidemiology of renal dysfunction in HIV-1-infected patients, the spectrum of renal injury associated with HIV-1 infection and its treatment, and the various forms of presentation seen in daily clinical practice. As a practical contribution to the management of HIV-1-associated renal dysfunction, guidelines are proposed for assessing the most common kidney-related problems and their management in daily practice.
Los avances en el tratamiento antirretroviral (ARV) en la última década se han traducido en una importante reducción de la morbimortalidad y en una mejoría en la calidad de vida de los pacientes infectados por VIH-1 en los países desarrollados1. El aumento en la esperanza de vida en estos pacientes ha traído como consecuencia un cambio en el espectro de las complicaciones clínicas y de las causas de mortalidad, y mientras que se aprecia una disminución de las infecciones oportunistas y otras enfermedades asociadas al síndrome de inmunodeficiencia adquirida (sida), se han incrementado las neoplasias no definitorias de sida, la hepatopatía y la enfermedad cardiovascular2–4.
La afección renal es relativamente frecuente en el curso de la infección por VIH-1, aunque existe una gran variabilidad en su prevalencia según las diferentes áreas geográficas, determinada por factores étnicos y por la epidemiología de la infección por VIH-1 (edad, sexo, conducta de riesgo). En poblaciones con un porcentaje elevado de individuos de raza negra, la nefropatía asociada al VIH-1 (HIVAN) se ha convertido en una causa frecuente de insuficiencia renal aguda (IRA), enfermedad renal crónica (ERC) y nefropatía terminal que requiere diálisis, y es un factor de progresión al sida y a la muerte en este grupo de pacientes5–7.
La etiología de la nefropatía en los pacientes infectados por VIH-1 es muy diversa. Puede estar directamente relacionada con la propia infección, como la HIVAN, las glomerulonefritis asociadas a inmunocomplejos o la microangiopatía trombótica; puede estar provocada por infecciones oportunistas o por el tratamiento de éstas, o puede estar provocada por el propio tratamiento ARV. Asimismo, esta nefropatía puede estar relacionada con comorbilidades concomitantes, como la diabetes mellitus (DM), la hipertensión arterial (HTA), y la coinfección por el virus de la hepatitis C (VHC), el virus de la hepatitis B (VHB) y la sífilis.
La afección renal puede manifestarse como IRA o ERC. En general, la IRA suele ser de moderada intensidad; las necesidades de diálisis, infrecuentes y el pronóstico, generalmente, bueno (igual que en la población sin infección por VIH-1). En la era previa al tratamiento antirretroviral de gran actividad (TARGA), se describió una prevalencia de IRA del 20% en los pacientes con infección por VIH-1 hospitalizados8; las principales causas eran la necrosis tubular aguda, un 75% de las cuales estaba relacionada con sepsis, y la HIVAN9. En la era pos-TARGA, se ha comunicado que el 10% de los pacientes ambulatorios desarrolla una IRA, con una incidencia de 5,9 episodios por 100 pacientes/año10; los fármacos son los causantes de un tercio de estos episodios. En pacientes hospitalizados, incluso en la era pos-TARGA, aquéllos con infección por VIH-1 tienen mayor riesgo de presentar IRA que los pacientes no infectados (odds ratio [OR]: 2,82; intervalo de confianza [IC] del 95%: 2,66-2,99). La mortalidad de los pacientes que presentaron IRA fue mayor en los infectados por VIH-1 con respecto a los no infectados (OR: 5,83; IC del 95%: 5,11–6,65)11. Los factores asociados a IRA fueron los factores clásicos de la población general, como la edad, la DM, la ERC, así como la insuficiencia hepática y la coinfección por VHB y VHC11. Otros factores identificados como desencadenantes de IRA son las causas prerrenales (deshidratación, sepsis) y la necrosis tubular aguda (isquémica o tóxica)12.
Al contrario que la IRA, la ERC en sus diferentes estadios se relaciona de forma independiente con un mayor riesgo de muerte, desarrollo de enfermedades cardiovasculares y mayor número de ingresos hospitalarios. La prevalencia de ERC —definida como filtrado glomerular (FG) estimado menor de 60ml/min/1,73m2— en pacientes con infección por VIH-1, descrita en la cohorte EuroSida, que incluyó a 4.474 pacientes, fue del 3,5% cuando se empleó la fórmula de Cockcroft-Gault (CG) y del 4,7% cuando se usó la ecuación de modificación de la dieta en la enfermedad renal (MDRD) para estimar el FG13. Como era de esperar, esta cohorte europea incluyó mayoritariamente pacientes caucásicos, mientras que en estudios que incluyeron una mayor proporción de pacientes de raza negra, la prevalencia de insuficiencia renal fue del 15,5%14. En España, la prevalencia ha sido del 8% en pacientes con tratamiento ARV y del 4,7% en pacientes sin tratamiento15. Los factores que de forma más consistente se asociaron a ERC fueron una mayor edad, el grado de inmunodepresión, la raza negra, la coinfección por VHC y la presencia de enfermedades concomitantes como la hipertensión y la DM13,15. El pronóstico de la ERC en pacientes con infección por VIH-1 es peor que en la población de pacientes no infectados; así, en una muy amplia cohorte de Norteamérica, que incluyó a 202.927 pacientes con ERC, de los que el 0,3% tenía infección por VIH-1, se demostró que los pacientes de raza negra tenían un riesgo mayor de insuficiencia renal terminal y de mortalidad (OR: 2,32; IC del 95%: 1,70–3,18) y los de raza blanca mayor riesgo de mortalidad (OR: 2,21; IC del 95%: 1,57–3,13) que los pacientes no infectados; además, esta mortalidad era superior a la de los pacientes diabéticos16.
La prevalencia de infección por VIH-1 descrita en centros de diálisis en España, en Francia y en Estados Unidos es del 0,59, 0,67 y 1,5%, respectivamente17–19. Es de esperar que al aumentar la esperanza de vida de los pacientes con infección por VIH-1 se incremente paralelamente la incidencia de ERC. Debido a que el deterioro de la función renal es clínicamente asintomático, sólo mediante determinaciones analíticas apropiadas es posible evaluar y diagnosticar la presencia de nefropatía en estadios tempranos, y permitir así su adecuado control y tratamiento.
Alteraciones nefrológicas en el paciente con infección por VIH-1Los individuos infectados por VIH-1 presentan una incidencia de nefropatía no despreciable. Tal como se ha apuntado anteriormente, estas alteraciones renales pueden deberse al efecto directo o indirecto del VIH-1 sobre las estructuras del riñón o pueden deberse a factores intercurrentes, entre los que cabe destacar infecciones concomitantes, procesos linfoproliferativos, diversos fármacos y comorbilidades sobreañadidas, como la hipertensión o la DM.
A continuación se revisan los aspectos más relevantes de las nefropatías que deben considerarse en todo paciente infectado por VIH-1 que presente alteraciones renales.
Nefropatías con síndrome glomerularEn pacientes con infección por VIH-1 y enfermedad glomerular debe considerarse siempre la posibilidad de que puedan coexistir lesiones de glomerulopatía asociada al VIH-1 junto con otras lesiones glomerulares por depósitos de inmunocomplejos.
Nefropatía asociada al VIHEs la nefropatía por excelencia de la infección por VIH-1, causada por la infección directa y la expresión génica viral en el tejido renal. A pesar de ser la más característica, no es la nefropatía predominante en España20,21. Su incidencia depende, en gran manera, de la situación geográfica y de las características raciales de la población estudiada, sobre todo, de la proporción de individuos de raza negra, en la que se manifiesta de forma predominante. En Estados Unidos, por ejemplo, se ha convertido en la tercera causa más importante de insuficiencia renal crónica terminal en afroamericanos de 20 a 64 años, y representa aproximadamente el 10% de todos los nuevos casos de insuficiencia renal crónica terminal6,22. Su presencia en individuos de raza blanca es poco frecuente.
Clásicamente, su clínica incluye proteinuria importante con síndrome nefrótico, insuficiencia renal de rápida progresión, riñones grandes e hiperecogénicos en la ecografía y, habitualmente, aunque no siempre, sin hematuria, edema ni hipertensión. Se suele presentar en fases avanzadas de la infección por VIH-1 no controlada o no tratada, con viremias elevadas y recuentos bajos de linfocitos CD4+, aunque se han descrito casos de presentación temprana durante la primoinfección.
El sustrato histológico es muy característico, aunque no patognomónico. Se observa una glomeruloesclerosis segmentaria y focal de tipo colapsante con una cierta expansión mesangial y marcada proliferación e hipertrofia de las células epiteliales glomerulares, que pueden englobar el ovillo retraído simulando semilunas. Está en discusión la procedencia podocitaria o parietal de estas células epiteliales glomerulares23. Simultáneamente aparece también una llamativa afección tubulointersticial con dilatación tubular microquística, con las luces dilatadas rellenas de material eosinofílico proteináceo, infiltrado mononuclear intersticial y fibrosis. La inmunofluorescencia suele ser negativa o inespecífica24,25.
A pesar de una presentación clínica muy sugestiva, si la situación del paciente lo permite, debe realizarse una biopsia renal, la que, además de confirmar el diagnóstico, aportará información sobre el pronóstico de la afección renal.
En cuanto al tratamiento de la HIVAN, a pesar de la falta de estudios prospectivos y aleatorizados que apoyen una determinada pauta frente a otra, datos circunstanciales repetidos en la literatura médica respaldan la idea de que el TARGA debe formar parte de la primera línea de actuación. En la era pre-TARGA, la HIVAN se presentaba como una nefropatía con una progresión inexorable hacia la insuficiencia renal terminal en 6 a 12 meses. Tras la extensión del uso del TARGA, en los pacientes con infección por VIH-1, la evolución hacia la insuficiencia renal terminal en esta entidad se ha reducido significativamente26,27. Además, la utilización del TARGA reduce en aproximadamente un 60% el riesgo de presentar HIVAN, mientras que su incidencia en pacientes tratados con TARGA con buena respuesta y que no han desarrollado sida es muy baja28. En la actualidad, la presencia de HIVAN por sí sola es una indicación absoluta para iniciar TARGA, cuyo uso se ha asociado con remisión clínica e histológica29. Como medidas alternativas o coadyuvantes se ha recomendado el tratamiento con inhibidores de la enzima de conversión de la angiotensina (IECA) o con antagonistas del receptor de la angiotensina-ii (ARA-II), que parecen retrasar la evolución de la nefropatía siempre que ésta no esté muy avanzada30. El tratamiento con esteroides ha mostrado resultados dispares, y su indicación es discutida ante la falta de estudios prospectivos aleatorizados que aseguren su utilidad.
Glomerulonefritis por depósitos de inmunocomplejosAl contrario de lo que sucede con la HIVAN, la glomerulonefritis por depósitos de inmunocomplejos, en general, no tiene una clara predilección racial y aparece también en individuos de raza blanca y asiáticos, lo que provoca que esta glomerulopatía sea la más predominante en los pacientes infectados por VIH-1 en España20,21,31. También en contraposición con la HIVAN, estas nefropatías suelen aparecer en estadios estables de la infección por VIH-1, con buenos recuentos de linfocitos CD4+. Se asocian frecuentemente a la coinfección por VHB y VHC, aunque la reacción inmune provocada por el mismo VIH-1 puede ser la causa primaria32. Estas glomerulopatías se desarrollan a partir de un estímulo antigénico continuado por la persistencia en el organismo del VIH-1 u otros patógenos, como el VHC, y de una respuesta inmune mantenida con la constante formación de inmunocomplejos, que pueden depositarse en las estructuras glomerulares y desencadenar el proceso inflamatorio local.
Las principales glomerulonefritis en este grupo son la glomerulonefritis membranoproliferativa, asociada o no a VHC, la nefropatía por depósitos mesangiales de IgA y la glomerulonefritis por inmunocomplejos similar al lupus. También se han descrito en esta población la glomerulopatía membranosa, la glomerulonefritis postinfecciosa y la glomerulopatía fibrilar e inmunotactoide. Su presentación clínica y evolución diferirá lógicamente según el sustrato histológico subyacente.
La glomerulonefritis membranoproliferativa frecuentemente aparece en individuos coinfectados por VHC, y puede aparecer aislada o en el contexto de crioglobulinemia junto con clínica sistémica de púrpura, artralgias y neuropatía periférica. Su expresión clínica renal suele incluir proteinuria frecuentemente de rango nefrótico, microhematuria e insuficiencia renal en grado variable, y en un determinado porcentaje de casos, acompañarse de descenso del complemento sérico y presencia de crioglobulinas circulantes. Cabe remarcar su interés si se tiene en cuenta que la coinfección por VIH-1-VHC aparece en un tercio de los pacientes con infección por VIH-1 (y predomina en aquellos pacientes con antecedentes de adicción a drogas por vía parenteral, en los que puede llegar a incidencias de hasta el 90%), y que la evolución de esta nefropatía es más agresiva en el paciente coinfectado, con una mayor tasa de evolución a insuficiencia renal terminal33. Su tratamiento es controvertido, con escasa experiencia al respecto en pacientes con infección por VIH-1; aunque parece apropiado un abordaje general, como en cualquier otra glomerulonefritis, con el control de la retención hidrosalina, el tratamiento de la dislipidemia y el control de la presión arterial con el bloqueo del eje renina-angiotensina, junto con el tratamiento de la causa subyacente, que en el caso de la coinfección por VHC pasaría por el tratamiento antiviral con interferón pegilado y ribavirina ajustada por peso y función renal34.
La glomerulonefritis por inmunocomplejos similar al lupus se define como una glomerulopatía con características histológicas, inmunohistológicas y ultraestructurales similares a la nefropatía lúpica proliferativa, focal o difusa, con depósitos subepiteliales y mesangiales de todas las inmunoglobulinas (Ig) y los factores del complemento, incluyendo IgG, IgA, IgM, C3 y C1q, sin evidencia clínica ni serológica de lupus eritematoso sistémico. Su presentación clínica suele ser en forma de proteinuria, habitualmente de rango nefrótico, sedimento activo e insuficiencia renal, que puede llegar a ser progresiva. No existe un tratamiento eficaz: ya de ha ensayado tratamiento con IECA e inmunosupresores con resultados poco prometedores, y se ha observado que el tratamiento ARV y el control de la replicación viral no modifica la historia natural de la enfermedad. El pronóstico de la función renal es malo35.
Se considera que la glomerulonefritis proliferativa mesangial por depósitos de IgA está mediada por la reacción inmune contra los péptidos del VIH-136. Clínicamente, se manifiesta como hematuria asociada a diversos grados de proteinuria e insuficiencia renal, y frecuentemente con HTA que puede llegar a ser grave. Suele tener un curso más benigno que el resto de las glomerulopatías y requerir principalmente el control ajustado de la presión arterial con IECA, tal como está indicado en toda nefropatía crónica proteinúrica.
Debe considerarse que, en determinados pacientes, pueden coexistir lesiones de HIVAN junto con otras lesiones glomerulares por depósitos de inmunocomplejos.
Nefropatías con lesión vascularMicroangiopatía trombóticaLas lesiones de microangiopatía trombótica, que se engloban en las entidades definidas como síndrome hemolítico-urémico (SHU) o púrpura trombótica trombocitopénica (PTT), pueden aparecer en el paciente con infección por VIH-1 con una incidencia variable según las series, y afectan principalmente a los individuos de raza blanca37,38. Se considera que las proteínas virales participan en su patogenia provocando una disfunción endotelial que desencadena la cascada microtrombótica que define esta entidad39 y que conlleva un peor pronóstico en los pacientes con infección por VIH-1 con respecto a los casos de microangiopatías trombóticas idiopáticas. Clínicamente se presenta como una anemia hemolítica microangiopática con trombocitopenia, insuficiencia renal con microhematuria y proteinuria habitualmente moderada. Pueden aparecer fiebre y alteraciones neurológicas. Cuando predomina la expresión de la insuficiencia renal se suele hablar de SHU, mientras que cuando aparecen alteraciones neurológicas o extrarrenales, incluso sin disfunción renal, se prefiere utilizar el término de PTT; aunque esta clasificación clínica, sometida frecuentemente a superposiciones, actualmente está en revisión. Suelen presentar HTA que puede ser grave, incluso con manifestaciones de HTA maligna, situación en la que es difícil valorar si la lesión de la microangiopatía trombótica es causa o consecuencia de la misma malignización de la HTA. Si la trombocitopenia y la situación clínica del paciente lo permiten, es aconsejable realizar una biopsia renal, que dará información del grado de lesión renal, del pronóstico e, incluso, de la existencia de otra glomerulopatía subyacente. Las opciones terapéuticas se basan en la práctica de plasmaféresis e infusión de plasma fresco, con un peor pronóstico que en los casos de microangiopatía trombótica idiopática, con frecuentes recidivas. La administración de antiagregantes plaquetarios, esteroides, Ig, etc. carece de evidencias sólidas para poder recomendarse.
Nefropatías con disfunción tubularEn la actualidad, es decir, en plena “era TARGA”, se debe considerar la posible afección tubular o tubulointersticial ante cualquier paciente infectado por VIH-1 que presente alteración de la función renal, progresiva o no (siempre que se hubieran excluido causas prerrenales u obstructivas), y que conserve la diuresis, con o sin proteinuria leve-moderada (habitualmente menor de 2g/día, de origen tubular), con un sedimento anodino o con leucocituria estéril, o trastornos iónicos o electrolíticos acompañantes, como hipofosfatemia, hipopotasemia o acidosis metabólica. Aunque este primer enfoque es válido, el concepto “afección tubulointersticial” es demasiado genérico para abarcarlo en su conjunto. El espectro de lesión es amplio, y puede ir desde defectos aislados en el túbulo proximal hasta necrosis tubular grave con fracaso renal. El contexto clínico subyacente del paciente es primordial, así como es importante una revisión en profundidad de los fármacos que recibe o ha recibido, tanto ARV como para el tratamiento de procesos intercurrentes40.
La presencia de necrosis tubular aguda debe considerarse ante un fracaso renal agudo progresivo —habitualmente, aunque no siempre, con diuresis conservada— en el contexto de un paciente séptico y hemodinámicamente inestable, o con acúmulo sanguíneo de pigmentos por hiperbilirrubinemia grave o rabdomiólisis, o que haya recibido alguno de los fármacos potencialmente implicados, como aminoglucósidos, trimetoprima-sulfametoxazol, pentamidina, anfotericina B, foscarnet, cidofovir o tenofovir, por citar los más habituales. La lesión isquémica o tóxica de las células tubulares provoca una apoptosis de éstas con denudación de los túbulos, situación que puede recuperarse una vez desaparecido el factor precipitante tras días o semanas según el grado de lesión; se corrigen, así, la función renal y la función tubular.
La lesión tubulointersticial puede deberse también a infiltración por células inflamatorias en relación con pielonefritis por patógenos, o por nefritis intersticial aguda habitualmente por reacción inmunoalérgica a fármacos, entre los que destacan diversos antibióticos (especialmente rifampicina), los antiinflamatorios no esteoideos y, de forma más infrecuente, algunos ARV (como abacavir, indinavir, atazanavir [ATV] o efavirenz). El tratamiento específico de cada entidad deberá resolver el problema, mientras que en el caso de la nefritis intersticial aguda por fármacos, tras la retirada de éstos, puede plantearse el tratamiento esteroideo si la disfunción renal es importante o si persiste en el tiempo mas allá de 1-2 semanas41, preferiblemente con previa realización de una biopsia renal para la confirmación diagnóstica y la valoración del daño renal crónico no recuperable.
Una lesión a considerar, aunque poco frecuente, es la nefropatía por cristales, que se presenta por el depósito masivo y la potencial obstrucción por cristales en la zona tubular tras el tratamiento con fármacos con baja solubilidad en la orina, sobre todo, ante elevadas concentraciones y determinados pH urinarios. Los fármacos implicados en los pacientes infectados por VIH-1 pueden ser la sulfadiazina, el foscarnet o altas dosis de aciclovir o indinavir, este último causante también de nefrolitiasis por acúmulo de los mismos cristales excretados. El ATV, que comparte algunas características con indinavir (el 7% excretado inalterado por orina), se asocia también a nefrolitiasis y en una revisión reciente se han documentado 20 casos que presentaron esta complicación tras una mediana de 1,7 años de tratamiento. De ellos, 5 presentaron una IRA, en 17 casos ATV se hallaba potenciado con ritonavir y 13 pacientes tomaban concomitantemente tenofovir disoproxil fumarato42. Una buena hidratación es importante para prevenir y tratar esta complicación, que suele ser reversible, aunque la reacción inflamatoria de los propios cristales puede provocar un mayor o menor grado de lesión tubulointersticial crónica persistente.
Cuando la lesión tubular no provoca apoptosis o pérdida de un número significativo de células tubulares, pueden manifestarse simplemente defectos funcionales tubulares. Básicamente, estos defectos se centran en el túbulo proximal, zona donde tiene lugar la secreción de múltiples de los fármacos administrados a estos pacientes. La lesión del túbulo proximal provoca las manifestaciones del síndrome de Fanconi, que se caracteriza por fosfaturia e hipofosfatemia, glucosuria con normoglucemia, y proteinuria tubular, así como, de forma menos frecuente, por aumento de la concentración de creatinina, hipopotasemia e hipocalcemia, acidosis metabólica por pérdida de bicarbonato con anión-gap normal (acidosis tubular renal tipo 2) e hipouricemia por pérdida de ácido úrico. Clínicamente, puede cursar de forma asintomática o, si es grave, puede manifestarse con astenia importante, polidipsia, poliuria, deshidratación y dolor óseo43,44. Aunque en este tipo de pacientes la lesión tubular proximal puede deberse a la posible presencia de paraproteínas en la orina en el contexto de síndrome linfoproliferativo, la principal causa suele ser farmacológica. De los fármacos implicados cabe destacar, entre otros, el adefovir utilizado como tratamiento de la coinfección por VHB, el cidofovir como tratamiento de rescate de retinitis por citomegalovirus, o diversos ARV inhibidores de la transcriptasa inversa, como didanosina, lamivudina, estavudina y, sobre todo, tenofovir. Aunque varios estudios comparativos confieren al tenofovir una buena seguridad, incluso en relación con la nefropatía44,45, su amplia utilización ha provocado que aparezcan múltiples series de casos de lesión renal en forma de tubulopatía proximal manifestada como síndrome de Fanconi, habitualmente incompleto, con o sin fracaso renal agudo e incluso, diabetes insípida nefrogénica44. La nefropatía como efecto secundario del tenofovir es, pues, infrecuente pero importante. Se han identificando diversos factores de riesgo para su aparición, como la presencia de nefropatía previa, un bajo peso corporal, tratamiento concomitante con otros fármacos nefrotóxicos o asociación con fármacos, como didanosina o inhibidores de la proteasa potenciados con ritonavir, que potencialmente pueden interferir en su secreción tubular. Habitualmente, la lesión renal provocada por este fármaco es reversible tras su retirada, aunque puede persistir más de 6 meses y se han descrito casos de lesión crónica persistente.
Las lesiones tubulares en otras zonas, como en el túbulo distal o colector, podrán traducirse en manifestaciones de acidosis tubular renal en mayor o menor grado y de diabetes insípida nefrogénica, respectivamente.
Hipertensión arterial y diabetes mellitusLa HTA y la DM son 2 factores de riesgo ampliamente reconocidos de insuficiencia renal, tanto en la población general como también en la población infectada por VIH-113. La HTA es frecuente en los pacientes infectados por VIH-1 tratados con TARGA, con una prevalencia que oscila del 21 al 34%46. Entre los factores predictores de HTA en esta población, se incluyen los antecedentes familiares, el síndrome metabólico, la lipodistrofia y la resistencia a la insulina. De hecho, la HTA parece formar parte del síndrome metabólico que desarrollan los pacientes con infección por VIH-1 tratados con TARGA47. Algunos fármacos ARV, como, por ejemplo, lopinavir/ritonavir, están significativamente asociados a la presencia de HTA, un efecto que parece estar mediado, al menos en parte, por un incremento del índice de masa corporal48. Como en todo paciente hipertenso, debe buscarse la normalización de las cifras tensionales mediante las medidas higienicodietéticas habituales y la administración de tratamiento hipotensor. Es importante tener en cuenta las interacciones medicamentosas que se pueden producir con los fármacos ARV. No se recomienda el uso de antagonistas del calcio, ya que tienen importantes interacciones medicamentosas con diversos ARV. El tratamiento de elección de la HTA en esta población son los IECA y los ARA-II, que, además de su efecto hipotensor, poseen propiedades renoprotectoras.
El aumento progresivo de la esperanza de vida de los pacientes infectados por VIH-1 provoca que se manifiesten alteraciones metabólicas propias del envejecimiento, que pueden verse potenciadas por el tratamiento ARV. El tratamiento con TARGA puede provocar alteraciones metabólicas como dislipidemia, resistencia a la insulina y DM, y síndrome metabólico, hecho que puede explicar que diversas series hayan demostrado un mayor riesgo de desarrollo de DM en la población con infección por VIH-149. Sin embargo, no hay series que hayan estudiado la repercusión de esta mayor incidencia de DM en términos de retinopatía, neuropatía o nefropatía. Algunas series de biopsias renales en pacientes con infección por VIH-1 han reportado un porcentaje de alrededor del 6% de casos donde la histología revelaba nefropatía diabética y un 4% donde el diagnóstico era el de nefropatía hipertensiva con nefroangioesclerosis31.
La prevalencia de HTA y DM en esta población es lo suficientemente importante como para considerar su monitorización y su control sistemático en la práctica clínica habitual. Su presencia obliga a valorar asimismo de forma específica los posibles signos de nefropatía mediante la estimación del FG y el control periódico de albuminuria y proteinuria, y a intensificar aun más, si cabe, el control de estos factores de riesgo emergentes ante cualquier signo de nefropatía incipiente50.
Valoración nefrológica de los pacientes con infección por VIH-1Valoración de la función renalLa creatinina sérica es un producto metabólicamente inerte del músculo y ha sido el marcador del FG o de la función renal más habitual utilizado hasta ahora en la práctica clínica. Sin embargo, la creatinina no es una herramienta exacta para evaluar el FG debido a lo siguiente:
- 1.
Su concentración se ve influida por otros factores, como la masa muscular, la edad, el sexo, la raza, el peso, las amputaciones, los fármacos (como el consumo de esteroides) y la ingesta de proteínas en la dieta (estado de nutrición).
- 2.
La secreción tubular de creatinina se ve inhibida por determinados fármacos, como la cimetidina y la trimetoprima, entre otros.
Igualmente, debe destacarse la variabilidad existente en las determinaciones de diferentes laboratorios y la variabilidad interindividual, que puede ser del 7 al 20%51,52. Así pues, la creatinina no es un buen indicador del FG, y su utilidad para detectar y evaluar las alteraciones de éste es muy limitada, como lo demuestran las pruebas de aclaramiento de inulina normales en personas con creatinina inferior a 1,3mg/dl que pueden, sin embargo, dar aclaramientos de creatinina (ClCr) entre el 20 y el 80%; se debe considerar que la progresión de la ERC no es lineal sino logarítmica.
Se han desarrollado una serie de fórmulas para la determinación más exacta del FG en la práctica clínica que, a pesar de ser más precisas, no están exentas de limitaciones. No es necesario en ninguna de las 2 recoger la orina de 24h como en el ClCr clásico, lo que evita errores de recogida o en la medida en laboratorio que hacen poco fiable el resultado. Dado que en la población general se ha detectado un porcentaje elevado de enfermedad renal oculta (basada en la estimación del FG mediante las diversas ecuaciones frente a la determinación aislada de creatinina) que aumenta a medida que se disminuye el grado de ERC, el hacer una determinación correcta del FG evitaría su aparición y repercusión en este colectivo de pacientes.
Siempre deben considerarse todas las condiciones que pudieran afectar al paciente.
A continuación se describen las 2 fórmulas más utilizadas que, si bien no están validadas para pacientes con infección por VIH-1, hoy en día se utilizan habitualmente en ensayos clínicos y se admiten como fiables en la práctica clínica.
La primera es la ecuación de CG53, derivada de 249 varones hospitalizados. Utiliza como referencia el ClCr en orina de 24 h y posteriormente se ajusta para sexo femenino.
Esta ecuación puede sobreestimar el FG cuando está en rangos normales. A pesar de esto, se usa frecuentemente en ensayos clínicos para estimar la función renal y determinar el ajuste de dosis de algunos fármacos.
La segunda es la ecuación de MDRD51 derivada de 1.628 pacientes con nefropatía crónica (con una tasa de FG entre 20–60ml/min/1,73m2) y utiliza como referencia el aclaramiento de yodotalamato. La siguiente es la ecuación de MDRD abreviada (con 2 variables eliminadas):
Esta ecuación no está validada en pacientes con tasas de FG superiores a 60ml/min/1,73m2 y subestima al paciente con tasas de FG en rangos normales o con fallo hepático. En general, ambas ecuaciones se ven afectadas por cambios en la masa celular corporal, que puede cambiar durante el transcurso de la vida del paciente con infección por VIH-1 (debido al avance de la enfermedad, al tratamiento con TARGA, a la malnutrición, etc.).
Conocer el FG es importante para los pacientes con infección por VIH-1 ya que muchos fármacos requieren ajustes de dosis/frecuencia y, además, si existe ERC es conveniente seguir su evolución y su tasa de progresión en el tiempo. En el caso de que se produzca alteración de la función renal con afección tubular la monitorización de la beta-2 microglobulina urinaria puede ser de gran utilidad54.
En general, se recomienda la estimación de la función renal de todos los pacientes con infección por VIH-1 en la evaluación inicial del paciente y posteriormente de forma anual (o más frecuente, según evolución) mediante las ecuaciones de MDRD o de CG, y considerar remitir al paciente al nefrólogo ante un deterioro progresivo de la función renal o con un FG por debajo de 60ml/min/1,73m2.
La ERC debe considerarse cuando existen alteraciones de la función renal persistentes por un período mayor de 3 meses (tabla 1)52.
Estadios de la enfermedad renal crónica47
| Estadio | Descripción | FG (ml/min/1,73m2) |
| I | Daño renal con FG normal o alto | ≥90 |
| II | Daño renal con FG ligeramente bajo | 60–89 |
| III | FG moderadamente bajo | 30–59 |
| IV | FG marcadamente bajo | 15–29 |
| V | Insuficiencia renal terminal | <15 (o diálisis) |
FG: filtrado glomerular.
Cabe destacar que la HTA y la DM no sólo son muy prevalentes en la población general, sino que también afectan con mucha frecuencia a los pacientes con infección por VIH-1; y, además, son factores de riesgo de progresión de la ERC, por lo que es importante detectar el deterioro de la función renal de una manera temprana para iniciar medidas que eviten la progresión de ésta.
Valoración de la proteinuriaLa proteinuria se define como la presencia en la orina de una cantidad anómala de proteínas (principalmente albúmina) que se debe habitualmente a un daño glomerular (p. ej., nefropatía diabética). También, puede producirse una proteinuria tubular, en la que la albúmina no es la principal proteína presente en la orina (p. ej., daño tubular inducido por fármacos o paraproteínas). Evaluar si existe o no proteinuria y el rango de ésta es importante para poder diferenciar si existe daño glomerular o tubular, y si es posible discernir si es asociado al VIH-1 (nefropatia asociada a la infección por VIH-1) o es secundario a otras comorbilidades, como DM, HTA, disfunciones tubulares que vayan asociadas o no a tratamiento ARV, o a infecciones del tracto urinario.
Existen 3 maneras de detectar y cuantificar la proteinuria en la práctica clínica:
- 1.
La primera es mediante el uso de tiras reactivas, que están disponibles y son de fácil uso en las consultas (algunas con rangos de detección de microalbúmina de 30–300mg/dl).
- 2.
La segunda es la recolección de orina de 24h que, aunque es más laboriosa por parte del paciente, facilita la cuantificación de la proteinuria si se ha realizado de una manera apropiada.
- 3.
Finalmente, el cociente proteína/creatinina en orina (CPCo) que posiblemente es la prueba que mayor información proporciona de manera rápida y reproducible utilizando albúmina o proteína/creatinina55. Si el cociente albúmina/creatinina es normal y está alterado el cociente proteína/creatinina, la proteinuria será de origen tubular.
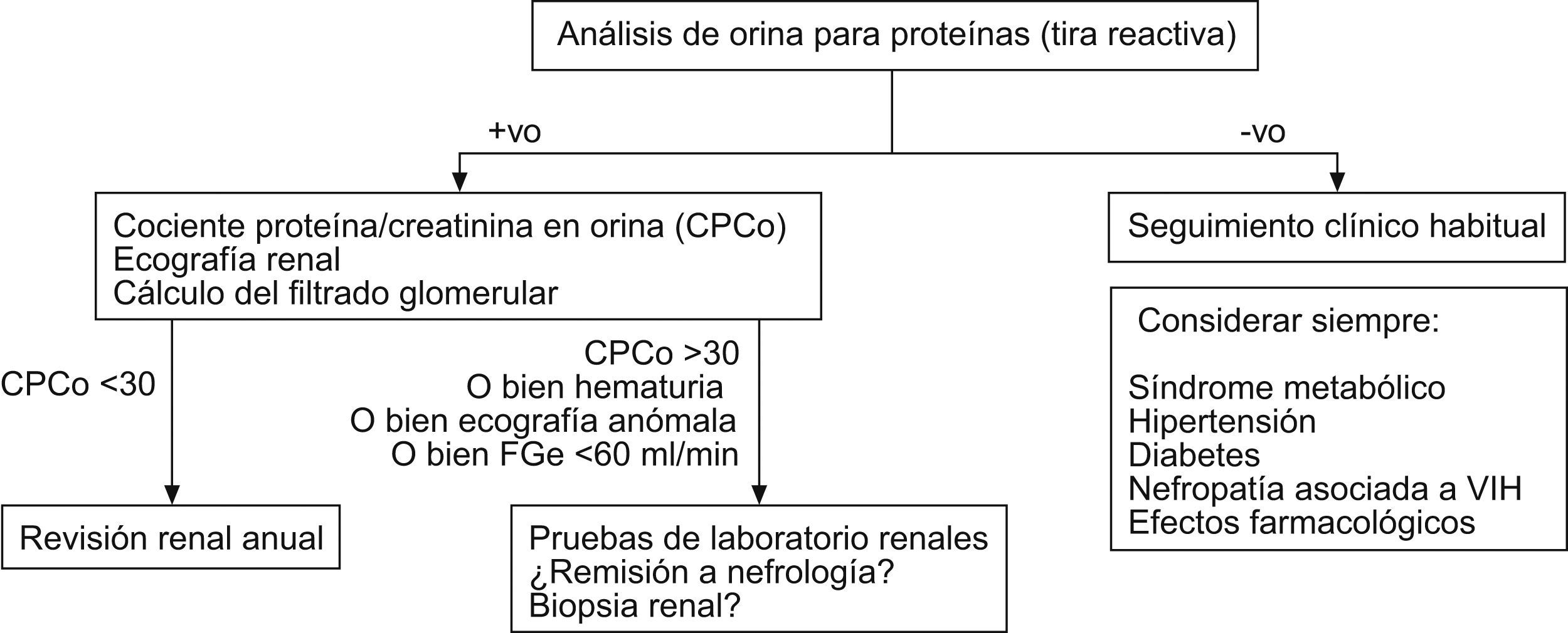
En general, para mayor facilidad y fiabilidad se recomienda utilizar tiras reactivas como prueba de cribado y, cuando el resultado sea 1+ o superior, deberá determinarse el CPCo.
Las tiras pueden dar un resultado aproximado de la intensidad de la proteinuria. Un resultado en las tiras reactivas de trazas equivale a una proteinuria de 150–300mg/l, una cruz a 300–1.000mg/l, 2 cruces a 1,0–3,0g/l (rango nefrótico), 3 cruces a 3,0–10g/l y, finalmente, 4 cruces a más de 10g/l. Un resultado de 300mg/l en las tiras reactivas, si el paciente tiene una diuresis de 2l en 24h, equivaldría a 600mg/24h.
Una de las ventajas del CPCo es que se puede evaluar la enfermedad renal mediante una pequeña muestra de orina obtenida al levantarse por la mañana (p. ej., un resultado del CPCo de 100mg/mmol equivale aproximadamente a 1 g/día de proteínas en la orina).
De manera práctica, si se utilizan las tiras reactivas y el resultado es una cruz o más, se debe proceder a realizar el CPCo, que ayudará a detectar una enfermedad renal oculta, identificar enfermedades como la DM o la HTA y, en pacientes con infección por VIH-1, la aparición de toxicidad renal por fármacos, HIVAN o enfermedades renales no relacionadas con la infección por VIH-1.
En la figura 1 se puede observar un algoritmo de actuación para la evaluación de la proteinuria.
Valoración de la hipofosfatemiaLa hipofosfatemia (fosfato en sangre<0,80mmol/l o, aproximadamente 2,54mg/dl) debe evaluarse en pacientes con infección por VIH-1 de forma rigurosa debido a que son numerosos los factores que pueden potencialmente alterar sus valores plasmáticos.
La ingesta diaria de fósforo es de 1.200mg, se absorben unos 700mg y el riñón realiza su control gracias al equilibrio glomerulotubular. En el paciente con infección por VIH-1 puede verse afectado el metabolismo del fósforo al alterarse su almacenamiento temporal en el adipocito para su posterior utilización por parte del hígado debido a la presencia de lipodistrofia. La importancia de la homeostasis del fósforo radica en que su deficiencia aguda o grave induce un déficit energético con graves consecuencias (debilidad muscular, rabdomiólisis, encefalopatía, hipotensión, insuficiencia cardíaca, insuficiencia pulmonar y hemólisis) y puede, incluso, poner en riesgo la vida del paciente. La deficiencia de fósforo de forma insidiosa o leve produce agotamiento de sus reservas y se expresa como astenia, mialgia y debilidad, síndrome fibromiálgico, dolor y desmineralización ósea a largo plazo.
Es importante recordar que la muestra para la determinación de fosfato debe realizarse en ayunas, no debe haber hemólisis y tiene que realizarse en plasma. En cuanto a la hipofosfatemia leve (0,65–0,80mmol/l o 2,02,5mg/dl) y moderada (0,32–0,64mmol/l o 1,0–1,99mg/dl), debe determinarse su etiología antes del tratamiento; a diferencia de la hipofosfatemia grave (<0,32mmol/l o <1mg/dl) que es una urgencia médica y se debe tratar inmediatamente, independientemente de la identificación de la causa.
En general, las causas de la hipofosfatemia son debidas a alguno de los siguientes mecanismos: disminución de la ingesta; disminución de la absorción; cambios intracelulares, como los producidos por la alcalosis respiratoria (salicilatos o alcohol), encefalopatía hepática y síndrome de realimentación (enteral o parenteral); aumento de la secreción urinaria (síndrome de Fanconi y uso de diuréticos) y, finalmente, mayor acumulación ósea (síndrome del hueso hambriento)56.
Además, hay que considerar si existe algún fármaco involucrado y, si es así, considerar interrumpir su administración, dado que la hipofosfatemia puede ser también multifactorial y en su desarrollo a veces puede ser difícil identificar cuál es el agente que más influye.
En este sentido, hay que comentar que el tenofovir es el que se ha puesto más en relación con la hipofosfatemia o el síndrome de Fanconi, y aumenta la probabilidad de desarrollo con algunas asociaciones de fármacos57.
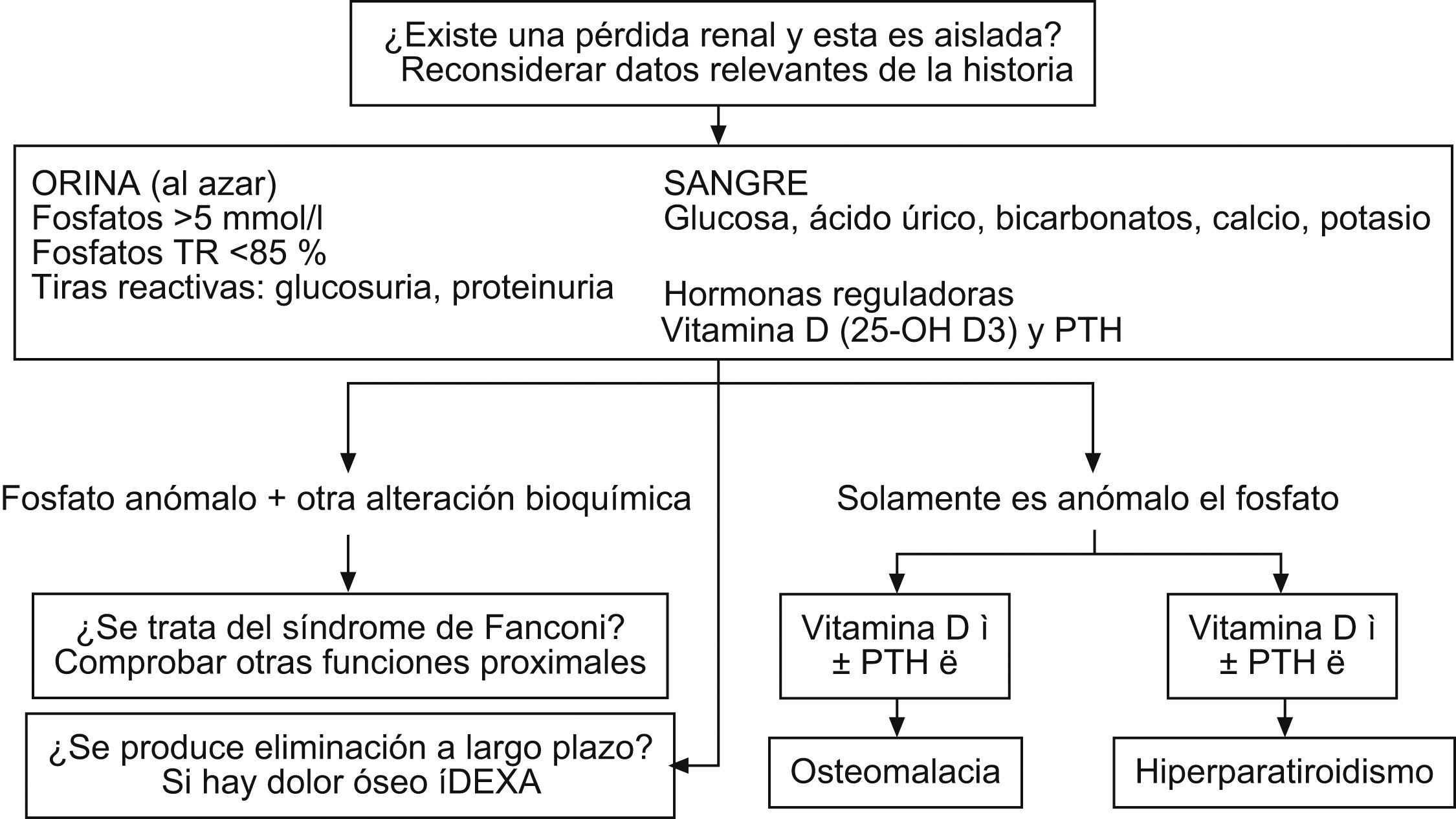
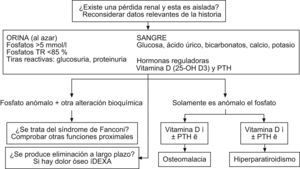
En la figura 2 se puede observar un enfoque práctico para la determinación de las causas de hipofosfatemia. El primer paso debe ser confirmar la hipofosfatemia con una muestra adecuada, correlacionada con datos clínicos relevantes (estado nutricional, comorbilidades, medicaciones, dieta, etc.), y determinar si existe pérdida renal. Si se determina que existe una alteración bioquímica adicional al fosfato, se debe descartar el síndrome de Fanconi. A nivel práctico, una tira de orina analizada indicará si hay proteinuria y glucosuria y una analítica en sangre confirmará si la glucemia es normal y si existe hipofosfatemia, con lo que se puede afirmar con alta probabilidad que se tratará de un trastorno tubular proximal y podrá descartarse o confirmarse un síndrome de Fanconi.
La tubulopatía proximal se caracteriza por aumento de creatinina, hipofosfatemia, hipouricemia, acidosis metabólica, hipopotasemia, glucosuria con glucemia normal, hiperaminoaciduria y proteinuria inferior a 2g/día.
Si no hay alteración tubular proximal y la alteración es solamente del fosfato, debe procederse a realizar una determinación de vitamina D y parathormona para evaluar si existe hiperparatiroidismo o un bajo remodelado óseo, como la osteomalacia. Si existe dolor óseo se debe realizar una densitometría ósea43,44.
Una vez evaluado debe establecerse el tratamiento adecuado:
- 1.
Si el fósforo está disminuido pero no de forma importante y se descarta tubulopatía proximal, deben buscarse otras causas y se tratará con fosforo oral monitorizando la respuesta.
- 2.
Si se comprueba que existe un síndrome de Fanconi y está en tratamiento con algún fármaco o asociación que lo pueda producir, debe valorarse el cambio de tratamiento una vez excluidas otras causas.
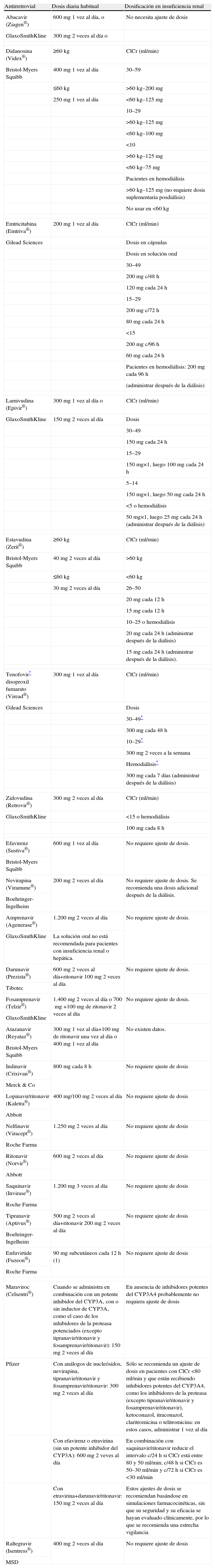
La investigación y el desarrollo de fármacos ARV han aumentado considerablemente en los últimos años. En la actualidad existen ya más de 20 medicamentos distintos en el mercado y un gran número de moléculas en diferentes fases de investigación. Algunos fármacos se excretan principalmente por vía renal y requieren una modificación de la dosis o el intervalo de dosificación en pacientes con insuficiencia renal. En general, es necesario modificar las dosis o el intervalo de todos los inhibidores de la transcriptasa inversa análogos de los nucleósidos/nucleótidos, (ITIAN/Nt), excepto en el caso del abacavir que no se elimina significativamente por el riñón (tabla 2).
Recomendaciones de dosificación de antirretrovirales en pacientes con insuficiencia renal
| Antirretrovial | Dosis diaria habitual | Dosificación en insuficiencia renal |
| Abacavir (Ziagen®) | 600mg 1 vez al día, o | No necesita ajuste de dosis |
| GlaxoSmithKline | 300mg 2 veces al día o | |
| Didanosina (Videx®) | ≥60kg | ClCr (ml/min) |
| Bristol-Myers Squibb | 400mg 1 vez al día | 30–59 |
| ≤60kg | >60kg–200mg | |
| 250mg 1 vez al día | <60kg–125mg | |
| 10–29 | ||
| >60kg–125mg | ||
| <60kg–100mg | ||
| <10 | ||
| >60kg–125mg | ||
| <60kg–75mg | ||
| Pacientes en hemodiálisis | ||
| >60kg–125mg (no requiere dosis suplementaria posdiálisis) | ||
| No usar en <60kg | ||
| Emtricitabina (Emtriva®) | 200mg 1 vez al día | ClCr (ml/min) |
| Gilead Sciences | Dosis en cápsulas | |
| Dosis en solución oral | ||
| 30–49 | ||
| 200mg c/48h | ||
| 120mg cada 24h | ||
| 15–29 | ||
| 200mg c/72h | ||
| 80mg cada 24h | ||
| <15 | ||
| 200mg c/96h | ||
| 60mg cada 24h | ||
| Pacientes en hemodiálisis: 200mg cada 96h | ||
| (administrar después de la diálisis) | ||
| Lamivudina (Epivir®) | 300mg 1 vez al día o | ClCr (ml/min) |
| GlaxoSmithKline | 150mg 2 veces al día | Dosis |
| 30–49 | ||
| 150mg cada 24h | ||
| 15–29 | ||
| 150mg×1, luego 100mg cada 24h | ||
| 5–14 | ||
| 150mg×1, luego 50mg cada 24h | ||
| <5 o hemodiálisis | ||
| 50mg×1, luego 25mg cada 24h (administrar después de la diálisis) | ||
| Estavudina (Zerit®) | ≥60kg | ClCr (ml/min) |
| Bristol-Myers Squibb | 40mg 2 veces al día | >60kg |
| ≤60kg | <60kg | |
| 30mg 2 veces al día | 26–50 | |
| 20mg cada 12h | ||
| 15mg cada 12h | ||
| 10–25 o hemodiálisis | ||
| 20mg cada 24h (administrar después de la diálisis) | ||
| 15mg cada 24h (administrar después de la diálisis). | ||
| Tenofovir* disoproxil fumarato (Viread®) | 300mg 1 vez al día | ClCr (ml/min) |
| Gilead Sciences | Dosis | |
| 30–49* | ||
| 300mg cada 48h | ||
| 10–29* | ||
| 300mg 2 veces a la semana | ||
| Hemodiálisis* | ||
| 300mg cada 7 días (administrar después de la diálisis) | ||
| Zidovudina (Retrovir®) | 300mg 2 veces al día | ClCr (ml/min) |
| GlaxoSmithKline | <15 o hemodiálisis | |
| 100mg cada 8h | ||
| Efavirenz (Sustiva®) | 600mg 1 vez al día | No requiere ajuste de dosis. |
| Bristol-Myers Squibb | ||
| Nevirapina (Viramune®) | 200mg 2 veces al día | No requiere ajuste de dosis. Se recomienda una dosis adicional después de la diálisis. |
| Boehringer-Ingelheim | ||
| Amprenavir (Agenerase®) | 1.200mg 2 veces al día | No requiere ajuste de dosis. |
| GlaxoSmithKline | La solución oral no está recomendada para pacientes con insuficiencia renal o hepática. | |
| Darunavir (Prezista®) | 600mg 2 veces al día+ritonavir 100mg 2 veces al día | No requiere ajuste de dosis. |
| Tibotec | ||
| Fosamprenavir (Telzir®) | 1.400mg 2 veces al día o 700mg +100mg de ritonavir 2 veces al día | No requiere ajuste de dosis. |
| GlaxoSmithKline | ||
| Atazanavir (Reyataz®) | 300mg 1 vez al día+100mg de ritonavir una vez al día o 400mg 1 vez al día | No existen datos. |
| Bristol-Myers Squibb | ||
| Indinavir (Crixivan®) | 800mg cada 8h | No requiere ajuste de dosis |
| Merck & Co | ||
| Lopinavir/ritonavir (Kaletra®) | 400mg/100mg 2 veces al día | No requiere ajuste de dosis |
| Abbott | ||
| Nelfinavir (Viracept®) | 1.250mg 2 veces al día | No requiere ajuste de dosis |
| Roche Farma | ||
| Ritonavir (Norvir®) | 600mg 2 veces al día | No requiere ajuste de dosis |
| Abbott | ||
| Saquinavir (Invirase®) | 1.200mg 3 veces al día | No requiere ajuste de dosis |
| Roche Farma | ||
| Tipranavir (Aptivus®) | 500mg 2 veces al día+ritonavir 200mg 2 veces al día | No requiere ajuste de dosis |
| Boehringer-Ingelheim | ||
| Enfuvirtide (Fuzeon®) | 90mg subcutáneos cada 12h (1) | No requiere ajuste de dosis |
| Roche Farma | ||
| Maraviroc (Celsentri®) | Cuando se administra en combinación con un potente inhibidor del CYP3A, con o sin inductor de CYP3A, como el caso de los inhibidores de la proteasa potenciados (excepto tipranavir/ritonavir y fosamprenavir/ritonavir): 150mg 2 veces al día | En ausencia de inhibidores potentes del CYP3A4 probablemente no requiera ajuste de dosis |
| Pfizer | Con análogos de nucleósidos, nevirapina, tipranavir/ritonavir y fosamprenavir/ritonavir: 300mg 2 veces al día | Sólo se recomienda un ajuste de dosis en pacientes con ClCr <80ml/min y que están recibiendo inhibidores potentes del CYP3A4, como los inhibidores de la proteasa (excepto tipranavir/ritonavir y fosamprenavir/ritonavir), ketoconazol, itraconazol, claritromicina o telitromicina: en estos casos, administrar 1 vez al día |
| Con efavirenz o etravirina (sin un potente inhibidor del CYP3A): 600mg 2 veves al día | En combinación con saquinavir/ritonavir reducir el intervalo c/24h si ClCr está entre 80 y 50ml/min; c/48h si ClCr es 50–30ml/min y c/72h si ClCr es <30ml/min | |
| Con etravirina+darunavir/ritonavir: 150mg 2 veces al día | Estos ajustes de dosis se recomiendan basándose en simulaciones farmacocinéticas, sin que su seguridad y su eficacia se hayan evaluado clínicamente, por lo que se recomienda una estrecha vigilancia | |
| Raltegravir (Isentress®) | 400mg 2 veces al día | No requiere ajuste de dosis |
| MSD | ||
ClCr: aclaramiento de creatinina.
Existen datos muy limitados sobre la seguridad y la eficacia de tenofovir en pacientes con función renal alterada. Sólo debe emplearse en pacientes con insuficiencia renal si se considera que los beneficios superan a los posibles riesgos. En general, no se recomienda su uso en pacientes con ClCr inferior a 30ml/min, excepto cuando no existan otras alternativas.
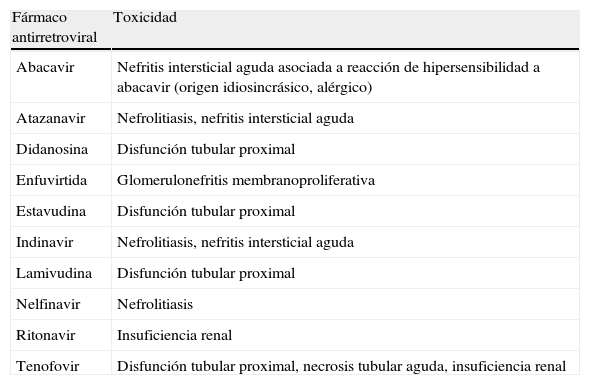
La nefrotoxicidad por ARV es poco frecuente, aunque se ha descrito con numerosos fármacos (tabla 3). Las manifestaciones son variadas e incluyen cuadros de presentación aguda y de disfunción crónica asintomática. Los cuadros mejor caracterizados son los asociados con algunos inhibidores de la proteasa, como el indinavir o el ATV, y los ITIAN/Nt, especialmente con tenofovir. El indinavir y, con mucha menor frecuencia, el ATV pueden producir nefrolitiasis y nefropatías por depósito intratubular de cristales42,58, mientras que la toxicidad de los ITIAN/Nt se produce preferentemente por disfunción tubular debida a la acumulación intracelular del fármaco y puede manifestarse por diversas alteraciones tubulares que pueden conformar un síndrome de Fanconi, con o sin IRA59–61. Se ha descrito también nefritis intersticial, en ocasiones mediada por un mecanismo inmunoalérgico, con diversos ARV, y glomerulonefritis membranoproliferativa con enfuvirtide62–65. La exposición a indinavir o tenofovir se ha asociado también con insuficiencia renal crónica13.
Toxicidades renales de los antirretrovirales descritas en la literatura médica53–61
| Fármaco antirretroviral | Toxicidad |
| Abacavir | Nefritis intersticial aguda asociada a reacción de hipersensibilidad a abacavir (origen idiosincrásico, alérgico) |
| Atazanavir | Nefrolitiasis, nefritis intersticial aguda |
| Didanosina | Disfunción tubular proximal |
| Enfuvirtida | Glomerulonefritis membranoproliferativa |
| Estavudina | Disfunción tubular proximal |
| Indinavir | Nefrolitiasis, nefritis intersticial aguda |
| Lamivudina | Disfunción tubular proximal |
| Nelfinavir | Nefrolitiasis |
| Ritonavir | Insuficiencia renal |
| Tenofovir | Disfunción tubular proximal, necrosis tubular aguda, insuficiencia renal |
Se han publicado numerosos casos de síndrome de Fanconi, la mayoría asociados con tenofovir60, pero también se han descrito casos asociados con otros ITIAN/Nt, como didanosina y estavudina66,67. En estos casos, el daño tubular suele ser reversible tras la retirada del fármaco causante.
La incidencia de nefrotoxidad asociada con el uso de tenofovir en los ensayos clínicos ha sido muy baja, comparable a la observada en el grupo control68–70. En algunos estudios observacionales se ha comunicado una reducción en el FG durante el tratamiento con tenofovir71,72, aunque la incidencia de toxicidad renal clínicamente significativa en la mayoría de las cohortes ha sido también baja73–77. En un análisis de más de 10.000 pacientes que participaron en el programa de acceso expandido de tenofovir, sólo el 0,5% de los casos presentó un acontecimiento adverso renal grave y el 2,2%, una elevación de la creatinina de más de 0,5mg/dl78. Los factores favorecedores de la nefrotoxicidad por tenofovir fueron la presencia de ERC previa, el uso concomitante de otros fármacos nefrotóxicos, un peso corporal bajo, la edad avanzada y un recuento bajo de linfocitos CD478. Se ha indicado que determinadas variaciones en los genes que codifican las proteínas transportadoras de tenofovir en las células de los túbulos proximales renales (MRP2, hOAT1 y MPR4) podrían condicionar una mayor susceptibilidad a la toxicidad renal asociada con el uso de este fármaco. En un estudio reciente se ha observado una reducción del aclaramiento de tenofovir y un aumento de las concentraciones intracelulares del fármaco en los portadores del polimorfismo 3463G del gen ABCC4 (MRP4)79. Por otro lado, determinados haplotipos del gen ABCC2 (MRP2) se han relacionado también con una mayor susceptibilidad a la tubulopatía proximal asociada con el tenofovir80.
El antecedente de infecciones oportunistas, la presencia de comorbilidad, la HTA, el dolor crónico (un marcador de uso de antiinflamatorios no esteroideos), el uso simultáneo de didanosina y la coadministración de inhibidores de la proteasa potenciados se han asociado también con un mayor riesgo de nefrotoxicidad con tenofovir81–85. Los inhibidores de la proteasa potenciados pueden disminuir el aclaramiento renal de tenofovir y favorecer su acumulación en las células del epitelio tubular86.
En una revisión reciente de 164 casos de síndrome de Fanconi asociado a tenofovir, el 84% estaba recibiendo simultáneamente inhibidores de la proteasa, en la mayoría de los casos potenciados con ritonavir87.
La identificación precoz de los pacientes que desarrollan disfunción renal durante el tratamiento ARV es importante para establecer medidas de protección orientadas a reducir el riesgo de progresión de la enfermedad renal. Para esto debe evaluarse de forma periódica la función renal en todos los pacientes que reciben tratamiento ARV. La European AIDS Clinical Society recomienda una evaluación antes del inicio del tratamiento, a las 4 semanas y a los 6 meses, y posteriormente cada año, si se mantiene dentro de la normalidad88. En el caso de los pacientes que empiezan tratamiento con tenofovir, la recomendación de la Agencia Europea del Medicamento, y así consta en la ficha técnica del producto, es una evaluación de la función renal con periodicidad mensual durante el primer año de tratamiento y posteriormente cada 3 meses89. Los controles analíticos podrían ser más espaciados en pacientes sin factores de riesgo para desarrollar nefrotoxicidad por tenofovir cuya función renal no haya experimentado cambios durante los primeros meses del tratamiento. La medición de la creatinina sérica no es apropiada para la determinación de la función renal y debe utilizarse alguna de las 2 fórmulas de estimación del FG (ecuaciones de MDRD o de CG). Puesto que el FG puede ser normal en algunos pacientes con ERC, debe medirse también la excreción de proteínas en orina, inicialmente con una tira reactiva, y si resultara positiva, debe calcularse el CPCo en la primera muestra de orina del día o cuantificar la excreción de proteínas en orina de 24h.
Cuando se detecte disfunción renal significativa durante el tratamiento ARV deben realizarse los estudios pertinentes para caracterizarla y las modificaciones oportunas en la pauta de tratamiento ARV, incluyendo el ajuste de la dosis o el intervalo de dosificación de los fármacos ARV seleccionados. En los pacientes tratados con tenofovir, se debe considerar la retirada del fármaco si el ClCr se reduce por debajo de 50ml/min89.
Tratamiento sustitutivo de la función renal: diálisis y trasplante renalAntes de la aparición del TARGA, para los individuos con infección por VIH-1 la mortalidad era elevada, y los que desarrollaban complicaciones renales fallecían en un elevado porcentaje de casos. El tratamiento sustitutivo de la función renal mediante diálisis se realizaba generalmente en pacientes con fracaso renal agudo y era excepcional que un paciente con infección por VIH-1 entrara en programa de crónicos, ya fuera hemodiálisis (HD) o diálisis peritoneal (DP), y existía una elevada mortalidad entre éstos.
Con el desarrollo del TARGA, el número de pacientes con infección por VIH-1 que presentan un buen control virológico de la infección y una adecuada reconstitución inmunológica ha aumentado de forma drástica, y con ello ha mejorado su supervivencia, su esperanza de vida y sin duda la calidad de ésta.
Este incremento de la supervivencia supone que un número cada vez mayor de pacientes pueden desarrollar ERC y, por lo tanto, que puede plantearse en ellos la indicación de tratamiento renal sustitutivo con HD, DP o, incluso, trasplante renal (TR)90. No hay diferencias de supervivencia según la técnica utilizada, ya sea HD o DP91,92, y actualmente se acumula la suficiente experiencia para afirmar que los pacientes con infección por VIH-1 trasplantados renales exhiben supervivencias a corto y medio plazo similares a las de los pacientes trasplantados seronegativos90.
Diálisis peritoneal en pacientes infectados por VIH-1La DP, si no ha habido infecciones previas que hayan podido dañar el peritoneo, es un tratamiento adecuado, con la ventaja adicional de obviar el riesgo potencial de transmisión nosocomial de la propia infección por VIH-1, que, como con otras enfermedades virales, puede asociarse a la HD. No obstante, la supervivencia a largo plazo de los pacientes con infección por VIH-1 que reciben DP, aunque buena, es inferior a la de los pacientes sin infección por VIH-1 (12,5 frente a 15 años, respectivamente); la infección por VIH-1 es un predictor independiente del riesgo de muerte en pacientes que reciben DP93, mientras que el TARGA, un mejor estado nutricional y el tratamiento precoz de la peritonitis se asocian a mejores tasas de supervivencia. En series españolas de menor tamaño se han observado también tasas de supervivencia aceptables y una incidencia de peritonitis incluso menor que la descrita en estudios anteriores94. Aunque es una forma poco frecuente, la peritonitis esclerosante puede aparecer también en esta población, y existe al menos un caso descrito que con tratamiento con tamoxifeno evolucionó favorablemente95.
A veces la infraestructura necesaria para realizar la DP, que es una técnica de diálisis fundamentalmente domiciliaria, es de difícil disposición por parte de los pacientes con infección por VIH-1. En estos casos, la HD puede ser la modalidad de elección, lo que, además, puede ayudar a un mayor control de la adherencia del paciente a su tratamiento.
Hemodiálisis en pacientes infectados por VIH-1La supervivencia de los pacientes con infección por VIH-1 en HD es equiparable a la de los pacientes en HD seronegativos. Son factores predictivos de mortalidad un recuento bajo de linfocitos CD4, una carga viral elevada, no recibir tratamiento con TARGA y la aparición de infecciones oportunistas96.
Existe evidencia de una mayor tasa de infección y menor supervivencia del acceso vascular cuando se utilizan prótesis en pacientes con infección por VIH-1 y que reciben HD que en pacientes no infectados por VIH-1, por lo que se recomienda que en estos pacientes se realicen de forma rigurosa fístulas arteriovenosas autógenas para evitar complicaciones. Cuando se utiliza este acceso, las tasas de infección y supervivencia son similares a las de los pacientes sin infección por VIH-197,98. Si el paciente es o ha sido adicto a drogas por vía parenteral, se requiere una exploración del territorio vascular para evaluar el estado de las venas y las posibilidades de éxito en la cirugía y en la maduración del acceso vascular. Si no es posible la realización de una fístula arteriovenosa, se puede utilizar un catéter central, si bien hay que extremar las medidas para prevenir infecciones que son más frecuentes que con las fístulas. Existe evidencia de que la infección por catéter con bacteriemia secundaria puede darse en una tasa similar en pacientes con o sin infección por VIH-1, si bien en los primeros adoptan formas más graves, requieren más frecuentemente hospitalización y, con mayor frecuencia, sus infecciones son polimicrobianas99.
No es estrictamente necesario el aislamiento de los pacientes con infección por VIH-1 que se dializan en una unidad de HD. Hoy en día legalmente no se contempla la prohibición de que los pacientes con infección por VIH-1 se dialicen en las mismas unidades de crónicos junto a otros pacientes VIH negativos100.
En relación con el tratamiento renal sustitutivo, en los pacientes con infección por VIH-1 pueden darse las siguientes situaciones:
- 1.
Paciente con ERC con infección por VIH-1 conocida, con o sin coinfección por VHC o VHB, que presenta progresión de su ERC y se plantea su inclusión en un programa de diálisis.
- 2.
Paciente con infección por VIH-1 que desarrolla fracaso renal agudo que no se recupera y que hace plantear su inclusión o no en el tratamiento renal sustituivo.
- 3.
Paciente ya en tratamiento sustitutivo, sea con HD o con DP, al que en un control se le detecta infección por VIH-1.
Respecto a los casos de los apartados 1 y 2, un análisis exhaustivo de la situación de la infección por VIH-1, como, por ejemplo, si cumple criterios de sida o la morbimortalidad es previsible, permitirá un planteamiento adecuado de las diversas opciones terapéuticas, respetando siempre la autonomía del paciente. En el supuesto del apartado 3, lo primordial es confirmar que el paciente esté infectado por VIH-1, ya que en algunos pacientes con ERC aparecen falsos positivos. Una vez confirmada la infección, se evaluará la situación inmunovirológica del paciente y se iniciará tratamiento ARV si procede. Asimismo, debe realizarse un adecuado cribado de otras coinfecciones virales y plantear su tratamiento específico en el momento más adecuado.
La prevalencia e incidencia de pacientes con infección por VIH-1 en las unidades de HD o DP ha ido en aumento en los últimos años debido a que un número cada vez mayor de pacientes con esta infección son candidatos a diálisis y su supervivencia en diálisis es cada vez mayor. No obstante, todavía constituyen un porcentaje bajo entre los pacientes en diálisis, variable de unos países a otros. Los datos de prevalencia en España provienen de una primera encuesta en la que la población con infección por VIH-1 en HD está probablemente sobreestimada por haber contestado fundamentalmente los centros que tenían pacientes con infección por VIH-1101. En 2005 se efectuó un estudio multicéntrico español (Gesida 48/05)7 en el que se recogió información de 14.876 pacientes, cuyos resultados arrojaron una prevalencia global en diálisis en España del 0,54%. Aunque había mayor número de pacientes con infección por VIH-1 en HD, la prevalencia de éstos era mayor en DP (1,66%) que en HD (0,44%). Asimismo, se evidenció que existía un elevado porcentaje de pacientes con coinfección por VHC (61%) y que era excepcional que estos pacientes hubieran recibido tratamiento para la infección por VHC. El mecanismo de transmisión del VIH-1 más frecuente entre estos pacientes era la adicción a drogas por vía parenteral (33%). A pesar de que los candidatos potenciales para recibir un TP eran del 39%, sólo un 12% de los pacientes se hallaba en lista de espera. La prevalencia observada en otros países es similar a la de España. En Estados Unidos la prevalencia de pacientes en diálisis con infección por VIH-1 era del 1,5% en 200219, mientras que de Europa se dispone de datos procedentes de Francia, con un 0,67% en 200218.
Trasplante renal en pacientes infectados por VIH-1Tradicionalmente, la infección por VIH-1 estaba considerada una contraindicación absoluta para el TR por el riesgo de los efectos negativos de la medicación inmunosupresora sobre el paciente y la evolución de la propia infección. No obstante, con los estándares de tratamiento actual mediante TARGA y el control virológico de la infección, actualmente es posible trasplantar a estos pacientes, siempre que se cumplan unos criterios aprobados en España en 2004102. El documento de consenso español expone de forma exhaustiva estos criterios, que resumidos son los siguientes:
- 1.
Criterios clínicos: idealmente el paciente no debe haber tenido enfermedades definitorias de sida, excepto tuberculosis, candidiasis esofágica y neumonía por Pneumocystis jirovecii, al ser éstas infecciones que tienen tratamiento efectivo y profilaxis igualmente eficaz.
- 2.
Criterios inmunológicos: la cifra de linfocitos CD4 debe ser superior a 200células/mm3, dado que es el punto de corte por debajo del cual aparecen con mayor incidencia la mayoría de las infecciones oportunistas.
- 3.
Criterios virológicos: el criterio fundamental es que el paciente tenga la posibilidad de un tratamiento ARV efectivo y duradero en el postrasplante. La situación ideal es que el paciente tolere el TARGA pretrasplante y llegue al trasplante con una carga viral del VIH-1en plasma indetectable por técnicas ultrasensibles (<50copias/ml).
- 4.
Otros criterios: todo paciente candidato a TR debe tener una valoración psiquiátrica favorable, debe excluirse el consumo activo de drogas (los pacientes incluidos de forma estable en programas de metadona no se deben excluir) y debe tener un grado adecuado de estabilidad social para su seguimiento y cuidados mínimos en el postrasplante.
La experiencia actual en TR en pacientes infectados por VIH-1 puede resumirse en las siguientes premisas:
- 1.
El TR en pacientes infectados por VIH-1 adecuadamente seleccionados es un procedimiento seguro a corto y medio plazo, y proporciona una tasa de supervivencia del paciente y del injerto similar a la de otros grupos de riesgo sin infección por VIH-1.
- 2.
Existe una mayor frecuencia de rechazo agudo.
- 3.
El TP no condiciona un impacto negativo en la evolución de la infección por VIH-1.
- 4.
El tratamiento clínico de estos pacientes es complejo por las interacciones farmacológicas entre los ARV y los inmunosupresores, que obligan a un cuidadoso seguimiento por parte de un equipo multidisciplinario (nefrólogos y especialistas en enfermedades infecciosas)103,104.
Existe evidencia en Estados Unidos de que los pacientes trasplantados renales infectados por VIH-1 presentan un tasa de supervivencia a los 3 años similar a la de los trasplantados sin infección por VIH-1 y que, con control virológico adecuado, no existe incremento del número de infecciones oportunistas. Los principales problemas descritos en el postrasplante son las interacciones entre la inmunosupresión y el TARGA, la coinfección por VHC y una tasa mas elevada de rechazo agudo105. En un estudio publicado en la población española, en 10 casos se observó buena supervivencia a los 11 meses de seguimiento medio con mayores tasas de rechazo agudo que respondieron al tratamiento102.
En los próximos años, la incidencia y la prevalencia de pacientes con infección por VIH-1 en tratamiento renal sustitutivo y con TR probablemente aumenten de forma considerable por las razones anteriormente expuestas.
Criterios de derivación a nefrologíaLos pacientes con infección por VIH-1 suelen seguir un estrecho control por parte del especialista en VIH. La aplicación durante el seguimiento de las sencillas herramientas expuestas en este documento (la medida de la presión arterial, la determinación de proteinuria y la estimación del FG, al que se podría añadir una regular determinación del sedimento urinario) deberá permitir al especialista en VIH-1 detectar cualquier indicio de enfermedad renal. La detección de alteraciones en alguno o más de los métodos de screening aplicados debe generar una revaloración etiológica, de progresión, de pronóstico y terapéutica, que requiere en muchas ocasiones el trabajo multidisciplinario entre los especialistas en VIH y los nefrólogos.
El momento de derivación de un paciente a nefrología debe ser siempre individualizado dependiendo de las características de cada caso, aunque debe sustentarse sobre unos determinados criterios generales50:
- 1.
FG estimado mediante la fórmula de MDRD inferior a 60ml/min/1,73m2 confirmado en diversas determinaciones, siempre que no exista una causa corregible evidente.
- 2.
Proteinuria persistente (tira reactiva >1+ o CPCo >300mg/g en una muestra de orina de primera de hora de la mañana) en 2 determinaciones por un período mínimo de 3 meses.
- 3.
Microhematuria persistente, si se ha descartado causa urológica y, en especial, si se acompaña de proteinuria o alteración de la función renal.
- 4.
Alteraciones sugestivas de tubulopatía proximal, como proteinuria leve de origen tubular, con un sedimento anodino o con leucocituria estéril, o trastornos iónicos o electrolíticos acompañantes (hipofosfatemia, hipopotasemia, hipocalcemia, hipouricemia, acidosis metabólica o glucosuria con normoglucemia).
- 5.
HTA grave o refractaria.
Se debe, asimismo, considerar criterios de derivación urgente al nefrólogo:
- 1.
FG estimado mediante la fórmula de MDRD inferior a 15ml/min/1,73m2 o un rápido y progresivo deterioro de la función renal en determinaciones seriadas.
- 2.
Síndrome nefrótico.
- 3.
Hipertensión maligna.
La enfermedad renal se ha convertido en los últimos años en una comorbilidad emergente en el contexto de la infección por VIH-1 y el TARGA. Esto obedece a múltiples causas a las que no es ajena la mayor supervivencia de la población con infección por VIH-1, con la potencialidad que esto conlleva de un mayor uso de agentes nefrotóxicos, incluyendo a algunos fármacos ARV. En el paciente con infección por VIH-1, las nefropatías pueden deberse a una acción directa del propio VIH-1 o que las causen episodios relacionados con las coinfecciones o con su tratamiento y, por ultimo, con el tratamiento de la propia infección por VIH-1. En realidad, la relación del tratamiento ARV con la afección renal es bidireccional; por un lado, el tratamiento ARV puede constituir el tratamiento de algunas formas de nefropatía (p. ej., la HIVAN), mientras que en otros casos son alguno o algunos de los componentes de un determinado régimen ARV los causantes de la disfunción renal. Por otro lado, una vez establecida la disfunción renal, aquellos fármacos utilizados en el tratamiento de la infección por VIH-1 precisarán de ajuste de la dosis para no sobrepasar su dintel de toxicidad. El ajuste de las dosis de los fármacos ARV resulta imperativo en pacientes con ERC y en los que reciben diálisis, tanto para obviar problemas de toxicidad como para optimizar el control de la infección por VIH-1.
El tratamiento de la disfunción renal en pacientes con infección por VIH-1 incluye también el tratamiento renal sustitutivo si el progreso de la enfermedad renal lo exige y si se cumplen los criterios establecidos por los documentos de consenso elaborados ad hoc por las sociedades correspondientes. Con el tratamiento renal sustitutivo se han logrado resultados que son similares a los obtenidos en la población no infectada.
Todos estos hechos hacen que el clínico que trata a pacientes con infección por VIH-1 deba estar atento a la posible aparición de daño renal y, por esto, es obligatorio evaluar el funcionalismo renal antes del inicio del tratamiento ARV y con posterioridad a éste de forma periódica. Esta evaluación debe examinar diversos aspectos del funcionalismo renal que incluyen el funcionalismo glomerular y los distintos aspectos del funcionalismo tubular. Para esto no sólo debe efectuarse un cribado mediante bioquímica hemática, sino que se precisa un examen detallado de orina que debe incluir tanto parámetros bioquímicos como celulares.
Para la preparación del artículo se ha empleado material didáctico derivado del programa formativo HIV and the Kidney, desarrollado y financiado por Gilead Sciences, en el que han participado todos los autores.