Existen pocos estudios sobre cómo la coinfección por el virus de la inmunodeficiencia humana (VIH) y el virus de la hepatitis C (VHC) alteran su evolución al coexistir en niños.
MétodosSe estudiaron cinco niños coinfectados por el VIH y el VHC con tratamiento antirretroviral gran actividad (TARGA) con lopinavir/ritonavir (LPV/r). Su evolución fue comparada con un grupo control de 72 pacientes con infección por el VIH.
ResultadosTodos los pacientes mantuvieron una recuperación inmunológica sostenida durante el seguimiento y también alcanzaron un mejor control de la carga viral que el grupo control. Ninguno de los cinco niños coinfectados experimentó ningún efecto adverso a LPV/r durante el estudio.
ConclusiónLa coinfección por el VIH/VHC no disminuye los beneficios obtenidos con el TARGA.
There are few studies investigating the effect of HCV coinfection on HIV-related disease among children.
MethodsWe studied 5 HIV/HCV coinfected children receiving an LPV/r-containing HAART regimen. Their evolution was compared with a control group of 72 HIV-infected children.
ResultsAll 5 HIV/HCV-coinfected children achieved sustained immune recovery during the study. Moreover, they showed better viral suppression than the control group. None of the 5 HIV/HCV-coinfected children experienced any adverse effects with the use of LPV/r
ConclusionHIV/HCV coinfection does not reduce the benefits obtained from HAART.
El tratamiento antirretroviral (TAR) ha logrado disminuir drásticamente la morbimortalidad en los niños infectados por el virus de la inmunodeficiencia humana (VIH), trasformando en nuestro medio la infección por el VIH/ sida en una enfermedad crónica1,2. Esto ha sido especialmente notorio tras la introducción de los inhibidores de la proteasa en pautas conocidas como tratamiento antirretroviral de gran actividad (TARGA)3.
No obstante, la imposibilidad de erradicar el virus con los tratamientos actuales hacen necesarios tratamientos prolongados que, en muchas ocasiones, se han de mantener de manera indefinida en los pacientes4,5.
La infección por el virus de la hepatitis C (VHC) se ha identificado en nuestro medio como una causa importante de morbimortalidad en pacientes adultos, coinfectados a su vez por el VIH6. Aunque en la población adulta existen datos disponibles sobre la coinfección VIH/VHC, en niños coinfectados por ambos virus existen menos estudios disponibles en la actualidad y sobre todo durante períodos prolongados de TAR7. Nosotros presentamos los resultados de un estudio retrospectivo y longitudinal realizado en cinco niños coinfectados por VIH/VHC que mantuvieron un TARGA con lopinavir/ritonavir (LPV/r) durante más de 4 años, comparando su evolución con una cohorte de 72 niños exclusivamente infectados por el VIH con TARGA con LPV/r durante un período mínimo de 12 meses.
MétodosPoblación de estudio y diseñoSe incluyeron en el estudio niños coinfectados por VIH/VHC que hubieran comenzado una pauta TARGA con LPV/r entre los años 2001 y 2002 y que tuvieran un seguimiento mínimo de 48 meses. No hubo limitación en el nivel basal de carga viral ni en el recuento de células T CD4+ para entrar en el estudio. Se exigió que los pacientes hubieran recibido previamente TAR pero que no hubieran recibido tratamiento previo con LPV/r. Los cinco niños incluidos pertenecían a cuatro hospitales terciarios españoles, donde existía una consulta pediátrica especializada en infección por el VIH/sida. Los niños fueron controlados cada 3 meses durante el seguimiento mediante la realización de una entrevista clínica, exploración física y control analítico según los protocolos existentes en cada hospital. El cumplimiento terapéutico se controló en cada visita mediante recuento de pastillas y entrevistas a los padres y/o tutores. El estudio se llevó a cabo según la declaración de Helsinki y fue aprobado por el comité de ética de cada hospital.
Como grupo de compación, se empleó una cohorte de 72 niños infectados exclusivamente por el VIH controlados en ocho hospitales terciarios españoles, que hubieran comenzado un TARGA con LPV/r entre los años 2000 y 2003 y que tuvieran un seguimiento mínimo de 12 meses. Se compararon las características clínicas y epidemiológicas basales de ambos grupos, así como sus antecedentes de TAR. Se consideró también la presencia de nuevos fármacos antirretrovirales, que junto al LPV/r constituían el TARGA.
Análisis estadísticoLa descripción de las características basales de la población se expresaron mediante media y desviación estándar (DE) o frecuencia y porcentajes. Debido a que el tamaño de los grupos comparados era tan diferente, no se realizaron comparaciones estadísticas entre los dos grupos. El seguimiento durante los primeros 60 meses se expresó mediante las variaciones en los valores medios de los diferentes parámetros medidos. El análisis estadístico se realizó con el programa SPSS versión 12.0.
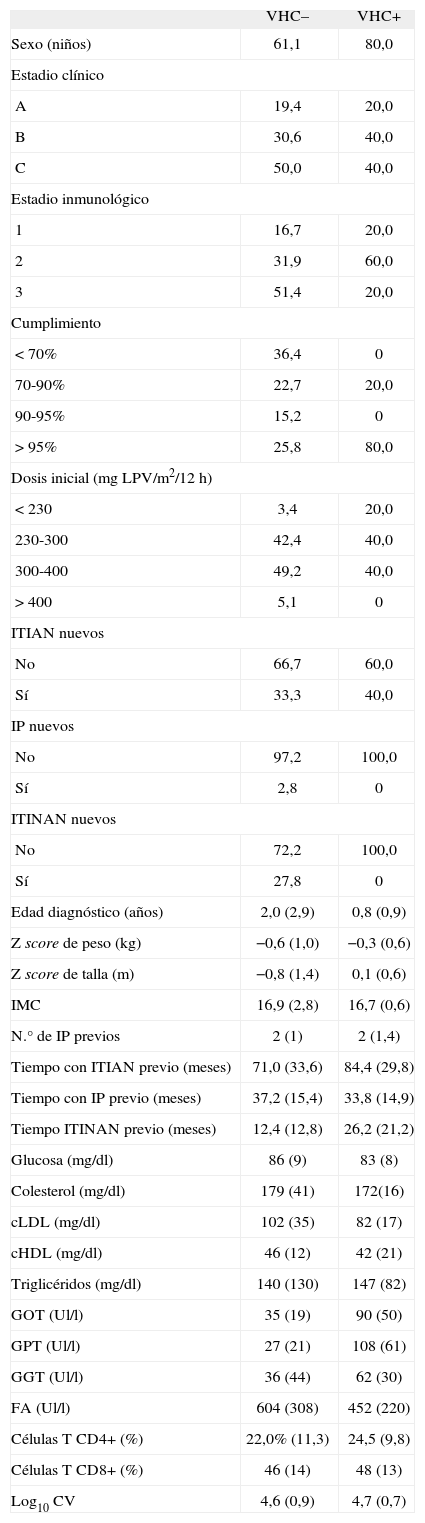
ResultadosDe los cinco niños coinfectados por VIH/VHC, cuatro habían adquirido ambas infecciones por vía vertical y un paciente hemofílico fue contagiado tras una transfusión de hemoderivados en los primeros años de vida, que se le detectó a los 2,5 años. Las características basales de estos cinco niños se resumen en la tabla 1. Se dispuso del genotipo del VHC en cuatro niños; dos tenían el genotipo 3, uno el genotipo 2a y otro el genotipo 1.
Características basales de los niños infectados por el VIH y en tratamiento antirretroviral de gran actividad (TARGA) que incluye lopinavir/ritonavir
| VHC– | VHC+ | |
| Sexo (niños) | 61,1 | 80,0 |
| Estadio clínico | ||
| A | 19,4 | 20,0 |
| B | 30,6 | 40,0 |
| C | 50,0 | 40,0 |
| Estadio inmunológico | ||
| 1 | 16,7 | 20,0 |
| 2 | 31,9 | 60,0 |
| 3 | 51,4 | 20,0 |
| Cumplimiento | ||
| < 70% | 36,4 | 0 |
| 70-90% | 22,7 | 20,0 |
| 90-95% | 15,2 | 0 |
| > 95% | 25,8 | 80,0 |
| Dosis inicial (mg LPV/m2/12 h) | ||
| < 230 | 3,4 | 20,0 |
| 230-300 | 42,4 | 40,0 |
| 300-400 | 49,2 | 40,0 |
| > 400 | 5,1 | 0 |
| ITIAN nuevos | ||
| No | 66,7 | 60,0 |
| Sí | 33,3 | 40,0 |
| IP nuevos | ||
| No | 97,2 | 100,0 |
| Sí | 2,8 | 0 |
| ITINAN nuevos | ||
| No | 72,2 | 100,0 |
| Sí | 27,8 | 0 |
| Edad diagnóstico (años) | 2,0 (2,9) | 0,8 (0,9) |
| Z score de peso (kg) | −0,6 (1,0) | −0,3 (0,6) |
| Z score de talla (m) | −0,8 (1,4) | 0,1 (0,6) |
| IMC | 16,9 (2,8) | 16,7 (0,6) |
| N.° de IP previos | 2 (1) | 2 (1,4) |
| Tiempo con ITIAN previo (meses) | 71,0 (33,6) | 84,4 (29,8) |
| Tiempo con IP previo (meses) | 37,2 (15,4) | 33,8 (14,9) |
| Tiempo ITINAN previo (meses) | 12,4 (12,8) | 26,2 (21,2) |
| Glucosa (mg/dl) | 86 (9) | 83 (8) |
| Colesterol (mg/dl) | 179 (41) | 172(16) |
| cLDL (mg/dl) | 102 (35) | 82 (17) |
| cHDL (mg/dl) | 46 (12) | 42 (21) |
| Triglicéridos (mg/dl) | 140 (130) | 147 (82) |
| GOT (Ul/l) | 35 (19) | 90 (50) |
| GPT (Ul/l) | 27 (21) | 108 (61) |
| GGT (Ul/l) | 36 (44) | 62 (30) |
| FA (Ul/l) | 604 (308) | 452 (220) |
| Células T CD4+ (%) | 22,0% (11,3) | 24,5 (9,8) |
| Células T CD8+ (%) | 46 (14) | 48 (13) |
| Log10 CV | 4,6 (0,9) | 4,7 (0,7) |
Valores expresados como porcentaje y media (desviación estándar [DE]). VHC-: niños infectados exclusivamente por el VIH-1. VHC+: niños coinfectados por el VIH-1 y el VHC. cHDL: colesterol unido a lipoproteínas de ata densidad; cLDL: colesterol unido a lipoproteínas de baja densidad; FA: fosfatasa alcalina; GGT: gamma-glutamil transpeptidasa; GOT: transaminasa glutámico oxalacética; GPT: transaminasa glutámico pirúvica; IMC: índice de masa corporal; IP: inhibidores de la proteasa; Log CV: logaritmo de carga viral; ITINAN: inhibidores de la transcriptasa inversa no análogos de nucleósido; ITIAN: inhibidores de la transcriptasa inversa análogos de nucleósido; UI: unidades internacionales; VHC: virus de la hepatitis C; VIH: virus de la inmunodeficiencia humana.
Los cinco pacientes continuaron el tratamiento con LPV/r y al finalizar el estudio tenían un tiempo medio de seguimiento de 56,7 meses (DE: 4,4 meses) frente al grupo de 72 niños monoinfectados por el VIH con TARGA con LPV/r, que tuvieron un tiempo medio de seguimiento de 48,2 meses (DE: 14,3 meses). La edad media al final del seguimiento en los cinco pacientes coinfectados fue de 14,9 años (DE: 4,6 años) y en el grupo de 72 pacientes infectados exclusivamente por el VIH fue de 13,4 años (DE: 3,8 años).
Como se resume en la tabla 1, los cinco niños coinfectados por el VIH/VHC tenían antecedentes de TAR más prolongado que los 72 niños no coinfectados por el VHC, mejores parámetros nutricionales y cifras de colesterol ligado a lipoproteínas de baja densidad (cLDL) y de fosfatasa alcalina basales más bajas, así como niveles de transaminasas considerablemente más elevados. No existían diferencias significativas en el recuento basal de células T CD4+ y CD8+ y la carga viral plasmática entre ambos grupos. Un mayor porcentaje de pacientes coinfectados por el VHC respecto al grupo de niños monoinfectados por el VIH, presentó un cumplimiento muy bueno (> 95%) durante el seguimiento.
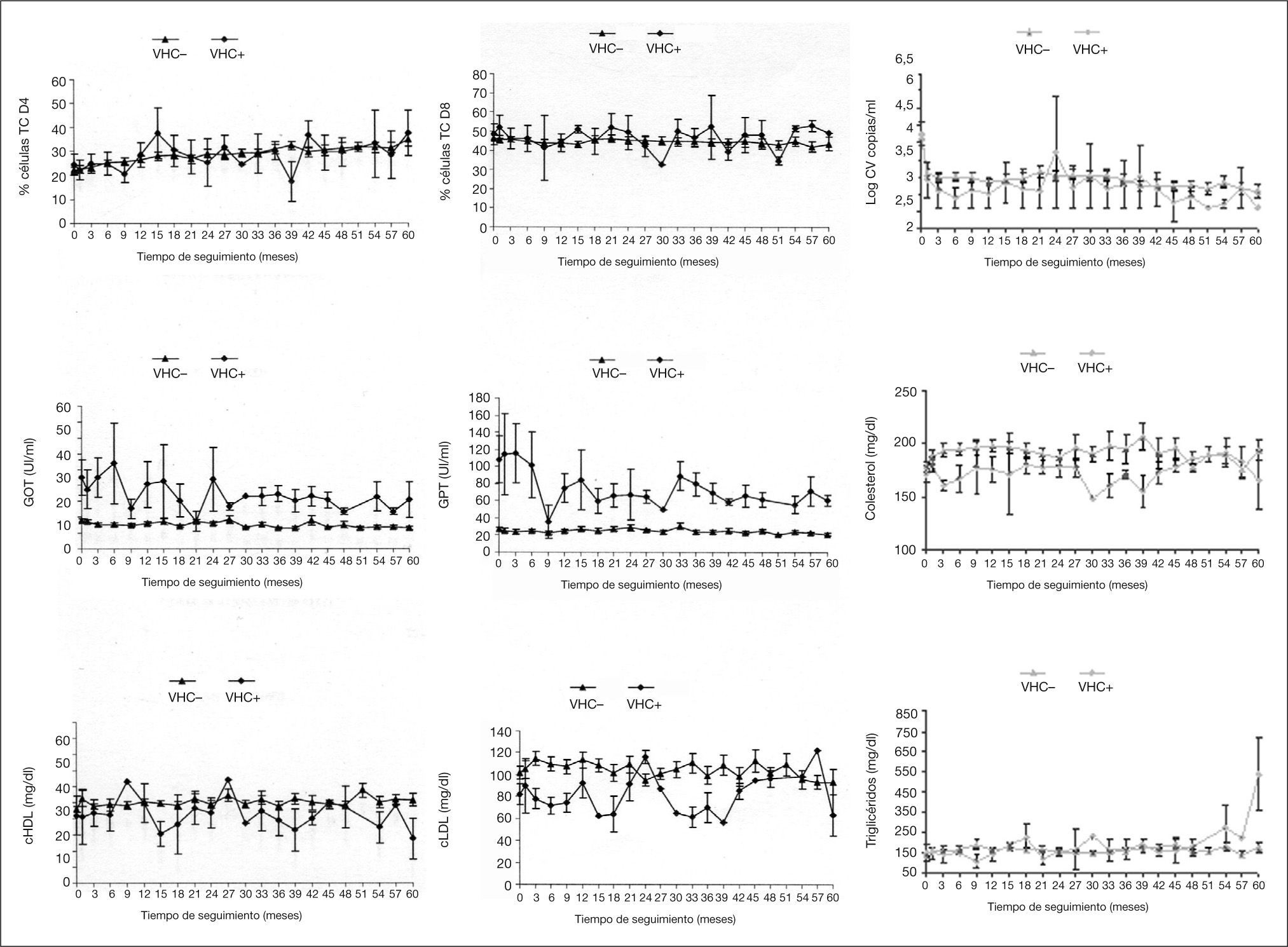
La evolución de los parámetros analíticos monitorizados en el estudio se resume en la figura 1. Ningún paciente coinfectado por el VHC experimentó ningún efecto adverso al LPV/r durante la evolución y mantuvieron durante todo el seguimiento la misma pauta de TARGA sin precisar ningún cambio. Los fármacos que junto al LPV/r componían las líneas TARGA en estos cinco niños fueron: a) LPV/r + estavudina (d4T) + efavirenz (EFV); b) LPV/r + + d4T + didanosina (ddI); c) LPV/r + abacavir (ABC) + ddI; d) LPV/r + lamivudina (3TC) + zidovudina (AZT) + ABC, y e) LPV/r + 3TC + AZT.
Evolución de los 5 niños coinfectados por VIH/VHC respecto a los 72 niños infectados exclusivamente por el VIH con TARGA con LPV/r. cHDL: colesterol unido a lipoproteínas de alta densidad; cLDL: colesterol unido a lipoproteínas de baja densidad; FA: fosfatasa alcalina; GGT: gamma-glutamil transpeptidasa; GOT: transaminasa glutámico oxalacética; GPT: transaminasa glutámico pirúvica; Log CV: logaritmo de carga viral; UI: unidades internacionales; VHC–: niños infectados exclusivamente por el VIH-1; VHC+: niños coinfectados por el VIH-1 y el VHC.
Como se aprecia en la figura 1, durante el seguimiento no existieron diferencias significativas entre los recuentos de células T CD4+ y CD8+ en ambos grupos de niños, aunque sí una tendencia a mantener cifras de carga viral plasmáticas más bajas en el grupo de los cinco niños coinfectados por el VHC. Durante los 60 meses las cifras de GOT, GPT y GGT se mantuvieron más elevadas en los cinco pacientes coinfectados por el VHC. No obstante, en estos cinco niños los valores de colesterol fueron inferiores a los correspondientes a los 72 niños no coinfectados por el VHC.
Ninguno de los cinco niños coinfectados por VIH/VHC experimentó ningún efecto adverso al TARGA con LPV/r durante el seguimiento ni se evidenciaron signos de lipodistrofia tras finalizar el estudio.
DiscusiónTanto el VIH como el VHC son virus capaces de transmitirse por vía vertical y aunque la transmisión de cada agente por separado es más frecuente en madres coinfectadas, también se ha descrito la transmisión conjunta de ambos virus7. Los efectos que la infección por el VHC tiene sobre la progresión del VIH son poco conocidos en la edad pediátrica y la mayoría de los datos derivan de estudios realizados con pacientes adultos, en los que además se han obtenido resultados muy dispares, probablemente debido al diferente genotipo del VHC que tenían los pacientes incluidos. En nuestro estudio el grupo de cinco niños coinfectados por el VHC tenían mejores parámetros nutricionales y estadios clínicos e inmunológicos menos avanzados en el momento basal, lo que podría sugerir una progresión más lenta de la infección por el VIH en estos pacientes. Además, aunque no hubo diferencias marcadas en los recuentos de células T CD4+, T CD8+ y carga viral al inicio del estudio, los niños coinfectados por el VHC lograron una ligera mejor supresión de la carga viral plasmática que los niños con infección por el VIH exclusivamente. Más aún, en el grupo de niños coinfectados no fue preciso ningún cambio en el TARGA durante el período que comprendió el estudio y todos los niños coinfectados no interrumpieron el TARGA con LPV/r, teniendo por tanto un tiempo medio de seguimiento más prolongado que el grupo de niños monoinfectados por el VIH (57 frente a 48 meses). La evolución más favorable de estos pacientes podría sugerir una evolución más lenta en la progresión de la infección por el VIH en presencia de la coinfección por el VHC. No obstante, el pequeño número de pacientes, así como la presencia de otros factores como el mejor cumplimiento de los pacientes coinfectados, respecto al grupo de niños monoinfectados por el VIH, limitan nuestros resultados e imposibilitan la comparación estadística entre ambos grupos.
En pacientes adultos ha sido ampliamente estudiado cómo la infección por el VIH acelera el curso de la enfermedad por el VHC, siendo la hepatopatía por el VHC una de las causas principales de mortalidad entre los pacientes adultos VIH positivos6. No obstante, en niños, la infección por el VHC sigue un curso más lento que en los adultos, como demostraron los resultados de la cohorte europea, donde sólo el 22% de los niños coinfectados experimentaba al menos una manifestación clínica menor antes de los 4 años8. Tanto los estudios realizados en niños como en población adulta muestran cifras más elevadas de transaminasas en el grupo de pacientes coinfectados, como ocurre en nuestro estudio, donde los niños con el VHC no sólo tienen cifras más elevadas de GOT, GPT y GGT en el momento basal, sino que mantienen esa tendencia durante todo el estudio.
En pacientes adultos, se ha demostrado cómo la coinfección por el VHC y el VIH se asocia a tasas más altas de lipodistrofia e intolerancia a la glucosa. Sin embargo, recientemente se han comunicado los resultados de dos estudios que muestran menor incidencia de dislipidemia en pacientes adultos coinfectados por el VIH y el VHC respecto a pacientes con infección por el VIH exclusivamente9,10. En nuestra cohorte, los niños coinfectados por el VHC y el VIH no sólo tenían cifras de colesterol total, colesterol ligado a lipoproteínas de alta densidad y cLDL más bajas en el momento basal, sino que además mantuvieron esta tendencia durante todo el tiempo que abarcó el estudio. Además, no se objetivó un aumento en las cifras de glucosa en el seguimiento de estos pacientes, y ninguno de los cinco niños coinfectados presentó signos de lipodistrofia al finalizar el estudio.
Por lo tanto, nuestro estudio muestra que la coinfección por VIH/VHC se asocia con una buena recuperación inmunológica durante un tiempo prolongado con TARGA que incluye LPV/r.
FinanciaciónEste estudio ha sido financiado por la Fundación para la Investigación Sanitaria (FIS) del Ministerio de Sanidad y Consumo (PI052476, PI061479); Red RIS RD06-0006-0035; FIPSE (36514/05, 24534/05) y Fundación Caja Navarra.
Beatriz Larrú y Salvador Resino tienen contratos del FIS con referencia CP04/00090 y FIS CM0600054, respectivamente.