Introducción
Debido a que los regímenes actuales no pueden erradicar la infección por el virus de la inmunodeficiencia humana (VIH), los pacientes que viven con el VIH deben asumir tratamientos crónicos que con frecuencia obligan a esquemas terapéuticos complejos con carga elevada de comprimidos. Este entorno puede conducir a una reducción de la adherencia, a una supresión incompleta de la replicación viral y a la emergencia de virus resistentes. Además, con la continuada exposición a los fármacos antirretrovirales los pacientes desarrollan a lo largo de los años efectos adversos que incluyen la redistribución de la grasa corporal, dislipidemia, diabetes, resistencia a insulina y osteopenia1 y el temor a la aparición de complicaciones no esperadas como la enfermedad cardiovascular2.
Una alternativa terapéutica al tratamiento antirretroviral (TAR) es la interrupción del tratamiento. El estudio de esta alternativa es aconsejable para intentar dar respuesta a aquellos pacientes que comenzaron el TAR en una situación inmunológica mejor que la que preconizan las actuales recomendaciones3. Los otros escenarios en los que se han probado las interrupciones de tratamiento como en la primoinfección y en enfermos con fallo virológico no han tenido éxito4.
Hasta la fecha, existe un número de potenciales riesgos que no se han determinado: el riesgo de exponer a los pacientes a diferentes concentraciones de los fármacos que pueden aumentar la selección de mutantes resistentes5,6, los efectos de la resiembra de los reservorios virales y el resultado final de las interrupciones del tratamiento comparado con el tratamiento antirretroviral de gran actividad (TARGA) continuo.
Para dar respuesta a estas cuestiones presentamos un modelo predictivo multivariable de los factores que pueden predecir el fracaso de esta estrategia de interrumpir el tratamiento en una cohorte de pacientes infectados crónicamente por el VIH.
Métodos
Diseño del estudio y pacientes
Los pacientes procedían de la cohorte dinámica (1.569 pacientes) del Hospital Severo Ochoa, Madrid. En el momento de realizar el estudio, entre los años 2001 al 2003, el número de pacientes en seguimiento era de 729. El diseño utilizado es el correspondiente a un estudio cuasi-experimental. La selección de los pacientes para la incorporación al grupo de intervención "de la estrategia de interrumpir el TAR" se realizó entre los pacientes que habían abandonado la medicación antirretroviral, habían presentado toxicidad o por "criterio inmunológico" cuando habían iniciado el tratamiento con una cifra de linfocitos CD4+ > 350 cél./μl, estando en la actualidad con una respuesta inmunológica mantenida (CD4+ > 500 cél./μl) durante más de 12 meses. En todos los pacientes se solicitó consentimiento oral. Todos los pacientes debían cumplir los siguientes criterios de inclusión: a) debían proceder de un solo centro (Hospital Severo Ochoa, Leganés); b) tenían que ser mayores de 18 años; c) debía disponerse en el centro de documentación de infección por el VIH-1 (confirmado al menos en dos ocasiones); d) tenían que tener un régimen estable con al menos tres fármacos como mínimo durante 24 meses, y e) no debían recibir ningún fármaco inmunomodulador ni estar embarazadas. Las pacientes permanecieron sin tratamiento hasta que las cifras de CD4+ descendieron por debajo de 350 cél./μl en dos ocasiones con el intervalo de un mes, independientemente de su carga viral, cuando presentaban una enfermedad relacionada con el VIH o cuando habían desarrollado enfermedad categoría C de los Centers for Disease Control and Prevention (CDC).
Monitorización y pruebas de laboratorios
Se incluyeron de forma consecutiva a aquellos pacientes que cumplían los criterios de inclusión. Los pacientes debían acudir a la consulta cada 3 meses y en cada visita se les realizaba un examen clínico, pruebas bioquímicas de rutina, recuento de CD4+ y determinación de la viremia VIH. Las visitas no fijadas se realizaron en función de las necesidades clínicas de los pacientes. El recuento de linfocitos CD4+ se llevó a cabo por citometría de flujo. El ARN VIH en plasma se determinó con reacción en cadena de la polimerasa (PCR) (Amplicor® HIV monitor; Roche Diagnostic system, umbral 50 copias/ml). El resto de las otras variables se midieron por las pruebas estandarizadas de laboratorio. Durante el seguimiento se buscaron de forma sistemática las enfermedades relacionadas con el VIH y se diagnosticó como sida en función de la categoría C del sistema de clasificación del CDC para infección por VIH.
Definición de fracaso de la estrategia
de interrupción del tratamiento
El criterio fundamental de valoración fue la proporción de pacientes con fracaso (definido como CD4+ < 350 cél./μl, enfermedades relacionadas con el VIH o la presentación de una enfermedad categoría C del sistema de clasificación de CDC para la infección por VIH).
Análisis estadístico
La descripción de la población del estudio se analizó con la mediana, el rango intercuartílico y las proporciones. Para la comparación de las variables cualitativas se utilizaron el test de la ji cuadrado (x2) y el test exacto de Fisher; y para las cuantitativas el test de la t de Student y el test U de Mann-Whitney. Se consideró como estadísticamente significativo un nivel a de 0,050 de dos colas. Las variables seleccionadas en el análisis univariable fueron: edad (años) en el momento de suspensión, sexo, grupo de riesgo, CD4+ (cél./μl) y ARN VIH (copias/μl) al iniciar TARGA, CD4+ (cél./μl) y ARN VIH (copias/ml) en el momento de suspensión, CD4+ (cél./μl) nadir, período de tiempo (meses) entre inicio de TARGA y la suspensión, tiempo (meses) con ARN VIH indetectable en el momento de la suspensión, tiempo (meses) hasta el fracaso, descenso de CD4+ (cél./μl) y aumento de ARN VIH (copias/ml) a los 3 meses de la suspensión y el tipo de tratamiento TARGA.
Para realizar el análisis multivariante se categorizaron las variables continuas (CD4+ y ARN VIH al inicio del TARGA, CD4+ y ARN VIH en el momento de la suspensión, CD4+ nadir, tiempo con ARN VIH indetectable en el momento de la suspensión) teniendo en cuenta los datos del estudio y las recomendaciones actuales (Deparment of Health and Human Services [DHHS] de marzo 2004). Los puntos de corte seleccionados fueron en CD4+ al inicio del tratamiento y en CD4+ nadir la cifra de 350 cél./μl; para CD4+ en el momento de la suspensión la cifra de 500 cél./μl; para ARN VIH al inicio del tratamiento 100.000 copias/ml, para el tiempo con ARN VIH indetectable en el momento de la suspensión que fuera menor de 6 meses.
Para contestar a la pregunta del estudio y dado que se han medido múltiples variables se realizó un análisis multivariante mediante un modelo predictivo de regresión logística (mediante exclusión secuencial = backward elimination LR). Se introdujeron en el análisis multivariante aquellas variables que en el análisis univariante tenían una p < 020 o porque fueran variables relevantes. El análisis estadístico se realizó con el programa estadístico SPSS 10.0.
Resultados
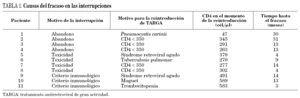
Se incluyeron 41 pacientes de forma prospectiva a los que se interrumpió el TARGA, con una mediana de seguimiento de 13 meses. Las causas de la interrupción fueron: lipodistrofia, 2 (4,9%); toxicidad hepática (grado 4), 6 (14,6%); complicaciones cardiovasculares, 1 (2,4%); por abandono de la medicación por el paciente, 11 (26,8%); y por "criterio inmunológico", 21 (51,2%). En 11 pacientes (26,8%) hubo que reintroducir el tratamiento: 4 pacientes por enfermedades relacionadas con el VIH (muguet uno, trombopenia uno, síndrome retroviral agudo dos), dos por enfermedades clase C (una neumonitis por Pneumocystis carinii y una tuberculosis pulmonar); y los otros cinco por descenso de CD4+ por debajo de 350 cél./μl. El paciente que desarrolló neumonitis por P. carinii había decidido abandonar el tratamiento y presentó la NPC con un recuento de CD4+ de 47 cél./ml y el que desarrolló tuberculosis pulmonar se le había retirado el tratamiento por toxicidad. Cuando desarrolló tuberculosis el recuento de CD4+ era 270 cél./μl (tabla 1). El fracaso se relacionó con el criterio de suspensión (p = 0,0063); en los que abandonaron el tratamiento por criterio inmunológico fue del 14,3% (3/21) y en los que pararon por toxicidad o por abandono, del 40% (8/20).
Con la reintroducción del tratamiento la carga viral se volvió indetectable (< 50 copias/ml) en todos aquellos en los que en el momento de la interrupción esta era inferior a 50 copias/ml y en todos volvieron a incrementarse los CD4+ a cifras similares a las anteriores a la interrupción.
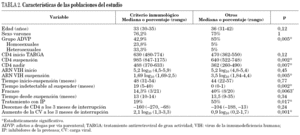
Al haber escogido dos poblaciones no homogéneas en la tabla 2 se presentan las características de los que pararon el tratamiento con el "criterio inmunológico" y de aquellos que lo hicieron por otros criterios. Había diferencias significativas entre los que pararon por criterio inmunológico del otro grupo en el porcentaje de adictos a drogas por vía parental (ADVP) como grupo de riesgo, en el recuento de CD4+ en el momento de suspensión, en el recuento de CD4 nadir, en el tiempo en meses indetectable antes del paro de tratamiento, en el ARN VIH en el momento de la interrupción, en el aumento de ARN VIH a los 3 meses de la suspensión y en el porcentaje de pacientes en tratamiento con inhibidores de proteasa (IP).
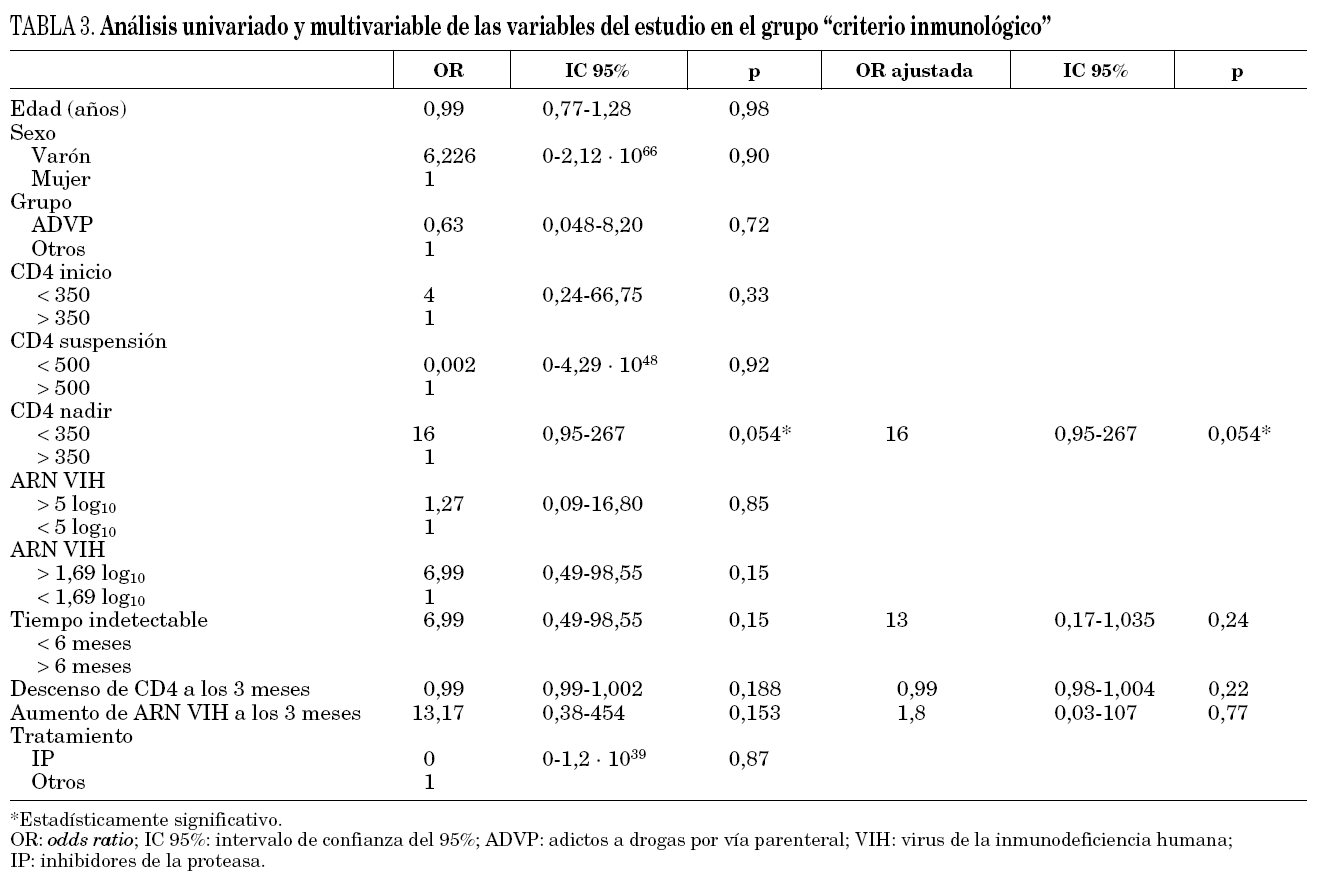
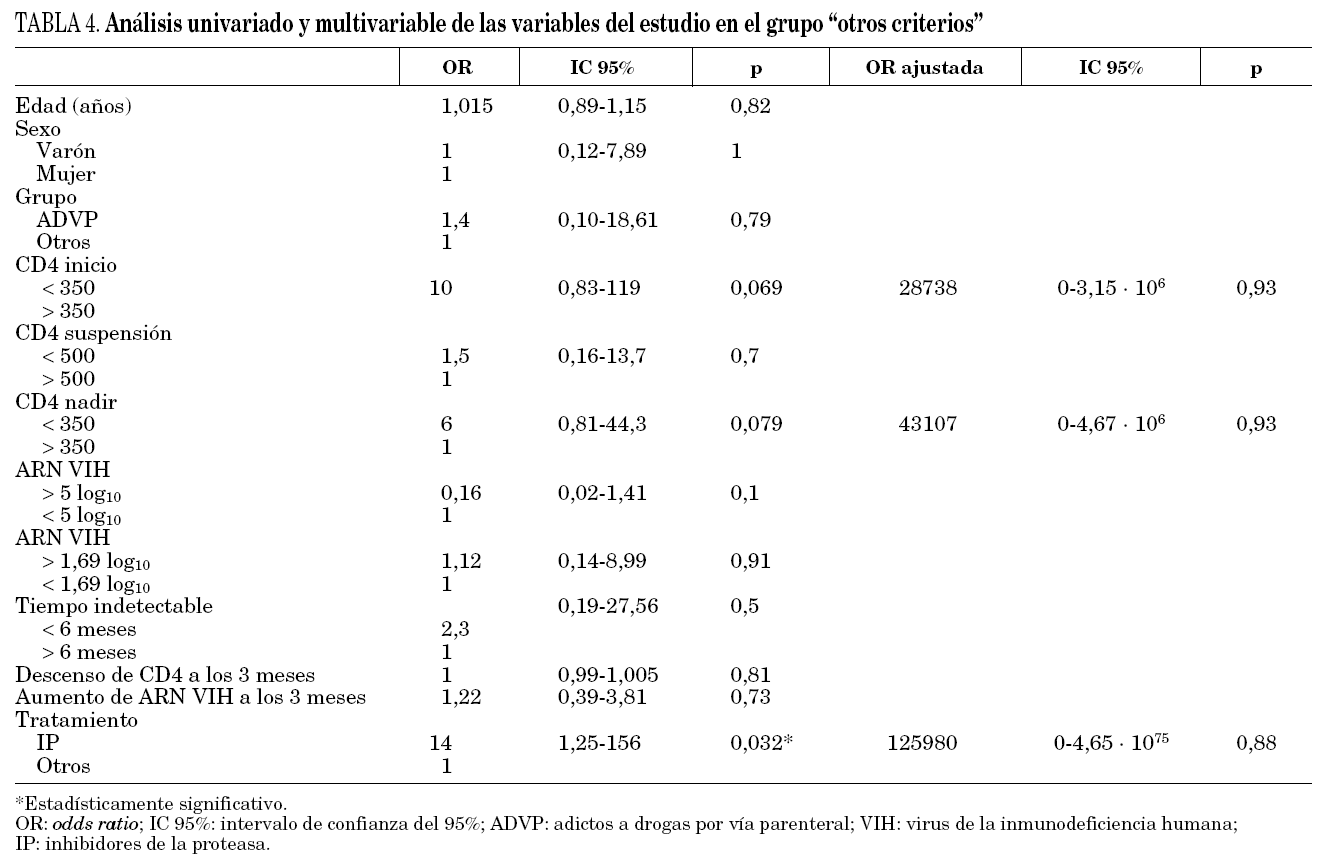
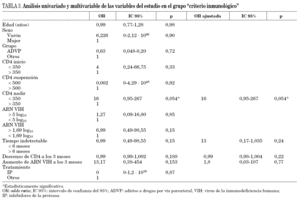
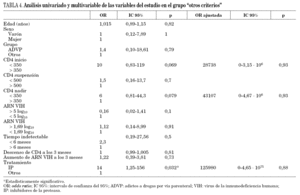
En el análisis univariado (tabla 3), separando ambas poblaciones, en el grupo que interrumpieron por criterio inmunológico sólo una cifra de CD4 nadir por debajo de 350 cél./μl se relacionó con el fracaso (OR CD4+ nadir 16; intervalo de confianza del 95% [IC 95%], 0,96-267; p = 0,054). En el otro grupo de pacientes "otros criterios" (tabla 4) el tratamiento con IP frente a otros tratamientos se relacionó con el fracaso (OR CD4+ nadir: 14; IC 95%: 1,25-1,56; p = 0,032). No se observó que el aumento de la viremia a los 3 meses de la suspensión tuviera impacto en el fracaso. En el análisis multivariante, la cifra de CD4 nadir por debajo de 350 cél./μl siguió relacionándose con el fracaso (grupo de criterio inmunológico) y no así el tratamiento con IP (grupo de otros criterios).
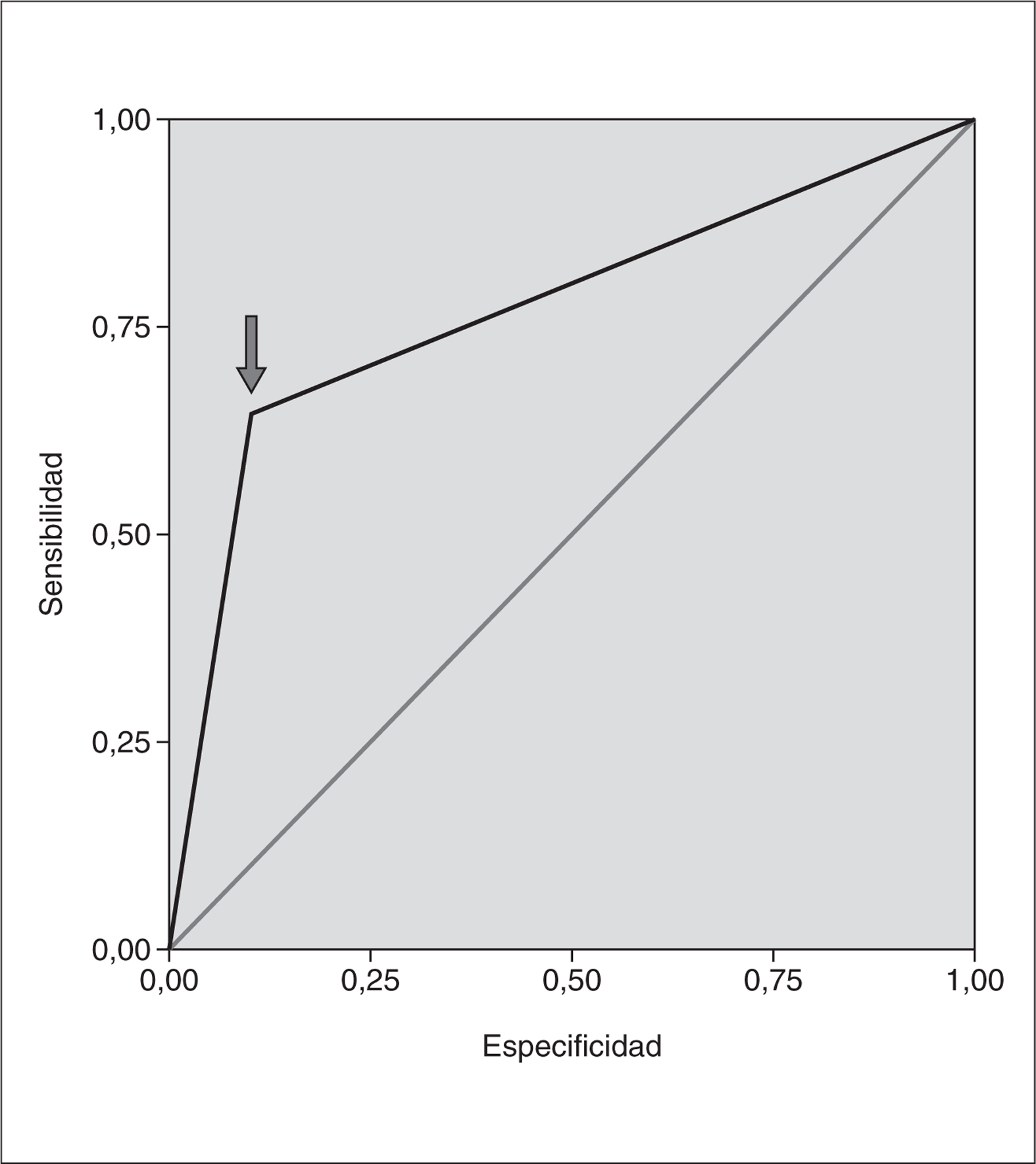
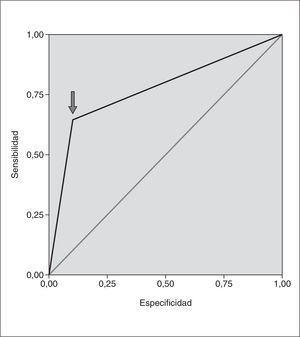
En el grupo que paró por "criterio inmunológico" la especificidad del modelo predictivo con la variable CD4 nadir por debajo de 350 cél./μl fue del 88,9% y la sensibilidad del 66,7% con un poder de discriminación del 85,7%. Consideramos que este modelo tiene un poder de clasificación aceptable al superar el 75%. Gráficamente lo representamos con la curva ROC (área bajo la curva [ABC], 0,77; IC 95%: 0,44-1,13) (fig. 1).
Figura 1. Curva ROC del modelo predictivo (la flecha indica dónde se encuentra en la curva ROC la cifra nadir de CD4+ < 350 cél./μl).
Discusión
Hoy en día los actuales fármacos antirretrovirales no pueden erradicar la infección por el VIH. Es un tratamiento indefinido que puede conducir a mal cumplimiento por "cansancio de pastillas" con emergencia de virus resistentes. Tiene efectos sobre la calidad de vida por las restricciones que impone en la alimentación, en el estilo de vida y en los horarios. Además de las frecuentes toxicidades a largo plazo de la mayoría de los fármacos, están surgiendo inesperadas toxicidades como el aumento de riesgo cardiovascular.
Para reducir estos inconvenientes la interrupción del TAR ha surgido como alternativa del manejo de estos enfermos.
En este estudio se incluyeron pacientes que nunca deberían haber iniciado TAR según las recomendaciones actuales por criterios de CD4+. También se incluyeron a pacientes que interrumpieron el tratamiento por decisión del paciente o por presentar toxicidad tipo 4, independientemente del recuento de CD4+.
El fracaso en este estudio a las interrupciones de tratamiento es comparable al de otros estudios (27,3%)7,8. Estudios recientes afirman en sus conclusiones que si se seleccionan los pacientes con un CD4+ nadir superior a 350 cél./μl9-11 y que han estado durante un largo tiempo con carga viral indetectable, las interrupciones son seguras12. En nuestro estudio sólo en el 14% de los pacientes que tenían estas características fracasaron a la interrupción del tratamiento y el fracaso se relacionó con el criterio de suspensión (mayor en los que suspendieron el tratamiento por abandono de medicación o por toxicidad). Ningún paciente que interrumpió por criterios de CD4+ presentó infección oportunista. En todos los pacientes en los que se reintrodujo el tratamiento se alcanzaron cifras de CD4+ comparables a las de antes de la interrupción. Lo mismo ocurrió con la carga viral ARN VIH. La trombocitopenia asociada a VIH puede condicionar el fracaso de la interrupción del tratamiento, como ocurrió en uno de nuestros pacientes que había iniciado el TAR con cifra de CD4+ > 350 cél./μl. Aunque se observó descenso del recuento de CD4 y aumento de carga viral a los 3 meses de la suspensión del tratamiento, la magnitud de estas variables no se relacionó con el fracaso.
Las interrupciones del TAR pueden ser una opción en pacientes crónicamente infectados por el VIH que empezaron el tratamiento TAR en una situación inmunológica mejor que las que preconizan las actuales recomendaciones, con grandes ventajas en la calidad de vida en cuanto reduce toxicidades y mejora el estilo de vida, favoreciendo el cumplimiento y haciendo más eficiente el manejo de estos pacientes en nuestro sistema sanitario de salud.
Como muestran nuestros datos es posible predecir que los pacientes con CD4+ nadir superior a 350 cél./μl se beneficiarán de esta estrategia. Estos resultados confirman la utilidad del enfoque conservador de inicio del TAR de las recomendaciones actuales. Conclusiones opuestas se han obtenido de estudios en que no seleccionaron a los pacientes en función de la cifra nadir de CD413.
La limitación principal de este estudio es que al tratarse de una cohorte dinámica sin grupo de comparación no permite que los resultados tengan la suficiente potencia para su generalización. También la validez de estos resultados puede estar afectada por el sesgo de selección al no haber habido aleatorización en la intervención. Otra limitación importante es el tiempo de seguimiento (13 meses). Serán por lo tanto los ensayos clínicos con períodos de seguimiento mayores los que podrán confirmar o refutar nuestros datos.