El objetivo de este estudio es estimar el impacto económico en España de la optimización del tratamiento antirretroviral (TAR) triple en pacientes con carga viral suprimida según las recomendaciones GeSIDA/PNS (2015) y su aplicabilidad en la práctica clínica.
MétodosA partir de los datos de prescripción del TAR de la encuesta hospitalaria 2014, siguiendo las recomendaciones de GeSIDA/PNS de optimización de TAR con grado de evidencia A-I, se desarrolló un modelo farmacoeconómico. Las pautas de optimización, la voluntad de optimización y demás asunciones y resultados del modelo fueron validados por un panel de expertos en la infección por VIH (infectológos y farmacéuticos hospitalarios). El análisis se realizó desde la perspectiva del SNS, considerando el coste farmacológico anual, precio de venta del laboratorio notificado, deducción RD-Ley-8/2010 e IVA.
ResultadosEl panel seleccionó 6 estrategias de optimización y estimó que en España de los 80.859 pacientes actualmente en TAR triple, 10.863 (13,4%) serían candidatos a optimizar su TAR según estas estrategias, generando ahorros de 15,9M€/año (2,4% del coste farmacológico del TAR triple). Las estrategias más factibles (>40% del total de pacientes candidatos a optimizar, n=4.556) y asociadas a mayores reducciones del gasto (ahorro entre 653 y 4.797€/paciente-año según el TAR triple de partida) serían las optimizaciones a ATV/r+3TC.
ConclusiónLa aplicación a la práctica clínica española de las principales estrategias de optimización recomendadas en el documento GeSIDA/PNS (2015) generaría ahorros sustanciales, especialmente aquellas basadas en biterapia con ATV+3TC, contribuyendo así al control del gasto farmacéutico y a la sostenibilidad del SNS.
The objective of this study is to estimate the economic impact associated with the optimisation of triple antiretroviral treatment (ART) in patients with undetectable viral load according to the recommendations from the GeSIDA/PNS (2015) Consensus and their applicability in the Spanish clinical practice.
MethodsA pharmacoeconomic model was developed based on data from a National Hospital Prescription Survey on ART (2014) and the A-I evidence recommendations for the optimisation of ART from the GeSIDA/PNS (2015) consensus. The optimisation model took into account the willingness to optimise a particular regimen and other assumptions, and the results were validated by an expert panel in HIV infection (Infectious Disease Specialists and Hospital Pharmacists). The analysis was conducted from the NHS perspective, considering the annual wholesale price and accounting for deductions stated in the RD-Law 8/2010 and the VAT.
ResultsThe expert panel selected six optimisation strategies, and estimated that 10,863 (13.4%) of the 80,859 patients in Spain currently on triple ART, would be candidates to optimise their ART, leading to savings of €15.9M/year (2.4% of total triple ART drug cost). The most feasible strategies (>40% of patients candidates for optimisation, n=4,556) would be optimisations to ATV/r+3TC therapy. These would produce savings between €653 and €4,797 per patient per year depending on baseline triple ART.
ConclusionImplementation of the main optimisation strategies recommended in the GeSIDA/PNS (2015) Consensus into Spanish clinical practice would lead to considerable savings, especially those based in dual therapy with ATV/r+3TC, thus contributing to the control of pharmaceutical expenditure and NHS sustainability.
En España se estima que alrededor de 150.000 personas están infectadas por el virus de la inmunodeficiencia humana (VIH)1, incrementándose este diagnóstico anualmente en unos 4.000 nuevos casos2. La situación epidemiológica, el impacto social y la repercusión económica hacen que la infección por el VIH sea actualmente considerada uno de los principales problemas de salud pública en España1. Desde que se dispone de tratamiento antirretroviral (TAR) de gran actividad se ha logrado reducir de forma drástica la morbimortalidad, e incluso modificar el curso natural de la infección por el VIH3–5. El objetivo del TAR es la supresión mantenida de la carga viral (CV)6,7, siendo la combinación de 2 inhibidores de transcriptasa inversa análogos de nucleósido (ITIAN) y un tercer fármaco de otra familia el estándar de tratamiento.
La mejora de la calidad de vida y la supervivencia de los pacientes infectados por el VIH debido a la eficacia y seguridad del TAR triple4,5, junto con la alta incidencia en España2 y la recomendación actual consensuada de iniciar el TAR en todos los pacientes independientemente de los niveles de CD43,6,7 incrementa el número anual de pacientes a tratar.
A pesar de haber demostrado ser coste-efectivo, el hecho de que el TAR triple deba administrarse de por vida y de que se asocie a medio y largo plazo con cierto nivel de toxicidad8, supone un elevado coste económico9,10. El gasto en TAR en España alcanzó en 2015 los 968M€, representando el 12% del gasto farmacéutico hospitalario11.
En este sentido, desde principios de la década de los años 2000, la búsqueda de tratamientos más sencillos y menos tóxicos como alternativas al TAR triple en pacientes con CV suprimida ha sido un objetivo a conseguir12,13, como se evidencia en las recomendaciones de GeSIDA/PNS3, y en menor medida de las guías europeas7 y norteamericanas6.
La optimización del TAR tiene como fin mejorar la calidad de vida del paciente y su adherencia al TAR, manteniendo la eficacia de la misma (control virológico y respuesta inmunológica)3,6,7,13. La optimización puede realizarse reduciendo la complejidad del tratamiento (reducción del número de fármacos antirretrovirales [FAR], tomas diarias, restricciones alimentarias, etc.), adaptando el tratamiento a los requisitos y particularidades del paciente, o para prevenir, reducir y/o revertir la toxicidad del TAR3,6,7,13.
Como consecuencia, el coste del TAR y la posibilidad de encontrar opciones terapéuticas que garanticen la eficacia y seguridad con menores costes asociados cobran cada vez más importancia14.
Desde 2011 se realizan anualmente análisis de coste-eficacia de las pautas de inicio de TAR recomendadas en el documento de consenso de GeSIDA/PNS15 vigente. Sin embargo, hasta la fecha no se ha evaluado el impacto económico, para el Sistema Nacional de Salud (SNS), de la implementación de las recomendaciones concernientes a la optimización del TAR. Por ello, el objetivo del presente análisis es estimar el impacto económico de la optimización del TAR triple según las recomendaciones con mayor grado de evidencia (A-I) del documento de consenso de GeSIDA/PNS (2015)16 consideradas de mayor aplicabilidad actualmente en la práctica clínica en España.
MétodosDiseño del estudioSe diseñó un modelo de análisis del impacto presupuestario durante un año, de la aplicación en la práctica clínica de las recomendaciones con grado de evidencia A-I del documento consenso GeSIDA/PNS (2015)16 relativas a la optimización del TAR triple en adultos infectados por VIH con CV suprimida.
Para diseñar y llevar a cabo el estudio se constituyó un panel de 6 expertos con amplia experiencia en el manejo de la infección por VIH en España (3 infectólogos y 3 farmacéuticos hospitalarios). En paralelo, con el fin de identificar los principales parámetros a incluir en el análisis se realizó una revisión de la literatura científica de ámbito nacional. El planteamiento inicial como los principales inputs y asunciones se recogieron mediante un cuestionario electrónico estructurado diseñado ad hoc y de cumplimentación individual por cada experto. A posteriori se realizaron 2 reuniones presenciales donde se consensuaron los parámetros y asunciones del modelo y se discutieron los resultados del análisis, evaluando las principales fortalezas y limitaciones del estudio.
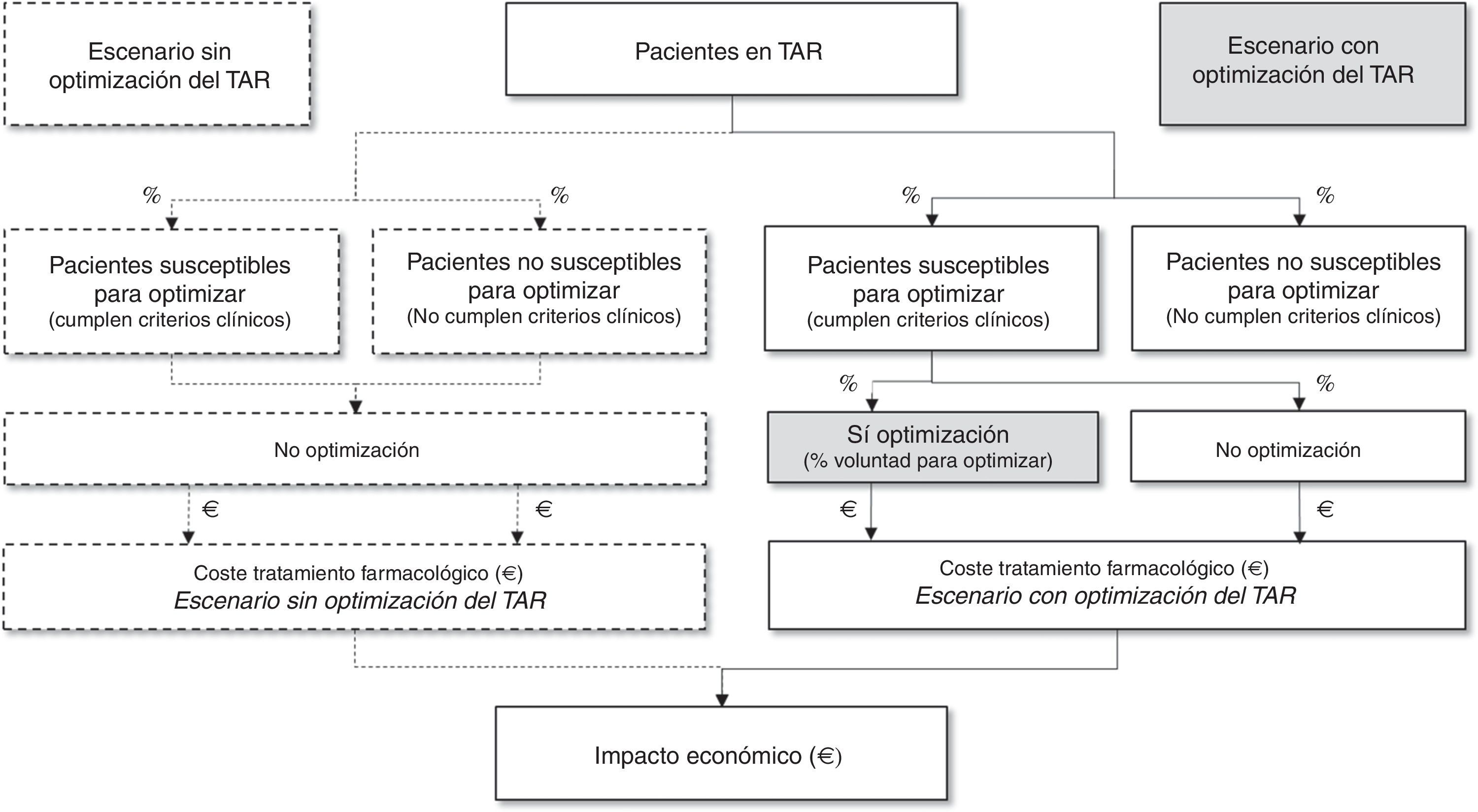
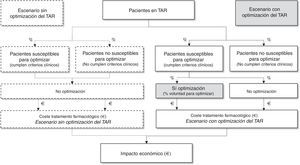
Así, a partir de la población española en TAR triple y las recomendaciones de optimización seleccionadas, se estimó la población susceptible de optimizar su TAR. Dado que la optimización del TAR triple depende de múltiples factores, el panel de expertos estimó la aplicabilidad en la práctica clínica de dichas recomendaciones a través del porcentaje de pacientes que serían potenciales candidatos a optimizar el TAR. Finalmente, el impacto presupuestario se estimó como la diferencia entre los costes del escenario sin optimización (los pacientes con CV suprimida, indistintamente de su idoneidad, no optimizarían su TAR) frente a los costes del escenario con optimización en la medida que se estima que se aplicarían en la práctica clínica actual en España (fig. 1).
Estrategias de optimizaciónDe las recomendaciones de cambio del TAR triple en pacientes con CV suprimida del documento consenso GeSIDA/PNS (2015)16 se desestimaron aquellas estrategias con TAR basal que incluían fármacos no recomendados para el inicio del TAR (zidovudina, estavudina o enfuvirtida) por representar una proporción marginal de pacientes candidatos a recibir cambios terapéuticos evaluables en el presente análisis. También se desestimó la optimización de 2ITIAN+EFV a TDF/FTC/EFV, al considerar que, actualmente, la mayoría de los pacientes en dicho TAR basal ya se habrían optimizado a recibir un régimen de comprimido único que fue autorizado en España en 2007 y de uso ampliamente extendido. Asimismo, se consideró desdoblar la recomendación de cambio de 2ITIAN+LPV/r o ATV/r a LPV/r+3TC o ATV/r+3TC en: a) 2 ITIAN+LPV/r a 3TC+LPV/r; y b) 2 ITIAN+IP/r o ITINN o INI a ATV/r+3TC, porque dicha recomendación, a pesar de ser acorde al diseño del estudio OLE17, donde todos los pacientes recibían basalmente LPV/r, no refleja el tratamiento basal de los pacientes incluidos en el estudio SALT18. En este sentido, en aras de ser fieles a la metodología establecidas para el estudio, se desestimó la optimización de 2ITIAN+1INI, 2ITIAN+NVP o TDF/FTC/RPV a ATV/r+3TC dada la nula o escasa representatividad de estas pautas como TAR basal en el estudio SALT18.
PoblaciónLa población que recibe TAR en España y, por tanto, susceptible de que este sea optimizado, se obtuvo del Informe de evaluación del plan multisectorial de VIH/sida (2012)19. A partir de los datos de la Encuesta hospitalaria de pacientes con VIH/sida (2014)20 se extrajo la proporción de pacientes en TAR triple. En ausencia de datos publicados sobre la distribución de las diferentes pautas de TAR en España, se estimaron los porcentajes de pacientes en cada pauta triple de partida en función de la mediana de los valores aportados por el panel de expertos en el cuestionario, reflejo de la realidad asistencial de sus respectivos ámbitos hospitalarios.
Proporción de pacientes a optimizarPara cada estrategia de optimización se estimaron: a) elegibilidad de optimización: proporción de pacientes que cumpliría las condiciones clínicas estipuladas en el documento consenso GeSIDA/PNS (2015); y b) voluntad de optimización: proporción de pacientes que, cumpliendo criterios clínicos, finalmente optimizarían su TAR triple considerando aspectos como la disponibilidad de otras opciones (preferencia terapéutica), el grado de resolución o prevención de toxicidad (adecuación terapéutica) o las consecuencias en términos económicos (coste terapéutico). La proporción final de pacientes a optimizar para cada una de las estrategias analizadas se calculó como el producto de la elegibilidad de optimización por la voluntad de optimización.
CostesEl análisis se realizó para un horizonte temporal de un año, desde la perspectiva del SNS considerando solo los costes farmacológicos del TAR. El coste total del tratamiento se estimó teniendo en cuenta el precio de venta del laboratorio (PVL) oficial notificado21, la deducción del RDL 8/2010 correspondiente en cada caso y el 4% relativo al IVA. Se consideraron exclusivamente las presentaciones farmacéuticas con autorización de comercialización21, siendo todos los costes valorados en euros del 2015. La posología de cada TAR se estableció teniendo en cuenta la dosis habitual recomendada en el documento consenso GeSIDA/PNS (2015)16.
Análisis de sensibilidadPara evaluar la robustez de los resultados e identificar los parámetros con mayor incertidumbre e impacto en las conclusiones del estudio, se realizaron una serie de análisis de sensibilidad utilizando los valores extremos obtenidos mediante la consulta con el panel de expertos. Estos fueron la voluntad de optimización y el precio de los FAR. El precio de los antirretrovirales puede variar en función del centro o región sanitaria. Dado que no fue factible realizar un análisis de sensibilidad que reflejara todos los escenarios, se ha habilitado una herramienta que permite reproducir el análisis aplicando los precios específicos de cada entorno sanitario, disponible en: https://ira.redbms.es/CalcOpt
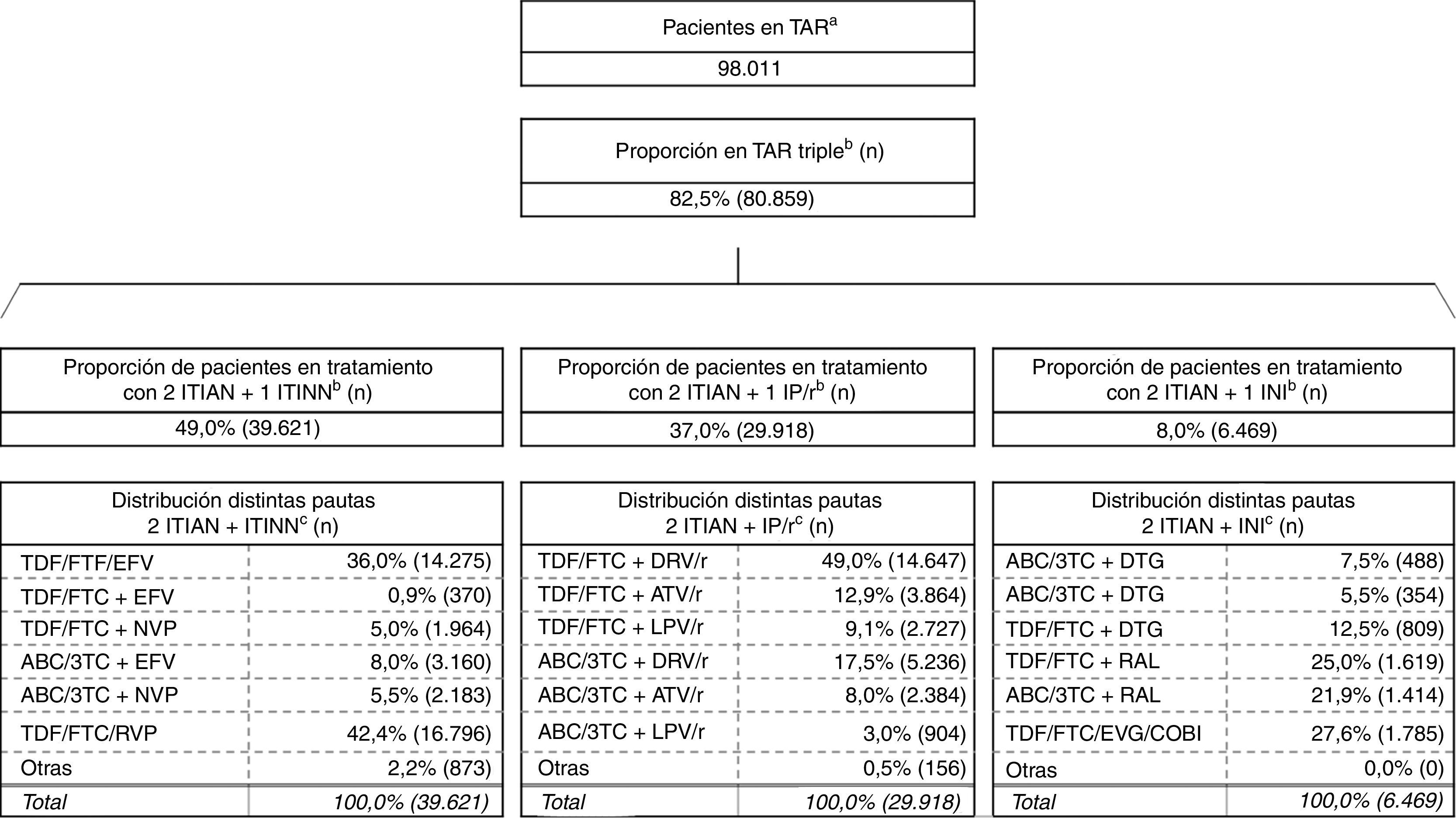
ResultadosResultado en pacientesA partir de la metodología descrita se obtuvo un número de 80.859 pacientes en TAR triple, siendo la combinación de 2ITIAN+1ITINN la más frecuentemente usada (49,0%), seguida por 2ITIAN+1IP/r (37,0%) y 2ITIAN+1INI (8,0%) (fig. 2)19,20.
Estimación de la distribución del uso de las diferentes pautas de TAR en España.
ABC: abacavir; ATV: atazanavir; COBI: cobicistat; DTG: dolutegravir; DRV: darunavir; EFV: efavirenz; EVG: elvitegravir; FTC: emtricitabina; INI: inhibidor de la integrasa; IP/r: inhibidor de la proteasa potenciado con ritonavir; ITIAN: inhibidor transcriptasa inversa análogo de nucleósido o nucleótido; ITINN: inhibidor transcriptasa inversa no nucleósido; LPV: lopinavir; NVP: nevirapina; r: ritonavir; RAL: raltegravir; RPV: rilpivirina; TAR: tratamiento antirretroviral; TDF: tenofovir; 3TC: lamivudina.
a Informe de evaluación del plan multisectorial de VIH/sida (2012).
b Encuesta hospitalaria de pacientes con VIH/sida (2014). La existencia de TAR triples basados en inhibidores de la entrada, inhibidores de la fusión o sin especificar representan el restante 6% de las distintas pautas de TAR triple consideradas.
c Mediana panel de expertos.
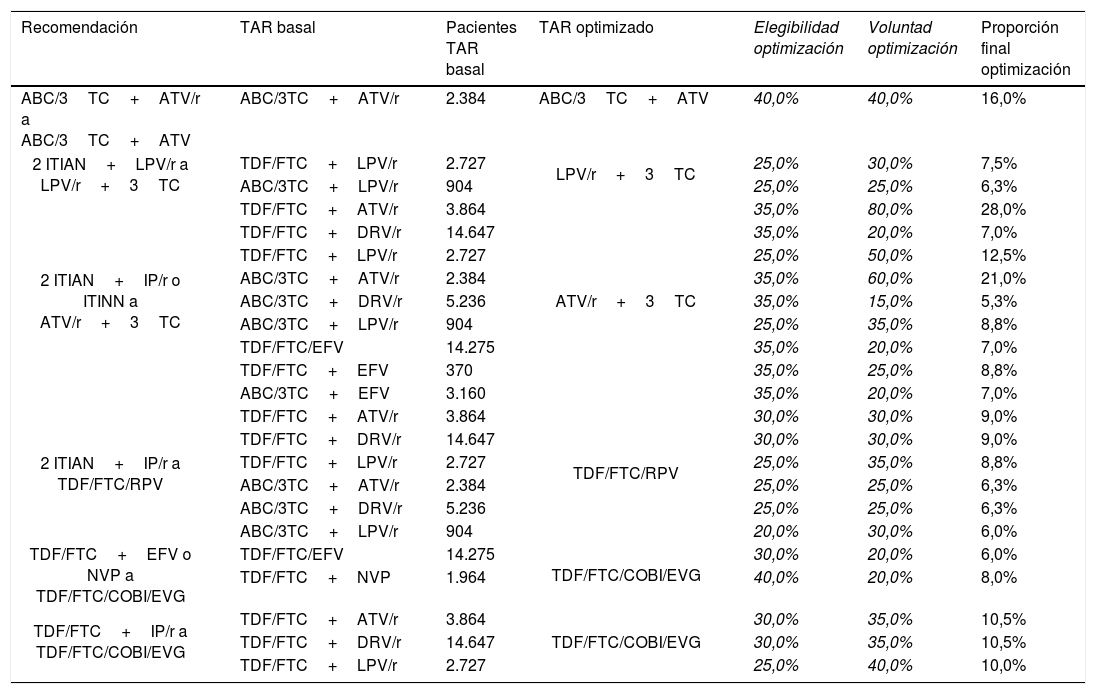
De las recomendaciones de cambio de TAR en pacientes con CV suprimida del documento consenso GeSIDA/PNS (2015)16, finalmente se seleccionaron 6 recomendaciones de optimización con grado de evidencia A-I que implican 23 pautas de TAR triple basales. En la tabla 1 se muestran las estrategias seleccionadas y los porcentajes de optimización consensuados. En función de la elegibilidad de optimización y voluntad de optimización la proporción final de optimización varió entre un máximo del 28,0% al optimizar de TDF/FTC+ATV/r a ATV/r+3TC y un mínimo de 5,3% al optimizar de ABC/3TC+DRV/r a ATV/r+3TC. De forma agregada se estima que a 10.863 (13,4%) pacientes se les optimizaría su TAR de acuerdo con la aplicabilidad en la práctica clínica de las recomendaciones seleccionadas.
Selección de recomendaciones de optimización del TAR con grado de evidencia A-I del documento de consenso de GeSIDA/PNS (2015) en pacientes con CV suprimida en España
| Recomendación | TAR basal | Pacientes TAR basal | TAR optimizado | Elegibilidad optimización | Voluntad optimización | Proporción final optimización |
|---|---|---|---|---|---|---|
| ABC/3TC+ATV/r a ABC/3TC+ATV | ABC/3TC+ATV/r | 2.384 | ABC/3TC+ATV | 40,0% | 40,0% | 16,0% |
| 2 ITIAN+LPV/r a LPV/r+3TC | TDF/FTC+LPV/r | 2.727 | LPV/r+3TC | 25,0% | 30,0% | 7,5% |
| ABC/3TC+LPV/r | 904 | 25,0% | 25,0% | 6,3% | ||
| 2 ITIAN+IP/r o ITINN a ATV/r+3TC | TDF/FTC+ATV/r | 3.864 | ATV/r+3TC | 35,0% | 80,0% | 28,0% |
| TDF/FTC+DRV/r | 14.647 | 35,0% | 20,0% | 7,0% | ||
| TDF/FTC+LPV/r | 2.727 | 25,0% | 50,0% | 12,5% | ||
| ABC/3TC+ATV/r | 2.384 | 35,0% | 60,0% | 21,0% | ||
| ABC/3TC+DRV/r | 5.236 | 35,0% | 15,0% | 5,3% | ||
| ABC/3TC+LPV/r | 904 | 25,0% | 35,0% | 8,8% | ||
| TDF/FTC/EFV | 14.275 | 35,0% | 20,0% | 7,0% | ||
| TDF/FTC+EFV | 370 | 35,0% | 25,0% | 8,8% | ||
| ABC/3TC+EFV | 3.160 | 35,0% | 20,0% | 7,0% | ||
| 2 ITIAN+IP/r a TDF/FTC/RPV | TDF/FTC+ATV/r | 3.864 | TDF/FTC/RPV | 30,0% | 30,0% | 9,0% |
| TDF/FTC+DRV/r | 14.647 | 30,0% | 30,0% | 9,0% | ||
| TDF/FTC+LPV/r | 2.727 | 25,0% | 35,0% | 8,8% | ||
| ABC/3TC+ATV/r | 2.384 | 25,0% | 25,0% | 6,3% | ||
| ABC/3TC+DRV/r | 5.236 | 25,0% | 25,0% | 6,3% | ||
| ABC/3TC+LPV/r | 904 | 20,0% | 30,0% | 6,0% | ||
| TDF/FTC+EFV o NVP a TDF/FTC/COBI/EVG | TDF/FTC/EFV | 14.275 | TDF/FTC/COBI/EVG | 30,0% | 20,0% | 6,0% |
| TDF/FTC+NVP | 1.964 | 40,0% | 20,0% | 8,0% | ||
| TDF/FTC+IP/r a TDF/FTC/COBI/EVG | TDF/FTC+ATV/r | 3.864 | TDF/FTC/COBI/EVG | 30,0% | 35,0% | 10,5% |
| TDF/FTC+DRV/r | 14.647 | 30,0% | 35,0% | 10,5% | ||
| TDF/FTC+LPV/r | 2.727 | 25,0% | 40,0% | 10,0% |
ABC: Abacavir; ATV: atazanavir; COBI: cobicistat; DRV: darunavir; EFV: efavirenz; EVG: elvitegravir; FTC: emtricitabina; IP/r: inhibidor de la proteasa potenciado con ritonavir; ITIAN: inhibidor transcriptasa inversa análogo de nucleósido o nucleótido; ITINN: inhibidor transcriptasa inversa no nucleósido; LPV: lopinavir; NVP: nevirapina; r: ritonavir; RPV: rilpivirina; TAR: tratamiento antirretroviral; TDF: tenofovir; 3TC: lamivudina.
Números en cursiva: valores originales validados por el panel de expertos y utilizados para calcular la «Proporción final optimización».
En función del número de pacientes en TAR triple (fig. 2) y del coste farmacológico anual de cada pauta de tratamiento se estimó que el coste del TAR triple en España resultaría ligeramente por encima de los 671M€ (sin considerar discontinuaciones terapéuticas ni pautas descritas como «otros»).
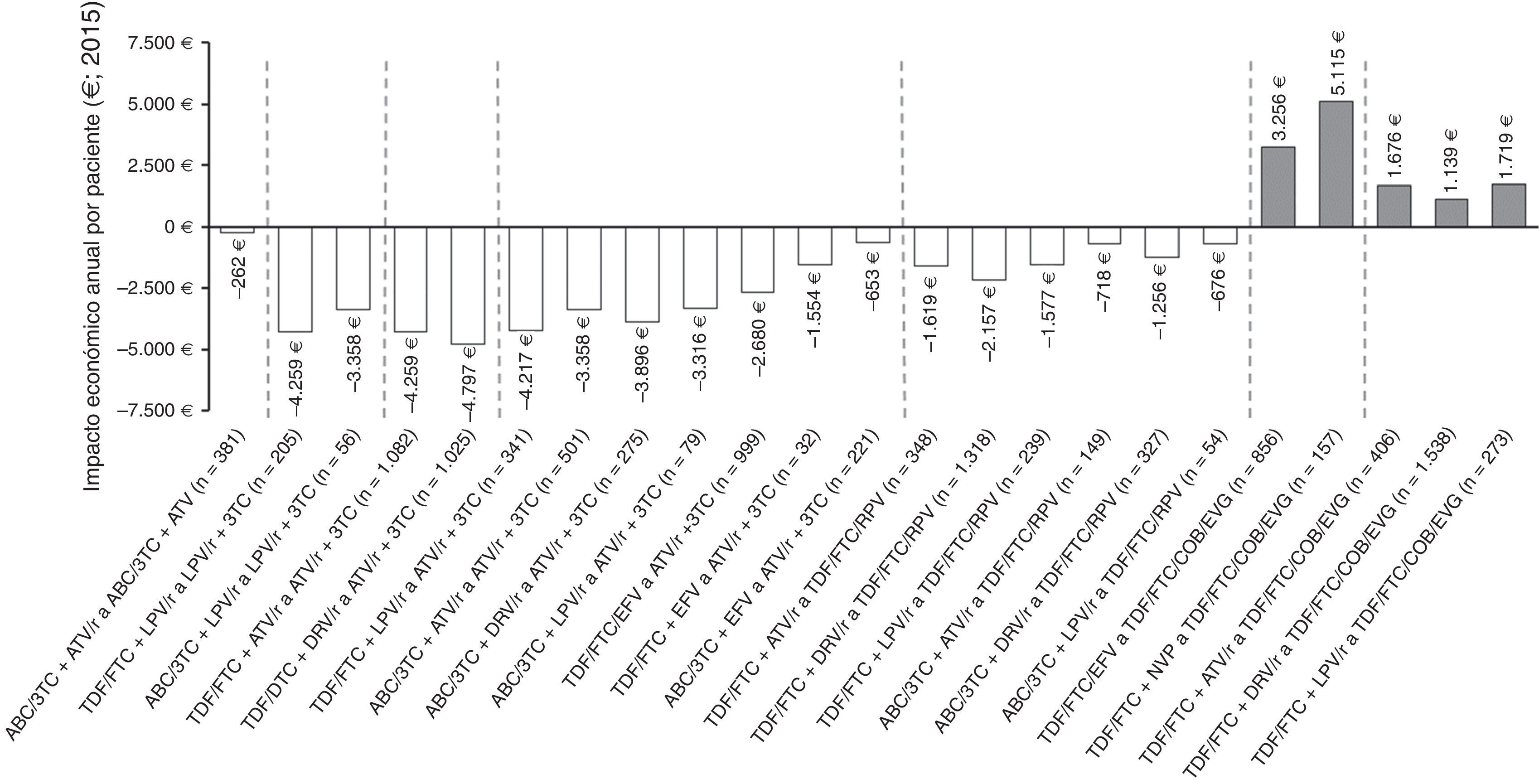
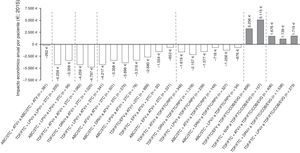
En la figura 3 se muestra el impacto económico por paciente/año de las estrategias de optimización evaluadas. La mayoría de ellas implicarían ahorros en costes farmacológicos que varían entre 262€ y 4.797€ por paciente/año. Todas las recomendaciones de optimización a biterapia de IP/r+3TC conllevarían ahorros, siendo el cambio a la biterapia basada en ATV/r+3TC a partir de TDF/FTC+DRV/r la optimización con mayor ahorro en términos de gasto farmacéutico por paciente/año (4.797€). Por el contrario, la optimización basada en la retirada de ritonavir de ABC/3TC+ATV/r implicaría el menor ahorro por paciente/año (262€). Por otro lado, todas las recomendaciones de optimización a TDF/FTC/COBI/EVG supondrían incrementos del gasto farmacológico (PVL oficial notificado), siendo el cambio a partir de TDF/FTC+NVP a TDF/FTC/COBI/EVG la optimización con mayor incremento en términos de gasto farmacéutico por paciente/año (5.115€).
Impacto económico anual por paciente de las 25 estrategias de optimización del TAR con grado de evidencia A-I del documento de consenso de GeSIDA/PNS (2015) en pacientes con CV suprimida en España.
ABC: abacavir; ATV: atazanavir; COBI: cobicistat; DRV: darunavir; EFV: efavirenz; EVG: elvitegravir; FTC: emtricitabina; LPV: lopinavir, NVP: nevirapina; r: ritonavir; RPV: rilpivirina; TDF: tenofovir; 3TC: lamivudina.
De los 10.863 pacientes a los que se le optimizaría su TAR triple, en el 70,3% (7.633) optimizaría a una alternativa más económica (ahorro medio de 2.928€ por paciente/año) y el 29,7% (3.230) a una alternativa más costosa (aumento medio de 2.010€ por paciente/año).
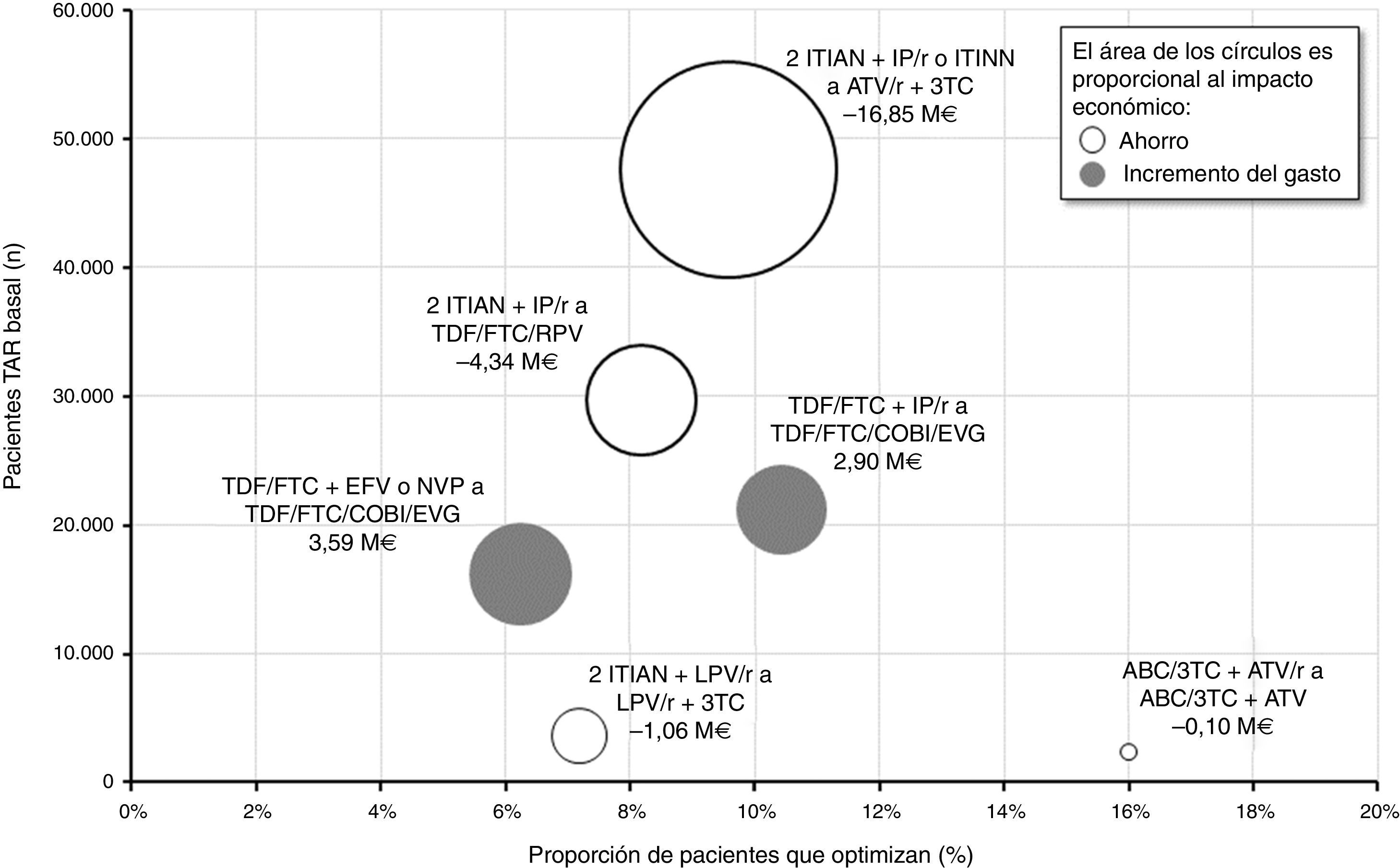
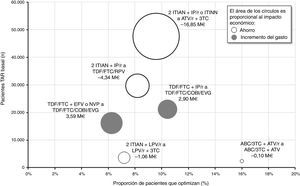
En la figura 4 se muestra de forma global la proporción de pacientes a los que se les optimizaría su TAR triple, el número de pacientes en TAR basal y el impacto (ahorro o incremento del gasto) económico de cada una de las 6 recomendaciones de optimización. La optimización a biterapia basada en ATV/r+3TC involucraría el mayor número de pacientes en TAR triple basal (47.567) y se aplicaría al 9,6% (4.556) de estos. Considerando un ahorro por paciente/año de entre 653€ y 4.797€ en función del TAR triple basal, finalmente, el impacto presupuestario de esta optimización alcanzaría los 16,85M€ por año, equivalente a un ahorro medio por paciente/año de 3.699€. Por el contrario, el cambio de TDF/FTC+EFV o NVP a TDF/FTC/COBI/EVG resultaría la recomendación asociada al mayor incremento del gasto farmacológico (3,59M€ por año). De manera global, la implementación en la práctica clínica de las recomendaciones del documento consenso GESIDA/PNS (2015) generaría un ahorro medio para el SNS de 1.460€ por paciente/año, correspondiente a un total de 15,86M€ anuales.
Impacto económico agrupado por recomendación de optimización.
ABC: abacavir; ATV: atazanavir; COBI: cobicistat; EFV: efavirenz; EVG: elvitegravir; FTC: emtricitabina; IP/r: inhibidor de la proteasa potenciado con ritonavir; ITIAN: inhibidor transcriptasa inversa análogo de nucleósido o nucleótido; ITINN: inhibidor transcriptasa inversa no nucleósido; LPV: lopinavir; NVP: nevirapina; r: ritonavir; RPV: rilpivirina; TAR: tratamiento antirretroviral; TDF: tenofovir; 3TC: lamivudina.
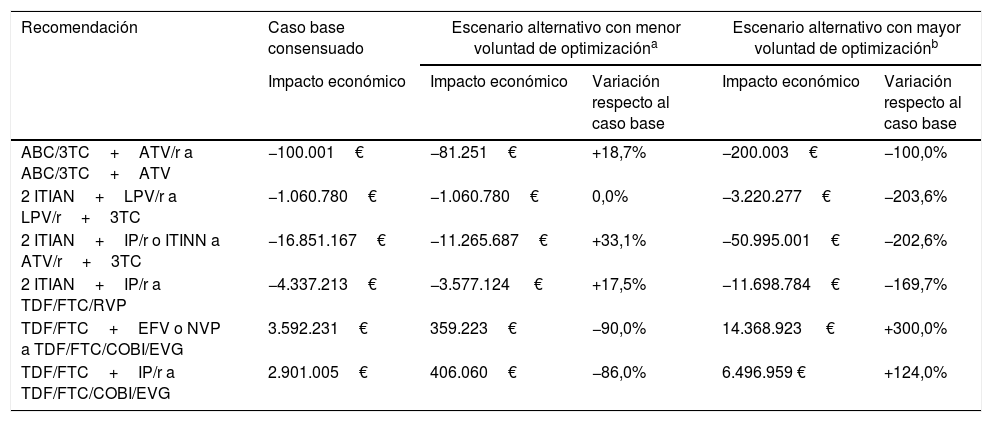
En función de los valores extremos de la voluntad de optimización (tabla suplementaria 1), el impacto económico de las estrategias de optimización variaría entre una reducción media del 40,9% (0,0-90,0%) y un aumento medio del 183,3% (100,0-300,0%) respecto al caso base (tabla 2). Asimismo, los ahorros proporcionados por la optimización a biterapia basada en ATV/r+3TC se reducirían hasta 11,3M€ considerando la mínima voluntad de optimización y aumentarían hasta 51,0M€ considerando la máxima voluntad de optimización. Por otro lado, una menor voluntad de optimización a TDF/FTC/COBI/EVG reduciría el incremento del gasto farmacéutico hasta 0,36-0,41M€, mientras que una mayor incrementaría el gasto hasta 6,5-14,4M€ en función del TAR basal. De forma global, aun considerando la menor voluntad de optimización en todos los casos, las recomendaciones de optimización del TAR evaluadas proporcionarían ahorros para el SNS de 15,2M€ anuales.
Variación de los principales resultados en función de los análisis de sensibilidad por voluntad de optimización
| Recomendación | Caso base consensuado | Escenario alternativo con menor voluntad de optimizacióna | Escenario alternativo con mayor voluntad de optimizaciónb | ||
|---|---|---|---|---|---|
| Impacto económico | Impacto económico | Variación respecto al caso base | Impacto económico | Variación respecto al caso base | |
| ABC/3TC+ATV/r a ABC/3TC+ATV | −100.001€ | −81.251€ | +18,7% | −200.003€ | −100,0% |
| 2 ITIAN+LPV/r a LPV/r+3TC | −1.060.780€ | −1.060.780€ | 0,0% | −3.220.277€ | −203,6% |
| 2 ITIAN+IP/r o ITINN a ATV/r+3TC | −16.851.167€ | −11.265.687€ | +33,1% | −50.995.001€ | −202,6% |
| 2 ITIAN+IP/r a TDF/FTC/RVP | −4.337.213€ | −3.577.124 € | +17,5% | −11.698.784€ | −169,7% |
| TDF/FTC+EFV o NVP a TDF/FTC/COBI/EVG | 3.592.231€ | 359.223€ | −90,0% | 14.368.923 € | +300,0% |
| TDF/FTC+IP/r a TDF/FTC/COBI/EVG | 2.901.005€ | 406.060€ | −86,0% | 6.496.959 € | +124,0% |
ABC: abacavir; ATV: atazanavir; COBI: cobicistat; EFV: efavirenz; EVG: elvitegravir; FTC: emtricitabina; IP/r: inhibidor de la proteasa potenciado con ritonavir; ITIAN: inhibidor transcriptasa inversa análogo de nucleósido o nucleótido; ITINN: inhibidor transcriptasa inversa no nucleósido; LPV: lopinavir; NVP: nevirapina; r: ritonavir; RPV: rilpivirina; TAR: tratamiento antirretroviral; TDF: tenofovir; TAR triple: triple terapia; 3TC: lamivudina.
Los resultados de nuestro estudio muestran que la mayoría de las recomendaciones con mayor grado de evidencia (A-I) en cuanto a la optimización del TAR del documento consenso GeSIDA/PNS (2015)16 generaría ahorros para el SNS: de manera global un ahorro medio de 1.460€ por paciente/año, correspondientes a 15,86M€, equivalentes al 2,4% del gasto en TAR triple en España. La magnitud de estos ahorros depende en gran parte de la situación basal (TAR de partida), siendo el principal vector de incremento el potencial de aplicar estas recomendaciones en la práctica clínica (voluntad de optimización). En este contexto la optimización a la biterapia ATV/r+3TC representa la recomendación que implicaría el mayor ahorro para el SNS en términos de gasto farmacológico (16,85M€). Además de la voluntad de optimización y del elevado diferencial económico que supone la retirada de un FAR del TAR triple, este impacto se debe al amplio potencial de optimización derivado del diseño y los resultados del estudio SALT18 que justifica la cantidad significativa de pacientes en TAR triple susceptibles de ser optimizados.
Estudios realizados en el ámbito nacional apuntan hacia la misma dirección, y muestran que habiéndose validado su adecuación clínica, la optimización es una alternativa atractiva desde el punto de vista económico12,22–25. Aunque desde el 2011 se difunden y actualizan análisis de coste-eficacia sobre las pautas de inicio del TAR del documento consenso GeSIDA/PNS15, ninguno ha indagado sobre el grado de aplicabilidad en práctica clínica de las recomendaciones sobre la optimización del TAR y su impacto presupuestario.
Por otro lado, los planes estratégicos para el control de la infección por el VIH1, las recomendaciones para mejorar la adherencia al TAR26 e informes técnicos27 hacen hincapié en la optimización del TAR y la indican como una de las medidas responsables de la disminución del gasto farmacológico por paciente1.
El reflejo de la práctica clínica actual en el manejo del VIH en España representa una de las fortalezas del presente estudio. Ante la falta de estudios recientes sobre la práctica clínica española relativa al grado de optimización del TAR triple en pacientes con CV suprimida, según las recomendaciones del documento consenso GESIDA/PNS, se recurrió al panel de expertos para estimar la elegibilidad de optimización y la voluntad de optimización para cada recomendación analizada. El análisis de sensibilidad mostró que: a) aun contemplado menores porcentajes de voluntad de optimización, en su conjunto, las recomendaciones de optimización del TAR siguen generando ahorros para el SNS; y b) el caso base resulta notablemente más próximo al escenario con menor voluntad de optimización. Ello reflejaría el entorno restrictivo en términos de gasto farmacológico en el ámbito hospitalario, y destacaría el amplio margen para alcanzar mayores niveles de voluntad de optimización.
Finalmente, se recomienda interpretar los resultados del análisis correspondiente al escenario con mayor voluntad de optimización de manera desagregada al representar el máximo potencial de cada estrategia, sin considerar la existencia de otras alternativas terapéuticas con la misma recomendación.
Entre las limitaciones del presente análisis, el impacto presupuestario resulta altamente dependiente de la distribución nacional de las distintas pautas de TAR triples. Realizar análisis de sensibilidad sobre ella resultó inviable, ante la carencia de información alternativa suficientemente robusta y representativa.
Por otro lado, la posible existencia de precios distintos al PVL notificado, derivados de acuerdos confidenciales, representa una limitación a la hora de interpretar y extrapolar los resultados del presente estudio a los distintos entornos sanitarios. Por ello, la herramienta interactiva facilitada permite la adaptación del impacto económico a distintas realidades particulares.
El análisis utilizado como punto de partida para la distribución del uso de TAR en 2015 se basó en los datos publicados en la Encuesta hospitalaria de pacientes con VIH/sida (2014)20 para el año 2014. La comercialización de nuevos FAR e implementación de las recomendaciones del documento de consenso GeSIDA/PNS en cuanto a inicio y cambio de TAR implican que esta estructura sea altamente dinámica, y ello condiciona los resultados y conclusiones del presente estudio. Por ello, y dado que el documento consenso GeSIDA/PNS se actualiza anualmente, se estableció de forma conservadora que realizar el análisis para horizontes temporales mayores de un año generaría un alto nivel de incertidumbre.
En este contexto, la revisión de las recomendaciones de tratamiento y la futura autorización de comercialización de nuevos TAR coformulados posiblemente modificarán los valores de voluntad de optimización, especialmente en aquellas recomendaciones cuya principal razón es reducir la complejidad del TAR. Se recomienda, por lo tanto, seguir evaluando de manera conjunta las consecuencias económicas de las nuevas recomendaciones a medida que se implementan en la práctica clínica.
El presente análisis permite identificar, a nivel nacional, aquellas estrategias de optimización aplicables a un mayor número de pacientes en TAR triple, y que conllevarían mayor impacto económico. Nuestros resultados podrían contribuir al proceso de toma de decisión de los profesionales, gestores y responsables sanitarios involucrados en el manejo de la infección por VIH, especialmente en situaciones de escasez o restricción de recursos sanitarios15,22, donde el uso eficiente de dichos recursos resulta un requisito fundamental para garantizar la sostenibilidad del SNS1,28,29.
En conclusión, la aplicación a la práctica clínica española de las principales estrategias de optimización recomendadas en el documento consenso GeSIDA/PNS (2015)16 generaría ahorros sustanciales, especialmente aquellas basadas en biterapia con ATV/r+3TC, contribuyendo así al control del gasto farmacéutico y a la sostenibilidad del SNS.
FinanciaciónLa realización del presente estudio ha sido patrocinada por Bristol-Myers Squibb. Oblikue Consulting S.L. ha ofrecido soporte técnico para el desarrollo del modelo farmacoeconómico.
AutoríaJosé Manuel Martínez-Sesmero y Javier Sánchez-Rubio han contribuido en igual medida al presente trabajo; la contribución de Celia Roldán y Beatriz Hernández-Novoa se produjo en el momento en el que se llevó a cabo el estudio.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A Eduardo Villa, Departamento de Acceso al Mercado de Bristol-Myers Squibb por su contribución en el desarrollo del presente trabajo y revisión del manuscrito.