Actualmente el diagnóstico microbiológico de las infecciones genitales se realiza con métodos moleculares, los cuales permiten detectar agentes etiológicos menos frecuentes, pero con potencial importancia patogénica, como Haemophilus spp. El objetivo de esta revisión es analizar y resaltar la importancia clínica del aislamiento de Haemophilus spp. en infecciones genitales y rectales, excluyendo H. ducreyi.
Material y métodosSe ha realizado una revisión sistemática en base a una búsqueda exhaustiva de las publicaciones incluidas en la base de datos MEDLINE hasta el 5 de agosto de 2021, sobre la presencia de Haemophilus spp. en infecciones genitales y rectales, excluyendo H. ducreyi.
ResultadosTras revisar lo descrito en la literatura, las especies de Haemophilus (excluyendo H. ducreyi: HSNOD) se detectaron en 2397 episodios de infección genital, siendo las especies más frecuentemente aisladas H. influenzae y H. parainfluenzae. La mayoría de los episodios (87,6%) están constituidos por aislamiento único. Existe un ligero predominio en mujeres (48,3%) donde puede producir cuadros de vaginitis, salpingitis, endometritis o complicaciones durante el embarazo. En hombres, el cuadro clínico suele corresponder a una uretritis. La mayoría de las muestras corresponde a exudados vaginales y uretrales, con una representación minoritaria a nivel rectal (2,3%).
ConclusiónHSNOD desempeña un papel patogénico relevante en episodios de infección genital, por lo que los protocolos de diagnóstico microbiológico deben incluir métodos que permitan su detección, así como incluirlos en el espectro etiológico de este tipo de cuadros clínicos.
Currently, the microbiological diagnosis of genital infections is carried out with molecular methods, which allow the detection of less frequent etiological agents but with potential pathogenic importance, such as Haemophilus spp. The objective of this review is to analyze and highlight the clinical importance of the isolation of Haemophilus spp. in genital and rectal infections, excluding H. ducreyi.
Material and methodsA systematic review was carried out based on an exhaustive search of the publications included in the MEDLINE database up to August 5, 2021, on the presence of Haemophilus spp. in genital and rectal infections, excluding H. ducreyi.
ResultsAfter reviewing what was described in the literature, Haemophilus spp. (excluding H. ducreyi: HSNOD) was detected in 2397 episodes of genital infection, the most frequently isolated species being H. influenzae and H. parainfluenzae. Most of the episodes (87.6%) are constituted by single isolation. There is a slight predominance in women (48.3%) where it can cause vaginitis, salpingitis, endometritis or complications during pregnancy. In men, the clinical picture usually corresponds to urethritis. Most of the samples correspond to vaginal and urethral exudates, with a minority representation at the rectal level (2.3%).
ConclusionHSNOD plays a relevant pathogenic role in episodes of genital infection, so microbiological diagnostic protocols must include methods that allow their detection, as well as include them in the etiological spectrum of this type of clinical picture.
Las infecciones del tracto genital son entidades frecuentes que comparten presentación clínica pero que pueden estar provocadas por multitud de agentes etiológicos, a parte de los microorganismos comúnmente considerados patógenos1. Además, se suma la gran diversidad de la microbiota y la importante variabilidad interindividual, lo que hace aún más difícil la distinción entre un posible papel patogénico o no2. Entre esos agentes menos frecuentes y con posible papel patogénico, se encuentran las especies del género Haemophilus, excluyendo a H. ducreyi (HSNOD). El género Haemophilus, perteneciente a la familia Pasteurallaceae, está formado por pequeños bacilos gramnegativos anaerobios facultativos, pleomórficos, inmóviles y no esporulados. Se caracteriza por requerimientos nutricionales exigentes, precisando el medio agar chocolate para su correcto crecimiento e identificación. Las especies de HSNOD más frecuentemente involucradas son Haemophilus influenzae (H. influenzae), Haemophilus parainfluenzae (H. parainfluenzae) y Haemophilus haemolyticus (H. haemolyticus). El primero de ellos es bien conocido, tratándose de un agente colonizador del tracto respiratorio superior y genital, pudiendo comportarse como patógeno oportunista. En los últimos años están apareciendo en la literatura cada vez más casos de uretritis asociada a H. influenzae, y recientemente se ha descrito su asociación con uretritis no gonocócica, tanto en hombres que tienen sexo con hombres (HSH) como con mujeres3. Además, es la segunda causa más frecuente de vulvovaginitis en niñas no vinculada a transmisión sexual4. H. parainfluenzae coloniza predominantemente la orofaringe, pudiendo dar lugar a infecciones por contigüidad, bacteriemias, endocarditis e infecciones genitales5. H. haemolyticus es difícil de diferenciar de las especies de H. influenzae no encapsuladas por sus similitudes morfológicas, bioquímicas y genéticas, siendo difícil distinguirlos en ocasiones mediante los métodos microbiológicos convencionales, por lo que algunos autores abogan por la combinación de métodos convencionales y análisis mediante reacción en cadena de la polimerasa (PCR)6; también la espectrometría de masas (MALDI-TOF) ha mostrado buenos resultados en capacidad de diferenciación7. Rara vez tiene potencial patógeno.
Además, se sabe de la existencia de genoespecies crípticas biotipo IV, genéticamente relacionadas con H. haemolyticus, pero con fenotipo y localización diferentes, como «Haemophilus quentini», cuya presencia se ha descrito en el tracto genitourinario y pueden provocar infecciones genitales en embarazadas, corioamnionitis y parto pretérmino, e incluso cuadros neumónicos o sépticos en neonatos8.
El objetivo de este trabajo es analizar la presencia de especies de HSNOD en el desarrollo de infecciones genitales, mediante una revisión sistemática de la literatura.
Material y métodosSe realizó una búsqueda en la base de datos MEDLINE, a través de PubMed, de aquellos trabajos que describen la presencia de Haemophilus spp. en exudados genitales (vaginal, endocervical y uretral) y rectales (en HSH). Se emplearon los términos de búsqueda: «Haemophilus and urethritis», «Haemophilus and proctitis», «Haemophilus and vaginitis», «Haemophilus and cervicitis», «Haemophilus and salpingitis», «Haemophilus and endometritis», «Haemophilus and bartholinitis», «Haemophilus and tubo-ovarian abscess», «Haemophilus and septic abortion», «Haemophilus and chorionamnionitis». Los criterios de inclusión fueron: trabajos publicados hasta el 1 de septiembre de 2021; y trabajos publicados en inglés o español. Los criterios de exclusión fueron: trabajos referidos a la especie H. ducreyi o Haemophilus vaginalis; y trabajos que analizan muestras de procedencia distinta a la genital o rectal. También se revisó la bibliografía de los trabajos para reducir el número de pérdidas.
ResultadosSe obtuvieron 145, 3, 583, 595, 21, 73, 14, 6, 16 y 30 publicaciones para los criterios «Haemophilus and urethritis», «Haemophilus and proctitis», «Haemophilus and vaginitis», «Haemophilus and cervicitis», «Haemophilus and salpingitis», «Haemophilus and endometritis», «Haemophilus and bartholinitis», «Haemophilus and tubo-ovarian abscess», «Haemophilus and septic abortion», «Haemophilus and chorionamnionitis» respectivamente, que, posteriormente, se sometieron a los criterios de inclusión y exclusión, obteniéndose 117 trabajos. De ellos, no se pudieron localizar 13 (Northwest Med. 1955;54(9):992-3, J Pathol Bacteriol. 1967;93(1):109-18, Am J Vet Res. 1971;32(12):2067-9, Am J Clin Pathol. 1980;73(2):285-7, Med J Aust. 1985;143(5):223, Med J Aust. 1985;142(9):531, J Infect Dis. 1986;153(1):165-7, Acta Paediatr Scand. 1987;76(2):363-4, Med Clin (Barc). 1989;92(9):335-7, Med Clin (Barc). 1989;93(19):758-9, Pediatr Infect Dis J. 1994;13(3):243, Am J Obstet Gynecol. 1994;170(4):1008-17, J Am Board Fam Pract. 1994;7(4):335-41). En la tabla 1 se incluyen 104 trabajos, que agrupan un total de 2397 episodios de infección genital producida por Haemophilus spp. Las especies aisladas con mayor frecuencia son H. influenzae (57,7%; 1383/2397) y H. parainfluenzae (35,7%; 855/2397). En un 6,7% (159/2397) de los episodios no se realiza identificación de especie. En la mayoría de los episodios (87,6%; 2099/2397), Haemophilus se aísla en cultivo monomicrobiano. En caso contrario, con frecuencia se detecta junto con Chlamydia trachomatis, Neisseria gonorrhoeae, Ureaplasma spp. o Mycoplasma spp.
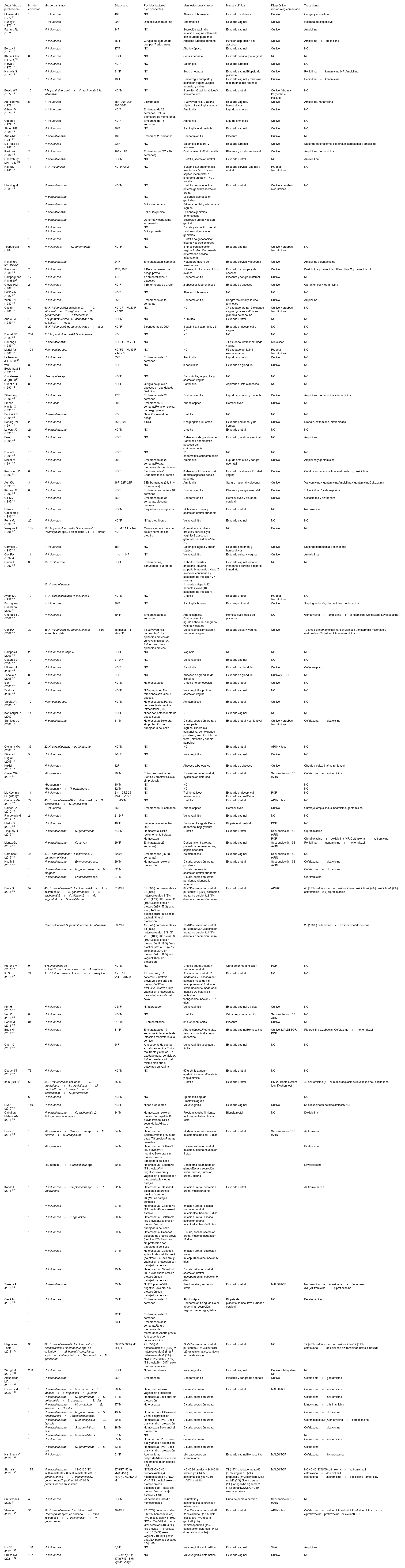
Estudios que informan del aislamiento de Haemophilus spp. en muestras genitales
| Autor (año de publicación) | N.° de episodios | Microorganismos | Edad/ sexo | Posibles factores predisponentes | Manifestaciones clínicas | Muestra clínica | Diagnóstico microbiológicoreflejado | Tratamiento |
|---|---|---|---|---|---|---|---|---|
| Skirrow MB (1970)9 | 1 | H. influenzae | 48/F | NC | Absceso tubo-ovárico | Exudado de absceso | Cultivo | Cirugía y ampicilina |
| Hurley R (1970)10 | 1 | H. influenzae | 29/F | Dispositivo intrauterino | Endometritis | Exudado vaginal | Cultivo | Retirada de dispositivo |
| Farrand RJ (1971)11 | 1 | H. influenzae | 4/ F | NC | Secreción vaginal e irritación. Vagina inflamada con exudado purulento | Exudado vaginal | Cultivo | Ampicilina |
| 1 | H. influenzae | 35/ F | Cirugía de ligadura de trompas 7 años antes. | Absceso tubárico derecho | Punción-aspiración del absceso | Cultivo | Ampicilina+cloxacilina | |
| Berczy J (1973)12 | 1 | H. influenzae | 27/F | NC | Aborto séptico | Exudado vaginal | Cultivo | NC |
| Khuri-Bulos N (1975)13 | 8 | H. influenzae | NC/ F | NC | Sepsis neonatal | Exudado cervical y/o vaginal | NC | NC |
| Herva E (1975)14 | 1 | H. influenzae | NC/F | NC | Salpingitis | Exudado tubárico | Cultivo | NC |
| Nicholls S (1975)15 | 1 | H. influenzae | 31/ F | NC | Sepsis neonatal | Exudado vaginalBiopsia de placenta | Cultivo | Penicilina+kanamicina(NR)Ampicilina |
| 1 | H. influenzae | 18/ F | NC | Hemorragia anteparto y secreción vaginal.Sepsis neonatal y éxitus | Exudado vaginal y muestras respiratorias del neonato | Cultivo | Penicilina+kanamicina | |
| Bowie WR (1977)16 | 10 | 7 H. parainfluenzae4+C. trachomatis3 H. influenzae | NC/ M | NC | 4 uretritis y3 asintomáticos3 asintomáticos | Exudado uretral | Cultivo (Virginia Polytechnic Institute) | NC |
| Albritton WL (1978)17 | 5 | H. influenzae | 18F, 20F, 22F 30F,33/F | 2 Embarazo | 1 vulvovaginitis, 2 aborto séptico, 1 salpingitis aguda | Exudado vaginal, hemocultivos | Cultivo | Ampicilina, kanamicina |
| Gibson M (1978)18 | 1 | H. influenzae | NC/F | Embarazo de 28 semanas. Rotura prematura de membranas | Amnionitis | Líquido amniótico | Cultivo | NC |
| Ogden E (1979)19 | 1 | H. influenzae | NC/F | Embarazo de 16 semanas | Amnionitis | Líquido amniótico | Cultivo | NC |
| Simon HB (1980)20 | 1 | H. influenzae | 36/F | NC | Salpingitis/endometritis | Exudado vaginal | Cultivo | NC |
| Arias JW (1981)21 | 1 | H. parainfluenzae | 18/F | Embarazo 29 semanas | Corioanmionitis | Placenta | Cultivo | NC |
| De Pass EE (1982)22 | 1 | H. influenzae | 22/F | NC | Salpingitis bilateral y absceso | Exudado tubárico | Cultivo | Salpingo-ooforectomía bilateral, histerectomía y ampicilina |
| Pastorek J (1982)23 | 2 | H. influenzae | 26F y 17F | Embarazadas (37 y 40 semanas) | CorioanmionitisEndometritis | Placenta y exudado cervical | Cultivo | Ampicilina, gentamicina |
| Chowdhury MN (1983)24 | 1 | H. parainfluenzae | NC/ M | NC | Uretritis, secreción uretral | Exudado uretral | NC | Amoxicilina |
| Hall GD (1983)25 | 11 | 11 H. influenzae | NC/ 9 F2 M | NC | 4 vaginitis, 2 endometritis asociada a DIU, 1 aborto séptico incompleto, 1 síndrome uretral y 1 NC2 uretritis | Exudado cervical, vaginal o uretral | Pruebas bioquímicas | NC |
| Messing M (1983)26 | 1 | H. parainfluenzae | NC/ M | NC | Uretritis no gonocócica: eritema genital y secreción uretral | Exudado uretral | Cultivo y pruebas bioquímicas | NC |
| 1 | H. parainfluenzae | NC | Lesiones ulcerosas en genitales | |||||
| 1 | H. parainfluenzae | Sífilis secundaria | Eritema genital y adenopatía inguinal | |||||
| 1 | H. parainfluenzae | Foliculitis púbica | Lesiones genitales eritematosas | |||||
| 1 | H. parainfluenzae | Gonorrea y condiloma acuminado | Secreción uretral y lesión genital | |||||
| 1 | H. influenzae | NC | Disuria y secreción uretral | |||||
| 1 | H. influenzae | Sífilis primaria | Lesiones ulcerosas en genitales | |||||
| 1 | H. influenzae | NC | Uretritis no gonocócica: disuria y secreción uretral | |||||
| Tebbutt GM (1984)27 | 6 | H. influenzae1+N. gonorrhoeae | NC/ F | NC | 3 niñas con secreción vaginal2 infección posnatal1 enfermedad pélvica inflamatoria | Exudado vaginal | Cultivo y pruebas bioquímicas | NC |
| Nakamura KT (1984)28 | 1 | H, parainfluenzae | 24/F | Embarazada 28 semanas | Rotura prematura de membranas | Exudado cervical y placenta | Cultivo | Ampicilina y gentamicina |
| Paavonen J (1985)29 | 2 | H. influenzae | 22/F, 29/F | 1 Relación sexual de riesgo previa | 1 Piosálpinx1 absceso tubo-ovárico | Exudado de trompa y de absceso | Cultivo | Doxiciclina y metronidazolPenicilina G y metronidazol |
| Campognone P (1986)30 | 17 | H. influenzae | 17 F | 17 embarazadas. 1 diabética | Corioamnionitis | Placenta y sangre maternal | Cultivo | NC |
| Crowe HM (1987)31 | 2 | H. influenzae | NC/F | 1 Enfermedad de Crohn | 2 abscesos tubo-ováricos | Exudado de absceso | Cultivo | Cloranfenicol y tobramicina |
| LW Davis (1987)32 | 1 | H. influenzae | NC/F | NC | Absceso tubo-ovárico | NC | NC | NC |
| Winn HN (1987)33 | 1 | H. influenzae | 25/F | Embarazada de 22 semanas | Corioamnionitis | Sangre maternal y liquido amniótico | Cultivo | Ampicilina |
| Casin I (1988)34 | 60 | 60 H. influenzae52 en solitario3+C. albicans3+T. vaginalis1+N. gonorrhoeae1+C. trachomatis | NC/ 37M, 20 F y 3 NC | NC | NC | 37 exudado uretral19 exudado vaginal y/o cervical3 orina1 glándula de bartolino | Cultivo y pruebas bioquímicas | NC |
| Andreu A (1989)35 | 10 | 7 H. parainfluenzae3 H. influenzae7 en solitario3+otros* | NC/ M | NC | 7 uretritis | Exudado uretral | NC | NC |
| 20 | 15 H. influenzae5 H. parainfluenzae+otros* | NC/ F | 5 portadoras de DIU | 8 vaginitis, 3 salpingitis y 9 NC | Exudado endocervical o vaginal | NC | NC | |
| Drouet EB (1989)36 | 244 | 216 H. parainfluenzae28 H. influenzae | NC | NC | NC | NC | NC | NC |
| Houang E (1989)37 | 73 | H. parainfluenzae | NC/ 71M y 2 F | NC | NC | 71 exudado uretral2 exudado vaginal | MicroScan | NC |
| Martel AY (1989)38 | 103 | Haemophilus spp. | NC/ 56M, 33 F y 14 NC | NC | NC | 55 exudado genital48 exudado rectal | Pruebas bioquímicas | NC |
| Leiberman JR (1989)39 | 1 | H. influenzae | 35/F | Embarazada de 16 semanas | Amnionitis | Líquido amniótico | Cultivo | NC |
| van Bosterhaut B (1990)40 | 3 | H. influenzae | NC/F | NC | 3 bartolinitis | Exudado de glándula | Cultivo | NC |
| Christensen JJ (1990)41 | 17 | Haemophilus spp. | NC/ F | NC | Bartholinitis, salpingitis y/o secreción vaginal | NC | NC | NC |
| Quentin R (1990)42 | 8 | H. influenzae | NC/ F | Cirugía de quiste o absceso en glándula de Bartolino | Bartolinitis | Aspirado quiste o absceso | NC | NC |
| Silverberg K (1990)43 | 1 | H. influenzae | 17/F | Embarazada de 29 semanas | Corioamnionitis | Líquido amniótico y placenta | Cultivo | Ampicilina, gentamicina, clindamicina |
| Pinhas-Hamiel O (1991)44 | 1 | H. influezae | 28/F | Embarazada 13 semanasRelación sexual de riesgo previa | Aborto séptico | Hemocultivos | Cultivo | NC |
| Facinelli B (1991)45 | 1 | H. parainfluenzae | NC | Relación sexual de riesgo | Uretritis | NC | NC | NC |
| Bendig JW (1991)46 | 2 | H. influenzae | 35/F, 29/F | 1 DIU | 2 salpingitis purulentas | Exudado peritoneal y de trompa | Cultivo | Drenaje, ceftriaxona, metronidazol |
| Lefevre JC (1991)47 | 21 | H. parainfluenzae | NC/ M | NC | Uretritis | Exudado uretral | NC | NC |
| Bosch J (1991)48 | 9 | H. influenzae | NC/F | NC | 7 abscesos de glándula de Bartolino1 endometritis poscesárea1 corioamnionitis | Exudado glándula y vaginal | NC | Ampicilina |
| Rusin P (1991)49 | 13 | H. influenzae | NC/F | NC | 13 endometritis/corioamnionitis | NC | NC | NC |
| Mazor M (1991)50 | 1 | H. influenzae | 28/F | Embarazada de 29 semanasRotura prematura de membranas | Amnionitis | Líquido amniótico y sangre neonatal | Cultivo | Ampiclina y gentamicina |
| Kragsberg P (1993)51 | 6 | H. influenzae | NC/F | 6 embarazadas1 Endometritis recurrentes | 3 abscesos tubo-ováricos2 abortos sépticos1 sepsis posparto | Exudado de abscesoExudado vaginal | Cultivo | Cefalosporina, ampicilina, metronidazol, doxiciclina |
| Ault KA (1993)52 | 3 | H. influenzae | 18F, 22F, 29F | 3 Embarazadas (29, 31 y 31 semanas) | Amnionitis | Sangre maternal y placenta | Cultivo | Vancomicina y gentamicinaAmpicilina y gentamicinaCeftizoxima |
| Kinney JS (1993)53 | 6 | H. influenzae | NC/F | Embarazadas de 24 a 40 semanas | Corioamnionitis | Placenta y sangre neonatal | Cultivo | 1 Ampicilina, 1 cefalosporina |
| Gill MV (1995)54 | 1 | H. influenzae | 36/F | Embarazada de 35 semanas, placenta pércreta | Corioamnionitis | Hemocultivos y exudado cervical | Cultivo | Ceftazidima y aztreonam |
| Llanes Caballero R (1996)55 | 1 | H. influenzae | NC/ M | Esquistosomiasis previa | Molestias al orinar y secreción uretral purulenta | Exudado uretral | NC | Norfloxacino |
| Pena MJ (1996)56 | 20 | H. influenzae | NC/ F | Niñas prepúberes | Vulvovaginitis | Exudado vaginal | NC | NC |
| Vázquez F (1996)57 | 155 | 100 H. parainfluenzae45 H. influenzae10 Haemophilus spp.21 en solitario134+otros* | 2M, 11 F y 142 NC | Mujeres trabajadoras del sexo y hombres con uretritis | 8 uretritis2 epidídimo-orquitis9 cervicitis y/o vaginitis2 abscesos glándula de Bartolino134 NC | NC | Cultivo | NC |
| Carmeci C (1997)58 | 1 | H. influenzae | 48/F | NC | Salpingitis aguda y shock séptico | Exudado peritoneal y hemocultivos | Cultivo | Salpingooforectomía y ceftriaxona |
| Cox RA (1997)4 | 11 | H. influenzae | <14/ F | NC | Vulvovaginitis | Exudado vulvar y vaginal | Cultivo | Amoxicilina |
| García E (1997)59 | 30 | 18 H. influenzae | NC/ F | Embarazadas, parturientas, puérperas | 1 aborto2 muertes anteparto1 muerte potparto14 neonatos vivos (5 infección confirmada y 5 sospecha de infección y 4 sanos) | Exudado vaginal tomado intraparto o durante posparto inmediato | NC | NC |
| 12 H. parainfluenzae | 1 muerte anteparto12 neonatos vivos (10 sospecha de infección) | |||||||
| Aydin MD (1998)60 | 19 | 11 H. parainfluenzae8 H. influenzae | NC/ M | NC | Uretritis | Exudado uretral | Pruebas bioquímicas | NC |
| Rodríguez-Guardado (2000)61 | 1 | H. influenzae | 36/F | NC | Salpingitis bilateral | Exudao peritoneal | Cultivo | Salpinguectomía, clindamicina, gentamicina |
| Cherpes TL (2002)62 | 1 | H. influenzae | 39/ F | Embarazada de 8 semanas | Aborto séptico. Corioamnionitis aguda.Febrícula, sangrado vaginal y cefalea | HemocultivoBiopsia de placenta | NC | Gentamicina+ampicilina+clindamicina.Ceftriaxona.Levofloxacino. |
| Cox RA (2002)63 | 39 | 38 H. influenzae1 H. parainfluenzae8+flora anaerobia mixta | 18 meses -11 años/ F | 14 vulvovaginitis recurrentes5 dos episodios previos de vulvovaginitis por H. influenzae, 1 tres episodios previos | Vulvovaginitis: irritación y secreción vaginal | Exudado vulvar y vaginal | Cultivo | 19 amoxicilina9 amoxicilina-clavulánico6 trimetoprim6 miconazol2 metronidazol2 claritromicina/ eritromicina |
| Campos J (2003)64 | 2 | H. influenzae serotipo e | NC/ F | NC | Vaginitis | NC | NC | NC |
| Cuadros J (2004)65 | 12 | H. influenzae | 2-12/ F | NC | Vulvovaginitis | Exudado vaginal | NC | NC |
| Mikamo H (2005)66 | 1 | H. influenzae | NC/F | NC | Bartolinitis | Exudado de glándula | Cultivo | Cefteram pivoxil |
| Tanaka K (2005)67 | 8 | H. influenzae | NC/F | NC | Absceso de glándula de Bartolino | Exudado de glándula | Cultivo y PCR | NC |
| Iser P (2005)68 | 2 | H. influenzae | NC/ M | Heterosexuales | Uretritis no gonocócica | Exudado uretral | Cultivo | NC |
| Tsai HY (2006)69 | 1 | H. influenzae | NC/ F | Niña prepúber. No relaciones sexuales, ni abusos. | Vulvovaginitis, profusa secreción vaginal | Exudado vaginal | NC | NC |
| Varela JA (2006)70 | 12 | Haemophilus spp. | NC/ M | Heterosexuales.Pareja con neoplasia cervical intraepitelial (CIN) | Asintomáticos | Exudado uretral | Cultivo | NC |
| Kohlberger P (2007)71 | 11 | H. influenzae | NC/ F | Niñas con antecedente de abuso sexual | NC | Exudado vaginal | NC | NC |
| Santiago JL (2008)72 | 1 | H. parainfluenzae | 41/ M | HeterosexualSexo oral sin protección con trabajadora del sexo | Disuria, secreción uretral y adenopatía inguinal.Hiperemia conjunctival con exudado purulento, reacción folicular tarsal, blefaritis y edema palpebral | Exudado uretral y conjuntival | Cultivo y pruebas bioquímicas | Ceftriaxona+doxiciclina |
| Orellana MA (2009)73 | 36 | 22 H. parainfluenzae14 H. influenzae | NC/ M | NC | NC | Exudado uretral | API NH test | NC |
| Sikanić-Dugić N (2009)74 | 5 | H. influenzae | 2-8/ F | NC | Vulvovaginitis | Exudado vaginal | Cultivo | NC |
| Kakisi (2010)75 | 1 | H. influenzae | 42F | NC | Absceso tubo-ovárico | Exudado de absceso | Cultivo | Cirugía y cefoxitina/metronidazol |
| Glover WA (2011)8 | 1 | «H. quentini» | 28/ M | Episodios previos de uretritis y prostatitis.Sexo sin protección | Escasa secreción uretral, eyaculación dolorosa | Exudado uretral | Secuenciación 16S rARN | Ceftriaxona+azitromicina |
| 1 | «H. quentini» | 30/ M | NC | NC | NC | |||
| 1 | «H. quentini»+N. gonorrhoeae | 32/ M | NC | NC | NC | |||
| Mc Kechnie ML (2011)76 | 11 | H. influenzae | 2 <25,5 25-29,4>35/ F | NC | 7 sintomáticos4 asintomáticos | Exudado endocervical Exudado vaginalOrina | PCR | NC |
| Orellana MA (2011)77 | 77 | 45 H. parainfluenzae32 H. influenzae4+C. trachomatis2+U. urealyticum | >15/ M | NC | Uretritis | Exudado uretral | API NH test | NC |
| Calner PA (2012)78 | 1 | H. influenzae | 36/F | Embarazada 16 semanas | Aborto séptico | Hemocultivos | Cultivo | Curetaje, ampicilina, clindamicina, gentamicina |
| Ranđelović G (2012)79 | 2 | H. influenzae | 2-12/ F | NC | Vulvovaginitis | Exudado vaginal | NC | NC |
| Martin D (2013)80 | 1 | H. influenzae | 48/ F | Leiomioma uterino. No DIU | Endometritis aguda.Dolor abdominal bajo y fiebre | Biopsia endometrial | PCR | NC |
| Tinguely R (2013)81 | 1 | H. parainfluenzae+N. gonorrhoeae | NC/ M | Homosexual.Sífilis recientemente tratada | Uretritis | Exudado uretral | Secuenciación 16S rARN | Ciprofloxacino |
| 1 | Homosexual | PCR | Ciprofloxacino+doxiciclina (NR)Ceftriaxona+azitromicina | |||||
| Mendz GL (2014)82 | 1 | H. parainfluenzae+C. curvus | 29/ F | Embarazada (25 semanas) | Corioamnionitis, rotura prematura de membranas, sepsis neonatal | Exudado vaginal | Secuenciación 16S rARN | Penicilina+gentamicina+metronidazol |
| Cardines R (2015)83 | 46 | 37 H. parainfluenzae7 H. pittmaniae2 H. parahaemolyticus | 32,5/ F | Embarazadas (25-38 semanas) | Asintomáticas | Exudado vaginal | Secuenciación 16S rARN | NC |
| Hsu MS (2015)84 | 1 | H. parainfluenzae+Enterococcus spp. | 29/ M | Homosexual, sexo sin protección | Disuria, secreción uretral purulenta | Exudado uretral | Secuenciación 16S rARN | Ceftriaxona+doxiclicina |
| 1 | H. parainfluenzae+N. gonorrhoeae+M. morganii | 32/ M | Disuria, frecuencia, secreción uretral purulenta | Ceftriaxona+doxiclicina | ||||
| 1 | H. parainfluenzae+Enterococcus spp. | 27/ M | Disuria, secreción uretral purulenta, adenopatía inguinal | Claritromicina | ||||
| Deza G (2016)85 | 52 | 45 H. parainfluenzae7 H. influenzae24+otros microbios10+N. gonorrhoeae8+C. trachomatis3+C. albicans2+G. vaginalis1+U. urealyticum | 31,8/ M | 31 (60%) homosexuales y 21 (40%) heterosexuales.4 (8%) VIH9 (17%) ITS previa52 (100%) sexo oral sin protección29 (55%) sexo anal, 44% sin protección19 (36%) sexo vaginal, 31% sin protección | 37 (71%) secreción uretral purulenta13 (25%) secreción uretral no purulenta2 (4%) disuria sin secreción uretral | Exudado uretral | API20E | 48 (92%) ceftriaxona+azitromicina/ doxiciclina2 (4%) doxiciclina1 (2%) azitromicina1 (2%) ciprofloxacino |
| 28 en solitario23 H. parainfluenzae5 H. influenzae | 33,7/ M | 15 (54%) homosexuales y 13 (46%) heterosexuales.3 (11%) VIH5 (18%) ITS previa28 (100%) sexo oral sin protección (5 (18%) única práctica sexual)13 (46%) sexo anal, 39% sin protección11 (39%) sexo vaginal, 32% sin protección | 18 (64%) secreción uretral purulenta9 (32%) secreción uretral no purulenta1 (4%) disuria sin secreción uretral | 28 (100%) ceftriaxona+azitromicina/ doxiciclina | ||||
| Frølund M (2016)86 | 9 | 6 H. influenzae en solitario2+adenovirus1+M. genitalium | NC/ M | NC | Uretritis agudaDisuria y secreción uretral | Orina de primera micción | PCR | NC |
| Ito S (2016)87 | 22 | 21 H. influenzae en solitario1+U. urealyticum | 7 <31 y14>31/ M | 11 casados y 10 solteros.12 uretritis previa.21 sexo oral sin protección(12 en exclusiva).9 sexo oral y vaginal sin protección.13 pareja trabajador/a del sexo | 21 secreción uretral (13 moderada y 8 escasa) en 10 serosa,6 mucoide y 5 mucopurulenta15 irritación uretra12 disuria moderada3 meatitis y/o balanitis3 molestias faríngeasIncubación <7 días | Exudado uretral | NC | NC |
| Kim H (2016)88 | 1 | H. influenzae | 0-9/ F | Niña prepúber | Vulvovaginitis | Exudado vaginal o vulvar | Cultivo | NC |
| You C (2016)89 | 8 | H. influenzae | NC/ M | NC | Uretritis | Orina de primera micción | Secuenciación 16S ARN | NC |
| Porter M (2016)90 | 31 | H. influenzae | 21-29/F | 31 embarazadas | 31 Corioanmionitis | Placenta | Cultivo | NC |
| Baba H (2017)91 | 1 | H. influenzae | 31/ F | Embarazada de 17 semanas.Antecedente de infección respiratoria alta con tos. | Aborto séptico.Fiebre alta, sangrado vaginal y dolor abdominal | Exudado vaginalHemocultivo | Cultivo, MALDI-TOF, PCR. | Piperacilina-tazobactamCefotaxima+metronidazol |
| Chen X (2017)92 | 1 | H. influenzae | 6/ F | Antecedente de cuerpo extraño en vagina.Rinitis recurrente y crónica. En exudado nasal se aísla H. influenzae derivado del mismo clon que el detectado en vagina | Vulvovaginitis asociada a rinitis | Exudado vaginal | NC | NC |
| Deguchi T (2017)93 | 73 | H. influenzae | NC/ M | NC | 67 uretritis aguda4 epididimitis aguda2 uretritis y epididimitis | Exudado uretral | NC | NC |
| Ito S (2017)1 | 68 | 54 H. influenzae en solitario5+U. urealyticum4+U. urealyticum+M. hominis2+U. parvum1+C. trachomatis1+N. gonorrhoeae | 35/ M | Uretritis | Exudado uretral | HN-20 Rapid system identification test | 43 azitromicina (5NR)20 sitafloxacino3 levofloxacino2 ceftriaxona | |
| 6 | H. influenzae | NC/ M | NC | Epididimitis aguda | NC | |||
| 1 | Prostatitis aguda | |||||||
| Li JP (2017)94 | 110 | H. influenzae | NC/ F | Niñas prepúberes | Vulvovaginitis | Exudado vaginal | Cultivo | 55 ofloxacino49 betalactámicos6 NC |
| Caballero Mateos AM (2018)95 | 1 | H. parainfluenzae+C. trachomatis L2 (linfogranuloma venéreo) | 34/ M | Homosexual, sexo sin protección.Hepatitis B previa tratada. Sífilis secundaria.Adicto a drogas. | Proctalgia, estreñimiento, rectorragia, fiebre.Úlcera rectal | Biopsia rectal | NC | Doxiciclina |
| Horie K (2018)96 | 1 | «H. quentini»+Streptococcus spp.+M. hominis+U. urealyticum | 34/ M | Heterosexual. SolteroUretritis previa (no otras ITS previas)Parejas casuales | Moderada secreción uretral mucoideIncubación 12 días | Exudado uretral | Secuenciación 16S rARN | Azitromicina |
| 1 | «H. quentini» | 24/ M | Heterosexual. SolteroNo ITS previasVIH negativoSexo oral sin protección con trabajadora del sexo | Escasa secreción uretral mucoide, disuriaIncubación 4 días | Sitafloxacino | |||
| 1 | «H. quentini»+Streptococcus spp. | 30/ M | Heterosexual. SolteroNo ITS previasVIH negativoSexo oral y vaginal sin protección con pareja estable y otras parejas | Condiloma acuminado en glandeEscasa secreción uretral serosa, irritación uretral, disuria | Levofloxacino | |||
| Kondo H (2018)97 | 1 | H. influenzae+Streptococcus spp.+U. urealyticum | 32/ M | Heterosexual. Casado4 episodios de uretritis previos (no otras ITS)Varias parejas sexuales | Irritación uretral, secreción uretral mucopurulenta | Exudado uretral | AzitromicinaNR | |
| 1 | H. influenzae | 27/ M | Heterosexual. CasadoNo ITS previasPareja sexual estable | Irritación uretral, escasa secreción uretral mucoideIncubación 16 días | ||||
| 1 | H. influenzae+S. agalactiae | 30/ M | Heterosexual. SolteroNo ITS previasSexo oral sin protección con trabajadora del sexo | Irritación uretral, escasa secreción uretral mucoideIncubación 5 días | ||||
| 1 | H. influenzae | 29/ M | Heterosexual Casado1 episodio de uretritis previo (no otras ITS)Sexo oral sin protección con trabajadora del sexo | Disuria, escasa secreción uretral mucoideIncubación 12 días | ||||
| 1 | H. influenzae | 21/ M | Heterosexual. Casado1 episodio de uretritis previo (no otras ITS)Sexo oral y vaginal sin protección con trabajadora del sexo | Irritación uretral, secreción uretral mucopurulentaIncubación 5 días | ||||
| 1 | H. influenzae | 25/ M | Heterosexual. CasadoNo ITS previasSexo oral sin protección con trabajadora del sexo | Disuria, irritación uretral, secreción uretral mucopurulentaIncubación 9 días | ||||
| Saxena A (2018)98 | 1 | H. parainfluenzae | 33/ M | No ITS previasVIH negativoSexo oral sin protección con trabajadora del sexo | Prurito uretral, secreción uretral | Exudado uretral | MALDI-TOF | Norfloxacino+amoxic-clav+fluconazol (NR)Azitromicina+ciprofloxacino |
| Cevik M (2019)99 | 1 | H. influenzae | 35/ F | Embarazada de 14 semanas | Aborto séptico. Corioamnionitis aguda.Dolor abdominal, secreción vaginal/ hemorragia, fiebre. | Biopsia de placentaHemocultivo.Exudado cervical | NC | Betalactámico |
| 1 | 22/ F | Embarazada de 14 semanas | ||||||
| 1 | 33/ F | Embarazada de 20 semanas.Rotura prematura de membranas.Aborto previo. Antecedentes de corioamnionitis | ||||||
| Magdaleno Tapial J (2019)100 | 38 | 32 H. parainfluenzae5 H. influenzae1 H. haemolyticus15 Haemophilus spp. en solitario9+M. hominis/ Ureaplasma spp7+Chlamydia6+Neisseria2+M. genitalium | 30.5/35 (92%) M3 (8%) F | 21 (55%) M homosexuales13 (34%) M heterosexuales3 (8%) F heterosexuales1 (3%) NC5 (13%) VIH20 (57%) ITS previa38 (100%) sexo oral sin protección | 22 (58%) secreción uretral purulenta6 (16%) disuria10 (26%) asintomático, contacto sexual de riesgo | Exudado uretral | NC | 17 (45%) ceftriaxona+azitromicina12 (31%) ceftriaxona+doxiciclina5 azitromicina4 doxiciclina6NR |
| Wang HJ (2019)101 | 230 | H. influenzae | NC/ F | Niñas prepúberes | Vulvovaginitis | Exudado vaginal | Cultivo Viteksystem NH | NC |
| Alsuhaibani MA (2019)102 | 1 | H. parainfluenzae | 26/F | Embarazada | Corioamnionitis | Placenta y sangre de neonato | Cultivo | Cefotaxima+gentamicina |
| Ducours M (2020)103 | 1 | H. parainfluenzae+S. hominis+E. faecalis+S. anginosus+p. harei | 20/ M | HeterosexualSexo vaginal sin protección | Secreción uretral | Exudado uretral | MALDI-TOF | Ceftriaxona+azitromicina |
| 1 | H. parainfluenzae+N. gonorrhoeae+S. epidermidis+S. anginosus+S. mitis | 31/ M | HomosexualSexo anal sin protección | Disuria, secreción uretral | Ceftriaxona+azitromicina | |||
| 1 | H. parainfluenzae+M. genitalium+E. faecalis+S. mitis | 37/ M | Heterosexual | Disuria, secreción uretral | Minociclina+pristinamicina | |||
| 1 | H. parainfluenzae+N. gonorrhoeae+S. haemolyticus+Corynebacterium sp. | 43/ M | HomosexualVIHSexo oral y anal sin protección | Disuria, secreción uretral | Ceftriaxona+doxiciclina | |||
| 1 | H. parainfluenzae+S. haemolyticus+E. faecalis | 30/ M | Homosexual. PrEPSexo oral y anal sin protección | Disuria, secreción uretral | Cotrimoxazol (NR)Gentamicina+ciprofloxacino | |||
| 1 | H. parainfluenzae+S. haemolyticus+S. mitis | 28/ M | HomosexualSexo anal sin protección | Disuria, secreción uretral | Ceftriaxona+doxiciclina | |||
| 1 | H. parainfluenzae+S. haemolyticus | 27/ M | NC | NC | NC | |||
| 1 | H. influenzae | 55/ M | Homosexual. PrEPSexo oral y anal sin protección | Secreción uretral | Ceftriaxona+azitromicina | |||
| 1 | H. parainfluenzae+N. gonorrhoeae+E. coli | 33/ M | Homosexual. PrEPSexo oral y anal sin protección | Disuria, secreción uretral | Ceftriaxona | |||
| Nishimura Y (2020)104 | 1 | H. influenzae | 51/ F | Adenomioma polipoideAdenocarcinoma endometrioide en estadio inicial | Microabscesos en adenomioma. | Exudado vaginalHemocultivo | MALDI-TOF | Ceftriaxona+histerectomía |
| Sierra Y (2020)105 | 175 | H. parainfluenzae+/- NC125 NO multirresistentes50 multirresistentes:30 H. parainfluenzae+C. trachomatis/N. gonorrhoeae/T. pallidum10 NC10 H. parainfluenzae en solitario | 37,8/97 (55%) M78 (45%) FNCNCNCNC42/ M | NCNCNCNCNC4 homosexuales, 4 heterosexuales y 2 NC.4 VIH6 ITS previa8 sexo sin protección con desconocido, 1 sexo sin protección con pareja estable y 1 NC | NCNC26 uretritis y 24 NC16 uretritis y 14 NC5 asintomáticos y 5 NC10 (100%) uretritis | 79 (45%) exudado uretral62 (35%) vaginal13 (7%) prepucial9 (5%) cervical6 (3%) rectal3 (2%) úlcera genital1 (1%) faríngeo1(1%) semen1 (1%) orinaNCNCNCNC10 exudado uretral | MALDI-TOF | NCNCNCNCNC5 ceftriaxona+azitromicina2 ceftriaxona+doxiciclina1 ceftriaxona+azitromicina+doxiciclina1 amox-clav |
| Snirivasan S (2020)3 | 40 | H. influenzae | NC/ M | 23 heterosexuales17 homosexuales | 16 uretritis y 7 asintomáticos16 uretritis y 1 asintomático | Orina de primera micción | Secuenciación 16S rARN | NC |
| Vives A (2020)106 | 30 | 19 H. parainfluenzae10 H. influenzae1 Haemophilus sp.25 en solitario5+otros microbios4+C. trachomatis1+N. gonorrhoeae | 36,6/ M | 17 (57%) heterosexuales, 8 (27%) homosexuales, 2 (7%) bisexuales y 3 (10%) NC3 (10%) VIH sin carga viral detectable13 (43%) ITS previa21 (75%) sexo oral, 15 (54%) sexo vaginal y 10 (36%) sexo anal.N.° parejas sexuales 3.5 [1-20] | 13 (43%) secreción uretral7 (23%) disuria5 (17%) dolor testicular2 (7%) úlcera genital1 (4%) hematospermia1 (4%) eyaculación dolorosa1 (4%) dolor abdominal bajo | Exudado uretral | API NH test | Ceftriaxona+azitromicina/ doxiciclinaAzitromicina+/- ciprofloxacinoCiprofloxacinoDoxiciclina8 NR |
| Hu BF (2021)107 | 140 | H. influenzae | 5,8/F | NC | Vulvovaginitis sintomática | Exudado vaginal | Vitek | Ampicilina |
| Bruins MJ (2021)108 | 127 | H. influenzae | 37 (<12 a)/F2(12-17 a)/F45(18-51 a)/F43(>51)/F | NC | Vulvovaginitis sintomática | Exudado vaginal | Cultivo | NC |
F: mujer; M: hombre; NC: no consta; NR: no respondieron al tratamiento.
La mayoría de los trabajos describen adecuadamente el método empleado en el laboratorio para el aislamiento de Haemophilus. Hasta 2011, destaca el empleo de técnicas de cultivo y pruebas bioquímicas. A partir de ese año, irrumpen las técnicas de biología molecular, como PCR o secuenciación de la subunidad 16S del ARNr. Más recientemente, se emplea espectrofotometría de masas (MALDI -TOF).
En cuanto al sexo de los pacientes, el 34,8% (835/2397) son hombres; el 48,3%, mujeres (1158/2397) y en el 16,9% (404/2397) no se informa. Solo la mitad de los trabajos proporcionan datos sobre la edad de los pacientes. Los hombres son todos adultos, con una edad media de 30 años (20-55). Las mujeres quedan divididas en dos grupos, uno de menores de 14 años (53,9%; 624/1158) y otro de adultas (a partir de 14 años, 28,4%; 329/1158). En el 17,7% de mujeres (205/1158) no consta la edad.
En el grupo de hombres se detectan con casi igual frecuencia H. parainfluenzae (44,1%; 367/835) y H. influenzae (42,6%; 356/835). La gran mayoría son diagnosticados de uretritis. Las manifestaciones clínicas más frecuentes son secreción uretral, purulenta o no, disuria e irritación o prurito uretral. Con respecto al tipo de muestra, en la gran mayoría de los casos se trata de exudados uretrales. El tratamiento administrado con más frecuencia es ceftriaxona con azitromicina y/o doxiciclina, aunque el tratamiento se encuentra especificado únicamente en el 40% (15/37) de las publicaciones referidas a varones.
El grupo de las mujeres adultas lo subdividimos en función de si la infección ocurrió durante el embarazo (52,9%; 174/329) o no (47,1%; 155/329). En estas últimas aparecen episodios de vaginitis, bartolinitis, salpingitis, endometritis o abscesos tubáricos. La ausencia de un número importante de datos nos impide extraer conclusiones sobre el predominio de una especie concreta de Haemophilus. En cuanto a las gestantes, casi todos los trabajos hacen referencia a aborto séptico, corioamnionitis aguda, rotura prematura de membranas y sepsis neonatal. Se detecta con más frecuencia H. influenzae (64,9%; 113/174) que H. parainfluenzae (30,5%; 53/174). En todas las muestras procedentes de niñas (exudados vaginales o vulvares) se aísla H. influenzae. La mayoría presentan secreción vaginal, irritación o prurito vulvar, y no reúnen factores predisponentes. El tratamiento antibiótico incluyó betalactámicos o quinolonas.
Las muestras de procedencia rectal solo suponen el 2,3% (55/2397). La información clínica y epidemiológica disponible sobre estos pacientes es muy escasa, a excepción de un caso reportado7.
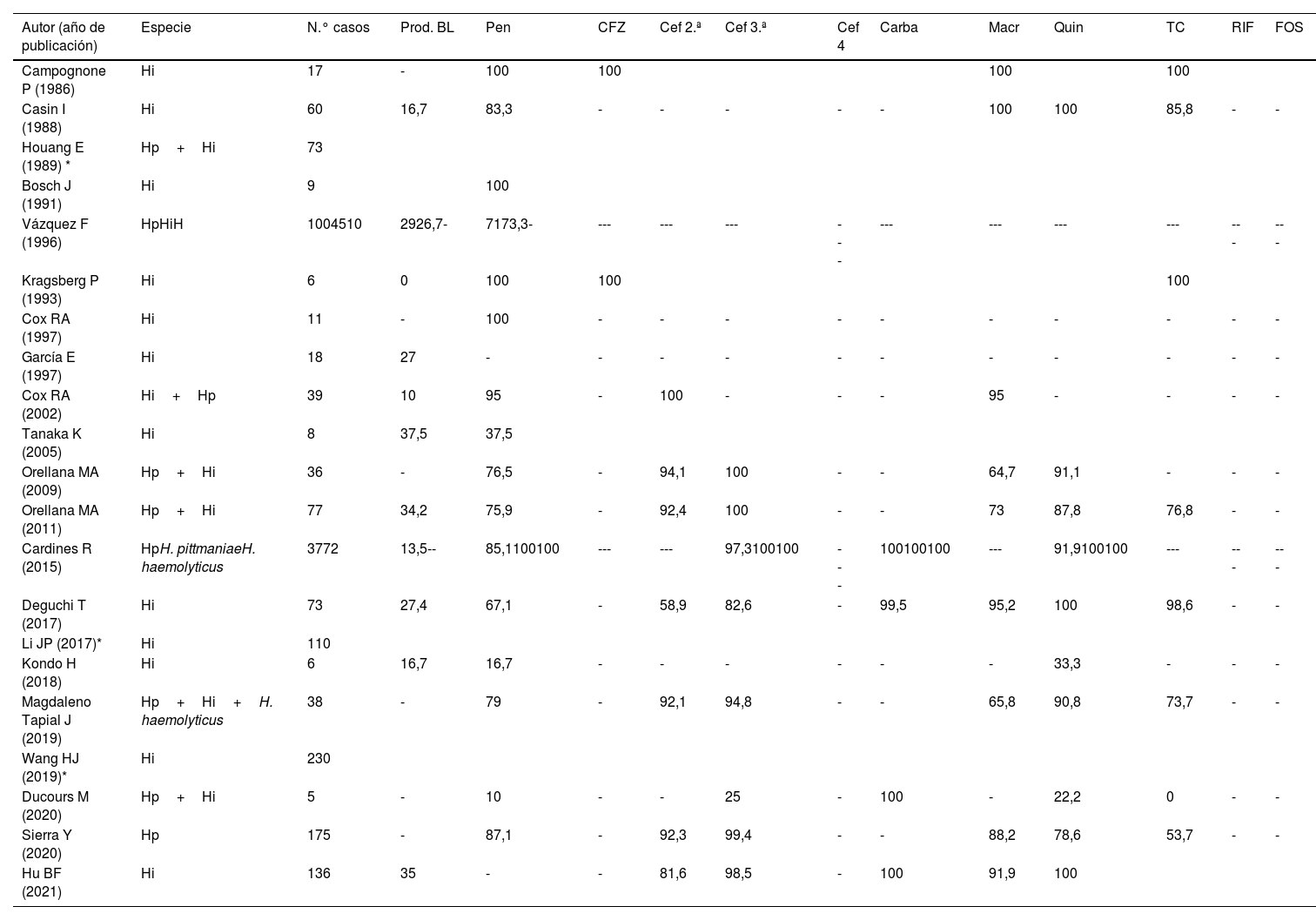
En la tabla 2 se resume la información sobre la sensibilidad de Haemophilus a diferentes grupos de antibióticos (penicilina, carbapenémicos, tetraciclina, quinolonas, cefalosporinas de primera, segunda y tercera generación) aportada por 21 de los 67 trabajos. Se han excluido 4 de ellos porque no segregan los resultados según la procedencia de las muestras, así como aquellos con menos de cincos casos reportados para evitar sesgos. La sensibilidad global de Haemophilus spp. a penicilinas fue del 78,9%, y la tasa global de producción de betalactamasas del 26,4%. Debe tenerse en cuenta que, si bien la producción de betalactamasas es el principal mecanismo de resistencia de este género, también existen cepas no productoras de betalactamasas pero con alteración en penicillin binding proteins con baja afinidad por betalactámicos, e, incluso, combinación de ambos mecanismos109.
Sensibilidad a los antibióticos (%) de los aislados de Haemophilus spp
| Autor (año de publicación) | Especie | N.° casos | Prod. BL | Pen | CFZ | Cef 2.ª | Cef 3.ª | Cef 4 | Carba | Macr | Quin | TC | RIF | FOS |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Campognone P (1986) | Hi | 17 | - | 100 | 100 | 100 | 100 | |||||||
| Casin I (1988) | Hi | 60 | 16,7 | 83,3 | - | - | - | - | - | 100 | 100 | 85,8 | - | - |
| Houang E (1989) * | Hp+Hi | 73 | ||||||||||||
| Bosch J (1991) | Hi | 9 | 100 | |||||||||||
| Vázquez F (1996) | HpHiH | 1004510 | 2926,7- | 7173,3- | --- | --- | --- | --- | --- | --- | --- | --- | --- | --- |
| Kragsberg P (1993) | Hi | 6 | 0 | 100 | 100 | 100 | ||||||||
| Cox RA (1997) | Hi | 11 | - | 100 | - | - | - | - | - | - | - | - | - | - |
| García E (1997) | Hi | 18 | 27 | - | - | - | - | - | - | - | - | - | - | - |
| Cox RA (2002) | Hi+Hp | 39 | 10 | 95 | - | 100 | - | - | - | 95 | - | - | - | - |
| Tanaka K (2005) | Hi | 8 | 37,5 | 37,5 | ||||||||||
| Orellana MA (2009) | Hp+Hi | 36 | - | 76,5 | - | 94,1 | 100 | - | - | 64,7 | 91,1 | - | - | - |
| Orellana MA (2011) | Hp+Hi | 77 | 34,2 | 75,9 | - | 92,4 | 100 | - | - | 73 | 87,8 | 76,8 | - | - |
| Cardines R (2015) | HpH. pittmaniaeH. haemolyticus | 3772 | 13,5-- | 85,1100100 | --- | --- | 97,3100100 | --- | 100100100 | --- | 91,9100100 | --- | --- | --- |
| Deguchi T (2017) | Hi | 73 | 27,4 | 67,1 | - | 58,9 | 82,6 | - | 99,5 | 95,2 | 100 | 98,6 | - | - |
| Li JP (2017)* | Hi | 110 | ||||||||||||
| Kondo H (2018) | Hi | 6 | 16,7 | 16,7 | - | - | - | - | - | - | 33,3 | - | - | - |
| Magdaleno Tapial J (2019) | Hp+Hi+H. haemolyticus | 38 | - | 79 | - | 92,1 | 94,8 | - | - | 65,8 | 90,8 | 73,7 | - | - |
| Wang HJ (2019)* | Hi | 230 | ||||||||||||
| Ducours M (2020) | Hp+Hi | 5 | - | 10 | - | - | 25 | - | 100 | - | 22,2 | 0 | - | - |
| Sierra Y (2020) | Hp | 175 | - | 87,1 | - | 92,3 | 99,4 | - | - | 88,2 | 78,6 | 53,7 | - | - |
| Hu BF (2021) | Hi | 136 | 35 | - | - | 81,6 | 98,5 | - | 100 | 91,9 | 100 |
Amin: aminoglucósidos; ATM: aztreonam (monobactámico); Carba: carbapenemes; Cef 2ª: cefalosporinas 2ª generación; Cef 3ª: cefalosporinas 3ª generación; Cef 4ª: cefalosporinas 4ª generación; CFZ: cefazolina (cefalosporina 1ª generación); CHL: cloranfenicol; FOS: fosfomicina; Hi: Haemophilus influenzae; Hp: Haemophilus parainfluenzae; Macr: macrólidos; Pen: penicilinas; Prod. BL: producción de betalactamasas; Quin: quinolonas; RIF: rifampicina; SXT: trimetoprim-sulfametoxazol; TC: tetraciclinas.
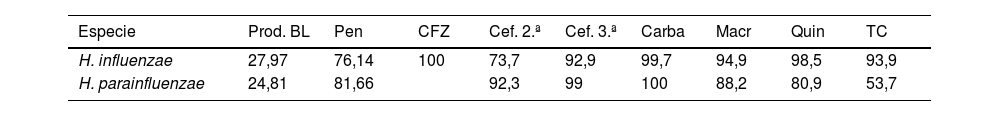
Además, se ha determinado la sensibilidad a dichos antibióticos por separado para cada especie. Estos datos se muestran en la tabla 3.
Tasas de susceptibilidad antibiótica y presencia de betalactamasas separados por especies (%)
| Especie | Prod. BL | Pen | CFZ | Cef. 2.ª | Cef. 3.ª | Carba | Macr | Quin | TC |
|---|---|---|---|---|---|---|---|---|---|
| H. influenzae | 27,97 | 76,14 | 100 | 73,7 | 92,9 | 99,7 | 94,9 | 98,5 | 93,9 |
| H. parainfluenzae | 24,81 | 81,66 | 92,3 | 99 | 100 | 88,2 | 80,9 | 53,7 |
Carba: carbapenemes; Cef 2ª: cefalosporinas 2ª generación; Cef 3ª: cefalosporinas 3ª generación; CFZ: cefazolina (cefalosporina 1ª generación); Macr: macrólidos; Pen: penicilinas; Prod. BL: producción de betalactamasas; Quin: quinolonas; TC: tetraciclinas.
Es difícil demostrar el papel patogénico de microorganismos que pueden ser colonizadores y presentarse de forma conjunta con otras especies, como en el caso de HSNOD y en particular de Haemophilus influenzae. Existen pocos estudios realizados con grupo control sobre la prevalencia de este último en varones con uretritis, no obstante, en uno de ellos3, sí se demuestra asociación con uretritis no gonocócica tanto en HSH como en heterosexuales, lo que iría a favor de su papel etiológico y patogénico en las uretritis. Del resto de especies HSNOD, su papel patogénico aún es dudoso, dado que no existen estudios rigurosos con metodología válida, siendo en su mayoría series de casos.
El mecanismo de adquisición varía en función de las características del paciente; por ejemplo, en niñas sin antecedentes de relaciones sexuales ni abusos podría existir un mecanismo de autoinoculación desde localización nasal hasta el área vaginal. Por el contrario, en los adultos, la vía de transmisión es predominantemente sexual. Uno de los datos más relevantes que podemos extraer de esta revisión bibliográfica es la elevada frecuencia con que se asocia la uretritis producida por HSNOD con la práctica de sexo oral sin protección, tratándose, en muchos casos, de la única forma de exposición reportada. La infección genital por HSNOD parece asociarse al contacto sexual con numerosas parejas sexuales y con el ámbito de la prostitución. Sin embargo, es importante ser cautos al extraer conclusiones sobre posibles factores predisponentes a la infección genital por HSNOD, ya que la información suministrada por las distintas publicaciones es escasa. Con respecto a la orientación sexual de los pacientes varones, un 53,3% eran heterosexuales y un 46,7%, homosexuales, pero la información disponible es muy limitada y no nos permite concluir que el riesgo de infección se relacione con la orientación sexual. Lo mismo ocurre con haber padecido previamente infecciones de transmisión sexual (uretritis, VIH, sífilis, etc.) como factor de riesgo. Encontramos el mismo número de pacientes con antecedentes de ITS que sin ellos, pero tampoco podemos extraer conclusiones definitivas debido a la ausencia generalizada de información. Llama la atención el escaso número de publicaciones en que se considera a HSNOD como agente patógeno causante de proctitis.
Las tasas de sensibilidad de Haemophilus frente a cefalosporinas, sobre todo de tercera generación, son muy elevadas, constituyendo junto a la amoxicilina/clavulánico, los tratamientos de elección. Teniendo en cuenta el perfil de sensibilidad antibiótica de cada especie descrito anteriormente, podemos deducir que el tratamiento empírico administrado para ITS podría resultar más eficaz frente a H. influenzae que frente a H. parainfluenzae, ya que este último presenta tasas más bajas de sensibilidad frente a macrólidos, tetraciclinas y quinolonas.
Tradicionalmente, los cuadros de vulvovaginitis en niñas se han tratado con penicilinas, habiéndose descrito una gran tendencia a la recidiva de estos episodios3, que podría deberse a la ineficacia del tratamiento empírico, ya que la tasa de sensibilidad de H. influenzae a estos antibióticos es tan solo del 72,3%. Esta hipótesis se ve reforzada por el hecho de que la tasa de recidiva es mayor en las niñas que habían recibido penicilinas en los meses previos para tratar infecciones en otras localizaciones. Una alternativa a las penicilinas son las cefalosporinas, que muestran buenas tasas de sensibilidad y carecen de los posibles efectos secundarios en edad infantil de otros antibióticos, como las quinolonas. Finalmente, uno de los trabajos revisados46 pone de manifiesto la frecuencia con que se detecta Haemophilus spp. en el exudado vaginal de gestantes asintomáticas, con porcentajes cercanos al 10%. Esto podría conllevar un mayor riesgo de transmisión vertical y de complicaciones infecciosas tanto a nivel maternal como de sepsis neonatal, pudiendo plantearse como estrategia su erradicación de manera profiláctica. Sin embargo, es necesario un análisis más profundo del balance riesgo-beneficio de esta intervención, que podría incrementar la presión antibiótica.
Esta revisión tiene varias limitaciones. Se ha realizado una búsqueda exhaustiva, no obstante, se han incluido artículos en español e inglés y no hemos tenido acceso a una serie de estudios publicados, enunciados al inicio del artículo, por lo que es posible que no esté incluidos todos los estudios publicados. Además, la gran variabilidad de datos publicados entre artículos, con respecto a datos epidemiológicos, microbiológicos y sensibilidad antibiótica, hacen difícil analizar los datos de forma homogénea y por tanto extraer conclusiones. Por otra parte, la metodología de la mayoría de los estudios incluidos es antigua y no permite establecer de forma firme el papel etiológico de estos microorganismos.
Tras la revisión realizada, sí destacamos, dentro de HSNOD, el papel de Haemophilus influenzae como agente etiológico en cuadros de uretritis no gonocócica en varones, tanto HSH como heteterosexuales, y, por tanto, la conveniencia de buscar este microorganismo de forma sistemática en esta entidad, pudiendo explicar un porcentaje importante de las uretritis sin aislamiento microbiológico. No se han podido encontrar descritos, de forma consistente, los factores de riesgo epidemiológicos y/o mecanismo de adquisición, por lo que harían falta más estudios. Por otra parte, teniendo en cuenta el perfil de resistencia antibiótica, las cefalosporinas de tercera generación, la amoxicilina-clavulánico y las quinolonas se postulan como las opciones con más éxito de erradicación. La azitromicina y la doxiciclina, ampliamente utilizadas en el tratamiento empírico de las ITS, si bien no encontramos en la revisión tasas de resistencia importantes, sí se está objetivando una tendencia creciente de cepas con mayor perfil de resistencia y concentraciones mínimas inhibitorias mayores para doxiciclina110.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.