La tosferina es una enfermedad reemergente que afecta sobre todo a lactantes. A esta edad la gravedad se puede afectar por infecciones intercurrentes como la del virus respiratorio sincitial (VRS).
ObjetivosEstimar la incidencia de la infección por el VRS durante su época epidémica en pacientes ingresados por tosferina. Asimismo, estudiar su repercusión sobre la gravedad observada durante el ingreso.
Pacientes y métodoEstudio descriptivo de casos con diagnóstico de tosferina ingresados en un hospital terciario durante 3años donde se analizó la presencia de coinfección por el VRS. La estimación de la gravedad se confrontó por la incidencia de complicaciones y el nivel de cuidados requeridos.
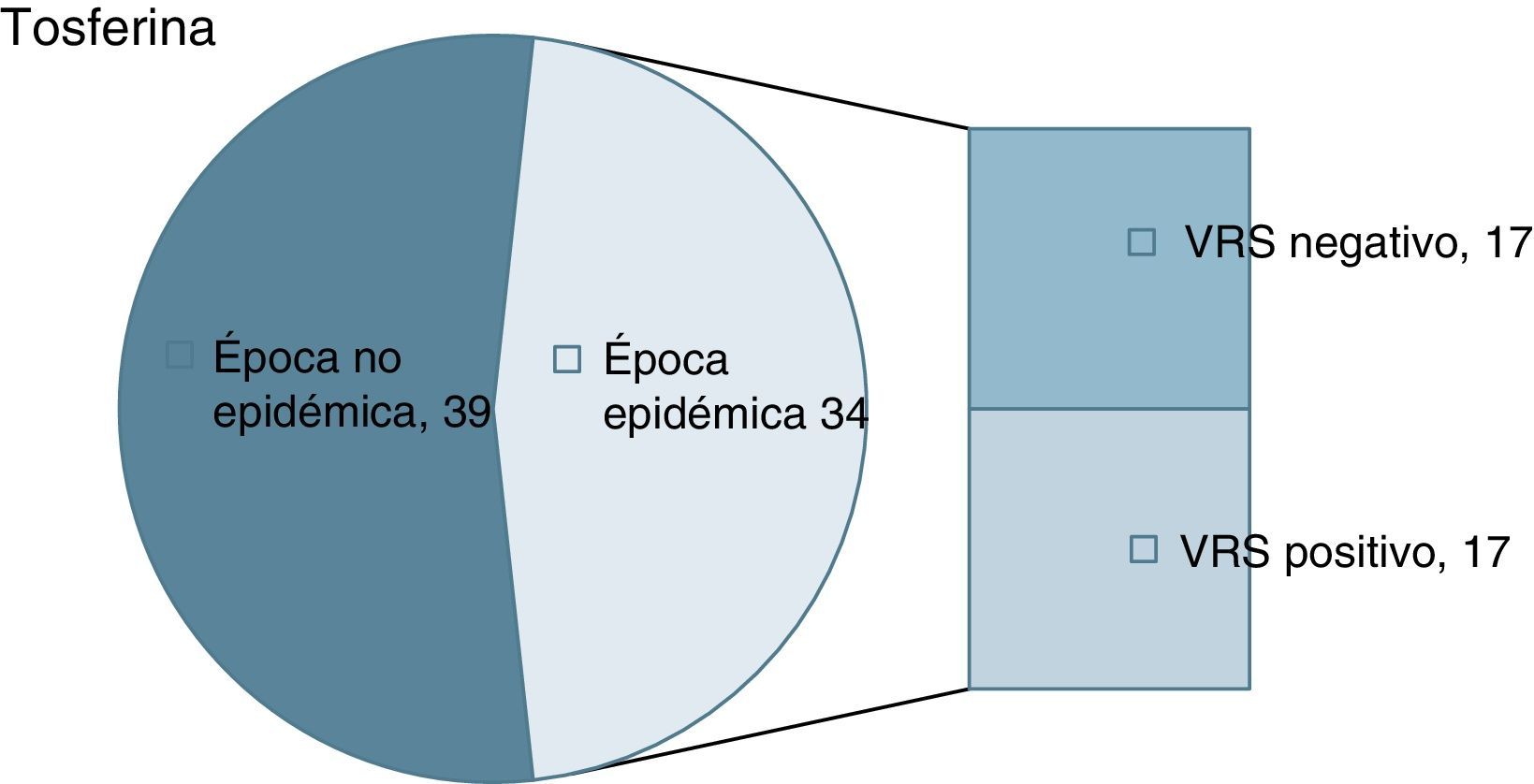
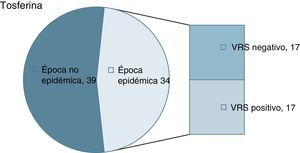
ResultadosDe un total de 73 lactantes con tosferina, 34 acontecieron en época epidémica de bronquiolitis. En 17 de los 34 se detectó coinfección por el VRS. La edad media no mostró diferencias significativas respecto a los no coinfectados. La estancia media y la necesidad de cuidados intensivos fue semejante. La necesidad de cuidados de oxigenoterapia y soporte nutricional fue superior en los coinfectados.
ConclusionesLa coinfección por el VRS en lactantes ingresados con tosferina aconteció en uno de cada 2 pacientes en época epidémica para el VRS, en lactantes de edad similar. La gravedad en términos de estancia, presencia de apneas e ingreso en cuidados intensivos fue semejante, pero con mayor necesidad de cuidados respiratorios y soporte nutricional.
Pertussis is a re-emerging disease that mostly affects infants. At this age, the severity can be affected by intercurrent infections such as respiratory syncytial virus (RSV).
ObjectivesTo estimate the incidence of RSV infection during an epidemic period in patients hospitalized due to pertussis. The impact on the severity was also observed during hospitalization.
Patients and methodA descriptive study of cases diagnosed with pertussis admitted to a tertiary hospital over a 3year period, where the presence of co-infection with RSV was analyzed. The estimate of severity was estimated using the incidence of complications and the level of care required.
ResultsFrom a total of 73 infants with pertussis, 34 occurred in a bronchiolitis season epidemic. A co-infection due to RSV was detected in 17 patients. The mean age was not significantly different compared to the non co-infected. The mean stay and the need for intensive care was similar in both groups. The need for oxygen therapy care and nutritional support was higher in the coinfected patients.
ConclusionsCoinfection with RSV in infants hospitalized with pertussis occurred in ono in 2 patients during a RSV epidemic season, in infants of similar age. Severity in terms of stay, presence of apnea and admission to intensive care was similar, but more need for respiratory care and nutritional support was found.
En los últimos años estamos asistiendo a un resurgimiento de la tosferina a nivel mundial1–5, una enfermedad que hasta mediados del siglo pasado era una de las causas de mayor mortalidad en niños menores de un año. Hasta los años noventa su incidencia y mortalidad fueron en descenso. Sin embargo, a partir de entonces, y sobre todo en los últimos 10años, su incidencia ha ido en claro aumento en países occidentales6. Este incremento parece debido a la pérdida de inmunidad inducida por la vacuna en jóvenes y adultos4,7–9 que actúan como vectores de transmisión10. Así, se ha observado una distribución por edades en 2 tramos: en los lactantes menores de 6meses, por un lado, y en adolescentes y adultos, por otro11.
Los ingresos por tosferina en época epidémica para el virus respiratorio sincitial (VRS) plantean la posibilidad de una coinfección por este virus y es razonable pensar que su gravedad y su evolución pueden verse afectadas. Nos proponemos estimar la incidencia de la infección por el VRS en su época epidémica, en pacientes ingresados por tosferina, y valorar su repercusión sobre la gravedad del cuadro durante su estancia. Los trabajos centrados en investigar la incidencia de esta coinfección están planteados generalmente desde la perspectiva del cuadro respiratorio por VRS12–16 y el escrutinio sistemático de VRS y Bordetella pertussis con independencia de la clínica, con el sesgo que puede suponer no tener en cuenta la posibilidad de portadores asintomáticos de B.pertussis en la infancia17,18. El cribado sistemático de coinfección por B.pertussis en pacientes ingresados por VRS parece presentar escasa rentabilidad según algunos autores, sobre todo en ausencia de síntomas de tosferina19,20. Por ello, en nuestro trabajo pretendemos, en pacientes con clínica y diagnóstico previo de tosferina, investigar la incidencia de coinfección por VRS y su repercusión en la evolución de los pacientes con esta patología reemergente.
Material y métodoSe realizó un estudio descriptivo considerando la definición de caso: lactantes menores de un año ingresados con diagnóstico inicial de tosferina en base a síntomas y signos clínicos (concretados en ataques de tos creciente paroxística seca y congestiva y/o emetizante en accesos y/o pausas de apnea, precedidas de un periodo catarral previo en ausencia de otros síntomas o signos sugerentes de otras enfermedades respiratorias) confirmados mediante PCR en tiempo real a B.pertussis y B.parapertursis21 en aspirado nasofaríngeo (Bordetella Pertussis/parapertussis Real-Time PCR, Cepheid, Sunnyvale, EE.UU.) durante la época epidémica de bronquiolitis en un periodo de 3años consecutivos, considerando esta, para nuestra latitud, la comprendida en los meses de octubre a marzo, ambos inclusive: desde abril de 2011 a marzo de 2014. El criterio de ingreso suficiente y necesario fue la sospecha de tosferina en menores de un año. Se determinó en estos pacientes la presencia de coinfección por VRS a partir del análisis antigénico del aspirado nasofaríngeo al ingreso (RSV Card letitest©, Leti Diagnostics, Barcelona, España)22.
Se estudiaron por cohortes, según la presencia de coinfección, la frecuencia de variables epidemiológicas: sexo, lactancia materna, presencia de fumadores, hermanos en domicilio y número de vacunas de tosferina recibidas. Asimismo se confrontó en ambos casos la evolución y las complicaciones mediante la recogida de la frecuencia de las siguientes variables: necesidad de oxigenoterapia, necesidad de alimentación por sonda nasogástrica, presencia de apneas, evolución a tosferina maligna considerada según criterios previamente publicados (insuficiencia respiratoria progresiva, cianosis, apnea + hiperleucocitosis con linfocitosis)23, necesidad de ingreso en la unidad de cuidados intensivos pediátricos (UCIP) y número de fallecimientos. Para los pacientes que evolucionaron a tosferina maligna se amplió el estudio diagnostico con el test para 20 patógenos por PCR en una nueva muestra (FilmArray©Respiratory panel, Biofire Diagnostics, Utah, EE.UU.). La estancia media y la edad media fueron comparadas mediante pruebas no paramétricas para muestras independientes.
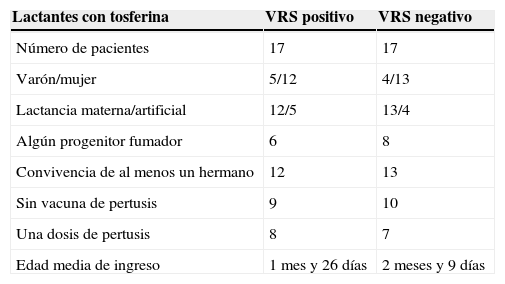
ResultadosEn el periodo definido se registraron 73 casos de tosferina por B.pertussis (no hubo casos por B.parapertussis), para un total de 16.965 recién nacidos. La incidencia de ingresos por tosferina de menores de un año registrada fue de 4,30/1.000 recién nacidos y año. Del total de 73 lactantes con tosferina confirmada, 34 acontecieron en época epidémica de bronquiolitis. De estos, en 17 pacientes se objetivó coinfección por el VRS (fig. 1). Todos iniciaron tratamiento con azitromicina. La distribución de variables epidemiológicas se muestra en la tabla 1. La edad media y la desviación estándar de presentación en los coinfectados fue de 56±25días (rango 28-102días), mientras que en los que no presentaban coinfección fue de 69±37días (rango 19-155 días). La comparación de las medias de edad no mostró diferencia estadística significativa. Se observó un claro predominio femenino en ambas situaciones. La presencia de fumadores en el entorno obtuvo una proporción similar en ambas cohortes. Asimismo, la presencia de hermanos convivientes fue semejante en ambos grupos. De los 17 pacientes coinfectados, 8 habían sido vacunados con la primera dosis de vacuna anti-pertusis. De los 17 lactantes sin el VRS, 7 habían recibido una dosis. Ninguno había recibido más de una dosis.
Distribución de las variables epidemiológica estudiadas en casos de tosferina según la presencia del virus respiratorio sincitial (VRS)
| Lactantes con tosferina | VRS positivo | VRS negativo |
|---|---|---|
| Número de pacientes | 17 | 17 |
| Varón/mujer | 5/12 | 4/13 |
| Lactancia materna/artificial | 12/5 | 13/4 |
| Algún progenitor fumador | 6 | 8 |
| Convivencia de al menos un hermano | 12 | 13 |
| Sin vacuna de pertusis | 9 | 10 |
| Una dosis de pertusis | 8 | 7 |
| Edad media de ingreso | 1 mes y 26 días | 2 meses y 9 días |
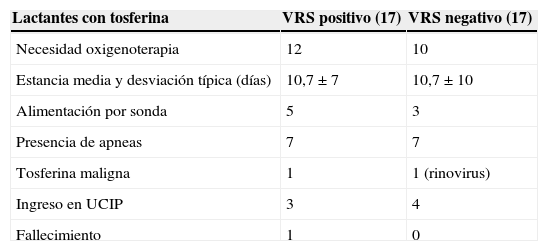
La tabla 2 muestra la gravedad de la infección en las variables tales como duración de la estancia, necesidad de cuidados respiratorios o nutricionales, presencia de apneas e ingresos en la UCIP. La estancia de los lactantes con coinfección por el VRS se situó en ambas cohortes en torno a 10 días y no alcanzó diferencia estadística significativa. La presencia de apneas fue semejante en ambos grupos. La necesidad de oxigenoterapia y alimentación por sonda fue superior en el grupo de coinfectados. Requirieron ingreso en la UCIP 3 pacientes de los que presentaban coinfección por VRS, frente a los 4 entre los lactantes sin coinfección por VRS, si bien uno de estos últimos presentaba una coinfección por rinovirus que, además, evolucionó a tosferina maligna. Durante este periodo 2 casos presentaron datos clínicos y analíticos compatibles con tosferina maligna, correspondiendo ambos casos a coinfecciones (tabla 2).
Distribución de las complicaciones estudiadas en casos de tosferina según la presencia del virus respiratorio sincitial (VRS)
| Lactantes con tosferina | VRS positivo (17) | VRS negativo (17) |
|---|---|---|
| Necesidad oxigenoterapia | 12 | 10 |
| Estancia media y desviación típica (días) | 10,7±7 | 10,7±10 |
| Alimentación por sonda | 5 | 3 |
| Presencia de apneas | 7 | 7 |
| Tosferina maligna | 1 | 1 (rinovirus) |
| Ingreso en UCIP | 3 | 4 |
| Fallecimiento | 1 | 0 |
La reemergencia de la tosferina hace que estemos presenciando tasas anuales de ingresos de 4,30/1.000 recién nacidos y año aproximadamente, como muestra nuestra serie. Serían cifras impensables hace una década5,6,9, pero es una nueva realidad a día de hoy. Se mantiene además una incidencia independiente de la estacionalidad, repartida de forma semejante a lo largo del año (fig. 1), lo que hace concluir que su transmisión no está condicionada por la presencia de cuadros respiratorios debidos a otras patologías.
Existen estudios contradictorios en relación con la frecuencia de la asociación de la tosferina con el VRS en niños no vacunados. Por un lado algunos autores encuentran que puede ser común en lactantes hospitalizados13,15. Otros estudios epidemiológicos en este sentido han publicado la baja rentabilidad de hacer escrutinio sistemático a las bronquiolitis que no asocien síntomas de tosferina16,19,20. Se ha cuestionado el cribado sistemático de la tosferina en los pacientes con bronquiolitis no vacunados, sin clínica sugerente cuando además es posible la presencia de portadores asintomáticos de B.pertussis17,18. No se ha centrado nuestro trabajo en conocer la coinfección tosferina-VRS en cualquier patología respiratoria del lactante ingresado, sino solo determinar la frecuencia de coinfección por VRS en pacientes con tosferina diagnosticada y su repercusión clínica.
A pesar de que, en nuestro medio, la cobertura de vacunación frente a la tosferina ronda el 98% en los primeros 12meses de edad24, estudios recientes indican que los lactantes continúan padeciendo tosferina25, sobre todo aquellos por debajo de los 2meses, constituyendo un grupo de alto riesgo por presentar un mayor número de ingresos, complicaciones y fallecimientos11. En nuestro estudio los 34 lactantes con tosferina diagnosticada durante la epidemia de bronquiolitis tenían una edad sobre los 2meses, con 13 menores de 6semanas y todos menos uno eran menores de 4meses20. Además, es llamativo el hecho de que 8 de 17 pacientes con coinfección habían recibido la primera dosis de vacuna y, asimismo, en 7 de las pertusis sin coinfección. También es de reseñar que ninguno de nuestros pacientes tenía 2 dosis de vacuna, lo que hace pensar que la revacunación precoz puede ser clave para evitar la enfermedad26.
Los casos de infección por el VRS alcanzó la proporción de la mitad de los pacientes ingresados por tosferina en época epidémica. En estudios de cribado sistemático para VRS y tosferina de todo cuadro respiratorio que precisa ingreso en lactantes, la proporción de coinfección es mucho menor a la de nuestra serie: 16%12. El análisis desde la perspectiva de la detección de B.pertussis en ingresos de bronquiolitis por VRS ofrece cifras de coinfección del 7,6% con (12 casos de tosferina en 142 análisis)13. En trabajos sobre pacientes atendidos en urgencias por bronquiolitis la detección sistemática ha mostrado cifras del 2%16. La explicación puede estar en la selección previa por la clínica de nuestros pacientes, lo cual habla en favor de optimizar el uso de test diagnósticos en base a la anamnesis y exploración que, aunque en lactantes puede solaparse, sigue presentando un evidente grado de eficiencia.
Las 2 cohortes mostraron una media de edad semejante, con una frecuencia similar de fumadores en el entorno y un claro predominio femenino en ambas (tabla 1). La presencia de hermanos convivientes en la familia fue parecida en ambos grupos, lo que parece indicar que no fue un factor determinante para la coinfección. La estancia media no mostró diferencias, aunque se objetivó una mayor necesidad de cuidados de oxigenoterapia y alimentación por sonda para el grupo coinfectado. La frecuencia de apneas fue semejante en ambos grupos, lo que indica que no parece existir un efecto sumatorio en la inducción de apneas que estas 2 infecciones tienen de forma característica entre sus manifestaciones.
Respecto a la estancia en la UCIP, el número de ingresos fue similar. Es de señalar que en los 2 casos de tosferina maligna ocurridos en época epidémica hubo una asociación a otro virus. En un caso fue el VRS, y en el otro, un rinovirus. También el único fallecimiento de la serie asociaba la infección por el VRS, como es recogido por otros trabajos15.
Recientemente se ha publicado un estudio extenso27 con resultados sorprendentes, según el cual los lactantes con bronquiolitis en época epidémica en los que se detecta tosferina presentan una clínica más leve y una estancia más corta que en aquellos con diagnóstico exclusivo de VRS, basándose en parámetros y escalas clínicas. Esto tiene una difícil interpretación y puede tener relación con el cribado masivo de pertusis y VRS con independencia de la clínica. Es posible que la B.pertussis detectada no desarrolle necesariamente enfermedad sintomática y se trate de portadores cuya evolución dependa del estado inmunitario de la madre17,18.
Es evidente que estamos ante un grave problema sanitario y que es preciso tomar iniciativas estratégicas de prevención que incluyan a la embarazada y al entorno del lactante28. En algún caso se ha publicado la eficacia de la vacunación precoz del recién nacido con resultados aún en estudio26. Las complicaciones de una tosferina son temibles en los lactantes pequeños, y una de ellas puede ser una coinfección por el VRS, que en nuestro estudio acaeció en la mitad de los casos con diagnóstico previo de tosferina. Nuestros resultados apuntan a una limitada repercusión clínica de la coinfección por VRS en la tosferina ingresada, aunque se trata de una muestra no muy amplia y es difícil evaluar si la evolución a tosferina maligna puede tener relación con la coinfección. La coinfección se asoció a los 2 únicos casos de evolución a tosferina maligna de la serie, en uno de ellos por el VRS y en otro por rinovirus. Son necesarios más estudios en este sentido para determinar la incidencia y las consecuencias de la coinfección por el VRS y otros virus estacionales que parece conveniente estudiar en casos de evolución a tosferina maligna.
ConclusionesLa epidemia por el VRS no parece incrementar la transmisión concomitante de tosferina que mantiene un patrón epidemiológico independiente a tenor de la incidencia de casos a lo largo del año.
En nuestra serie, la infección por el VRS en lactantes ingresados por tosferina aconteció en uno de cada 2 casos en época epidémica para este virus, con una gravedad ligeramente superior en necesidad de cuidados respiratorios y oxigenoterapia, si bien con un comportamiento semejante en días de estancia, necesidad de ingreso en la UCIP y presencia de apneas.
Conflicto de interesesDMP ha colaborado en actividades docentes subvencionadas por GlaxoSmithKline y Sanofi Pasteur MSD. JMRF ha colaborado en actividades docentes subvencionadas por Sanofi Pasteur MSD. Resto de autores declaran no tener conflicto de intereses.