Estudio clínico-epidemiológico que incluyó todos los casos de enfermedad neumocócica invasiva diagnosticados en Tarragona entre 01/01/2006-01/12/2009. Se observaron 286 casos totales, lo que representó una incidencia global de 21,2 por 100.000 personas-año (IC 95%: 16,6-26,9). La incidencia fue 26,3/100.000 (IC 95%: 14,4-44,3) en niños, 12,2/100.000 (IC 95%: 8,2-17,6) en personas 15-64 años y 59,6/100.000 (IC 95%: 40,0-85,8) en personas ≥65 años. La letalidad global fue 7,3% (ninguna en niños, 3,4% en 15-64 años, 14,8% en personas ≥65 años; p<0,001).
An epidemiological study was conducted on all cases of invasive pneumococcal disease (IPD) diagnosed in Tarragona, Spain, between 1 January 2006 and 31 December 2009. A total of 286 IPD cases were observed, which was an overall incidence of 21.2 episodes per 100,000 persons-year (95% CI: 16.6-26.9). Incidence rates were 26.3/100,000 (95% CI: 14.4-44.3) among children, 12.2/100,000 (95% CI: 8.2-17.6) among patients between 15-64 years and 59.6/100,000 (95% CI: 40.0-85.8) in those ≥65 years. Overall lethality rate was 7.3% (none in children, 3.4% among patients 15-64 years, and 14.8% among patients ≥65 years; p<0.001).
Las infecciones causadas por Streptococcus pneumoniae (S. pneumoniae) son una importante causa de morbimortalidad. Sin embargo, la incidencia real de la enfermedad neumocócica es difícil de estimar, existiendo amplia variabilidad en las tasas reportadas en diferentes países y regiones1. En la actualidad, considerando el posible impacto epidemiológico que pudiera derivarse de la introducción en 2010 de las nuevas vacunas neumocócicas conjugadas (VNC) de segunda generación2, resulta imperativo disponer de datos válidos y precisos sobre la incidencia de la enfermedad neumocócica en distintas poblaciones durante la etapa previa a la introducción de estas vacunas. Estos estudios deben proporcionar datos importantes para monitorizar y comparar la incidencia y distribución de los serotipos causantes de infección en las diferentes poblaciones en riesgo, permitiéndonos evaluar en el futuro posibles efectos directos y/o indirectos que pudieran producirse tras la introducción de estas vacunas3. El presente estudio analizó la incidencia y letalidad de la enfermedad neumocócica invasiva (ENI) en la población general del área de Tarragona durante el periodo 2006-2009 (cuatrienio inmediatamente anterior a la comercialización de la VNC10 y la VNC13).
Pacientes y métodosEstudio clínico-epidemiológico retrospectivo que incluye todos los casos de ENI (S. pneumoniae aislado en sangre, LCR u otros fluidos estériles) ocurridos en personas de cualquier edad en la región de Tarragona (comarcas del Tarragonès, Alt Camp y Baix Penedès) entre 01/01/2006 y 01/12/2009. La región de estudio incluye 19 Áreas Básicas de Salud y dos hospitales públicos/concertados de referencia (Hospital Universitario Joan XXIII y Hospital Santa Tecla) que cuentan con sendos Servicios de Laboratorio y Microbiología que realizan las analíticas y cultivos tanto de los pacientes hospitalizados como ambulatorios correspondientes a las 19 Áreas Básicas de Salud de las tres comarcas de estudio (con una población total de 337.289 habitantes al inicio del estudio)4.
Los códigos diagnósticos CIE-9 (Clasificación Internacional de Enfermedades, 9.a revisión) del Conjunto Mínimo Básico de Datos de altas hospitalarias/urgencias de los dos hospitales de referencia fueron utilizados para identificar inicialmente la ocurrencia de posibles casos de infección neumocócica (códigos CIE-9: 038.2, 041.2, 320.1, 481, 510.9, 567.1 y 711.0). Adicionalmente, los registros específicos de Microbiología de los dos laboratorios de referencia del ámbito del estudio fueron también revisados para identificar posibles casos de ENI no detectados en los códigos diagnósticos de altas hospitalarias/urgencias. Todos los presuntos casos de ENI inicialmente identificados fueron posteriormente validados mediante revisión de la historia clínica (por parte de dos investigadores médicos que confirmaron el diagnóstico clínico y microbiológico y clasificaron los casos en función de la forma de presentación clínica de la ENI).
La identificación de S. pneumoniae fue realizada mediante técnicas microbiológicas convencionales en los dos laboratorios de referencia del área de estudio. Los aislamientos fueron enviados al Laboratorio Nacional de Referencia de Neumococos del Instituto de Salud Carlos III (Majadahonda, Madrid) donde fueron serotipados mediante reacción de Kellung5.
Las tasas de incidencia fueron calculadas considerando en el denominador la población adscrita al inicio del estudio (52.203 niños ≤14 años; 236.821 personas 15-64 años; 48.265 personas ≥65 años)4. Los intervalos de confianza (IC) fueron calculados asumiendo una distribución de Poisson para eventos infrecuentes. Chi cuadrado y test exacto de Fisher fueron usados en la comparación de proporciones, considerándose diferencias significativas si p<0,05 (bilateral).
ResultadosSe observaron un total de 286 episodios de ENI, de los que 191 (66,8%) ocurrieron en varones y 95 (33,2%) en mujeres. Por grupos etarios, 55 (19,2%) ocurrieron en niños ≤14 años, 116 (40,6%) en personas de 15-64 años y 115 (40,2%) en personas ≥65 años. En total, 105 casos (36,7%) ocurrieron en invierno, 75 (26,2%) en primavera, 31 (10,8%) en verano y 75 (26,2%) en otoño.
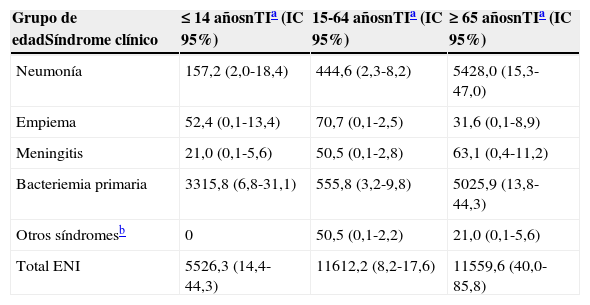
La incidencia global de ENI fue de 21,2 episodios por 100.000 personas-año (IC 95%: 16,6-26,9). La incidencia fue de 8,4 por 100.000 (IC 95%: 5,6-12,2) para neumonía bacteriémica; 1,1 por 100.000 (IC 95%: 0,3-2,8) para empiema; 1,0 (IC 95%: 0,2-2,9) para meningitis; 10,2 por 100.000 (IC95%: 7,1-14,2) para bacteriemia primaria y 0,5 por 100.000 (IC 95% 0,1-1,8) para otros síndromes. La tabla 1 muestra las tasas de incidencia según grupos de edad y tipo de presentación clínica de la ENI.
Incidencia de enfermedad neumocócica invasiva (ENI) según grupos de edad y tipo de presentación clínica, en la región de Tarragona durante 2006-2009
| Grupo de edadSíndrome clínico | ≤14 añosnTIa (IC 95%) | 15-64 añosnTIa (IC 95%) | ≥ 65 añosnTIa (IC 95%) |
|---|---|---|---|
| Neumonía | 157,2 (2,0-18,4) | 444,6 (2,3-8,2) | 5428,0 (15,3-47,0) |
| Empiema | 52,4 (0,1-13,4) | 70,7 (0,1-2,5) | 31,6 (0,1-8,9) |
| Meningitis | 21,0 (0,1-5,6) | 50,5 (0,1-2,8) | 63,1 (0,4-11,2) |
| Bacteriemia primaria | 3315,8 (6,8-31,1) | 555,8 (3,2-9,8) | 5025,9 (13,8-44,3) |
| Otros síndromesb | 0 | 50,5 (0,1-2,2) | 21,0 (0,1-5,6) |
| Total ENI | 5526,3 (14,4-44,3) | 11612,2 (8,2-17,6) | 11559,6 (40,0-85,8) |
Se produjeron 21 casos fatales, lo cual supone un índice de letalidad global del 7,3% (ninguno en niños, 3,4% en personas de 15-64 años, 14,8% en personas ≥65 años; p<0,001). La letalidad alcanzó el 53,8% (7/13) en las sepsis, 11,5% (13/113) en las neumonías bacteriémicas y 6,7% (1/15) en los empiemas. No se produjo ningún caso fatal entre las meningitis ni entre las bacteriemias no focales.
El serotipo responsable fue identificado en 237 (82,9%) de los 286 casos totales de ENI. Entre los niños ≤14 años (n=47), el serotipo más frecuentemente identificado fue el serotipo 1 (44,7%), seguido por los serotipos 14 (17%) y 19A (10,6%). En pacientes de 15-64 años (n=94), los serotipos más prevalentes fueron el 1 (21,2%), 7F (12,8%), 3 (8,5%) y 19A (8,5%). En pacientes ≥65 años (n=96), los serotipos más prevalentes fueron el 19A (12,5%), 7F (11,4%) y 3 (9,4%).
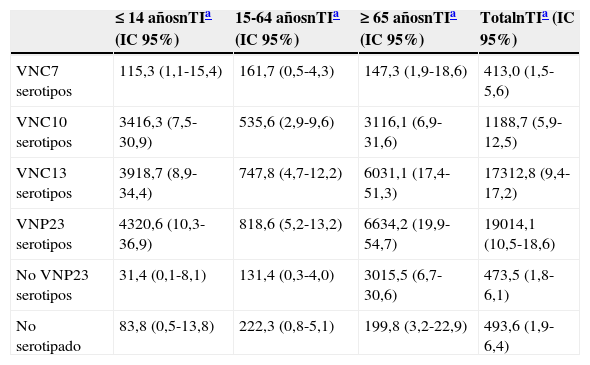
En total, de los 237 casos serotipados, solo 41 (17,3%) fueron causados por serotipos incluidos en la VNC7, mientras que 118 (49,8%) estuvieron ocasionados por alguno de los serotipos incluidos en la VNC10, 173 (73%) en la VNC13 y 190 (80,2%) en la VNP23. La tabla 2 muestra, por grupos etarios, las tasas de incidencia de ENI causadas por serotipos incluidos en las distintas formulaciones de vacunas antineumocócicas.
Incidencia de enfermedad neumocócica invasiva (ENI) causadas por serotipos incluidos en las distintas formulaciones de vacuna antineumocócicas conjugadas (VNC) y polisacárida (VNP)
| ≤14 añosnTIa (IC 95%) | 15-64 añosnTIa (IC 95%) | ≥ 65 añosnTIa (IC 95%) | TotalnTIa (IC 95%) | |
|---|---|---|---|---|
| VNC7 serotipos | 115,3 (1,1-15,4) | 161,7 (0,5-4,3) | 147,3 (1,9-18,6) | 413,0 (1,5-5,6) |
| VNC10 serotipos | 3416,3 (7,5-30,9) | 535,6 (2,9-9,6) | 3116,1 (6,9-31,6) | 1188,7 (5,9-12,5) |
| VNC13 serotipos | 3918,7 (8,9-34,4) | 747,8 (4,7-12,2) | 6031,1 (17,4-51,3) | 17312,8 (9,4-17,2) |
| VNP23 serotipos | 4320,6 (10,3-36,9) | 818,6 (5,2-13,2) | 6634,2 (19,9-54,7) | 19014,1 (10,5-18,6) |
| No VNP23 serotipos | 31,4 (0,1-8,1) | 131,4 (0,3-4,0) | 3015,5 (6,7-30,6) | 473,5 (1,8-6,1) |
| No serotipado | 83,8 (0,5-13,8) | 222,3 (0,8-5,1) | 199,8 (3,2-22,9) | 493,6 (1,9-6,4) |
Como hallazgos principales, el presente estudio muestra una tasa global de incidencia que podría calificarse como intermedia (21,2 episodios por 100.000 personas/año) y un índice de letalidad relativamente bajo (7,3%) en comparación con otras regiones1.
El grupo de personas ≥65 años soportó la mayor carga de la enfermedad (59,6 episodios por 100.000 personas/año), con tasas de incidencia que duplicaron a las observadas en niños (26,3 por 100.000) y casi quintuplicaron a las observadas en personas de 15-64 años (12,2 por 100.000).
Globalmente, considerando la población de cualquier edad, la incidencia de ENI causada por serotipos contenidos en la VNC7 fue solamente de 3 casos por 100.000 personas/año, ascendiendo a 8,7 por 100.000 para serotipos contenidos en la VNC10, 12,8 por 100.000 para serotipos contenidos en la VNC13 y 14,1 por 100.000 para serotipos contenidos en la vacuna neumocócica polisacárida 23-valente (VNP23). Resaltamos la baja incidencia de casos de ENI causados por serotipos incluidos en la VNC7, tanto entre los niños como entre los adultos, lo cual podría estar reflejando un cierto efecto indirecto de la introducción de esta vacuna en 2001 para uso pediátrico3, a pesar de que las tasas de vacunación infantil con esta vacuna (no financiada públicamente) apenas alcanzaron un 50% en nuestra región6.
Resaltamos también que en nuestra población, en los años previos a la introducción de la VNC13, los serotipos contenidos en esta vacuna estaban causando el 73% del total de casos serotipados en pacientes de cualquier edad, proporción que alcanzaba el 80% para la VNP23. Señalamos, no obstante, que estas coberturas serotípicas podrían estar cambiando en la actualidad. De hecho, un reciente estudio que ha evaluado la proporción de casos de ENI en personas >65 años en seis países ha observado un reciente incremento en el diferencial de cobertura serotípica entre la VNC13 y la VNP23 (de un 16,3% antes de 2010 hasta un 24,4% en los primeros años tras la comercialización de la VNC13)7.
Los estudios españoles sobre la incidencia de enfermedad neumocócica en la pasada década mostraron resultados dispares5,8–10. En un estudio del Laboratorio Nacional de Referencia de Neumococos del Instituto de Salud Carlos III, que evaluó la tendencia de la ENI a lo largo del tiempo en nuestro país, se reportó una disminución en la incidencia de ENI por serotipos de la VNC7 entre 1996-2006, mientras que la incidencia de serotipos no incluidos en la VNC7 aumentó, por lo que no hubo un patrón claro en la incidencia global de ENI considerando todos los serotipos5.
Como principales fortalezas del presente estudio señalamos su diseño de base poblacional y que todos los casos incluidos fueron validados mediante revisión de los datos microbiológicos y de la historia clínica. La alta frecuencia de bacteriemias primarias/no focales observadas en nuestro estudio puede deberse, en parte, a la rigurosidad de los criterios utilizados para la clasificación clínica de los casos (por ejemplo, aquellos pacientes con probable neumonía sintomática pero sin confirmación radiológica fueron clasificados como bacteriemias primarias). Como principal limitación, el estudio estuvo realizado en un área geográfica relativamente pequeña, lo cual limita la generalización de los resultados.
En conclusión, nuestra región puede ser considerada como un área mesoendémica de infección neumocócica. En la actual era de las vacunas conjugadas, el grupo de población >65 años soporta la mayor parte de la carga total de la enfermedad. Posibles efectos directos e indirectos tras la introducción de las nuevas vacunas conjugadas deberán ser evaluados en los próximos años.
Autoría/colaboradoresA. Vila, E. Salsench y O. Ochoa escribieron y editaron el manuscrito; O. Ochoa, C. Aguirre, J. Utrera y J. Guzmán obtuvieron y revisaron los datos; E. Salsench realizó el análisis estadístico; A. Vila coordinó el estudio. Los dos primeros autores contribuyeron de forma similar en este artículo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Los autores agradecen al personal de los Laboratorios de Microbiología de los Hospitales Joan XXIII y Santa Tecla de Tarragona su trabajo en la identificación de los casos. Así mismo agradecen al personal de Laboratorio de Referencia de Neumococos (Majadahonda, Madrid) que realizó el serotipaje de las muestras.