Las infecciones nosocomiales (IN) tiene todavía una alta incidencia en las unidades de cuidados intensivos (UCI), convirtiéndose en uno de los problemas más importantes que ocurren. Asimismo se asocian con una alta mortalidad y morbilidad en los pacientes críticos y están asociadas a un aumento en la estancia media de los pacientes y del coste hospitalario. Tomando como base el Estudio Nacional de Vigilancia de Infección Nosocomial en Unidades de Cuidados Intensivos (ENVIN-UCI) se hace una descripción de la etiología de las principales IN, como son la neumonía asociada a ventilación mecánica, la infección urinaria asociada a sondaje uretral y la bacteriemia primaria y relacionada con catéter. Se hace asimismo una revisión del impacto de las IN, incluyendo las infecciones causadas por microorganismos multirresistentes. Finalmente se hace una descripción de medidas y programas de control de infección en la UCI, tales como Bacteriemia Zero y Neumonía Zero, que claramente conllevan una disminución de las tasas de IN.
Nosocomial infections (NI) still have a high incidence in intensive care units (ICUs), and are becoming one of the most important problems in these units. It is well known that these infections are a major cause of morbidity and mortality in critically ill patients, and are associated with increases in the length of stay and excessive hospital costs. Based on the data from the ENVIN-UCI study, the rates and aetiology of the main nosocomial infections have been described, and include ventilator-associated pneumonia, urinary tract infection, and both primary and catheter related bloodstream infections, as well as the incidence of multidrug-resistant bacteria. A literature review on the impact of different nosocomial infections in critically ill patients is also presented. Infection control programs such as zero bacteraemia and pneumonia have been also analysed, and show a significant decrease in NI rates in ICUs.
La infección nosocomial (IN) en su definición tradicional es aquella que aparece durante el ingreso hospitalario, que se manifiesta transcurridas 72h o más del ingreso del paciente en el hospital, y que en el momento de ingreso del paciente en el hospital no estaba presente ni en período de incubación, pero en la actualidad se extiende también a la que se relaciona con los cuidados sanitarios en un sentido amplio1,2. En las unidades de cuidados intensivos (UCI) estas infecciones son unas veces motivo de ingreso en las mismas y otras, consecuencia de la estancia en estas2. Las IN constituyen uno de los problemas más importantes que pueden darse en los servicios que atienden pacientes críticos, conllevando —como luego desarrollaremos— una mayor mortalidad y unos costes sanitarios más elevados2. Se hace necesario, por tanto, establecer un sistema de vigilancia continuo que permita conocer la epidemiología, los factores de riesgo para su desarrollo y el impacto que estas infecciones tienen en el paciente crítico con el objeto de poder establecer medidas de prevención y control que traten de disminuir la incidencia de las IN y, consecuentemente, el importante efecto que tienen en el enfermo crítico.
Es por ello que la Sociedad Española de Medicina Intensiva y Unidades Coronarias (SEMICYUC) formó el Grupo de Trabajo de Enfermedades Infecciosas (GTEI), hoy GTEIS (para incorporar en sus competencias el estudio de la sepsis), en el seno de dicha sociedad, que celebra este año su XXV reunión anual, con el objeto de promocionar y favorecer el conocimiento en la patología infecciosa grave «crítica» creando la figura del «infectólogo intensivista» en todas y cada una de las UCI del territorio nacional. Desde entonces, en los servicios de medicina intensiva hay un cuerpo de conocimiento referido a las enfermedades infecciosas de los pacientes críticos y unos profesionales que realizan su trabajo en torno a ese conocimiento3.
La Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica (SEIMC), con un claro enfoque multidisciplinar, no se queda atrás y aprueba la creación, unos años más tarde que el GTEI-SEMICYUC, del Grupo de Estudio de Infecciones en el Paciente Crítico, cuyos objetivos inmediatos son promover la investigación y el conocimiento, elaborar documentos de consenso con otros grupos o sociedades científicas y favorecer la docencia y la formación en los aspectos específicos en los que exista interés entre los asociados, siempre desde una perspectiva múltiple y variada donde, además de intensivistas, participen habitualmente microbiólogos, infectólogos, farmacéuticos, farmacólogos y todos los profesionales en relación directa o indirecta con la patología infecciosa crítica3. Es el GTEl el que lleva acabo desde 1994 el Estudio Nacional de Vigilancia de la Infección Nosocomial en UCI (ENVIN-UCI)4, estudio de incidencia en el que participan más de 170 unidades cada año y tiene una base de datos de más de 70.000 pacientes. Recientemente en muchas comunidades autónomas se ha despertado un gran interés por el conocimiento de las tasas de IN, y en la mayoría de ellas para cuantificar la existente en intensivos se utiliza el ENVIN-UCI. Este estudio ha permitido conocer de forma profunda la IN en UCI mediante vigilancia activa durante 3meses al año (abril; mayo y junio) o de forma continua y mejorar la forma de abordarla, teniendo una repercusión directa en el trabajo diario desarrollando programas de control de infección como son Bacteriemia Zero (BZ), Neumonía Zero (NZ),con importante reducción de las tasas de infección, y el reciente Resistencia Zero (RZ), en fase de inicio. Actualmente estamos en un proceso de convergencia con Europa desarrollando un programa común (HELICS-ICU) que cuantifique la IN en las unidades de Medicina Intensiva5, en el que ENVIN-UCI tiene un papel predominante. La reciente incorporación en ENVIN-HELICS de un programa de control de calidad ha demostrado la fiabilidad y el ajuste a la realidad de sus datos6.
EpidemiologíaEl Estudio de Prevalencia de la Infecciones Nosocomiales en España (EPINE) es un instrumento de vigilancia de la IN que se realiza de forma anual desde el año 1990, con la misma metodología en más de 250 hospitales del territorio nacional, con participación voluntaria, y nos permite conocer la evolución plurianual de la IN en nuestro país, arrojando una tasa de pacientes con IN en el año 2012 del 7,61%. Las unidades de cuidados críticos, si bien solo supusieron el 3,34% de los pacientes incluidos en dicho año, presentaron la prevalencia más alta de IN, que llegó al 26,8%, si bien esta tasa ha ido disminuyendo progresivamente desde el año 1990, en el que se alcanzaron tasas de casi el 40%7.
En el ámbito de los cuidados críticos el estudio europeo de prevalencia de infección en UCI aporta valiosa información. Se han realizado hasta ahora 2 cortes de un día prospectivos de prevalencia, el primero de ellos el 29 de abril del año 1992 (EPIC)8 y el segundo, más reciente, el 8 de mayo de 2007 (EPICII)9.
El estudio EPIC incluyó 10.038 pacientes ingresados en 1.417 UCI de 17 países europeos, de los cuales el 44,8% presentaban algún tipo de infección y el 20,6% correspondían a una infección adquirida en la UCI. La infección más prevalente en cuidados críticos, según los datos del estudio EPIC, fue la infección pulmonar (64,7%), seguida de la infección del tracto urinario (17,6%) y de la bacteriemia (12%). Cuando en el primer estudio EPIC se analizaron las infecciones más frecuentes adquiridas en la UCI, estas eran, en orden de frecuencia, neumonía asociada a ventilación mecánica (NAVM), sinusitis, bacteriemia e infecciones asociadas a catéter, diarrea nosocomial e infecciones de sitio quirúrgico. En este estudio también se analizaron los factores de riesgo para poder desarrollar una infección adquirida en la UCI que resultaron ser: estancia mayor de 24h, ventilación mecánica, patología traumática, profilaxis de úlceras de estrés, catéter venoso central, catéter en arteria pulmonar y sonda urinaria. La neumonía adquirida en la UCI, la presentación clínica como sepsis y la bacteriemia se asociaron de forma independiente con mayor riesgo de mortalidad7.
El estudio EPICII realizado 15años después incluyó un mayor número de pacientes (14.414) provenientes de 1.265UCI de 75 países europeos, de los cuales el 51% presentaban algún tipo de infección, si bien no se distinguió si se trataba de infecciones comunitarias o nosocomiales. La infección más prevalente en cuidados críticos, según los datos del estudio EPICII, fue la infección pulmonar (63,5%), seguida de la infección intraabdominal (19,6%) —a diferencia del estudio EPIC— y la bacteriemia (15,1%). La mortalidad fue significativamente mayor en los pacientes con algún tipo de infección (25% vs 11%)8.
Recientemente se ha realizado un corte de prevalencia de un día siguiendo la misma metodología de los estudios EPIC en el sureste de Europa, Turquía e Irán en unidades de 11 países, incluyendo 749 pacientes, de los cuales el 40,7% presentaron algún tipo de infección: el 22,6% infecciones comunitarias, el 20% asociadas a cuidados sanitarios y el 57,7% restante adquiridas en el hospital. La más frecuente entre ellas fue la NAVM (43,3%). Se demostraron diferencias estadísticamente significativas en las tasas de prevalencia de NAVM, dependiendo si la unidad atendía a enfermos médicos, quirúrgicos o se trataba de una unidad mixta, aumentando la tasa según el orden referido10.
Sin embargo, los estudios y programas de vigilancia y control de la IN en las UCI nacionales e internacionales son los que aportan una información más específica y detallada de la misma, que permiten conocer las tasas de las principales entidades, su etiología, su evolución en el tiempo y sus variaciones locales. Destacaremos entre ellas el sistema de vigilancia nacional belga11 y nuestro ya referido sistema nacional ENVIN-HELICS2,4.
El sistema belga de vigilancia, en funcionamiento desde el año 1997, ha incluido en su programa 6.478 pacientes críticos hasta el año 2010. Las tasas globales de densidad de incidencia descritas para las infecciones controladas fueron: 12 episodios de NAVM por 1.000 días de ventilación mecánica; 3,2 episodios bacteriemia relacionada con catéter por 1.000 días de catéter y de 2,3 episodios de bacteriemia primaria por 1.000 días de catéter. Este estudio demuestra una importante disminución de las tasas de NAVM (27 a 12 episodios) y de bacteriemia asociada a catéter (4,7 a 2,6 episodios por 1.000 días de catéter) desde el inicio del programa de vigilancia10.
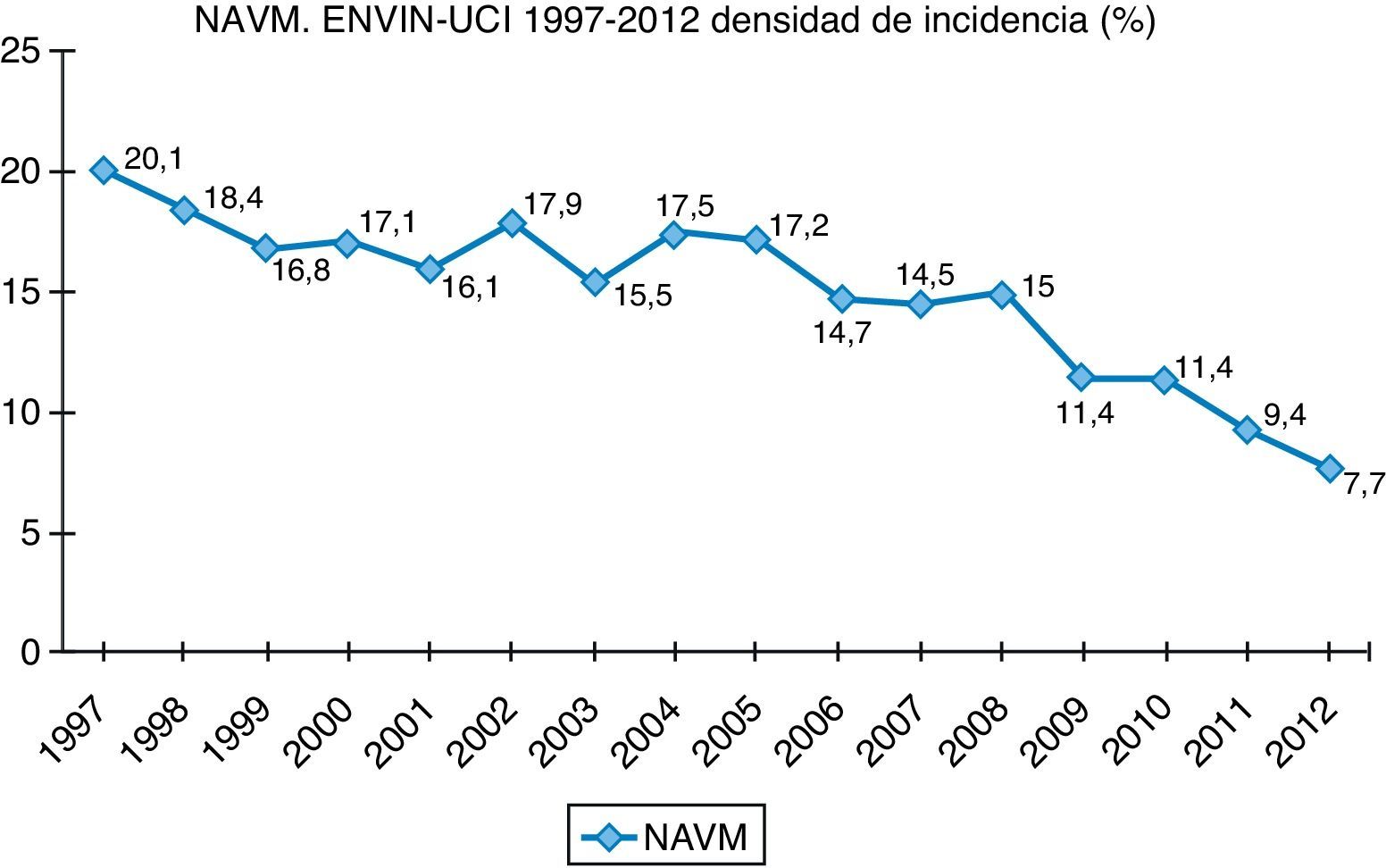
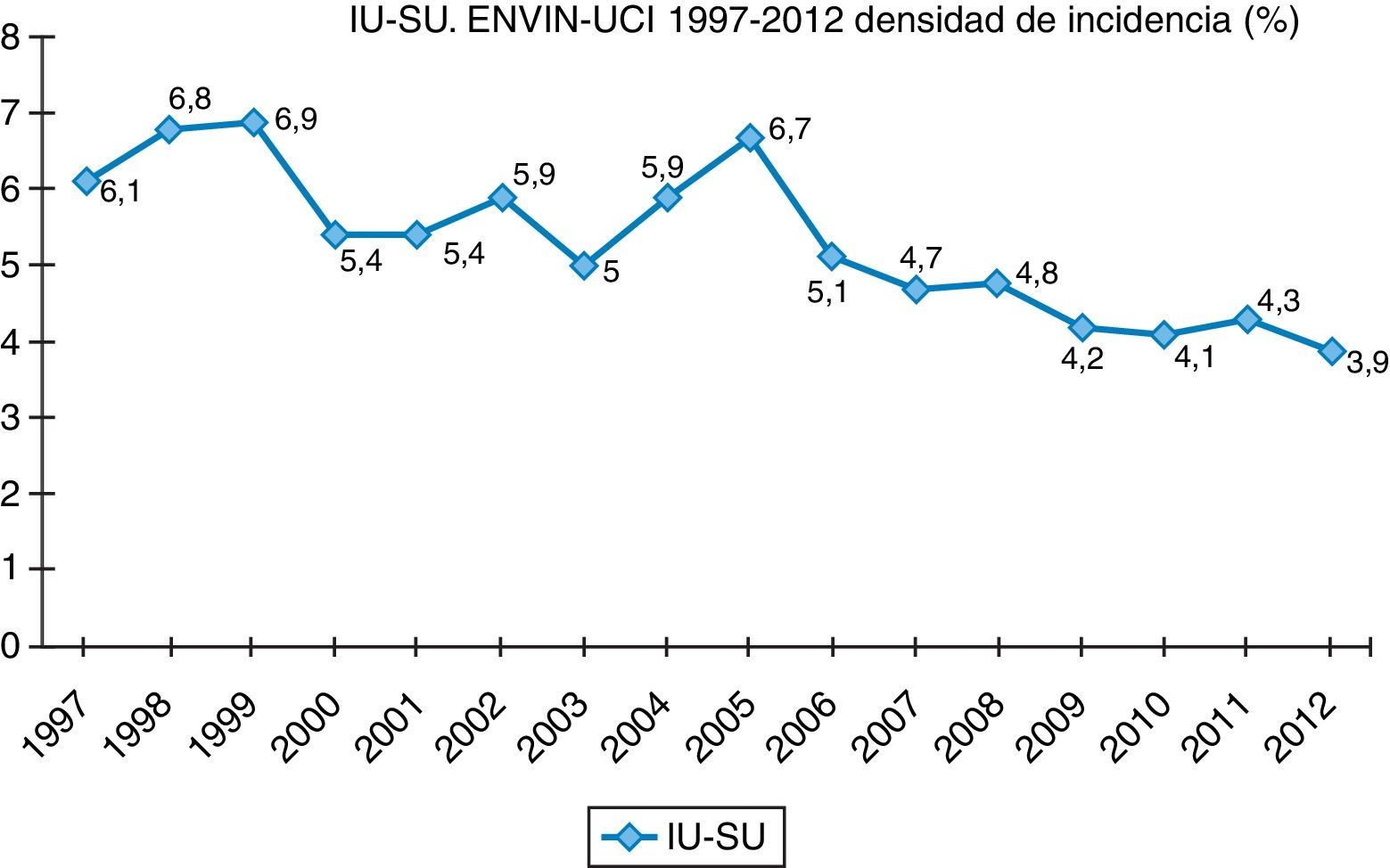
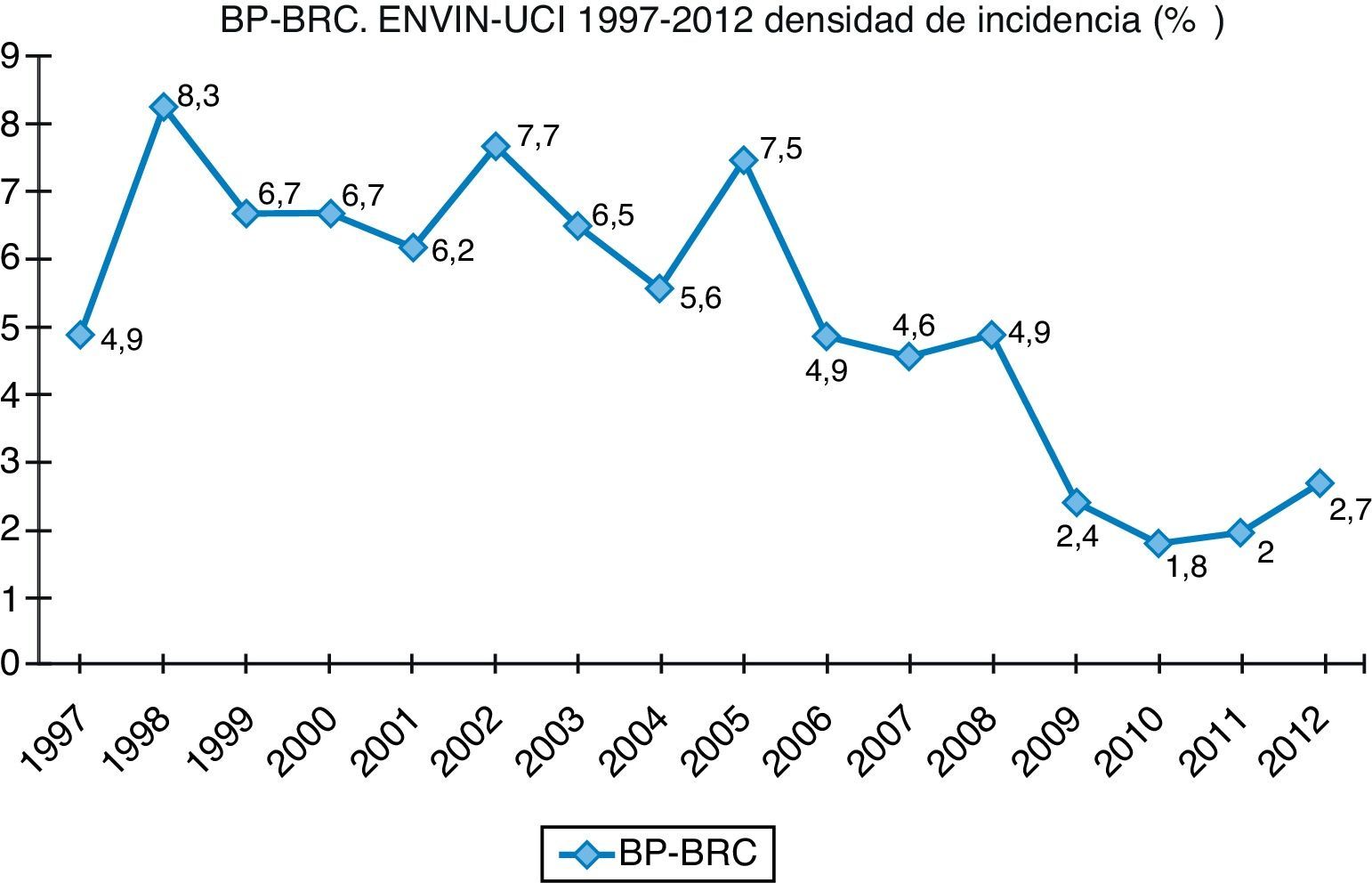
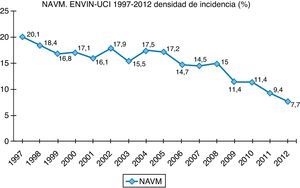
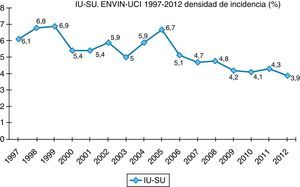
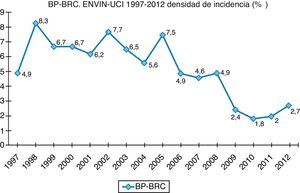
Finalmente, datos extraídos del registro ENVIN-UCI nacional han documentado globalmente que los pacientes que han adquirido alguna infección en la UCI han descendido paulatinamente: desde el 15,51% en 2009, el 11,30% en 2010, el 10,98% en 2011, al 10,24% en 2012. Si analizamos solo las infecciones asociadas a dispositivos controladas por ENVIN (neumonía, infección urinaria y bacteriemia), tan solo el 6,16% de pacientes ingresados sufrieron esta complicación en 2012, siendo la más frecuente de ellas la NAVM, que supuso el 33,53% de las infecciones controladas, seguida de la infección urinaria asociada a sonda urinaria (IU-SU) (30,51%) y de las bacteriemias primarias y relacionadas asociadas a catéteres (BP-BRC) (19%). Destaca la reducción espectacular de la tasa de NAVM a 7,27 episodios por 1.000 días de ventilación mecánica, así como el mantenimiento a la baja de las tasas de bacteriemias de origen desconocido y relacionada con catéter, 2años después de acabado oficialmente el proyecto BZ, situándose en 2,79 episodios por 1.000 días de catéter, ambas tasas en el año 2012. Por último, las infecciones urinarias asociadas a sonda urinaria se situaron en 3,94 por 1.000 días de dispositivo. En las figuras 1–3 se registra la evolución de estas tasas desde 1997 hasta 2012.
Un aspecto esencial de la epidemiología de las IN es el conocimiento de la etiología de estas infecciones y las modificaciones que pueden ocurrir en el tiempo en cada UCI en su flora local, elemento necesario para soslayar el tratar inadecuadamente a nuestros enfermos de forma empírica.
Si en algo coinciden tanto los estudios EPIC anteriormente citados como los programas de prevención y control de IN en la UCI, tanto el belga como el español, es en la descripción pormenorizada de la etiología tanto estudiada globalmente como por entidades vigiladas. En términos generales existe una predominancia de los microorganismos gramnegativos (55-65%), seguido de los microorganismos grampositivos (25-35%) y levaduras (10-20%)2,8-11.
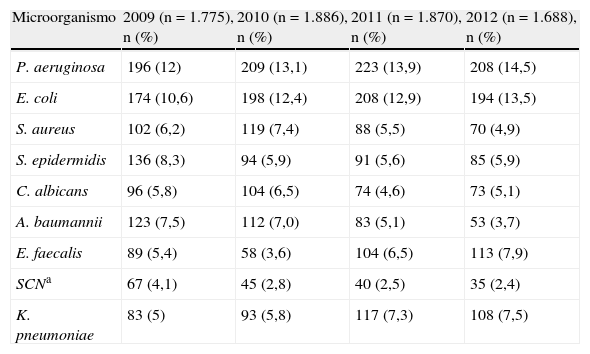
Centrándonos en el programa ENVIN-HELICS2 y al considerar los patógenos de forma individual, en el informe del año 2012 el primer lugar lo ocupa Pseudomonas aeruginosa (14,5%), seguido de Escherichia coli (13,5%), Enterococcus faecalis (7,9%), Staphylococcus epidermidis (5,9%), Klebsiella pneumoniae (7,5%) y, en sexto lugar, Candida albicans (5,1%). En la tabla 1 se describen los microorganismos más frecuentemente aislados en los últimos cuatro años.
Microorganismos aislados en las principales infecciones nosocomiales en cuidados intensivos (excluyendo bacteriemias secundarias) (ENVIN-UCI en el periodo 2009-2012)
| Microorganismo | 2009 (n=1.775), n (%) | 2010 (n=1.886), n (%) | 2011 (n=1.870), n (%) | 2012 (n=1.688), n (%) |
| P. aeruginosa | 196 (12) | 209 (13,1) | 223 (13,9) | 208 (14,5) |
| E. coli | 174 (10,6) | 198 (12,4) | 208 (12,9) | 194 (13,5) |
| S. aureus | 102 (6,2) | 119 (7,4) | 88 (5,5) | 70 (4,9) |
| S. epidermidis | 136 (8,3) | 94 (5,9) | 91 (5,6) | 85 (5,9) |
| C. albicans | 96 (5,8) | 104 (6,5) | 74 (4,6) | 73 (5,1) |
| A. baumannii | 123 (7,5) | 112 (7,0) | 83 (5,1) | 53 (3,7) |
| E. faecalis | 89 (5,4) | 58 (3,6) | 104 (6,5) | 113 (7,9) |
| SCNa | 67 (4,1) | 45 (2,8) | 40 (2,5) | 35 (2,4) |
| K. pneumoniae | 83 (5) | 93 (5,8) | 117 (7,3) | 108 (7,5) |
aStaphylococcus coagulasa negativo.
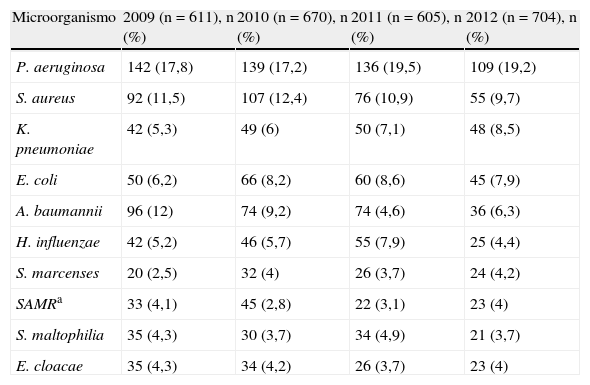
En lo que se refiere a la etiología de la NAVM (tabla 2), infección que representó el 33,5% del conjunto de las IN estudiadas en el año 2012, P.aeruginosa (19,2%) ocupó la primera posición, seguida por Staphylococcus aureus (9,7%) y K.pneumoniae (8,4%). Existen importantes variaciones etiológicas, pero dependen, entre otros factores como pudiera ser el uso de antibioterapia previa, de que la neumonía sea de aparición precoz (≤7días) o tardía (>7días). Así, mientras en las precoces domina S.aureus sensible a meticilina (SASM) (15,6% de las mismas), en las tardías lo hace P.aeruginosa (24,1% de las tardías). Si nos centramos en las que aparecen en los 4 primeros días, SASM sigue ocupando el primer puesto (15,6%), seguido de Haemophilus influenzae (13,8%). En la tabla 2 se describen las principales etiologías desde 2009 a 2012 de NAVM en el programa ENVIN-UCI, observándose un claro aumento de la incidencia de casos causados por K.pneumoniae y una disminución de los episodios por Acinetobacter baumanni.
Microorganismos predominantes en la neumonía asociada a ventilación mecánica (ENVIN-UCI en el periodo 2009-2012)
| Microorganismo | 2009 (n=611), n (%) | 2010 (n=670), n (%) | 2011 (n=605), n (%) | 2012 (n=704), n (%) |
| P. aeruginosa | 142 (17,8) | 139 (17,2) | 136 (19,5) | 109 (19,2) |
| S. aureus | 92 (11,5) | 107 (12,4) | 76 (10,9) | 55 (9,7) |
| K. pneumoniae | 42 (5,3) | 49 (6) | 50 (7,1) | 48 (8,5) |
| E. coli | 50 (6,2) | 66 (8,2) | 60 (8,6) | 45 (7,9) |
| A. baumannii | 96 (12) | 74 (9,2) | 74 (4,6) | 36 (6,3) |
| H. influenzae | 42 (5,2) | 46 (5,7) | 55 (7,9) | 25 (4,4) |
| S. marcenses | 20 (2,5) | 32 (4) | 26 (3,7) | 24 (4,2) |
| SAMRa | 33 (4,1) | 45 (2,8) | 22 (3,1) | 23 (4) |
| S. maltophilia | 35 (4,3) | 30 (3,7) | 34 (4,9) | 21 (3,7) |
| E. cloacae | 35 (4,3) | 34 (4,2) | 26 (3,7) | 23 (4) |
aStaphylococcus aureus resistente a meticilina.
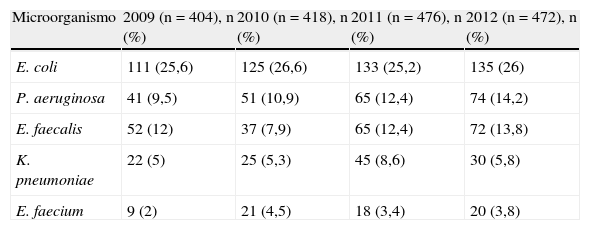
Las IU-SU representan el 30,5% del total de las infecciones investigadas en la UCI en el año 2012. En estas, E.coli fue con diferencia el primer agente etiológico, con el 26% de los casos, seguido a distancia por P.aeruginosa (14,6%) y E.faecalis. En la tabla 3 se describen las principales etiologías desde 2009 a 2012 de las IU-SU en el programa ENVIN-UCI, donde se muestra un incremento de las infecciones por P.aeruginosa.
Microorganismos predominantes en la infección urinaria asociada a sondaje uretral (ENVIN-UCI en el periodo 2009-1012)
| Microorganismo | 2009 (n=404), n (%) | 2010 (n=418), n (%) | 2011 (n=476), n (%) | 2012 (n=472), n (%) |
| E. coli | 111 (25,6) | 125 (26,6) | 133 (25,2) | 135 (26) |
| P. aeruginosa | 41 (9,5) | 51 (10,9) | 65 (12,4) | 74 (14,2) |
| E. faecalis | 52 (12) | 37 (7,9) | 65 (12,4) | 72 (13,8) |
| K. pneumoniae | 22 (5) | 25 (5,3) | 45 (8,6) | 30 (5,8) |
| E. faecium | 9 (2) | 21 (4,5) | 18 (3,4) | 20 (3,8) |
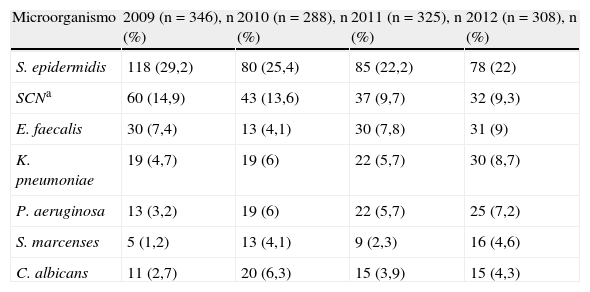
En las BP-BRC (el 19,6% del total de las infecciones) en el año 2012, el agente causal más frecuente es S.epidermidis (22,6%), seguido por Staphylococcus coagulasa negativos (9,28%) y E.faecalis (9%). En la tabla 4 se describen las principales etiologías desde 2009 a 2012 de las BP-BRC en el programa ENVIN-UCI, objetivándose un discreto aumento de los episodios por K.pneumoniae y un discreto descenso de los episodios causados por Staphylococcus coagulasa negativos.
Microorganismos predominantes en las bacteriemias primarias y relacionadas con catéter venoso central (ENVIN-UCI en el periodo 2009-1012)
| Microorganismo | 2009 (n=346), n (%) | 2010 (n=288), n (%) | 2011 (n=325), n (%) | 2012 (n=308), n (%) |
| S. epidermidis | 118 (29,2) | 80 (25,4) | 85 (22,2) | 78 (22) |
| SCNa | 60 (14,9) | 43 (13,6) | 37 (9,7) | 32 (9,3) |
| E. faecalis | 30 (7,4) | 13 (4,1) | 30 (7,8) | 31 (9) |
| K. pneumoniae | 19 (4,7) | 19 (6) | 22 (5,7) | 30 (8,7) |
| P. aeruginosa | 13 (3,2) | 19 (6) | 22 (5,7) | 25 (7,2) |
| S. marcenses | 5 (1,2) | 13 (4,1) | 9 (2,3) | 16 (4,6) |
| C. albicans | 11 (2,7) | 20 (6,3) | 15 (3,9) | 15 (4,3) |
aStaphylococcus coagulasa negativo.
Los microorganismos multirresistentes (MMR) se definen como aquellos microorganismos que son resistentes a una o más clases de antibióticos12, siendo necesario que esa resistencia tenga relevancia clínica (que pueda suponer una dificultad para el tratamiento) y epidemiológica (posibilidad de brotes epidémicos, transmisión del mecanismo de resistencia, etc.)13.
Entre los microorganismos grampositivos debemos considerar en las UCI: S.aureus resistente a la meticilina (SARM), más recientemente Enterococcus spp. resistente a vancomicina (ERV) —en nuestro país, aunque hace tiempo que se han descrito y se ha referenciado algún brote epidémico, los porcentajes de resistencia son actualmente inferiores al 5%—, y en los últimos años S.epidermidis resistentes a linezolid2,13.
Entre los microorganismos gramnegativos, enterobacterias productoras de betalactamasas de espectro extendido (BLEE), también con una incidencia creciente, y bacilos gramnegativos (BGN) no fermentadores, como A.baumannii o P.aeruginosa resistentes a distintos grupos de antimicrobianos son el objeto de la vigilancia2,13.
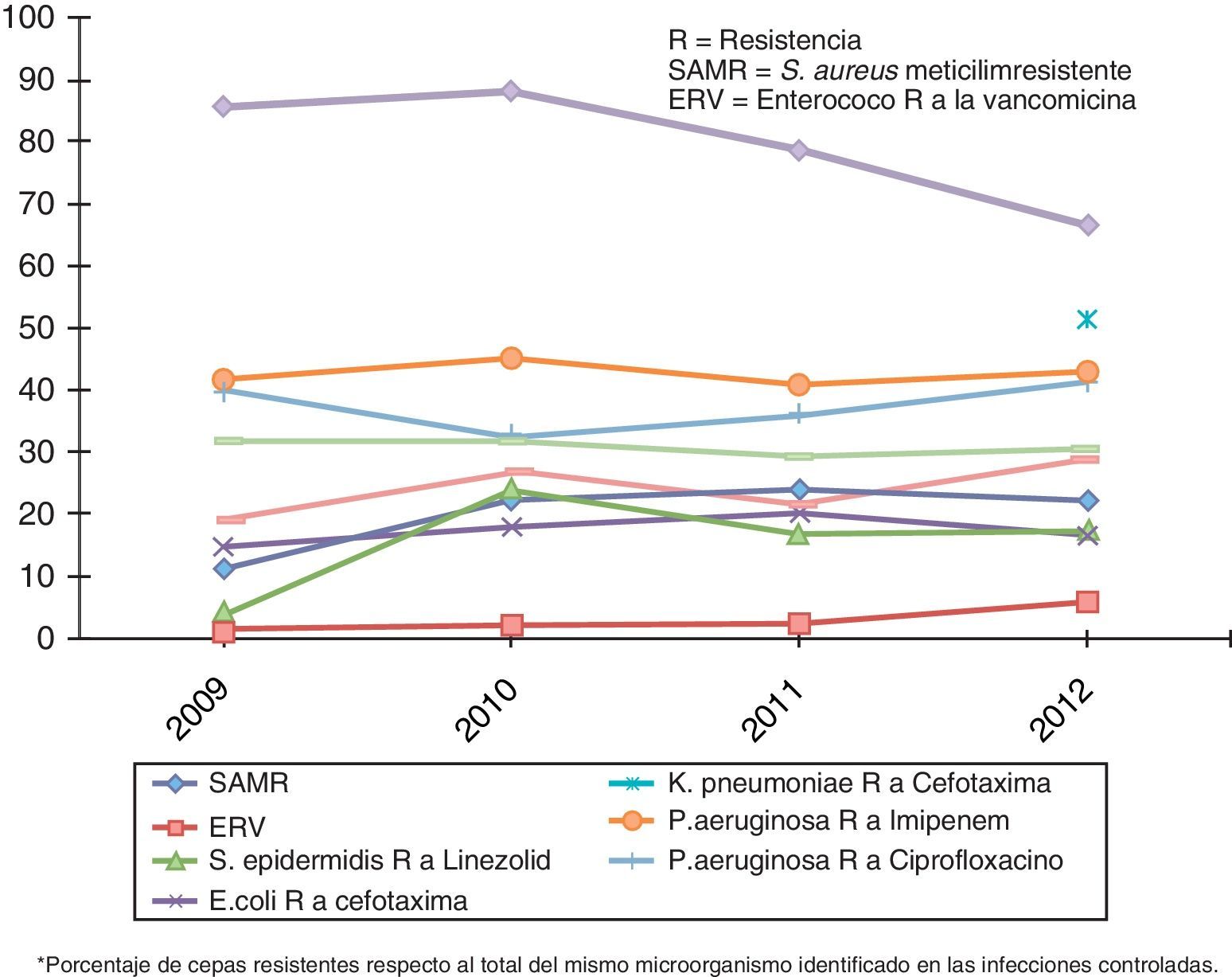
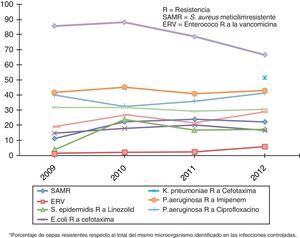
La evolución global de la multirresistencia, tomados los datos del ENVIN-UCI del periodo 2009-2012, se expone en la figura 4. El constante incremento de la multirresistencia debe impulsar la búsqueda de nuevas opciones terapéuticas de mayor efectividad y seguridad, al tiempo que se necesita un estrecho seguimiento del perfil de sensibilidad-resistencia de los agentes etiológicos frente a los antimicrobianos que se van incorporando13.
Principales entidades de la infección nosocomial en el paciente críticoPrevisiblemente las principales entidades en la IN del paciente crítico se asocian al uso de un dispositivo invasivo concreto o a la realización de alguna práctica diagnóstica o terapéutica. A continuación revisaremos los aspectos más importantes de dichas entidades.
Neumonía asociada a la ventilación mecánicaDebemos distinguir 2 formas de presentación de la NAVM: aquella con un claro inicio (propia de la NAVM precoz [≤4días desde el inicio de la ventilación mecánica] y debida al inóculo bacteriano implantado en el acto de la intubación) y aquella con un curso relativamente insidioso en el que los signos y síntomas definitorios de NAVM se suman a lo largo de varios días (propia de la NAVM tardía: >4días desde el inicio de la ventilación mecánica)14,15. La presencia del tubo endotraqueal (TET) y la ventilación mecánica propician la colonización de la vía aérea por bacterias potencialmente patógenas. La reacción del sistema inmune se traduce en la aparición de signos y síntomas tales como el aumento de la secreción bronquial e incluso la purulencia de la misma, la fiebre o la leucocitosis. Si la respuesta inmune no logra frenar el avance bacteriano, los signos y síntomas progresarán y, finalmente, la afectación del parénquima podrá visualizarse en una radiografía de tórax. A modo de convención se ha establecido que el diagnóstico de NAVM requiere de la presencia de al menos 2 signos (purulencia de las secreciones, fiebre o hipotermia y leucocitosis o leucopenia) junto a la aparición de una opacidad en la radiografía de tórax15. Sin embargo, está adquiriendo cada vez más consistencia la idea de que ese proceso previo al cumplimiento de los requisitos diagnósticos es merecedor de nuestra atención e incluso de la instauración de un tratamiento antibiótico. En esta línea se situaría la traqueobronquitis asociada a la ventilación mecánica (TAVM)16. De hecho, aunque la evidencia es por el momento escasa, los pacientes con TAVM parecen beneficiarse —en términos de mortalidad— de la instauración de un tratamiento antibiótico correcto17.
Una vez establecida la sospecha clínica, se exige la confirmación microbiológica. Dada la elevada frecuencia de colonización aérea, resulta conveniente basar el diagnóstico de NAVM en un cultivo cuantitativo (cuyo umbral diagnóstico dependerá del tipo de muestra analizado: 103 en el mini lavado alveolar, 104 en el lavado alveolar y 105 en el aspirado bronquial)15. Sin embargo, el cultivo cuantitativo también puede verse interferido por diversos factores, como el uso previo de antibióticos o la exactitud en la zona pulmonar en la que se obtuvo la muestra18. Por todo lo anterior, el diagnóstico de la NAVM (más allá del cumplimiento estricto de unos criterios de interés fundamentalmente epidemiológico o investigacional) se mueve en un abanico de claroscuros en el que debe prevalecer la capacidad clínica del médico asistencial para la correcta indicación de un tratamiento antibiótico.
En nuestro medio la etiología más frecuente es P.aeruginosa (19,26% de todos los episodios de NAVM recogidos en el ENVIN), seguida de una gran diversidad de bacterias grampositivas y gramnegativas. En cualquier caso, el orden en frecuencia de los diversos microorganismos en la NAVM estará muy influido por la epidemiología local2,4.
El esquema terapéutico para la NAVM más aceptado incluye una quinolona o amoxicilina-clavulánico o cefalosporina no antipseudomónica en la NAVM precoz (siempre que el paciente no tenga factores de riesgo para bacterias multirresistentes) y una combinación de cefalosporina antipseudomónica junto a un aminoglucósido o una quinolona en la NAVM tardía. La existencia de una situación clínica o epidemiológica particular que haga prever la presencia de microorganismos no cubiertos por esta estrategia (A.baumannii, enterobacterias productoras de BLEE, SARM, etc.) deberá motivar la valoración del uso de otros antibióticos15.
Infección del tracto urinario asociada a sonda vesicalComo se ha comentado anteriormente, la infección del tracto urinario asociada a sonda vesical (IU-SU) es la segunda IN en frecuencia en el registro ENVIN (30,51% de todas las infecciones registradas), con una densidad de incidencia (DI) de 3,93 episodios por 1.000 días de sonda vesical4. A pesar de que la cifra es aparentemente correcta, prácticamente dobla a la DI recogida en el registro de los CDC (2 episodios por 1.000 días de sonda)19.
Es factible que un diagnóstico basado en la presencia de signos inflamatorios sistémicos junto a un cultivo urinario cuantitativo (>100.000ufc/ml) haya determinado un sobrediagnóstico de esta entidad. En una situación tan compleja como el paciente crítico es recomendable acogerse a criterios diagnósticos más exigentes que exigen la presencia de un sedimento urinario patológico; incluso hay autores que abogan por reconocer a la IU-SU como responsable de la sepsis solo cuando exista una bacteriemia acompañante.
Con respecto a la etiología son los BGN, fundamentalmente Enterobacteriaceae, los microorganismos que con más frecuencia se relacionan con las ITUS. Especial mención merece el género Enterococcusspp., bacteria denostada por su naturaleza de comensal del tracto gastrointestinal (al igual que la mayoría de las enterobacterias) pero que cada vez está adquiriendo mayor relevancia como responsable de IN fundamentalmente de foco abdominal. El uso previo de antibióticos (sobre todo cefalosporinas) es un factor de riesgo para la selección de esta bacteria, sobre todo en su especie E.faecium, habitualmente resistente a la ampicilina4.
El tratamiento de la ITUS dependerá del estado clínico del paciente y del riesgo de bacterias multirresistentes. Si el paciente está en sepsis grave o shock séptico, o si existen factores de riesgo para la presencia de bacterias multirresistentes, el tratamiento de elección será un carbapenem±aminoglucósido; en ausencia de las 2 premisas anteriores el paciente podrá ser tratado con un betalactámico no antipseudomónico o con fosfomicina.
Bacteriemia asociada a catéter vascularLa presencia del catéter vascular supone la posibilidad de la entrada de las bacterias directamente en el torrente sanguíneo. El frecuente uso de catéteres venosos centrales en el paciente crítico determinaría un paso directo a la circulación sistémica.
La bacteriemia relacionada con catéter (BRC) es la tercera IN en frecuencia en el registro ENVIN (10,07% de todas las IN), con una DI en 2012 de 1,42 BRC por 1.000días de uso de catéter4. Esta encomiable baja cifra de DI es el resultado de un exitoso programa nacional de prevención de la BRC (BZ)20. Al igual que otras infecciones asociadas a dispositivos, la BRC puede deberse a un déficit de esterilidad en el momento de la colocación del catéter o a una colonización del mismo a lo largo de su uso (mediatizado por el desarrollo de una biopelícula exo o endoluminal) con una eventual transformación a infección.
La principal dificultad diagnóstica de la BRC no radica en la identificación de la infección sino en la atribución al catéter de su responsabilidad en la misma. Ante hemocultivos procedentes de venopunción y catéter positivos al mismo microorganismo, el catéter podrá ser responsabilizado si su cultivo mediante técnica de Maki ofrece un recuento superior a 15ufc o superior a 100ufc si la pieza es sometida a sonicación21. No obstante, resulta de mayor interés asistencial la atribución de la infección al catéter sin que sea necesaria su retirada (precisamente por si es evitable). En este caso la técnica diagnóstica de elección es el hemocultivo cuantitativo que arroje un mayor inóculo en la muestra obtenida a través del catéter. Sin embargo, esta técnica no está disponible en la mayoría de laboratorios y ha podido ser exitosamente sustituida por la observación del tiempo de crecimiento de los hemocultivos; en caso de que el hemocultivo procedente de catéter se positivice al menos 2h antes que el obtenido por venopunción podremos considerar que estamos frente a una BRC22. Esta maniobra diagnóstica es aplicable a las BRC pero no a las candidemias relacionadas con catéter23.
Aunque los BGN han aumentado su cuantía en las BRC, esta infección sigue siendo causada fundamentalmente por cocos grampositivos, especialmente Staphylococcus del grupo coagulasa negativo (SCN)21. Sin embargo, la BRC por SCN tiene mayor dificultad diagnóstica por ser este un microorganismo especialmente vinculado a la colonización del catéter y a la contaminación de las muestras sanguíneas, de modo que será necesaria una mayor perspicacia clínica. Además, los SCN vinculados a BRC son en su mayoría resistentes a la meticilina y en una proporción creciente (20% en el registro ENVIN) al linezolid4.
En el tratamiento empírico de una supuesta BRC recomendamos una actitud modulada por el estado clínico del paciente. En caso de sepsis grave o shock séptico se retirará el catéter y el paciente será tratado con una combinación de daptomicina+betalactámico antipseudomónico o vancomina+cloxacilina+aminoglucósido. En ausencia de sepsis grave o shock séptico podremos contemporizar la retirada del catéter (se recomienda la toma de una torunda de la zona de entrada del catéter, de modo que la ausencia de microorganismos en la tinción de Gram ofrecerá un elevado valor predictivo negativo para el diagnóstico de BRC) y tratar al paciente con vancomicina o daptomicina21. Obviamente, el tratamiento antibiótico deberá ajustarse a los resultados microbiológicos.
Colitis pseudomembranosa. Infección por Clostridium difficileLa colitis pseudomembranosa por C.difficile en nuestro medio no supone un problema de la envergadura epidemiológica existente en otros países. Sin embargo, la aparición de esta complicación en un paciente ya de por sí crítico puede tener drásticas consecuencias en cuanto a morbimortalidad24.
Tras la detección de la toxina en heces deberemos instaurar el correspondiente tratamiento antibiótico. Si bien las opciones terapéuticas de primera línea siguen siendo el metronidazol oral, la vancomicina oral o una combinación de ambos, la existencia de otras alternativas aparentemente más eficaces (en el paciente crítico los tratamiento clásicos se asocian a una tasa de recurrencia del 13%) quizá determinará en el futuro un cambio del algoritmo terapéutico25. La fidaxomicina ha mostrado una mayor eficacia que el tratamiento estándar y una menor tasa de recurrencia26. Otras medidas, como el trasplante fecal, requieren una infraestructura que hace difícil su aplicación en nuestro medio27.
Otras infecciones nosocomialesLa ventriculitis asociada a los drenajes ventriculares externos (VADVE) es una grave complicación relacionada con estos dispositivos. Su incidencia varía enormemente entre las diversas series (4-25%), probablemente debido a la elección de distintos criterios diagnósticos. Si bien es cierto que la detección de un cultivo positivo de líquido cefalorraquídeo (LCR) en un contexto infeccioso (fiebre y/o leucocitosis) y/o de mayor disfunción neurológica se acepta como diagnóstico de VADVE, todos los signos y síntomas enumerados son inespecíficos en un paciente neurocrítico y el cultivo positivo puede reflejar una mera colonización/contaminación. Por ello, algunos autores han añadido el requisito de una citobioquímica alterada en el LCR, mejorando así la especificidad del algoritmo diagnóstico28.
Aunque las bacterias grampositivas siguen siendo la etiología más frecuente de las VADVE, los BGN están aumentando progresivamente su relevancia. Además de un tratamiento antibiótico sistémico adecuado (e incluso la asociación de un antibiótico intratecal), el correcto manejo de la VADVE requiere la retirada o el recambio de los drenajes ventriculares externos (DVE) implicados en la infección28.
La infección de la herida quirúrgica es una compleja entidad que escapa a los objetivos de esta revisión. Son múltiples los factores implicados en su etiopatogenia, incluyendo factores modificables y otros difícilmente alterables que son inherentes al paciente o al tipo de cirugía. En función de la profundidad alcanzada por la infección podemos distinguir afecciones superficiales o profundas. Además de un tratamiento antibiótico sistémico adecuado será necesaria la revisión quirúrgica y la retirada de tejido desvitalizado cuando sea preciso.
Estrategias de prevención y control de la infección nosocomialLa primera medida para evitar las IN asociadas al uso de dispositivos invasivos es la retirada del dispositivo en cuanto este no sea necesario. En segundo lugar debemos aplicar estrictamente las medidas habituales sobre el lavado de manos y la asepsia en la colocación y manipulación del dispositivo invasivo. Una vez hemos comprobado que el dispositivo es inevitable y que la política general de control de la IN se aplica correctamente, deberemos dirigir nuestros esfuerzos a aplicar medidas preventivas específicas para cada dispositivo. Habitualmente las medidas preventivas se aplican a modo de paquetes que engloban recomendaciones universales de asepsia y recomendaciones específicas cuya evidencia científica nunca supera a las medidas básicas de control de la IN. A continuación resumimos las medidas preventivas específicas para las principales IN.
Neumonía asociada a la ventilación mecánica. Tubo endotraquealSecreciones del espacio subglóticoLas secreciones procedentes de la orofaringe y del tracto gastrointestinal se acumulan en el espacio subglótico e inevitablemente se colonizan por bacterias. El paso de estas secreciones a la vía aérea inferior se ha relacionado con el desarrollo de NAVM. Las actuaciones sobre dichas secreciones se han basado en disminuir su producción, su eliminación, su descontaminación o en dificultar su entrada al árbol bronquial.
• Postura del enfermo. La posición semiincorporada dificultaría el reflujo de las secreciones del tracto gastrointestinal y su acumulación en el espacio subglótico. Basados en esta hipótesis, diversos estudios han demostrado una menor incidencia de NAVM al mantener la posición semiincorporada29.
• Aspiración de secreciones del espacio subglótico. Probablemente sea la medida preventiva con mayor evidencia científica. El uso de TET con un canal de aspiración abierto al espacio subglótico que permite la aspiración intermitente o continua ha demostrado una clara reducción de la incidencia de NAVM29.
• Descontaminación de las secreciones subglóticas. Este objetivo es alcanzable mediante el uso de antibióticos no absorbibles (orofaríngeos±digestivos) o de desinfectantes. En ambos casos se ha observado un beneficio en cuanto a incidencia de la NAVM e incluso —en el caso de los antibióticos— de la mortalidad. Sin embargo, las dudas sobre un posible efecto deletéreo (sobre todo en las unidades con elevada prevalencia de MMR) han dificultado su uso generalizado29.
• Entrada al árbol bronquial. Aunque es escasa la evidencia científica, es evidente que el mantenimiento de una correcta presión del neumotaponamiento (entre 20 y 30cmH2O) dificultará el paso de las secreciones hacia las vías respiratorias inferiores. Múltiples neumotaponamientos han sido diseñados para evitar la formación de pliegues que permiten la entrada de secreciones, aunque hasta el momento ninguno de ellos ha demostrado un claro impacto en la incidencia de NAVM29.
En relación con las secreciones subglóticas pero por su participación en el inóculo antes de la intubación o durante la misma, existe un trabajo que demuestra una menor incidencia de NAVM si los pacientes que han sido intubados en situación de coma reciben 2 o 3 dosis de antibiótico profiláctico. En el proyecto Neumonía Zero se recogen todas estas medidas preventivas a modo de paquete que ha sido implantado en la mayoría de las UCI del territorio nacional dando lugar a una contundente y mantenida disminución de la DI de NAVM.
BiopelículaSobre la superficie de cualquier dispositivo invasivo los microorganismos se adhieren y forman una biopelícula en la que quedan resguardados del efecto del antibiótico y desde la que pueden actuar como fuente o reservorio de infección. En el caso del TET se ha demostrado una concordancia microbiológica entre la biopelícula y la NAVM y un mayor porcentaje de falta de respuesta en aquellas NAVM en las que, a pesar del tratamiento antibiótico, el microorganismo responsable persiste en el seno de la biopelícula. Por ello se han diseñado TET con una cubierta de plata que dificulta la adherencia bacteriana; los resultados clínicos son poco contundentes y por tanto la eficiencia del dispositivo es discutible. Otra rama de prevención es el afeitado de la biopelícula mediante una herramienta diseñada a tal fin; aunque sí logra eliminar la biopelícula, aún no existen datos que lo relacionen con un beneficio clínico29.
Infección del tracto urinario asociada a sondaEl sistema de drenaje de la orina debe ser cerrado, toda transgresión del sistema supondrá un mayor riesgo de ITUS y, por tanto, deberá evitarse o realizarse de la forma más aséptica posible. No existen datos que evalúen la utilidad en el paciente crítico de sondas impregnadas en sustancias antisépticas30.
Bacteriemia relacionada con catéterEn esta entidad es aún más evidente que los mayores beneficios proceden de la aséptica colocación y mantenimiento del catéter y de prescindir del mismo en cuanto sea posible. El acceso venoso subclavio se asocia en menor medida a la infección que otras localizaciones, tales como la yugular y sobre todo la femoral. En un estudio multicéntrico en el que participaron la mayoría de UCI de España se logró implantar un paquete de medidas (en la implantación del catéter: higiene adecuada de manos, desinfección de la piel con clorhexidina, máximas medidas de barrera y preferencia de la localización subclavia junto al manejo estéril del catéter y la retirada del mismo en cuanto no fuera necesario) y su correspondiente monitorización; todo ello permitió disminuir drásticamente la DI de BRC y además propiciar el asentamiento de una cultura de seguridad en las UCI que ha beneficiado a otras IN20. Otras medidas, como los catéteres recubiertos de plata, antisépticos o antibióticos, o el uso de apósitos que liberan clorhexidina, deberán considerarse individualmente o en caso de que tras el cumplimiento de las medidas básicas persista una DI de BRC elevada.
Ventriculitis asociada a drenajes ventriculares externosAunque con una evidencia científica de escaso grado, está bastante extendido el uso de DVE impregnados en antibióticos (habitualmente anti-grampositivos). Aunque algunos autores defienden el recambio periódico profiláctico de los DVE, no existen estudios que demuestren la utilidad de esta agresiva recomendación de forma independiente al cumplimiento de las medidas básicas de manejo aséptico del DVE31.
Impacto de las infecciones nosocomiales en el paciente críticoLas IN en las UCI conllevan un destacado impacto en términos de mortalidad y costes hospitalarios. Este hecho ha sido constatado, como desarrollaremos a continuación, en especial en el caso de las NAVM, las BP-BRC y/o la etiología por MMR2.
Si bien es un tema discutido en la literatura32, debido a los distintos tipos de pacientes estudiados, parece estar demostrado que los episodios de NAVM conllevan una mayor mortalidad, especialmente en aquellos episodios que reciban un tratamiento empírico antibiótico inadecuado33, en determinadas etiologías34, entre ellas las causadas por P.aeruginosa35, las que se desarrollan tardíamente y no las precoces36. Un reciente metaanálisis37 publicado en 2013, que incluye 24 ensayos clínicos que estudian prevención, encuentra una mortalidad atribuible para NAVM del 13%, siendo las tasas mayores en los pacientes quirúrgicos y en aquellos con gravedad moderada.
Parece evidente que la NAVM se asocia a mayores costes hospitalarios, con claro aumento de la estancia hospitalaria2, representando, según un estudio alemán retrospectivo también publicado en al año 2013, un coste atribuido por episodio de 17.015euros y una estancia media de 36días, con una estancia mayor atribuida de 9días38. Asimismo, y dentro de los costes asociados a un episodio de NAVM, el cumplimiento de las guías de manejo y tratamiento en el paciente afecto conlleva una menor estancia y menor coste hospitalario que en aquellos que no siguieron las mismas39.
Un estudio de casos-controles con datos extraídos del registro ENVIN-UCI demostró en pacientes críticos que la adquisición de una BP-BRC produjo un significativo incremento de la mortalidad y la estancia. La mortalidad atribuible fue del 9,4%. El riesgo de muerte varía de acuerdo con la fuente de la infección, la etiología, el momento de aparición de la bacteriemia y la gravedad al ingreso en la UCI. Los pacientes que sobrevivieron y sufrieron una BP-BRC tuvieron además una estancia en la UCI 13días de mediana más prolongada que los controles, variando también según la etiología, el momento de aparición de la bacteriemia y la gravedad al ingreso en la UCI40. Estos datos han sido corroborados por otro estudio publicado recientemente41.
La IN por MMR se asocia a retraso en el inicio de una terapia adecuada y a fracaso terapéutico. Como consecuencia, prolonga la estancia hospitalaria y aumenta los costes y la mortalidad. Existe información científica sobre la responsabilidad de los MMR en el tratamiento antibiótico empírico inadecuado y en el retraso del inicio de un tratamiento correcto, lo que puede llevar a duplicar la mortalidad, hecho que parece ampliamente demostrado13,42. Al centrarnos en la influencia sobre la mortalidad de diferentes MMR, los más estudiados han sido: SAMR, P.aeruginosa, A.baumanni y las enterobacterias productoras de BLEE, si bien por sí mismos los resultados han sido dispares13. Asimismo, la infección por un MMR, comparada con la causada por uno sensible, incrementa los costes entre 5.000 y 25.000dólares, según datos de un estudio americano43.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Sirva este trabajo para honrar la memoria de la Dra. María Jesús López Pueyo, nuestra Chus, que dedicó gran parte de su vida al estudio de la infección nosocomial, siendo una de las figuras más destacadas en el registro ENVIN-UCI en la última década. Es, ha sido y será una figura de referencia y gran relevancia en nuestros corazones.
Nota: sección acreditada por el Consell Català de Formació Continuada de les Professions Sanitàries. Consultar preguntas de cada artículo en: http://www.eslevier.es/eimc/formacion.