La infección urinaria (IU) nosocomial se relacionafundamentalmente con la utilización de la sonda urinaria (SU). En este capítulo se repasan los mecanismos patogénicos por los cuales los microorganismos alcanzan el tracto urinario, así como la capacidad de adhesion y de formación de biopelículas, lo cual depende tanto del microorganismo como del tipo de SU. En la etiología de la IU del paciente sondado intervienen multiples microorganismos, lo cual dificulta la elección de un tratamiento empírico adecuado, especialmente si se sospecha infección por microorganismos multirresistentes. En el sondado las manifestaciones clínicas son menos características y el diagnóstico, a menudo, difícil. La terapia deberá estratificarse según el tipo de IU; mientras la bacteriuria asintomática no requiere habitualmente de tratamiento, en el paciente con shock séptico la cobertura deberá ser amplia. Se efectúa, asimismo, un amplio repaso de las medidas preventivas. Las infecciones del tracto genital relacionadas con dispositivos protésicos se han asociado fundamentalmente a la utilización de dispositivos intrauterinos (DIU). En este apartado se repasa la epidemiología, la etiología, el tratamiento y la prevención de las infecciones asociadas a la utilización de DIU.
Hospital-acquired urinary tract infections (UTI) are mainly associated with indwelling urinary catheter use. In this chapter, the pathogenesis of hospital-acquired UTI in catheterized patients, the mechanisms by which microorganisms reach the urinary tract and are able to adhere and form biofilms, and the influence of other risk factors, such as time since catheter insertion and catheter composition, are reviewed. A wide variety of infecting microorganisms can affect patients with urinary catheters, making the choice of an adequate empirical antimicrobial course complex, particularly in cases of suspected multiresistant microorganisms. Moreover, the clinical symptoms are less characteristic in catheter infection and the diagnosis may be difficult. Treatment should be stratified according to the clinical features, which can vary from asymptomatic bacteriuria that may not require treatment, to severe septic episodes that need wide antibiotic coverage. The prevention measures for UTI in permanently catheterized patients are reviewed. Infections of the female genital tract associated with foreign bodies are mainly related to the use of intrauterine devices (IUDs). The epidemiology, microbiology profile, antimicrobial treatment, and prophylaxis of pelvic inflammatory disease related to IUD use in women are also reviewed.
Las infecciones urinarias (IU) en pacientes portadores de sondas urinarias (SU) constituyen un problema de salud pública, por su frecuencia y morbilidad (son una de las causas más usuales de bacteriemia nosocomial) tanto en el hospital como en centros de larga estancia1–3. Por otro lado, los pacientes portadores de SU son un importante reservorio de microorganismos multirresistentes, entre los que se incluyen los bacilos gramnegativos productores de betalactamasas de espectro extendido (BLEE) en el hospital y en la comunidad4–6, lo cual dificulta su tratamiento empírico si la IU es grave.
La IU nosocomial está relacionada con la presencia de una SU en más del 80% de los casos y el resto con otras manipulaciones genitourinarias tales como cirugía urológica. Actualmente, entre el 15 y el 20% de los pacientes atendidos en nuestros hospitales son portadores de SU, y la IU sigue siendo la causa más frecuente de IU nosocomial, aunque su frecuencia ha disminuido en los últimos años, con la generalización de los sistemas de drenaje urinario cerrados, desde porcentajes del 40% a los actuales del 20-25%.
La prevalencia de pacientes con SU en la comunidad se ha estimado entre 0,02 y el 0,07%, porcentaje que aumenta al 4% en población anciana asistida, hasta el 20% de internos en residencias geriátricas y es superior al 35% si existe incontinencia urinaria asociada7. En este colectivo, la IU es una de las causas más frecuentes de fiebre y el riesgo de bacteriemia es 60 veces superior al de los pacientes no cateterizados7. Además, en nuestro país se estima una incidencia de 12 a 20 nuevos lesionados medulares por año, de los cuales el 15% lleva SU 5 años después del accidente, y una proporción importante utiliza la cateterización intermitente. Por último, un porcentaje desconocido de pacientes es portador transitorio de una SU.
Desde un punto de vista práctico, tiene interés dividir la cateterización en corta duración y cateterismo permanente si la duración de la misma es superior a los 30 días.
Cateterismo de corta duraciónLos pacientes hospitalizados son portadores de una SU una media de 2-4 días. La IU suele ser monomicrobiana y la incidencia de bacteriuria asintomática (BA), definida como la presencia de un urocultivo positivo (> 105 unidades formadoras de colonias [ufc]/ml) en ausencia de síntomas urinarios, e IU sintomática se relaciona fundamentalmente con la duración de la cateterización. Con un sistema de drenaje abierto, la incidencia de BA es del 100%, mientras que con un sistema de drenaje cerrado oscila entre el 3 y el 6% por día1 y es aproximadamente del 50% a las 2 semanas7. En los pacientes con BA, la incidencia de IU sintomática es de alrededor del 10% y la de bacteriemia se encuentra entre el 0,5% y el 5%7–9, la cual se asocia fundamentalmente con la presencia de obstrucción urinaria o a hemorragia tras el recambio traumático de la SU7,10. En las unidades de cuidados intensivos la incidencia de IU sintomática oscila entre 3,9 y 8,9 casos por 1.000 días de cateterización11. La IU relacionada con la SU parece aumentar la mortalidad, aunque este factor ha sido poco estudiado y, sin duda, incrementa los costes sanitarios12.
Otros factores asociados con un riesgo superior de BA son el sexo femenino, la edad superior a los 50 años, la diabetes mellitus y la insuficiencia renal, el ingreso en un servicio de traumatología o urología (probablemente por un riesgo superior a padecer una uropatía obstructiva o un catéter ureteral), la contaminación de la bolsa recolectora, la ausencia de un urinómetro, la colonización periuretral por uropatógenos, las desconexiones inadvertidas o erróneas del sistema de drenaje cerrado, el hecho de que la bolsa recolectora esté por encima del nivel de la sonda urinaria y una técnica no estéril en el momento de insertar la sonda7,9. Por el contrario, la administración de antibióticos sistémicos o en la bolsa recolectora disminuye la incidencia de bacteriuria durante los primeros días, pero a expensas de una mayor colonización por bacterias resistentes7,9.
Cateterismo permanenteEn los pacientes con SU permanente, la IU sintomática, definida como la presencia de fiebre no atribuible a otra causa, se ha estimado entre 6 y 11 episodios por 1.000 días de cateterización en ancianos institucionalizados y de 2 a 3,4 episodios en pacientes con asistencia domiciliaria7,13. El riesgo de bacteriemia durante el episodio febril oscila entre el 10 y el 24% y puede llegar a ser 60 veces superior al del paciente no sondado. La IU sintomática se ha relacionado con la obstrucción de la sonda, los recambios traumáticos de la misma, la piuria intensa (> 50 leucocitos por campo) y la BA por Serratia marcescens1.
Las complicaciones a largo plazo de la SU permanente son la obstrucción de la sonda (el 50% de los casos), que es más frecuente en pacientes con orinas alcalinas13, la hematuria macroscópica (el 30% casos) y un mayor riesgo de pielonefritis crónica, epididimitis, prostatitis, absceso prostático, litiasis vesical o renal y de cáncer vesical1,7,13.
En los lesionados medulares, la cateterización intermitente es una alternativa que se asocia a menores tasas de IU sintomática, estimada en cuatro episodios por 1.000 días de sondaje14.
PatogeniaLos microorganismos pueden alcanzar la vejiga urinaria por tres mecanismos: a) durante la inserción del catéter, que ocurre sobre todo en pacientes ancianos con colonización uretral por uropatógenos; b) por vía intraluminal, a través de la luz de la sonda, bien por rotura del sistema de drenaje cerrado a nivel de las conexiones o por vía ascendente a partir de la bolsa recolectora, y c) por vía exoluminal, a través del espacio entre la SU y la uretra, mecanismo más frecuente en la mujer por el hecho de poseer la uretra más corta y ancha. Esta última vía cobra importancia a partir de la primera semana de sondaje; las diferentes medidas preventivas inciden sobre estos tres mecanismos.
En la patogenia de la IU asociada a la SU son fundamentales dos factores, la adhesión y la capacidad de formación de una biopelícula o biofilm, lo cual depende tanto del microorganismo como del tipo de SU3. En este sentido, los catéteres de silicona o recubiertos de hidrogel son más resistentes a la fijación de las bacterias que los de goma o látex; además, se ha observado que las SU recubiertas de plata, por sus propiedades bactericidas, o con lecitina, que convierte la superficie del catéter en hidrofóbica, retrasan la adhesión bacteriana3,15. Por otro lado, la presencia de flagelos y la motilidad de la bacteria son factores importantes para la adhesión bacteriana.
Una vez adheridas, las bacterias secretan una serie de polisacáridos formando una matriz extracelular llamada glucocálix o biofilm, en 3-7 días. En el interior del biofilm, el crecimiento bacteriano es más lento, probablemente por la falta de oxígeno y nutrientes y las bacterias se vuelven más resistentes a la acción de los antimicrobianos, bien por dificultar la penetración de los mismos, bien porque las bacterias presentes en el interior del biofilm tienen una menor capacidad de división (fase estacionaria) y, por tanto, los antibióticos que actúan sobre la pared bacteriana, como los betalactámicos, perderán actividad. Como consecuencia, el tratamiento antibiótico de una IU asociada a una SU, no erradica la bacteria del biofilm, lo cual facilitará las recidivas. En un estudio prospectivo y aleatorizado reciente, se ha demostrado que el recambio de la SU es eficaz en la prevención de las recidivas en pacientes con IU sintomática tratada con antimicrobianos16.
Por otro lado, determinados microorganismos, fundamentalmente Proteus spp. y otras especies de Proteeae, pero también bastantes cepas de Klebsiella pneumoniae, Pseudomonas aeruginosa, S. marcescens y Corynebacterium urealyticum, por la acción de ureasas bacterianas, tienen la capacidad de hidrolizar la urea y dar lugar a la formación de depósitos de cristales de estruvita (fosfato amónico-magnésico) y apatita (fosfato cálcico), que ocluirán la sonda favoreciendo el desarrollo de bacteriemia3,7,16. Esto sucede a partir de pH de 6,7. En el aspecto práctico, un simple pH urinario puede orientar sobre el tiempo de recambio de la SU. Si el pH es bajo, la SU podría recambiarse cada 3 meses o más y si el pH es elevado (> 6,7), el recambio debería efectuarse con mayor frecuencia, especialmente en pacientes con obstrucción de repetición.
Por último, recientemente se ha demostrado que en pacientes con BA recidivante por el mismo microorganismo, en los cuales se cambia la SU, el reservorio sería el propio tracto urinario, al haberse demostrado la capacidad de los microorganismos de sobrevivir en el interior de las células uroepiteliales, donde también formarían biofilms17–19.
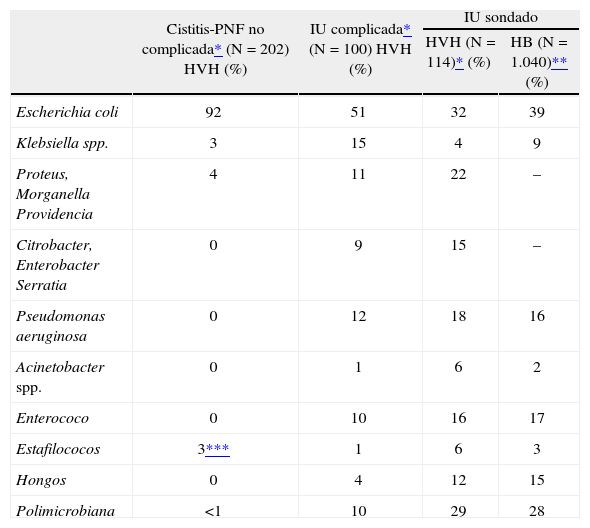
EtiologíaLos microorganismos causales de la IU del sondado proceden de la propia flora del paciente, modificada con frecuencia (especialmente en el sondado permanente) por la presión ambiental exógena transportada por las manos del personal sanitario. Con frecuencia, especialmente si el cateterismo es prolongado, la IU es polimicrobiana1 (el 15% en el sondado corto y hasta el 95% en el prolongado). Como se observa en la tabla 1 y comparando con los pacientes con IU no complicada, aumenta la incidencia de infecciones por otras enterobacterias (Klebsiella spp., Proteus spp. y P. aeruginosa), enterococo (favorecido por la administración previa de cefalosporinas), estafilococos y en el sondaje permanente y/o con tratamientos antibióticos previos, por otros gramnegativos a menudo multirresistentes, entre ellos Acinetobacter spp. y recientemente por BLEE, que en Escherichia coli alcanzaron cifras del 8% en 2006 en el Hospital de Bellvitge, por Staphylococcus aureus resistente a meticilina (SARM), especialmente en el paciente previamente colonizado y Candida spp.20,21.
Etiología de la infección urinaria en distintos grupos de riesgo
| Cistitis-PNF no complicada* (N = 202) HVH (%) | IU complicada* (N = 100) HVH (%) | IU sondado | ||
| HVH (N = 114)* (%) | HB (N = 1.040)** (%) | |||
| Escherichia coli | 92 | 51 | 32 | 39 |
| Klebsiella spp. | 3 | 15 | 4 | 9 |
| Proteus, Morganella Providencia | 4 | 11 | 22 | – |
| Citrobacter, Enterobacter Serratia | 0 | 9 | 15 | – |
| Pseudomonas aeruginosa | 0 | 12 | 18 | 16 |
| Acinetobacter spp. | 0 | 1 | 6 | 2 |
| Enterococo | 0 | 10 | 16 | 17 |
| Estafilococos | 3*** | 1 | 6 | 3 |
| Hongos | 0 | 4 | 12 | 15 |
| Polimicrobiana | <1 | 10 | 29 | 28 |
HB: Hospital de Bellvitge; HVH: Hospital Vall d'Hebron; IU: infección urinaria; PNF: pielonefritis.
Un aspecto importante es el hecho de que en el sondado permanente, la flora bacteriana cambia con frecuencia, por lo cual un urocultivo previo tomado semanas antes no permite orientar la terapia empírica si el paciente presenta una bacteriemia de origen urinario. Por otro lado, en estos pacientes, sólo el 10% de los E. coli que producen una IU febril son portadores de fimbrias, con lo cual el factor de la adherencia podría tener un papel secundario. En el sondado, el paso del microorganismo al torrente sanguíneo se realizaría, en muchos casos, por la erosión que puede causar la propia SU o como consecuencia de la obstrucción de la misma. Por último, los microorganismos procedentes de la orina vesical tras recambiar la sonda vesical pueden diferir de los aislados a partir de la sonda, por lo que algunos autores recomiendan recoger el urocultivo, una vez cambiada la SU, si ésta es permanente.
Manifestaciones clínicasLa cistitis aislada es poco frecuente en el sondado permanente, ya que, a menudo, está afectado el tracto urinario superior. Puede observarse en sondajes de corta duración, en pacientes sin enfermedad urológica previa, los cuales presentan tras la retirada de la sonda un síndrome miccional sin fiebre ni dolor lumbar. En los pacientes con afectación del parénquima renal, las manifestaciones clínicas son mucho menos específicas, ya que la mayoría de los pacientes sondados son individuos ancianos o parapléjicos, debido a su frecuente alteración en la sensibilidad. En los pacientes con pielonefritis, la fiebre sin clínica focal es el síntoma más común, aunque ésta puede ser poco elevada. El dolor lumbar, a menudo, es poco manifiesto y localizado en flanco o hipogastrio. No es inhabitual que los pacientes consulten por un deterioro de su estado neurológico basal con delirio, por hipotensión, un deterioro del estado general con astenia, apatía y deterioro funcional, o bien la descompensación de una diabetes mellitus o una hepatopatía crónica.
Por otro lado, la presencia de «molestias urinarias» en forma de síndrome miccional, dolor o irritación en el pene o vagina son tan frecuentes en el paciente sondado sin IU (hasta en el 60% de los casos), debido a la propia irritación que causa la sonda, que son de escasa utilidad clínica para etiquetar dichas manifestaciones como secundarias a una IU sintomática8.
Además, en el sondado con BA, la presencia de piuria es tan frecuente que carece de valor predictivo de infección clínica. Por otro lado, en un estudio prospectivo, se observó que la presencia de piuria no predecía el desarrollo de BA, en un porcentaje significativo de pacientes, especialmente en infecciones por bacilos grampositivos o Candida spp.22. Asimismo, en las IU causadas por bacterias productoras de ureasa, el número de leucocitos puede ser normal, ya que estas células pueden ser destruidas al ser centrifugadas.
DiagnósticoEl diagnóstico de IU sintomática es difícil en el sondado, por lo inespecífico de los síntomas clínicos, especialmente en pacientes de edad avanzada, por el hecho de que la propia sonda urinaria puede causar un síndrome irritativo vesical y por el escaso valor predictivo de infección clínica que tiene la presencia de la piuria, como se ha comentado anteriormente.
Para confirmar el diagnóstico la mayoría de los autores requieren de la presencia de piuria, definida como más de 10 leucocitos por campo, y de un urocultivo positivo (presencia de bacteriuria), definido como la presencia de más de 103 ufc/ml (aunque habitualmente el recuento es superior a 105 ufc/ml) de un microorganismo uropatógeno7. En el paciente que lleva varios días sondado, incluso con un sistema de drenaje cerrado, la presencia de bacteriuria es frecuente, por lo cual el valor predictivo de la prueba disminuye considerablemente. Además, el hallazgo, en el urocultivo, de más de un microorganismo, que habitualmente se consideraría una contaminación, debe ser interpretado con cautela, ya que en el sondado la IU a menudo es polimicrobiana, especialmente en el cateterizado permanente. Por ello, el diagnóstico definitivo de una IU en el paciente sondado requiere de una evaluación clínica cuidadosa para descartar otros posibles focos de infección.
No existe un consenso sobre los criterios clínicos para establecer el diagnóstico de IU sintomática. En una revisión reciente, el criterio más utilizado fue tan inespecífico como: presencia en el urocultivo de más de 104 ufc/ml asociado a signos y síntomas sistémicos23. En una conferencia de consenso del año 199 124 se establecía como diagnóstico la presencia de 2/4 criterios: 1) fiebre, en ausencia de otra etiología; 2) dolor en flanco o suprapúbico de nueva aparición; 3) cambios en el aspecto de la orina, y 4) deterioro del estado mental o funcional. En otra conferencia de consenso más reciente25 se requería para establecer el diagnóstico la presencia de: disuria aguda o fiebre > 37,9 o aumento de 2 grados por encima de la basal, en ausencia de otro diagnóstico asociado a uno de los siguientes: a) urgencia (nueva o que empeora); b) frecuencia miccional; c) dolor suprapúbico; d) hematuria franca; e) dolor en el ángulo costovertebral, f) incontinencia urinaria. Evidentemente, para confirmar el diagnóstico se requería de la presencia de piuria (> 10 leucocitos por campo) y de un urocultivo positivo que se definía como el asilamiento de > 105 ufc/ml. Por otro lado, en un artículo reciente sobre infecciones asociadas a cuerpos extraños, en 55 unidades de cuidados intensivos de ocho países, el diagnóstico se estableció en función de uno de los dos criterios siguientes: El primero incluía uno o más de los siguientes: fiebre, urgencia o dolor suprapúbico en ausencia de otra causa, con un urocultivo con mas de 105 ufc/ml sin más de dos microorganismos. El segundo requería de dos o más de las siguientes condiciones, en ausencia de otra causa que las justificara: tira reactiva positiva, piuria, tinción de Gram positiva, diagnóstico de IU o inicio de tratamiento por IU por el médico que atendía al paciente.
Por último, queremos remarcar que la tinción de Gram puede ser de utilidad en el enfoque terapéutico inicial especialmente del paciente grave, dada la naturaleza polietiológica de esta infección.
TratamientoLa decisión terapéutica se basará en la gravedad de las manifestaciones clínicas que presente el paciente, en el o los microorganismos más probables (la administración previa de cefalosporinas favorece la infección por enterococo) y el o los patrones de resistencia de los principales microorganismos involucrados en la IU. En este sentido, en la actualidad, en España, globalmente, el 20-25% de las IU causadas por E. coli son resistentes a las fluoroquinolonas, porcentaje que es mucho más elevado, alrededor del 50% según nuestra experiencia, en el paciente con IU complicada y en el sondado, por lo que estos antibióticos no deben emplearse empíricamente en pacientes con IU graves.
Así mismo, es fundamental, realizar una detallada historia clínica para determinar los antibióticos administrados recientemente. Se ha demostrado que la utilización de un determinado antibiótico en el mes o 2 meses previos aumenta significativamente la posibilidad de una IU por un microorganismo resistente al mismo. Por último, debe considerarse el antecedente de colonización-infección previa por microorganismos resistentes del propio paciente; así, la colonización previa por SARM o BLEE deberá incluirse entre las posibilidades etiológicas.
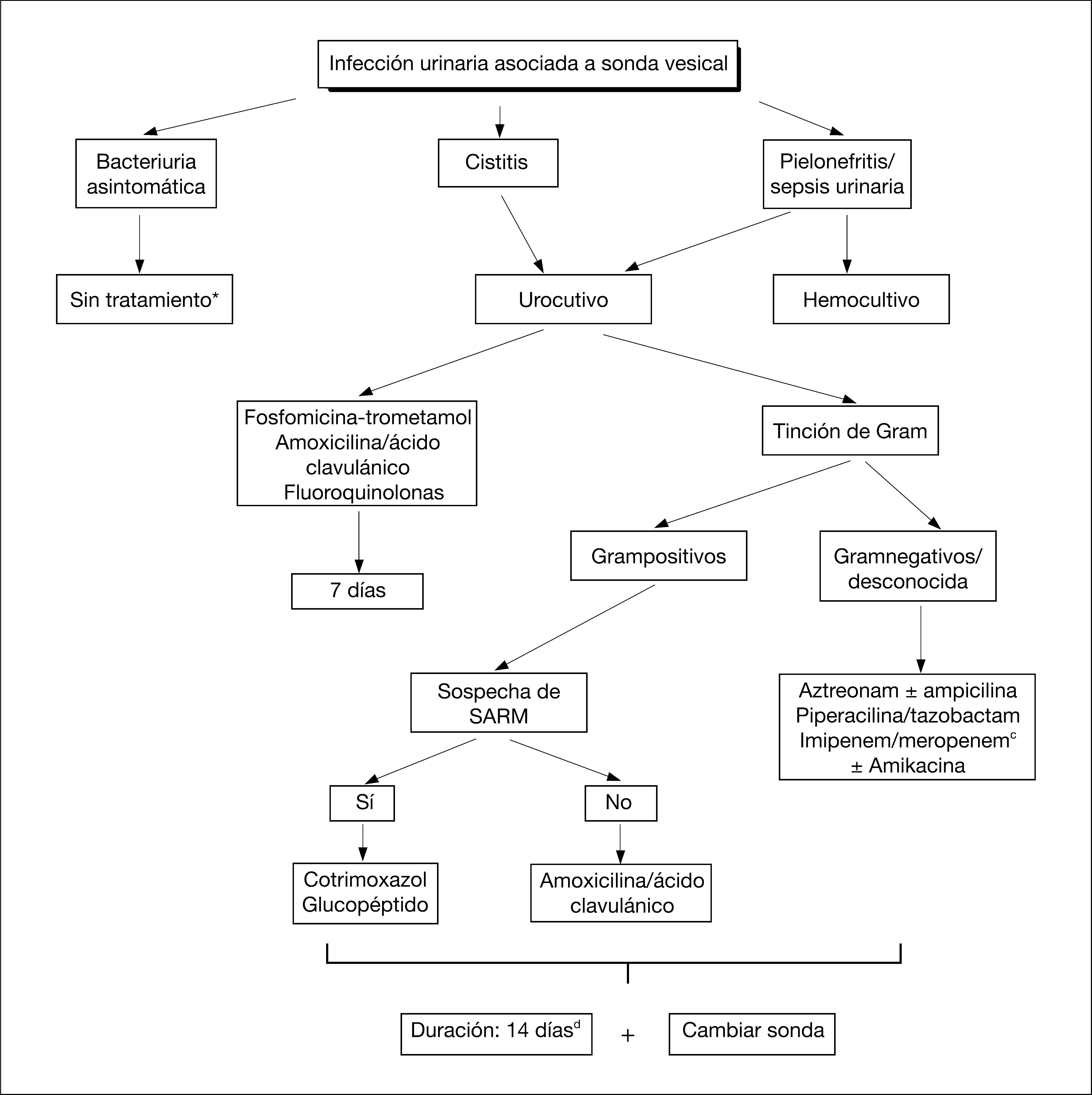
La actitud terapéutica en la IU asociada a un cateterismo vesical ha de diferenciar si se trata de una bacteriuria asintomática, una cistitis o una pielonefritis/sepsis urinaria. En la figura 1 se muestra un algoritmo de actuación en cada una de estas situaciones.
Algoritmo de actuación en la infección urinaria asociada a catéter vesical.
- a
Excepto cirugía urológica, embarazadas, recambio de sonda si hay riesgo de endocarditis y si existe bacteriuria persistente tras retirada sonda.
- b
Evitar si se han administrado recientemente.
- c
Reservar para pacientes graves con factores de riesgo de BLEE o Enterobacter.
- d
Si hay sepsis tras manipulación puede acortarse la duración a 5-7 días, BLEE: betalactamasas de espectro extendido; SARM: Staphylococcus aureus resistente a meticilina (cloxacilina).
El paciente con BA, tanto si tiene piuria asociada como si no, no requiere de tratamiento antibiótico ya que: a) el riesgo de desarrollar una infección urinaria sintomática es bajo; b) la BA recurrirá a los pocos días; c) el tratamiento de la BA no reduce el porcentaje de episodios febriles de origen urinario con respecto a los pacientes no tratados; d) la administración de antibióticos repetidos condicionará la selección de microorganismos resistentes, lo cual dificultará en un futuro el tratamiento de una IU sintomática20,26. Sin embargo, la BA deberá ser tratada antes de someter al paciente a cirugía urológica (riesgo > 60% de bacteriemia), en cualquier manipulación del tracto urinario (excepto en el recambio de sonda), en pacientes con factores de riesgo de endocarditis y en embarazadas. Algunos autores la aconsejan también en la BA persistente tras la retirada de la sonda urinaria26, basándose en un estudio aleatorizados en mujeres con cateterismo de corta duración, en el cual la incidencia de IU sintomática fue del 17% en el grupo no tratado frente al 0% en el grupo que recibió antibióticos27. En el paciente sondado, las guías del IDSA (Infectious Diseases Society of America) no recomiendan la práctica rutinaria de un urocultivo para la detección de la BA, pero se acepta como adecuada la posibilidad de tratar la BA persistente tras la retirada de la sonda en mujeres27.
El tratamiento de la IU sintomática y de la bacteriemia requerirá de la administración de antibióticos. Previamente, debe realizarse siempre un urocultivo, dada la variabilidad etiológica de la IU y la susceptibilidad antimicrobiana de los uropatógenos aislados.
La cistitis aislada es poco frecuente en el sondado permanente, ya que, a menudo, está afectado el tracto urinario superior. Puede observarse tras la retirada de la sonda urinaria, en sondajes de corta duración, en pacientes sin patología urológica previa. Fosfomicina-trometamol en una dosis de 3 g, por su elevada actividad frente a E. coli, P. aeruginosa y los bacilos grampositivos se considera una buena opción terapéutica. Amoxicilina/ácido clavulánico 500 mg/8 h puede ser una alternativa, en unidades con bajo riesgo de infección por P. aeruginosa, y en pacientes sin tratamiento antibiótico previo.
En la cistitis, se aconseja una duración del tratamiento de 7 días, ya que no disponemos de estudios con pautas más cortas. Si se emplea fosfomicina-trometamol, por su semivida prolongada, se aconseja administrar dos dosis separadas por 3 días (días 1 y 4).
En los pacientes con pielonefritis y/o sepsis urinaria el tratamiento se iniciará por vía parenteral, generalmente en el medio hospitalario. El tratamiento antibiótico empírico ha de abarcar además de las enterobacterias, P. aeruginosa y enterococo. En esta situación la tinción de Gram puede ser de inestimable ayuda.
Si la tinción de Gram muestra microorganismos grampositivos y no se sospecha infección por un SARM, amoxicilina/ácido clavulánico 1 g i.v./8 h puede ser una buena opción terapéutica, ya que cubre tanto enterococo como S. aureus. En el paciente con sospecha de SARM (colonización previa) y en el alérgico a los betalactámicos, se iniciará con glucopéptidos (vancomicina, teicoplanina). El cotrimoxazol es una buena opción terapéutica en el SARM.
Si la tinción de Gram muestra microorganismos gramnegativos se iniciará tratamiento con aztreonam 1 g/8 h o ceftazidima 1 g/8 h. Si la tinción de Gram no ha sido realizada se añadirá ampicilina a la pauta anterior para cubrir enterococo. Como alternativa podrían utilizarse piperacilina/tazobactam 4 g/8 h o un carbapenemes (imipenem-meropenem). La necesidad de una cobertura empírica adecuada ha de hacerse compatible con un uso racional de los carbapenemes, ya que un aumento considerable en su consumo puede condicionar un aumento en las resistencias. Por lo tanto, este último antibiótico debería reservarse para pacientes graves con riesgo de infecciones por patógenos multirresistentes (colonización previa, administración previa de cefalosporinas de segunda o tercera generación o fluoroquinolonas, estancias en unidades de riesgo como las UCI). Si el paciente presenta shock séptico se añadirá empíricamente amikacina (15 mg/kg/día) para cubrir la eventualidad de una infección por P. aeruginosa resistente a los antibióticos antiseudomónicos anteriormente mencionados.
El tratamiento antibiótico empírico será modificado por uno de espectro más reducido cuando se conozca la sensibilidad del agente etiológico.
En las infecciones por BLEE, los carbapenemes son preferibles a las fluoroquinolonas, la cefepima y los betalactámicos/inhibidores de las betalactamasas, ya que en los pacientes con bacteriemia, las tasas de curación y la mortalidad a los 14 días son inferiores28,29. Tigeciclina puede fracasar en el paciente bacteriémico, debido a los bajos niveles sanguíneos, y se desaconseja en el tratamiento de las IU por su baja concentración urinaria28,29. Colistina y los aminoglucósidos pueden ser una alternativa, por su elevada actividad in vitro frente a estos patógenos (en especial amikacina), aunque hasta la fecha, la experiencia clínica es escasa28,29. Aunque fosfomicina es activa in vitro frente a los BLEE, tampoco disponemos de experiencia clínica con el preparado parenteral. Si bien fosfomicina-trometamol parecía eficaz en un estudio no controlado, que incluía a un número escaso de pacientes con IU baja, la curación microbiológica fue de sólo el 78%, y teniendo en cuenta que el urocultivo de control se realizó a los 7-9 días, cuando aún podrían existir concentraciones urinarias del fármaco30. Creemos que se requieren de estudios amplios para evaluar el papel de este antibiótico en el tratamiento de las IU causadas por BLEE.
La duración de la terapia antibiótica no está bien establecida. Si existe clínica (dolor lumbar, puñopercusión positiva) o sospecha de afectación del parénquima renal (pielonefritis) se aconsejan 14 días de tratamiento. En los pacientes que presentan una sepsis urinaria después de la manipulación de la vía urinaria (p. ej., recambio de sonda), y si no existe evidencia de pielonefritis o prostatitis subyacente, el tratamiento podría acortarse a 5-7 días7,20. En los lesionados medulares sin cateterización permanente y con síntomas de IU baja, la administración de ciprofloxacino durante 14 días fue más eficaz en la prevención de recidivas clínicas y microbiológicas que una pauta de 3 días31.
La BA por Candida spp. tampoco requiere de tratamiento y si es posible deben retirarse los antibióticos y la sonda urinaria. En la cistitis por Candida spp. sensible se aconseja fluconazol 200 mg/día durante 7-14 días32. En la pielonefritis/sepsis urinaria se aconseja fluconazol 200 mg durante 2 semanas. Si la candiduria recidiva tras el tratamiento deberá descartarse mediante técnicas de imagen un "bola de hongos" renal.
En los portadores de una SU con una duración de más de 1 semana se recomienda el recambio de la misma para evitar la recidiva de la infección relacionada con la persistencia de las bacterias adheridas a la sonda, en forma de biofilm (biocapa o glucocálix)7,20. Además, en un estudio prospectivo y aleatorizado en sondados permanentes, la sustitución de la sonda por una nueva antes de iniciar el tratamiento se asociaba a una menor duración de la fiebre y una mejora de la situación clínica a las 72 h33.
La administración de antibióticos profilácticos al recambiar una SU era una práctica habitual hace años, especialmente en los pacientes con sondaje permanente, que condicionó la selección de microorganismos resistentes. En la actualidad, no se recomienda la administración profiláctica de antibióticos en el recambio de la sonda urinaria, ya que el riesgo de sepsis grave es muy bajo20. Podría indicarse en sondajes traumáticos con hematuria, ya que en esta situación, el riesgo de bacteriemia es superior.
PrevenciónEn cuanto a la prevención, debemos realizar unas consideraciones generales. Es conocido que cerca del 50% de las cateterizaciones son innecesarias o su duración excesiva y que existen otras alternativas de drenaje vesical con menos riesgo de BA, como son la colocación de una sonda-condón en los varones y la cateterización intermitente en los lesionados medulares1,3,7,9. Aunque la cateterización suprapúbica reduce la bacteriuria y las complicaciones locales (erosión del meato, epididimitis, prostatitis) en los varones, su uso no se ha generalizado debido a la mayor complejidad de colocación y el riesgo, aunque mínimo de complicaciones quirúrgicas (sangrado, etc.)34. Por lo tanto, evitar la colocación de SU y acortar la duración del sondaje son medidas primordiales para reducir la IU nosocomial. En este sentido, una revisión reciente del centro Cochrane concluyó que la retirada temprana de la sonda (a medianoche) después de cirugía urológica se asoció con menor riesgo de IU y una estancia más corta, aunque también se asoció con un tiempo más prolongado de la primera micción35. Estas medidas preventivas no son eficaces para prevenir la bacteriuria en el sondaje permanente. En esta situación, la prevención irá encaminada a evitar la obstrucción y la infección clínica.
Además, debe recordarse que la mayoría de las bacteriurias relacionadas con el cateterismo de corta duración son asintomáticas y, por lo tanto, las medidas que previenen la aparición de la bacteriuria tienen un impacto clínico mucho menor, ya que son pocos los pacientes que desarrollan una infección del tracto urinario (ITU) sintomática, y menos aún los que presentan una ITU grave (bacteriemia). Por ello, deben evaluarse siempre los beneficios y riesgos, así como su coste antes de su aplicación.
Las medidas generales destinadas a prevenir la BA relacionada con un cateterismo de corta duración incluyen la utilización de un equipo estéril, y una técnica aséptica en el momento de la inserción, reducir al mínimo las desconexiones de la SU con el sistema colector, asegurarse de que este último esté en una posición declive respecto a la vejiga y evitar que el tubo caiga por debajo de la bolsa de recogida7. Es importante el lavado de manos antes y después de vaciar el depósito de orina para minimizar la contaminación exógena del mismo y el riesgo de transmisión cruzada en pacientes institucionalizados.
El lavado diario del meato uretral y la aplicación periuretral de antisépticos o cremas de antibióticos es ineficaz en la reducción de la bacteriuria9. Por otro lado, la aplicación de antibióticos en la bolsa recolectora o los lavados vesicales con antibióticos o antisépticos locales, aunque pueden posponer la aparición de la bacteriuria, no reducen el número de IU sintomáticas y tienen el inconveniente de facilitar el desarrollo de infecciones por microorganismos resistentes, ya que el circuito cerrado se transforma en abierto9.
Antibióticos sistémicosVarios estudios, tanto observacionales como controlados, han demostrado que la administración de antibióticos sistémicos reducen la incidencia de BA e IU clínica en los primeras 2 semanas de cateterización1,7,9. Sin embargo, la administración de antibióticos sistémicos se asocia a un riesgo de colonización por microorganismos resistentes1,7. Dado que, hasta la actualidad, no ha podido demostrarse que la administración de antibióticos sistémicos reduzca la IU grave (con bacteriemia), ni la mortalidad, no se recomienda su administración profiláctica, dados los costes de la misma, los posibles efectos adversos y la posibilidad de selección de microorganismos resistentes tanto en el individuo como en la unidad hospitalaria correspondiente. Además, la sobreutilización de antibióticos puede favorecer la aparición de Clostridium difficile36. Aunque no está indicada la detección sistemática de la presencia de BA en el paciente cateterizado37, si se detecta su presencia en pacientes de riesgo, como en embarazadas y el paciente granulocitopénico, deberá plantearse su tratamiento1.
Como se ha comentado anteriormente, tampoco existe evidencia de que el tratamiento de la BA mejore la supervivencia en el sondado permanente26. Asimismo, en el paciente con vejiga neurógena y cateterización intermitente, aunque la profilaxis con antibióticos reduce la incidencia de BA, no reduce de forma significativa el de IU sintomática7, e incrementa el riesgo de resistencias. Aunque en un estudio reciente y observacional, en lesionados medulares con cateterización intermitente, la administración cíclica semanal de antibióticos redujo la incidencia de IU sintomática y los episodios febriles atribuidos a IU, así como el consumo de antibióticos38, se necesita diseñar estudios prospectivos, aleatorizados y doble ciego para conocer los beneficios reales de esta actitud, evaluando especialmente la selección de microorganismos multirresistentes.
Por otro lado, aunque existe un riesgo de IU sintomática tras la retirada de la sonda, en un estudio piloto que incluía solo 48 pacientes la administración de ciprofloxacino durante 2 días, iniciada 2 h antes de retirar la sonda, no redujo la incidencia de IU sintomática (el 8 frente al 4%) y en el grupo de ciprofloxacino las IU fueron causadas por un microorganismo resistente a dicho antibiótico39.
Sondas impregnadas con antimicrobianosEn las últimas dos décadas se han incorporado diversas sustancias a base de compuestos argénticos o antibióticos (minociclina-rifampicina, nitrofurazona) con el fin de evitar la adhesión de los microorganismos y la formación de biopelículas1,7,9,19.
Los catéteres recubiertos de óxido de plata fueron retirados por falta de eficacia. Sin embargo, en una revisión del año 2004 realizada por el centro Cochrane que incluía ocho estudios comparativos de sondas recubiertas de aleaciones de plata frente a catéteres estándar se observó que las sondas con plata reducían la incidencia de BA e IU sintomática, especialmente en la primera semana40. Por otro lado, en una revisión más reciente, que incluía nueve estudios, aunque se concluía que las sondas impregnadas con plata reducían la incidencia de BA41, la evidencia sobre su efecto en la incidencia de IU sintomática y especialmente en la prevención de la bacteriemia de origen urinario, mortalidad, resistencia antimicrobiana y la relación entre los costes y los beneficios era escasa. En la actualidad no hay evidencia suficiente para recomendar su utilización y más teniendo en cuenta el riesgo de desarrollo de resistencia a la plata, ya descrita en unidades donde su utilización es amplia, como en las de quemados17.
Aunque en estudios comparativos, las sondas impregnadas con minociclina-rifampicina o con nitrofurazona también reducen la incidencia de BA en los pacientes con sondaje corto, tampoco se conoce su impacto en el desarrollo de IU sintomática, IU bacteriémica y en la mortalidad3,40,41, por lo que hoy en día no se aconseja su uso, por sus costes superiores y por el riesgo a desarrollar resistencias.
ArándanosAunque existe cierta evidencia de la eficacia de los arándanos en la prevención de las IU recurrentes42, no disponemos de evidencia suficiente para recomendar su uso en el paciente sondado. Además, por su mecanismo patogénico de acción, secundario a las proantocinadinas que contienen, que interfieren con la adherencia de las fimbrias de E. coli a las células uroepiteliales, hace poco probable que sean eficaces; como se ha comentado anteriormente, en el sondado con IU, sólo el 10% de los uropatógenos involucrados contienen fimbrias. En este sentido, dos estudios preliminares en lesionados medulares sugieren que los arándanos no previenen las IU ni inhiben la formación de incrustaciones7,43.
Otras estrategias preventivasEn la actualidad no se recomienda la acidificación de la orina con ácido ascórbico (vitamina C) e hipurato de metenamina, ya que es difícil conseguir pH persistentemente bajos y la evidencia de su eficacia es escasa9.
Se está evaluando la eficacia de la denominada interferencia bacteriana con cepas avirulentas de E. coli, las cuales en instilación vesical parecen reducir la incidencia de IU sintomática, o impregnando la sonda con dichas cepas, impediría la colonización del catéter por uropatógenos17.
Por último, y especialmente en los sondajes permanentes, se están probando estrategias en la prevención de la obstrucción de la sonda, lo cual evitaría la IU bacteriémica. En este sentido, se aconseja una ingesta diaria de 2-4 l de líquidos, para intentar disminuir la precipitación de cristales13. Se han intentado utilizar inhibidores de la ureasa, pero son tóxicos para el ser humano. La investigación, al igual que en otras infecciones, se dirige a evitar la formación o la progresión del biofilm, bien utilizando distintos tipos materiales en las sondas44 (hidrogel-látex, silicona, etc.) o impregnándolos con diversas sustancias, como heparina, un biocida como el triclosán45, la N-acetilcisteína o el ácido acetilsalicílico17. De momento, no disponemos de estudios clínicos, o estos son insuficientes44 para recomendar su utilización.
Infecciones del tracto genital relacionadas con los dispositivos protésicosIntroducciónLas primeras descripciones acerca del uso de dispositivos intrauterinos (DIU) se remontan a la década de 1920 en Alemania46. La descripción de infecciones pélvicas graves asociadas hizo abandonar su utilización hasta que, a finales de la década de 1950, Oppenheimer e Ishihama comunicaron que estos dispositivos eran seguros siempre que se insertasen de manera aséptica en mujeres sin historia de enfermedad inflamatoria pélvica (EIP)46. El desarrollo posterior de DIU de materiales inertes y plásticos químicamente modificados marcó una nueva era en su investigación y uso46.
Durante la década de 1960 diferentes estudios comunicaron tasas de EIP del 0,6 al 3,5% en mujeres portadoras de DIU. El estudio de Mishell et al47 mostró en 1966 que si se cultivaban los DIU retirados quirúrgicamente a partir de los 30 días de su colocación éstos eran estériles. Así pues, se asumió que los episodios de EIP diagnosticados más allá del día 30 de la colocación del DIU se debían a transmisión sexual y no al hecho de llevar DIU. Durante la década de 1970 aparecieron diferentes comunicaciones de abortos espontáneos sépticos en mujeres portadoras del dispositivo Dalkon Shield, lo que originó una nueva revisión del tema y que la Food and Drug Administration (FDA) obligase en 1977 a incorporar una nota informativa de que los DIU podían aumentar el riesgo de EIP de tres a cinco veces y, por tanto, se recomendaba cambiarlos cada 3 años46. No obstante, múltiples trabajos actuales cuestionan el hecho de que los DIU estén asociados a un incremento de las EIP46,48–50.
Tipos de DIU y mecanismo de acciónLos DIU son de dos tipos: inertes, hechos con un material no absorbible como polietileno impregnado con sulfato de bario para darles radioopacidad y aquéllos en los que hay eliminación de una sustancia químicamente activa (cobre o un agente progestágeno)46. Además, para facilitar su localización y retirada, la mayoría de los DIU lleva una cola compuesta de un filamento de plástico recubierto por una vaina de nailon.
No está claro su mecanismo de acción. Aunque entran en contacto con menos del 20% de la superficie uterina, impiden la implantación del óvulo fecundado en el endometrio al originar una respuesta inflamatoria local 46. La implantación del DIU se asocia a colonización bacteriana de la cavidad uterina (que en condiciones normales es estéril y vuelve a serlo 20 o 30 días después), lo que produce una reacción inflamatoria a cuerpo extraño que se extiende a endometrio y endosalpinx46. Se han propuesto diferentes hipótesis para explicar cómo esta respuesta inflamatoria del endometrio impide el embarazo: fallo en la implantación del blastocisto, destrucción del blastocisto y los espermatozoides por diferentes enzimas y fagocitosis de los espermatozoides por los macrófagos, todo ello mediado por las prostaglandinas y citoquinas que liberan los macrófagos locales46.
Complicaciones infecciosas asociadas a los DIUEl uso de DIU se ha relacionado con la aparición de diferentes complicaciones infecciosas entre las que destacan: la EIP en pacientes portadoras de DIU, la vaginitis y vaginosis, la actinomicosis pélvica y el aborto espontáneo séptico46.
Enfermedad inflamatoria pélvica (EIP)Se entiende por EIP la inflamación e infección del tracto genital superior femenino, que en condiciones normales es estéril. Afecta a las trompas de Falopio, ovarios y estructuras adyacentes y comprende una variedad de trastornos inflamatorios del tracto genital superior, incluyendo endometritis, salpingitis, abscesos tuboováricos y pelviperitonitis46,48. La utilización de DIU se ha asociado clásicamente a EIP, en especial con ciertos tipos no utilizados hoy en día. Sin embargo, algunos factores de confusión como la conducta sexual de las pacientes y la comparación con grupos control no bien seleccionados tienden a sobrestimar el riesgo46,48,49. Se considera que el desarrollo de EIP en estas pacientes se relaciona más con la instrumentación y manipulación (mayor riesgo durante el mes posterior a la inserción del dispositivo) que con el DIU en sí mismo48–53. Fuera de este período en mujeres sin factores de riesgo para EIP, no se considera que aumente el riesgo de padecerla48–53.
EpidemiologíaSe estima que cada año más de un millón de mujeres presentan un episodio de EPI en EE.UU., lo cual supone el 8% de las mujeres en edad reproductiva. En España, según los datos del informe SESPAS (Sociedad Española de Salud Pública y Administración Sanitaria) sobre salud de la mujer, se han estimado 3.000 ingresos anuales por EIP48. La incidencia de EIP en pacientes portadoras de DIU es poco conocida y depende de la definición utilizada, así como de los medios diagnósticos, por lo que oscila entre 1/100 y 1,6/1.000 mujeres-año en los diferentes estudios46,50,51. La menor frecuencia en el recambio de los DIU desde la utilización de DIU de cobre posiblemente sea un factor determinante en cuanto a la disminución de la incidencia de esta patología49,50. En la actualidad, la mortalidad asociada a la EIP es muy baja (estimada 1 × 10.000 casos) y se debe mayoritariamente a la rotura de abscesos tuboováricos48.
Los factores de riesgo asociados a la aparición de EIP en pacientes portadoras de DIU son: edad inferior a 25 años, múltiples compañeros sexuales, el tratarse de una mujer nulípara, enfermedad de transmisión sexual o vaginosis bacteriana, historia previa de EIP46,48–52. Otros factores no bien documentados son la condición socioeconómica baja, la raza, los coitos frecuentes y las duchas vaginales frecuentes48.
Todos los estudios coinciden en destacar que el mayor período de riesgo se sitúa entre los días 20 y 30 siguientes a la colocación o el recambio del dispositivo y se cree que esto se debe a la introducción de bacterias en la cavidad uterina tras la contaminación del DIU con la flora cérvico-vaginal en el momento del implante (maniobra que se ha asociado al 13% de bacteriemia transitoria)46,48–53. Aunque los estudios son contradictorios, hay autores que concluyen que la implantación de DIU en mujeres afectadas de enfermedad por Chlamydia trachomatis o Neisseria gonorrhoeae aumenta el riesgo de EIP46,49,53–56. En la actualidad, se recomienda descartar y tratar, en caso de ser diagnosticada, una posible enfermedad de transmisión sexual antes de colocar un DIU. La utilización de doxiciclina 200 mg o azitromicina 500 mg como profilaxis previa a la inserción del DIU no se ha mostrado efectiva de forma concluyente54,55. Respecto a la utilización de DIU en mujeres afectadas de infección por el virus de la inmunodeficiencia humana (VIH), no parece que éste tenga ningún efecto sobre la replicación viral ni que este grupo de mujeres tenga un riesgo superior de desarrollar EIP comparado con mujeres negativas para el VIH49.
Etiopatogenia. MicrobiologíaEn la EIP los microorganismos ascienden a través de la vagina y el cérvix hasta el endometrio, trompas de Falopio y estructuras adyacentes46,48. Se pueden distinguir dos fases de la enfermedad. En la primera se produce la inflamación de tejidos blandos de la pelvis, con implicación de gérmenes aerobios facultativos. En la segunda fase se pueden formar abscesos intraabdominales con implicación de gérmenes anaerobios48. Inicialmente, la infección es monomicrobiana (frecuentemente por gérmenes de transmisión sexual como C. trachomatis y N. gonorrhoeae)48. Con posterioridad, se produce una lesión de la mucosa tubárica, lo que permite que sea susceptible de colonizarse por gérmenes oportunistas del tracto genital inferior, con predominio gradual de los gérmenes anaerobios, presentes especialmente en las formas más graves de la enfermedad48.
Aunque C. trachomatis y N. gonorrhoeae son los microorganismos más implicados, en el 25-50% de los casos no se aísla ninguno de ellos46,48. Otros microorganismos identificados en el tracto genital superior de mujeres con EIP son diferentes especies de aerobios (Gardnerella vaginalis, Mycoplasma genitalium, Ureaplasma urealyticum, E. coli, Streptococcus spp., Haemophilus influenzae) y anaerobios (Prevotella spp., Peptostreptococcus, Peptococcus y Bacteroides spp.), pero su papel patógeno en la EIP no está totalmente establecido46,48,57.
ClínicaLa semiología de la enfermedad varía desde el proceso asintomático hasta el compromiso vital, aunque la condición clínica más frecuente de la EIP es la presencia de dolor pélvico con escasa afectación del estado general48,50. Sólo un pequeño porcentaje de pacientes presentan formas pelviperitoníticas graves. La aparición de dolor pélvico es el primer síntoma indicativo de infección ascendente, localizándose en la parte inferior del abdomen. Su instauración suele ser subaguda pero persistente. Si la EIP se presenta en una mujer portadora de DIU, este cuadro aparece durante las primeras 3 semanas posteriores a su colocación46,48–53. El sangrado irregular aparece con mayor frecuencia en los casos de infección por Chlamydia spp., la leucorrea se presenta aproximadamente en la mitad de los casos de EIP (a menudo precozmente) y también es frecuente la dispareunia48. En el 50% de los casos existe febrícula, y aparece fiebre alta con náuseas y vómitos en los casos de infección grave con pelviperitonitis48. El dolor en el hipocondrio derecho aparece en el 1-10% de las EIP agudas y es reflejo de una perihepatitis (síndrome de Fitz-Hugh-Curtis)48. Existen diversas clasificaciones de la EIP, la más utilizada de las cuales es la de Monif de 198258, que permite establecer la gravedad y el pronóstico de la infección y orientar unas pautas terapéuticas.
Exploración física y exploraciones complementariasLa palpación abdominal puede producir dolor y puede existir positividad de la maniobra de Blumberg. El diagnóstico diferencial debe hacerse principalmente con apendicitis aguda, embarazo ectópico y la torsión de quiste ovárico. Mediante especuloscopia se valorará la vagina y el cérvix, que se ven inflamados, con presencia de leucorrea y en ocasiones salida de exudado por el orificio cervical externo.
La recogida de muestras endocervical y vaginal servirá para realizar tinción de Gram, frotis en fresco y cultivos. La presencia de leucocitos en el frotis vaginal no tiene valor diagnóstico, pero su ausencia nos excluye con elevada probabilidad un cuadro de EIP de inicio reciente. La ecografía transvaginal es de gran utilidad en el diagnóstico diferencial de esta entidad. Pero la laparoscopia ha sido considerada el patrón estándar, ya que además de confirmar el diagnóstico, permite realizar un estudio exhaustivo de la cavidad abdominal, un estudio microbiológico y patológico, y además dirigir la actitud terapéutica48. Al tratarse de una prueba invasiva, la laparoscopia estará indicada sólo en casos de duda diagnóstica o en formas agudas en las que pueda realizarse un tratamiento endoscópico48.
Tratamiento y prevenciónLos objetivos del tratamiento han de ser aliviar la sintomatología y conseguir la erradicación de los gérmenes causantes de la infección, así como la prevención de las secuelas a largo plazo. El tratamiento antibiótico inicial debe ser empírico, de amplio espectro, precoz y debe tener en cuenta los patógenos más frecuentemente implicados, incluyendo una amplia cobertura frente a anaerobios, y los patrones de susceptibilidad microbiana de cada área46,48,52. La gravedad del cuadro clínico inicial con afectación del estado general de la paciente, la presencia de un absceso tuboovárico, la falta de respuesta a las 48-72 h de tratamiento oral y la intolerancia al mismo obligarán al ingreso hospitalario48,52. No hay datos en la literatura médica que indiquen que en los casos asociados a DIU la pauta antibiótica deba ser diferente que en las mujeres no portadoras de estos dispositivos52. Las dos más utilizadas son cefoxitina-doxiciclina y clindamicina-gentamicina seguida de clindamicina o doxiciclina oral asociadas o no a metronidazol48,52. Pautas alternativas incluirían las quinolonas (ofloxacino o levofloxacino), con o sin metronidazol, o ampicilina/sulbactam (amoxicilina/ácido clavulánico) ambas asociadas a doxiciclina48,52. Ante la descripción reciente de cepas de gonococo resistentes a las fluoroquinolonas, los Centers for Disease Control and Prevention (CDC) aconsejan tener en cuenta este hecho y evitar su uso empírico si existe riesgo de N. gonorrhoeae resistente a quinolonas52,59. Recientemente, también se han observado en España cepas de N. gonorrhoeae resistentes a quinolonas, cuyo porcentaje se ha incrementado considerablemente, por lo que debemos ser precavidos con el uso empírico de estos antibóticos60. También ha sido utilizada azitromicina sola o combinada con metronidazol, aunque existe el temor a la aparición de aislados de N. gonorrhoeae resistentes; además, no existen datos respecto a las posibles secuelas sobre la fertilidad en las mujeres tratadas con este antibiótico, por lo que no puede ser recomendado hasta no disponer de más estudios52. En las tablas 2 y 3 pueden verse reflejadas las diferentes pautas del tratamiento de la EIP según las recomendaciones recientes de los CDC52.
Tratamiento hospitalario de la EIP aconsejado basado en las recomendaciones de los CDC de 200652
| Tratamiento parenteral | |
| Cefoxitina 2 g i.v./6 h+doxiciclina 100 mg/12 h, i.v. o v.o. | Clindamicina 900 mg i.v./8 h + gentamicina i.v. 2 mg/kg inicial seguido de 1,5 mg/kg/8 h (puede sustituirse por una dosis única diaria de 5 mg/kg/día)Levofloxacino 500 mg/día + metronidazol 500 mg/8 hAmpicilina/sulbactam (amoxicilina/ácido clavulánico) + doxiciclina |
| Tras un mínimo de 48 h y si hay mejoría clínica se puede seguir con pauta oral hasta completar 14 días | |
| Doxiciclina 100 mg/12 h v.o.+metronidazol 500 mg/12 h | Clindamicina 450 mg/6 h |
CDC: Centers for Disease Control and Prevention; EIP: enfermedad inflamatoria pélvica; i.v.: intravenoso; v.o.: vía oral.
Tratamiento ambulatorio de la EIP basado en las recomendaciones de los CDC de 200652
| Régimen A | Régimen B |
| Ofloxacino* 400 mg/24 holevofloxacino* 500 mg v.o./24 hdurante 14 díasasociadas o no aetronidazol 500 mg/v.o./12 h | Ceftriaxona 250 mg i.m. dosis inicialocefoxitina 2 g i.m. dosis inicial + 1 g probenecid v.o.+doxiciclina 100 mg/v.o./12 h × 14 díascon o sinmetronidazol 500 mg v.o./12 h x 14 días |
Cuando se paute un tratamiento ambulatorio se recomienda un control clínico a las 48-72 h para comprobar la correcta evolución clínica. CDC: Centers for Disease Control and Prevention; EIP: enfermedad inflamatoria pélvica; i.m.: intramuscular; i.v.: intravenoso; v.o.: vía oral;.
La detección creciente de cepas de N. gonorrhoeae resistentes a quinolonas obliga a considerar esta posibilidad antes de escoger este régimen terapéutico50,53.
El tratamiento quirúrgico deberá considerarse en casos graves o cuando existe una clara evidencia de absceso pélvico46,48,52.
El tema de la retirada del DIU en caso de diagnosticarse una EIP es controvertido. Mientras que algunos autores no objetivan cambios en la respuesta terapéutica de la EIP en relación con la retirada o no del DIU y, por tanto, opinan que sólo debería retirarse en casos de infección grave49,56,61, otros concluyen que la retirada del DIU mejora de manera significativa la respuesta al tratamiento en las formas leves y moderadas62. Pese a que los datos publicados al respecto no son concluyentes, parece prudente, dado que el DIU es un cuerpo extraño, su retirada para optimizar el tratamiento de la EIP. En caso de no ser retirado, se recomienda una máxima precaución y el seguimiento clínico estrecho de estas pacientes48,52.
Con respecto a la prevención en un metaanálisis de Cochrane se concluyó que la administración profiláctica de azitromicina o doxiciclina no redujo la incidencia de EIP ni la necesidad de retirada del DIU en los primeros 3 meses55. Las de portadoras de DIU que mantengan relaciones sexuales de riesgo deberían utilizar preservativo para minimizar el riesgo de la adquisición de una enfermedad de transmisión sexual.
SecuelasLas secuelas más frecuentes de la EIP son la esterilidad de origen tubárico, el embarazo ectópico y el dolor pélvico crónico46,48.
Vaginitis/vaginosis bacterianaAproximadamente el 20% de las mujeres portadoras de un DIU tienen flujo vaginal maloliente, grisáceo, no purulento46. Esto se debe a un cambio cualitativo y cuantitativo de la flora vaginal normal, consistente en la disminución de Lactobacillus sp., que es sustituido por una flora rica en G. vaginalis, Mobiluncus, Prevotella y micoplasmas genitales46,48. La incidencia de vaginosis bacteriana en algunos estudios es cuatro veces superior que en las mujeres no portadoras de DIU46. Se ha sugerido que la vaginosis bacteriana sería precursora de la EIP y que el tratamiento adecuado de esta entidad disminuye el riesgo de EIP46,48,50. Sin embargo, en un estudio reciente, no se observó un riesgo superior de EIP en las pacientes con vaginosis bacteriana, excepto en pacientes con vaginosis bacteriana y crecimiento bacteriano elevado o en vaginosis bacteriana relacionadas con una nueva pareja sexual50.
Actinomicosis pélvicaEn 1976, Gupta describió por primera vez la asociación entre el uso de DIU y la presencia de microorganismos tipo Actinomyces en la extensión del Papanicolau46. Su prevalencia es variable según la población estudiada, el tipo de DIU y la duración de su uso. Así, en dos estudios publicados, la prevalencia entre mujeres atendidas en centros públicos oscilaba entre 5,3 y 25,5%, mientras que en centros privados, entre 1,6 y 8%63. Los CDC estiman el riesgo de actinomicosis como muy bajo y sólo citan 200 casos entre 20-30 millones de pacientes al año que estarían en riesgo hipotético de padecerla46. Existe, además, controversia respecto al significado del hallazgo de estos microorganismos en el exudado vaginal, ya que frecuentemente se encuentran en asociación con otras bacterias anaerobias y podrían simplemente actuar como marcadores de colonización por estos gérmenes46. Mientras que grupos como The Association of British Family Planning Doctors recomiendan el control mediante el estudio seriado de las secreciones vaginales en las mujeres con cultivo positivo sin tratamiento activo, otros grupos, basándose en el hecho no bien demostrado de que hasta el 25% de mujeres con exudado positivo para Actinomyces sp. pueden desarrollar una EIP, recomiendan su búsqueda específica en todas las pacientes portadoras de DIU y la retirada del mismo en caso de exudado vaginal positivo46.
La manifestación clínica habitual de la actinomicosis es igual a la de la EIP, aunque se han descrito casos que se presentan como masas pélvicas y se plantea el diagnóstico diferencial con un proceso neoplásico. Con respecto al tratamiento, en las mujeres sintomáticas con exudado positivo se aconseja la retirada del DIU y penicilinas durante 2 semanas, permitiéndose la recolocación del DIU a las 4-6 semanas si el cultivo se ha negativizado46. En los casos complejos el tratamiento debe prolongarse durante meses.
Aborto espontáneo sépticoLas primeras alarmas respecto a este hecho se dieron en mujeres portadoras del dispositivo Dalkon Shield, las cuales presentaron una elevada incidencia de abortos espontáneos sépticos durante 197346. Este hecho hizo que la FDA recomendase la retirada de los DIU en caso de que la mujer quedase embarazada46. Las pacientes que decidan continuar la gestación sin la retirada del DIU deben ser avisadas del riesgo de aborto séptico y en el caso de que aparezcan signos de sepsis se aconseja la retirada inmediata del DIU y del feto46.