La implantación de válvulas cardíacas biológicas o mecánicas, de marcapasos o desfibriladores y de prótesis vasculares puede salvar la vida a muchos pacientes con cardiopatías valvulares, trastornos de la conducción o arritmias y enfermedades vasculares. Su uso es creciente en la población. La profilaxis antibiótica está indicada para prevenir las infecciones de estos dispositivos cardiovasculares protésicos que, aunque poco frecuentes, tienen una morbilidad y mortalidad elevadas. En este capítulo se revisa la epidemiología, patogenia, etiología, manifestaciones clínicas, diagnóstico, tratamiento y prevención de estas infecciones.
Los estafilococos son los agentes etiológicos más frecuentes. La contaminación se origina durante el acto operatorio o en el postoperatorio inmediato. La presencia de hemocultivos positivos y las pruebas de imagen (ecocardiografía transesofágica, tomografía computarizada, resonancia magnética) e isotópicas (gammagrafía con leucocitos marcados) son básicas para realizar el diagnóstico. El tratamiento de estas infecciones es complejo y requiere la administración prolongada de antibióticos frente a los microorganismos aislados y la explantación de la prótesis para lograr la curación.
The implantation of biological or mechanical heart valves, pacemakers, defibrillators, and prosthetic vascular grafts can save the life of patients with valvular heart disease, conduction disorders, arrhythmia, or vascular disease. The use of these devices has increased in the general population. Antibiotic prophylaxis is indicated to prevent cardiovascular device-related infections, which are uncommon, but have high associated morbidity and mortality. We review the epidemiology, pathogenesis, clinical manifestations, diagnosis, treatment, and prevention of these infections.
Staphylococci are the most common etiological agents, and the infection is thought to result from contamination during device implantation or in the early postoperative period. Positive blood culture status, and diagnostic imaging (transesophageal echocardiography, computed tomography, magnetic resonance imaging) and nuclear medicine study (scintigraphy using labeled leukocytes) are the basic tools to establish the diagnosis. Treatment is complex and requires prolonged antibiotic administration targeting the isolated organisms, and device removal to attain cure.
Los dispositivos médicos protésicos constituyen actualmente una importante herramienta para la terapéutica de numerosas enfermedades agudas o crónicas. El crecimiento importante de su utilización queda ilustrado por el aumento del 124% en sólo una década, del año 1990 al 1999, de los dispositivos protésicos cardíacos colocados en Estados Unidos. La implantación de válvulas cardíacas biológicas o mecánicas, de marcapasos o desfibriladores y de prótesis vasculares puede salvar la vida a muchos pacientes con cardiopatías valvulares, trastornos de la conducción o arritmias y enfermedades vasculares. A pesar de los avances en la prevención y el tratamiento de las infecciones asociadas con los dispositivos cardiovasculares protésicos, el aumento de su uso y el mantenimiento del riesgo durante toda la vida del implante hacen que la frecuencia de estas infecciones aumente progresivamente y que un número considerable de pacientes fallezcan como consecuencia de las mismas1–5. En este capítulo revisamos la epidemiología, patogenia, etiología, manifestaciones clínicas, diagnóstico, tratamiento y prevención de estas infecciones. Su tratamiento es especialmente complejo, ya que para curar la infección de estos dispositivos cardiovasculares protésicos se requiere, además de la administración de antibióticos de forma prolongada, su explantación. Como además estas prótesis o dispositivos cardiovasculares protésicos son esenciales para la vida de estos pacientes, deberán volver a reimplantarse, en muchas ocasiones en el mismo acto operatorio y lugar, con el posible riesgo de reinfección.
Infecciones asociadas a las válvulas protésicas cardíacasIntroducciónEl uso de prótesis valvulares desde la década de 1960 ha sido esencial para mantener la capacidad hemodinámica del corazón en los pacientes con enfermedades valvulares. Su uso ha aumentado en los últimos años como consecuencia del envejecimiento de la población. En el registro de intervenciones de la Sociedad Española de Cirugía Torácica y Cardiovascular6 se documentó para el año 2005 la implantación de un total de 10.079 prótesis valvulares, de las que el 52% eran mecánicas, el 32% biológicas, el 11% anillos protésicos mitrales o tricúspides, el 1% homoinjertos y el 4% prótesis vasculares con válvulas cardíacas. La infección de estas prótesis da lugar a la endocarditis protésica, una situación clínica extremadamente compleja que tiene una elevada morbimortalidad, a pesar de los avances en el tratamiento antimicrobiano y de la cirugía cardíaca valvular1,4,5,7,8. Del total de 2.670 episodios de endocarditis infecciosa recogidos por el Grupo Colaborativo Internacional de Endocarditis (ICE) entre los años 2000 y 2005, un 20% se correspondió a infecciones sobre prótesis cardíacas. Casi la mitad de estos pacientes precisaron cirugía cardíaca durante su hospitalización y la mortalidad fue del 23%9.
EpidemiologíaLa frecuencia de endocarditis infecciosa sobre válvula protésica (EIVP) después de la cirugía cardíaca no es uniforme. Es más frecuente durante los tres primeros meses que siguen a la cirugía, va disminuyendo durante los 6-12 meses siguientes y, a partir de entonces, se mantiene constante en el tiempo con una frecuencia que oscila entre el 0,3 y el 0,6%10–12. En estudios longitudinales, la incidencia acumulada de EIVP a los 12 y 60 meses oscila entre el 1,0 y el 1,4% y entre el 3,0 y el 5,7%, respectivamente10–15. Aunque ha habido resultados contradictorios, estudios recientes indican que la frecuencia de EIVP es similar en la posición mitral o la aórtica10,12,15. Además, al final del primer año de implantación de las prótesis, la frecuencia de EIVP sobre una válvula mecánica o una bioprótesis también es parecida15–18. Otros estudios sugieren que la frecuencia es mayor al final del primer año en las prótesis mecánicas, pero posteriormente aumenta más en las bioprótesis, con lo que a los cinco años de la cirugía valvular las cifras son similares10,12,14,17. En cualquier caso, las prótesis valvulares permanecen vulnerables a la infección durante todo el tiempo que permanecen implantadas.
Clasificación de la EIVPExisten dos tipos de EIVP, la endocarditis protésica precoz, que es la que acontece durante los 12 meses que siguen a su implantación, y la endocarditis protésica tardía, que ocurre a partir de los 12 meses1,4,5,7,8. Algunos autores dividen la EIVP precoz en dos períodos, el que ocurre en los primeros 60 días y el que va entre los días 61 y 365, si bien su etiología es muy similar19. La patogenia y la etiología y, por tanto, las manifestaciones clínicas y el pronóstico de estos dos tipos de endocarditis son completamente diferentes, siendo la EIVP tardía similar a la endocarditis infecciosa (EI) sobre válvula nativa de la población general. En estudios iniciales, aproximadamente entre el 35 y el 50% de los casos de EIVP se correspondían a una forma precoz20–22. Sin embargo, en un estudio reciente del ICE, la EIVP precoz sólo afectó al 14% de los casos23. Datos similares se han observado en otras publicaciones recientes24,25, lo que puede estar relacionado con una mejoría en la técnica quirúrgica, en la prevención y en el control de la infección nosocomial.
PatogeniaLa patogenia de la EI es compleja. Las alteraciones anatómicas y hemodinámicas pueden lesionar la superficie endotelial, tras lo cual puede formarse un trombo fibrinoplaquetario sobre el que los microorganismos circulantes, que tengan componentes en su superficie que actúen como adhesinas, pueden adherirse1,4,5,7,8. Algunos microorganismos, como Staphylococcus aureus, tienen proteínas de superficie (MSCRAMM [Microbial surface components recognizing adhesive matrix molecules]) que reconocen y se unen a las moléculas de adhesión del trombo fibrinoplaquetario, pero también puede adherirse al endotelio normal o mínimamente traumatizado1,4,26,27. Una vez colonizado el trombo por dichos microorganismos, éstos pueden proliferar y sobrevivir en su interior dando lugar a la vegetación característica de la EI. La presencia de cuerpos extraños intravasculares, como pueden ser las prótesis cardíacas, introducen nuevas variables que favorecen la EI, ya que los estafilococos, tanto S. aureus como los estafilococos coagulasa negativos [ECN], se pueden adherir formando biocapas1,4,26,27. Una vez colocadas, la interfase anillo-prótesis no está endotelizada y favorece la formación de trombos fibrinoplaquetarios. Los puntos de sutura donde se anclan las prótesis constituyen una vía por la cual los microorganismos pueden invadir el tejido cardíaco y formar abscesos. Además, en las bioprótesis el estrés continuo que origina el movimiento repetitivo puede alterar con el paso de los años la superficie de los velos y predisponer a la infección del trombo fibrinoplaquetario constituido. Por otra parte, el material protésico puede impedir actuar a las defensas del huésped en su inmediato microambiente, alterar el comportamiento de los microorganismos infectantes, al formar biocapas, haciendo imposible erradicar la infección sólo con tratamiento antibiótico1,4,27.
Los microorganismos pueden alcanzar las prótesis por contaminación de la prótesis valvular durante la intervención quirúrgica o por vía hematógena1,4,5,7,8. En la EIVP precoz generalmente se coloniza la prótesis valvular durante la intervención quirúrgica o en el postoperatorio inmediato. Por tanto, la mayoría de estas infecciones son de origen nosocomial. Durante la intervención quirúrgica los microorganismos proceden de la piel, del paciente o del personal asistencial, o de la contaminación del sistema de circulación extracorpórea (Staphylococcus epidermidis, corinebacterias o difteromorfos) y, excepcionalmente, del aire ambiental (Aspergillus spp.)1,4,5,7. En el postoperatorio, los microorganismos alcanzan la prótesis en el curso de una bacteriemia o fungemia cuya puerta de entrada puede ser la infección relacionada con un catéter, de la herida quirúrgica, del pulmón o de la vía urinaria1,4,5,7. Es especialmente importante la asociación entre bacteriemia por S. aureus relacionada con el catéter, resistencia a la cloxacilina (SARC) y el desarrollo de EIVP23. Estudios epidemiológicos y microbiológicos* han relacionado la EIVP precoz con los ECN, principalmente con S. epidermidis19,22,28,29. La EIVP por S. epidermidis sólo se puede erradicar con la exéresis de la prótesis, ya que este microorganismo produce una biocapa que lo adhiere a la prótesis y lo protege de la acción de los antibióticos o de los polimorfonucleares. En la EIVP precoz, la infección de la prótesis generalmente se asocia con invasión perivalvular y disfunción valvular hemodinámica1,30.
La bacteriemia y fungemia nosocomial constituye un riesgo para el desarrollo de una EIVP en los pacientes portadores de prótesis valvulares. En el estudio de Fang et al31, 18 de 115 pacientes (16%) con bacteriemia nosocomial desarrollaron una EIVP, siendo su origen los catéteres intravasculares (61%) o las infecciones de la herida quirúrgica o la piel. La etiología de la EIVP fue estafilocócica en el 55% de casos y producida por bacilos gramnegativos en el 33% de episodios. Un total de 6 de los 19 pacientes (31%) con una bacteriemia por S. epidermidis desarrollaron una EIVP, 4 de 23 (17%) con una bacteriemia por S. aureus y 6 de 58 (10%) con una bacteriemia por bacilos gramnegativos. En 12 de los 18 casos de EIVP la bacteriemia ocurrió en los primeros 60 días31. Por otra parte, Nasser et al32 evaluaron el riesgo de EIVP en 44 pacientes con candidemia de origen nosocomial. Once pacientes (25%) desarrollaron una EIVP. En siete casos (16%) el episodio de candidemia fue coincidente con la EIVP, presentándose una mediana (rango) de 149 (8-1.240) días después de la cirugía cardíaca. Ninguno de estos pacientes tenía una puerta de entrada evidente ni había tenido complicaciones en el postoperatorio. De los 37 pacientes sin evidencia de EIVP en el momento de la candidemia, 4 (11%) desarrollaron una EIVP. Los hemocultivos fueron positivos entre el día 4 y 36 del postoperatorio, pero la EIVP fue diagnosticada 26, 101, 112 y 690 días después. Estos pacientes tuvieron una puerta de entrada conocida y un postoperatorio complicado, y la duración de la candidemia fue mayor (media de 14 días en los cuatro pacientes que desarrollaron una EIVP y de sólo 4 días en los 33 sin EI). Por tanto, es muy importante seguir a los pacientes con prótesis valvulares que tienen un episodio de candidemia, ya que pueden desarrollar una EIVP semanas o meses después.
A partir de los 12 meses, la patogenia de la EIVP tardía y los microorganismos responsables se parecen más a los descritos en la infección de la válvula nativa de la población general1,4,5,7,8,19; es decir, en estos casos la prótesis se coloniza a partir de bacteriemias comunitarias con puerta de entrada orofaríngea, genitourinaria o digestiva en la mayoría de los casos, aunque en los últimos años están aumentando los episodios de EI relacionados con los cuidados sanitarios33,34.
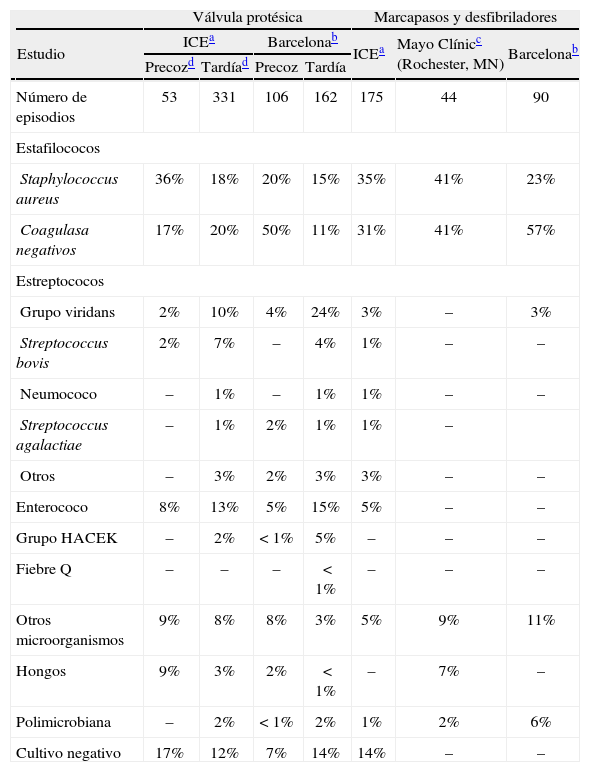
MicrobiologíaCualquier microorganismo puede producir una EIVP1,5,7. Sin embargo, la mayoría de los episodios están producidos por un pequeño número de microorganismos (tabla 1)9,35. Desde un punto de vista microbiológico existe una clara diferencia entre los microorganismos aislados en la EIVP precoz (< 12 meses) y en la EIVP tardía (> 12 meses)1,5,7,9,19,35. En la EIVP precoz predominan los estafilococos (tanto S. aureus como ECN), que en muchas ocasiones son resistentes a la cloxacilina. En el estudio del ICE9, S. aureus (36%) fue el germen más frecuente, seguido de los ECN (16%). Por el contrario, en nuestra experiencia en dos hospitales de Barcelona35, los ECN y casi de forma exclusiva S. epidermidis, fueron la causa más frecuente (50%) de EIVP precoz. Otros microorganismos que causaron EIVP precoz fueron enterococos (tanto E. faecalis como E. faecium), Corynebacterium spp. (difteromorfos), bacilos gramnegativos fermentadores y no fermentadores de la lactosa y hongos (Candida albicans y Aspergillus spp.). Entre el 10 y el 20% de los casos, la EIVP cursa con hemocultivos negativos. Cuando la EIVP aparece en los primeros 60 días tras la cirugía cardíaca, el origen de la infección es nosocomial, como consecuencia de una contaminación quirúrgica o de una bacteriemia o fungemia nosocomial, y los microorganismos sueles ser resistentes a los antimicrobianos.
Etiología de la endocarditis infecciosa en adultos sobre válvula protésica o marcapasos/desfibriladores
| Válvula protésica | Marcapasos y desfibriladores | |||||||
| Estudio | ICEa | Barcelonab | ICEa | Mayo Clínicc (Rochester, MN) | Barcelonab | |||
| Precozd | Tardíad | Precoz | Tardía | |||||
| Número de episodios | 53 | 331 | 106 | 162 | 175 | 44 | 90 | |
| Estafilococos | ||||||||
| Staphylococcus aureus | 36% | 18% | 20% | 15% | 35% | 41% | 23% | |
| Coagulasa negativos | 17% | 20% | 50% | 11% | 31% | 41% | 57% | |
| Estreptococos | ||||||||
| Grupo viridans | 2% | 10% | 4% | 24% | 3% | – | 3% | |
| Streptococcus bovis | 2% | 7% | – | 4% | 1% | – | – | |
| Neumococo | – | 1% | – | 1% | 1% | – | – | |
| Streptococcus agalactiae | – | 1% | 2% | 1% | 1% | – | ||
| Otros | – | 3% | 2% | 3% | 3% | – | – | |
| Enterococo | 8% | 13% | 5% | 15% | 5% | – | – | |
| Grupo HACEK | – | 2% | < 1% | 5% | – | – | – | |
| Fiebre Q | – | – | – | < 1% | – | – | – | |
| Otros microorganismos | 9% | 8% | 8% | 3% | 5% | 9% | 11% | |
| Hongos | 9% | 3% | 2% | < 1% | – | 7% | – | |
| Polimicrobiana | – | 2% | < 1% | 2% | 1% | 2% | 6% | |
| Cultivo negativo | 17% | 12% | 7% | 14% | 14% | – | – | |
Microorganismos aislados en 559 episodios consecutivos de endocarditis sobre válvula protésica o marcapasos/desfibriladores diagnosticados en 61 centros sanitarios de 27 países del Grupo Colaborativo Internacional de Endocarditis (ICE) desde 2000 hasta 20069.
Microorganismos aislados en 358 episodios consecutivos de endocarditis infecciosa diagnosticados en los Hospitales Clínico y Vall d'Hebron de Barcelona desde 1975 hasta 200235.
Microorganismos aislados en 44 episodios consecutivos de endocarditis sobre válvula protésica o marcapasos/desfibriladores diagnosticados en la Clínica Mayo (Rochester, MN, EE.UU.) entre los años 1991 y 2003141.
En la EIVP tardía9,19,35, aunque los estafilococos (S. aureus y ECN) continúan siendo frecuentes, la distribución de microorganismos es más similar a la observada sobre válvula nativa, con predominio de los estreptococos del grupo viridans, Streptococcus bovis, enterococo (en general E. faecalis) y microorganismos del grupo HACEK (Haemophilus spp., Actinobacillus actinomycetemcomitans, Cardiobacterium hominis, Eikenella spp. y Kingella spp.). Entre el 5 y el 15% de los casos la EIVP tardía cursa con hemocultivos negativos.
Los ECN pueden originar una EIVP días, semanas o meses después de la implantación de la prótesis valvular, muchas veces cuando el paciente lleva tiempo en su domicilio y la EI puede simular una EI sobre válvula nativa comunitaria36. Sin embargo, la mayoría de los episodios acontecen entre los días 60 y 36536. En los casos de EIVP precoz, la mayoría son S. epidermidis resistentes a la cloxacilina. En los casos de EIVP tardía, el 50% son S. epidermidis y el otro 50% otras especies de ECN (S. lugdunensis y S. hominis entre otros); sólo una tercera parte son resistentes a la cloxacilina1,10,36,37. Aunque el mecanismo de resistencia a la cloxacilina es el mismo que para S. aureus, los ECN suelen presentar heterorresistencia, lo que hace que su detección sea más difícil. Por tanto, ante una EIVP producida por un ECN debe tratarse inicialmente como un microorganismo resistente a la cloxacilina hasta que el laboratorio de microbiología ofrezca los resultados del antibiograma.
Varios difteroides o Corynebacterium spp., incluyendo C. jeikeium resistente a la cloxacilina, pueden causar una EIVP. La mayoría de estos microorganismos son muy sensibles a la vancomicina y aquellos que sean sensibles a la cloxacilina y la gentamicina pueden ser tratados con un betalactámico y gentamicina, ya que es una combinación sinérgica38. En una serie de 270 endocarditis fúngicas recogida entre 1965 y 1995, 135 episodios (50%) ocurrieron sobre prótesis valvulares39. C. albicans, seguida por otras especies de Candida y Aspergillus spp., fueron las causas más frecuentes de EIVP1,40,41. Hay casos descritos causados por Cryptococcus neoformans, Histoplasma capsulatum y una amplia variedad de hongos, patógenos infrecuentes en el ser humano. Los hemocultivos suelen ser positivos en la EIVP por Candida spp. o C. neoformans, mientras que suelen ser negativos para el resto de hongos. En estos casos es muy importante las tinciones y cultivos de los émbolos o de las vegetaciones cardíacas para llegar al diagnóstico. También se han descrito casos de EIVP producidos por Coxiella burnetii, Mycoplasma hominis, Tropheryma whipplei, micobacterias atípicas y Legionella pneumophila1,5,7. De todos ellos, C. burnetti es una causa relativamente frecuente de EIVP en países donde la fiebre Q es endémica. En una serie de 229 episodios de EI por C. burnetii diagnosticados entre 1985 y 1998, en 157 casos (69%) la EI fue sobre válvula protésica42.
Anatomía patológicaLa vegetación es la lesión característica de la endocarditis infecciosa1,5,7. Se trata de un agregado fibrinoplaquetario, no vascularizado, en cuya matriz existen colonias de microorganismos y escasos leucocitos polimorfonucleares y hematíes. La concentración de microorganismos en su interior es muy elevada, de aproximadamente 108-1010 microorganismos por gramo de tejido. En los pacientes con prótesis valvulares mecánicas las vegetaciones se asientan en la línea de sutura entre el anillo válvular y la prótesis, pudiendo causar una dehiscencia de la misma e invasión miocárdica con abscesos periprotésicos1,5,7,43–47. Los abscesos originados en el anillo aórtico pueden afectar el tejido específico de conducción y provocar distintos grados de bloqueo auriculoventricu-lar1,5,7,43,44,47,48. En los pacientes con bioprótesis u homoinjertos la infección también puede afectar a los velos, pudiendo rasgarlos o perforarlos y originar una insuficiencia valvular grave. En los pacientes que no han necesitado recambio valvular, una vez la EI se ha curado, el endurecimiento de los velos puede causar, a la larga, una estenosis grave. En ocasiones las vegetaciones pueden ser tan grandes que pueden obstruir las prótesis, especialmente en posición mitral1,5,49.
En un estudio efectuado en 85 pacientes con EI sobre válvula mecánica se encontró invasión del anillo y abscesos miocárdicos en la cirugía cardíaca o en la autopsia en el 42 y el 14% de casos, respectivamente22,46. Ismail et al45 encontraron invasión del anillo y dehiscencia valvular en el 82% de 41 casos de EI sobre válvula mecánica. En la EI sobre bioprótesis, sobre todo cuando es precoz (< 12 meses), la afectación del anillo y la invasión anular se objetivó en el 36 y el 54% de casos, respectivamente1,49,50. En una serie de pacientes con EIVP tratados quirúrgicamente, Lytle et al30 encontraron invasión del tejido perivalvular en 43 de 54 (79%) válvulas mecánicas y en 37 de 90 (41%) bioprótesis. Además observaron que la invasión perivalvular era independiente del tiempo transcurrido en los pacientes con válvulas mecánicas, mientras que en los que tenían bioprótesis se objetivaba fundamentalmente cuando la EIVP era precoz (15 de 18 casos [83%] frente a 22 de 71 casos [31%] con EIVP tardía)30.
Las manifestaciones extracardíacas son similares a la EI sobre válvula nativa y dependen fundamentalmente de los embolismos secundarios a la fragmentación de la vegetación (en el sistema nervioso central, el bazo, el riñón), de las metástasis sépticas (bazo, osteoarticulares, piomiositis) cuando el agente causal es muy virulento y de fenómenos inmunológicos1,5,7.
Manifestaciones clínicas y de laboratorioLas manifestaciones clínicas y de laboratorio de la EIVP son similares a las que tienen los pacientes con EI sobre válvula nativa1,5,7, en especial cuando la EIVP es tardía. Cuando la EIVP se presenta en el período postoperatorio inicial, los signos de EI pueden estar ausentes o enmascarados por las complicaciones posquirúrgicas. La elevada frecuencia de afectación perivalvular, especialmente en los pacientes con EI precoz sobre prótesis aórticas condiciona una mayor frecuencia de soplos, insuficiencia cardíaca, fiebre persistente y trastornos de la conducción (bloqueos auriculoventriculares) que los observados en la EI sobre válvula nativa1,5,7,51.
Casi el 40% de pacientes con EIVP tendrá embolismos sistémicos; del 20 al 40% tendrá complicaciones neurológicas (embolias cerebrales, hemorragia cerebral)45,52,53. Los hemocultivos, a no ser que se hayan administrado antibióticos de forma previa al diagnóstico, serán positivos en el 80-90% de pacientes con EIVP (tabla 1)9,35 y con frecuencia la bacteriemia será persistente. Cuando se obtengan hemocultivos positivos para ECN o difteroides, la bacteriemia persistente ayudará a distinguir una bacteriemia verdadera de una contaminación. Aunque se han descrito bacteriemias policlonales por ECN, este fenómeno es infrecuente. Las pruebas de biología molecular pueden ayudar a confirmar el diagnóstico de EIVP cuando se demuestra la clonalidad en los casos de bacteriemia intermitente por ECN54,55. Cuando los hemocultivos son negativos y no se han administrado antibióticos se ha de investigar la existencia de microorganismos de crecimiento lento o que no crezcan en los cultivos convencionales, como por ejemplo estreptococos con dependencia nutricional (Granulicatella spp. o Abiotrophia spp.), microorganismos del grupo HACEK, Brucella spp., Legionella spp., C. burnetii, M. hominis, Bartonella spp., micobacterias atípicas, hongos diferentes a Candida spp. y otros microorganismos (T. whipplei)1,4,7. En estos casos, los cultivos en medios especiales, las pruebas serológicas (detección de antígenos o anticuerpos) y, cuando sea posible, el estudio microscópico, el cultivo y el análisis molecular (RNA ribosómico 16S) de las vegetaciones pueden facilitar el diagnóstico microbiológico56.
El ecocardiograma transtorácico (ETT) combinado con el transesofágico (ETE) utilizando transductores de dos o más planos (o tridimensionales), Doppler pulsado y color son imprescindibles para el diagnóstico y tratamiento de la EIVP1,5,7,56–58. Aunque los dos tipos de ecocardiogramas son complementarios, el ETE proporciona una imagen óptima de las prótesis en posiciones aórtica, mitral y tricuspídea y es más sensible, sin perder especificidad, que el ETT para el diagnóstico de EIVP (el 82-96% frente al 17-36%) independientemente del tipo de prótesis y posición anatómica57–61. Además, el ETE también es superior al ETT para el diagnóstico de los abscesos perivalvulares, las fístulas y las dehiscencias protésicas62. El valor predictivo negativo de un ETE en pacientes en que se sospecha una EIVP oscila entre el 86 y el 94%60,63. Sin embargo, un ETE negativo no descarta una EIVP y, si la sospecha clínica es elevada, debe repetirse transcurridos los 7-10 días. Un segundo ETE negativo hace muy improbable una EIVP, aunque nunca debe excluirse si la evidencia clínica es muy consistente63. Los puntos de sutura de las prótesis y las pequeñas excrecencias de fibrina (strands) pueden simular vegetaciones pequeñas y dar resultados falsamente positivos, especialmente en la evaluación de pacientes con prótesis valvulares y cuadros febriles.
DiagnósticoEl diagnóstico definitivo de la EIVP sólo puede establecerse con absoluta certeza por medio del examen histológico y microbiológico de las vegetaciones obtenidas en el acto quirúrgico o en la necropsia. Desde el punto de vista clínico no existe ningún hallazgo que permita establecer el diagnóstico con absoluta seguridad, por lo que éste se realiza sobre la base de la presencia de determinadas características clínicas, el resultado de los hemocultivos y los hallazgos del ecocardiograma. En la tablas 2 y 3 se describen los criterios diagnósticos de la Universidad de Duke, que son la base para el diagnóstico de la EI en general y de la EIVP en particular64,65. Se consideran criterios mayores la presencia de bacteriemia continua para microorganismos habitualmente responsables de endocarditis y la presencia de claras alteraciones ecocardiográficas (vegetaciones, abscesos o disfunciones protésicas). La fiebre, la presencia de cardiopatía predisponente o la drogadicción, los fenómenos vasculares o inmunológicos y algún dato microbiológico (sin cumplir requisitos de criterio mayor) se consideran criterios menores. El diagnóstico se considera definitivo cuando existen dos criterios mayores, un criterio mayor y tres menores, o cinco criterios menores. El diagnóstico se considera posible cuando existe un criterio mayor y otro menor o tres criterios menores.
Criterios diagnósticos de la endocarditis infecciosa (EI)65
|
Definiciones utilizadas para los criterios diagnósticos de la endocarditis infecciosa65
| Criterios mayores de endocarditis |
|
| Criterios menores de endocarditis |
|
EI: endocarditis infecciosa; ETE: ecocardiograma transesofágico; ETT: ecocardiograma transtorácico.
Los criterios de Duke fueron evaluados en tres estudios con confirmación patológica de la EIVP. El diagnóstico de EIVP fue definitivo en el 76-79% de los casos y posible en el resto66–68. Aunque el ETE no fue realizado en todos los casos, sólo un caso de 118 pacientes evaluados con EIVP fue erróneamente rechazado. La importancia del ETE en la evaluación diagnóstica de la EIVP fue analizada por Roe et al69 en 34 pacientes con sospecha de EIVP. La clasificación de 13 casos (38%) fue cambiada cuando en la evaluación diagnóstica se incluyó el ETE en lugar del ETT. Once casos fueron reclasificados de EI posible a EI definitiva y dos casos que se habían rechazado fueron EI posibles. El valor predictivo positivo del ETE para la EIVP fue del 89%. Como se ha comentado previamente, el ETE puede ser negativo en la EIVP y, por tanto, un resultado negativo nunca debe excluir la EI en presencia de datos clínicos que lo sugieran63,69.
Medidas terapéuticasEl tratamiento de la EIVP se basa en la administración de los antibióticos bactericidas más adecuados para el microorganismo aislado, a las dosis necesarias y durante un tiempo prolongado (en general 6 semanas)1,5,7. Este tratamiento requiere, en muchos casos, la resección quirúrgica de las válvulas protésicas colonizadas, el drenaje de los abscesos, la corrección anatómica de los defectos que haya causado la EIVP y la implantación de una nueva prótesis valvular mecánica o biológica o un homoinjerto1,5,7. Además, deben tratarse de forma adecuada las complicaciones extracardíacas que tengan los pacientes. La compleja valoración de los pacientes con prótesis valvulares en los que se sospecha una EIVP hace que deban ser hospitalizados en centros con experiencia en el manejo de la EI y dispongan de cirugía cardíaca.
Tratamiento antibióticoComo es muy importante identificar el agente etiológico, han de efectuarse los hemocultivos antes de iniciar el tratamiento antibiótico. En pacientes con una EIVP no complicada y hemodinámicamente estables, el inicio del tratamiento antibiótico puede posponerse 2 o 3 días en espera de los resultados. Por el contrario, en los pacientes con EIVP complicada o hemodinámicamente inestables, que pueden requerir cirugía cardíaca urgente, el tratamiento antibiótico empírico debe instaurarse inmediatamente una vez realizados los hemocultivos. El tratamiento antibiótico empírico dependerá de si la EIVP es precoz o tardía1,5,7. En la EIVP precoz predominan los estafilococos resistentes a la cloxacilina, por lo que el tratamiento empírico ha de incluir la vancomicina y la gentamicina. Si la infección ha ocurrido en los 60 primeros días tras el implante valvular, ha de añadirse un betalactámico con actividad frente a bacilos gramnegativos, incluyendo Pseudomonas aeruginosa. Por el contrario, si la EIVP es tardía se administrará el mismo tratamiento antibiótico empírico que en la población general (ampicilina y gentamicina, añadiendo cloxacilina si la duración de los síntomas es menor a 30 días). En cualquier caso, los centros hospitalarios que atiendan a estos pacientes adaptarán este tratamiento empírico a la prevalencia local de microorganismos y su patrón de resistencia antibiótica.
El tratamiento antibiótico específico se señala en la tabla 4 y se explica con detalle en las guías recientemente actualizadas56,70. La EIVP por ECN generalmente está causada en la forma precoz (< 12 meses) por S. epidermidis resistente a la cloxacilina (concentración mínima inhibitoria [CMI] igual o superior a 0,5 mg/l). El tratamiento antibiótico debe ser combinado. Se administrará vancomicina y rifampicina durante 6 semanas como mínimo y gentamicina durante las dos primeras semanas de tratamiento56,70. Los datos in vitro e in vivo en animales de laboratorio y la experiencia clínica indican que la rifampicina tiene un papel clave en los esquemas terapéuticos de las infecciones estafilocócicas asociadas a cuerpos extraños y, por tanto, es muy importante para el tratamiento de la EIVP37,71–75. Como los estafilococos tienen una tasa de mutaciones elevada en el gen donde actúa la rifampicina, ésta no debe darse nunca en monoterapia por la selección rápida de microorganismos resistentes. Esta situación es la que puede observarse en las vegetaciones cardíacas y, debido a que la vancomicina difunde mal a su interior, ha de administrarse gentamicina para evitar la selección de cepas resistentes a la rifampicina. En caso de que no pueda administrarse la gentamicina, puede utilizarse una quinolona (ciprofloxacino o levofloxacino) en su lugar72,75. Si sólo se administra un antibiótico antiestafilocócico, la rifampicina debe añadirse 3-5 días después, una vez se ha reducido el inóculo bacteriano. La reciente aparición de ECN con sensibilidad disminuida o resistencia a la vancomicina es motivo de preocupación dada las pocas alternativas terapéuticas. El papel de los nuevos antibióticos activos frente a los cocos grampositivos multirresistentes, como la daptomicina, el linezolid u otros antibióticos (tigeciclina, dalfopristina con quinupristina, telavancina, nuevas cefalosporinas o quinolonas), está por definir en la EIVP por ECN. Aunque existen pocos datos, si los ECN son sensibles a la cloxacilina (CMI igual o inferior a 0,25 mg/l), la EIVP puede tratarse con cloxacilina, rifampicina y gentamicina56,70. En pacientes alérgicos a la penicilina, las cefalosporinas de primera generación o la vancomicina pueden sustituir a la cloxacilina56,70.
Tratamiento antibiótico de la endocarditis sobre válvula protésica, marcapasos o desfibriladores por estreptococos del grupo viridans (incluyendo Streptococcus bovis), enterococos, estafilococos, microorganismos del grupo HACEK y hongos56
| Microorganismo | Pautas de elección | Duración (semanas) | Pautas en alérgicos a la penicilina | Duración (semanas) |
| Estreptococos del grupo viridans o S. bovis sensibles a la penicilina G (CIM ≤ 0,12 μg/ml) | Penicilina G, 12-18 MU/día en 6 dosis i.v. o | 6 | Vancomicinaa 30 mg/kg/24 h dividida en dos dosis i.v., o | 6 |
| Ceftriaxonac, 2 g/día i.v./ i.m. con o sin | 6 | Teicoplaninab, 6-10 mg/kg/12 h las 9 primeras dosis y cada 24 h a partir de la décima dosis por vía i.v./i.m. | ||
| Gentamicina 3 mg/kg/día i.v./i.m. en una sola dosis | 2 | |||
| Estreptococos del grupo viridans o S. bovis con sensibilidad intermedia a la penicilina G (CIM > 0,12 y ≤ 0,5 μg/ml), cepas tolerantes y variantes nutricionales | Penicilina G o ceftriaxona (misma dosis) + gentamicina (misma dosis) | 6 | Vancomicina (misma dosis) o Teicoplanina (misma dosis) | 6 |
| 2 | ||||
| Enterococos o estreptococos del grupo viridans con resistencia a la penicilina (CIM > 0,5 μg/ml)e | Penicilina G, 24 MU/día i.v. o ampicilina, 12 g/día i.v. en 6 dosis, más gentamicinad, 1 mg/kg (≤ 80 mg) cada 8 h i.v. o | ≥6 | Vancomicina (misma dosis) más gentamicina (misma dosis) | ≥6 |
| Ampicilina (misma dosis) más ceftriaxona 2 g/12 h i.v. | 6 | |||
| Estafilococos (S. aureus) o ECN (S. epidermidis u otros) | Sensibles a cloxacilinaf: Cloxacilina 12 g/día en 6 dosis i.v. + rifampicinag, 300 mg/8 h i.v./v.o. + gentamicina, 1 mg/kg (≤ 80 mg) cada 8 h i.v.) | ≥6≥62 | Vancomicina (misma dosis) + rifampicina, 300 mg/8 h v.o. + gentamicina (misma dosis) | ≥6≥62 |
| Resistentes a cloxacilina: Vancomicina (misma dosis) + rifampicina, (misma dosis) + gentamicina (misma dosis) | ≥6≥62 | Misma pauta | ||
| Corinebacterias y difteroides | Penicilina G 18 MU/día en 6 dosis i.v. + gentamicina (misma dosis) | 62 | Vancomicina (misma dosis) | 6 |
| Resistentes a cloxacilina: Vancomicina (misma dosis) | 6 | |||
| HACEKh | Ceftriaxona (misma dosis), o Ampicilina, 12 g/día en 6 dosis i.v. | 66 | Ciprofloxacino, 800 mg/24 h i.v. o 1.000 mg/24 h v.o. en dos dosis | 6 |
| Hongos | Anfotericina B 1-1,5 mg/kg/día i.v. + 5-fluorocitosina (150 mg/kg/día v.o.) (véase texto) | ≥6≥6 |
Las dosis recomendadas deben ajustarse en pacientes con alteración de la función renal. La dosificación de los aminoglucósidos o de los glicopéptidos en función del peso (dosis en mg/kg) produce concentraciones más elevadas en pacientes obesos, por lo que en estos casos la dosis debe administrarse en función del peso ideal. En caso de alergia a las penicilinas, no deben utilizarse cefalosporinas si existe antecedente de anafilaxis a la penicilina por la potencial alergia cruzada entre las cefalosporinas y las penicilinas.
Microorganismos del grupo HACEK: Haemophilus spp., Actinobacillus actinomycetemcomitans, Cardiobacterium hominis, Eikenella corrodens y Kingella kingae.
Las concentraciones séricas de vancomicina para la endocarditis estreptocócica y enterocócica 1 h después de su infusión deben oscilar entre 30-45 mg/l y el valle es 10-15 mg/l. Para la endocarditis estafilocócica se recomienda que los niveles valle sean de 15-20 mg/l. Si la concentración mínima inhibitoria (CMI) para la vancomicina es de 2 o superior debe considerarse otra alternativa terapéutica (véase texto). La vancomicina debe administrarse lentamente i.v. (1-2 h) para reducir el riesgo del síndrome del hombre rojo secundario a la liberación de histamina.
Las concentraciones séricas pico y valle de la teicoplanina son de 30-40 mg/l y 10-12 mg/l, respectivamente. La teicoplanina puede administrarse i.v. en bolus o i.m. Su posología una vez al día permite su uso en programas de hospitalización a domicilio.
Su posología una vez al día permite su uso en programas de hospitalización a domicilio. La administración i.m. es dolorosa.
Los niveles pico y valle de gentamicina cuando se administra cada 8 h son de 3-4 mg/l y < 1 mg/l, respectivamente.
Pautas recomendadas si los enterococos no son resistentes a las penicilinas, glicopéptidos y no muestran alta resistencia a la gentamicina. La combinación de ampicilina y ceftriaxona es una alternativa a la de ampicilina y gentamicina cuando no hay alta resistencia a la gentamicina y se puede administrar en pacientes con insuficiencia renal y es la pauta de elección cuando hay alta resistencia a los aminoglucósidos.
Si los estafilococos son sensibles a la penicilina (CMI ≤ 0,1 μg/ml) puede sustituirse la cloxacilina por penicilina G sódica (24 MU/día en 6 dosis) durante 6 semanas.
La rifampicina se recomienda en infecciones por ECN. Debe utilizarse combinada con la gentamicina para evitar el desarrollo de resistencia a la rifampicina. Su eficacia en infecciones por S. aureus en controvertida (ver texto). La rifampicina aumenta los requerimientos de dicumarínicos, metadona y anticonceptivos orales (inductor enzimático).
El tratamiento de la EIVP por S. aureus se ha extrapolado de la EIVP por ECN tanto para las cepas sensibles a la cloxacilina como para las resistentes (SARC)56,70. En esta última situación es importante conocer la CMI a la vancomicina, ya que en pacientes con bacteriemia por SARC aquéllos que tenían una CMI mayor de 1 mg/l presentaban mayor mortalidad76. No hay información en la EIVP por SARC, pero sería lógico en estos casos utilizar la daptomicina a dosis de 10 mg/kg/día. Este nuevo antibiótico lipopeptídico tiene aprobado su uso clínico para la EI derecha sobre válvula nativa por S. aureus (resistente o no a la cloxacilina) en una dosis de 6 mg/kg/día, pero los resultados en la EI izquierda por SARC fueron tan pobres como los de la vancomicina77. Teniendo presente que en comparación con la vancomicina presenta una actividad bactericida muy rápida, actúa frente a microorganismos en fase estacionaria, difunde muy bien a las vegetaciones y tiene una actividad en el modelo experimental de endocarditis por SARC con una CMI a la vancomicina de 2 mg/l superior a la vancomicina78, un panel de expertos español79 ha recomendado utilizar 10 mg/kg/día en los casos que se utilice para tratar la EIVP por S. aureus. La combinación de fosfomicina e imipenem también podría ser una alternativa, aunque hay poca experiencia clínica80. El papel de otros antibióticos activos frente a cocos grampositivos multirresistentes (v. apartado anterior) está por definir en la EIVP por SARC. Finalmente, dado que la endocarditis protésica por S. aureus tiene una elevada mortalidad (30-40%), muchos autores recomiendan efectuar cirugía valvular precoz independientemente de que existan indicaciones cardiológicas en base a los resultados de algún estudio observacional66.
Los enterococos (E. faecalis, 90% y E. faecium, 10%) y el 15-20% de las cepas de estreptococos del grupo viridans son resistentes a la penicilina (CMI superior a 0,5 mg/ml)56. El tratamiento de la endocarditis por enterococo es complicado debido a la relativa resistencia a la penicilina, penicilinas de amplio espectro y vancomicina y a la aparición en los últimos años de cepas resistentes a las penicilinas, aminoglucósidos y glicopéptidos. La combinación de penicilina, ampicilina o vancomicina con gentamicina o estreptomicina tiene un efecto sinérgico y bactericida frente a dicho microorganismo y constituye el tratamiento de elección de esta endocarditis56,70. Sin embargo, este efecto bactericida sinérgico desaparece cuando los enterococos presentan resistencia a la penicilina o vancomicina o tienen resistencia de alto nivel (RAN) a los aminoglucósidos (≥ 500 μg/ml de gentamicina o ≥ 1.000 μg/ml de estreptomicina), una situación clínica relativamente frecuente56,70. La RAN a la gentamicina es cruzada para netilmicina, kanamicina, tobramicina y amikacina. Por ello es muy importante conocer con detalle en cada capa causante de endocarditis su patrón de sensibilidad antibiótica. Un gran avance ha sido demostrar in vitro, en modelos animales y en un ensayo clínico abierto no comparativo en humanos que la combinación de ampicilina con cefalosporinas de tercera generación (fundamentalmente ceftriaxona) es sinérgica y bactericida en cepas sin resistencia a las penicilinas, con o sin alto nivel de resistencia a los aminoglucósidos, y muestra unas tasas elevadas de curación81. En la actualidad, esta combinación de ampicilina y ceftriaxona es una alternativa eficaz y segura a la de ampicilina y gentamicina.
El tratamiento de la EIVP por cepas de enterococo multirresistentes (penicilina, ampicilina, aminoglucósidos y vancomicina), en especial por E. faecium resistente a la vancomicina, no se conoce bien56. El tratamiento se basa en administrar los antibióticos que se han utilizado para el tratamiento de la bacteriemia por dicho microorganismo, como son la asociación de dalfopristina/quinupristina (no es activa frente a E. faecalis), la daptomicina, el linezolid u otros antibióticos activos frente a cocos grampositivos multirresistentes por vía compasiva56. La cirugía cardíaca también debe considerarse en estos pacientes.
El tratamiento de la EI fúngica sobre válvula protésica plantea dificultades especiales, porque las vegetaciones suelen adquirir gran tamaño y la concentración de antifúngicos en el seno de las mismas es baja56,70. Por otra parte, estos fármacos poseen un margen terapéutico muy estrecho y la toxicidad concomitante es frecuente. La mortalidad de la EI por Candida spp. y de la EI por Aspergillus spp. es del 40-60% y mayor del 90%, respectivamente56. Después de 7 o 14 días de tratamiento con dosis plenas de anfotericina B (1-1,5 mg/kg de peso y día) y 5-fluocitosina (150 mg/kg de peso por vía oral y día repartido en 4 tomas) es necesario efectuar recambio valvular precoz39,40,41,56,70 y a continuación seguir con el mismo tratamiento durante como mínimo 6 u 8 semanas (dosis total de anfotericina de unos 3 g). Tras observarse recidivas hasta 2 años después, muchos autores recomiendan administrar tratamiento supresivo por vía oral durante varios meses (un año) o indefinido con azoles activos frente a Candida spp. o Aspergillus spp., como por ejemplo fluconazol o voriconazol, respectivamente40,41,56,82. El papel de las nuevas formulaciones lipídicas de anfotericina B, de las nuevas equinocandinas (caspofungina o micafungina) o de los nuevos azoles (voriconazol o posaconazol) como tratamiento de la fase aguda o supresivo, y de sus potenciales combinaciones (por ejemplo, anfotericina B lipídica o voriconazol asociados a una equinocandina) está aún por definir.
Para el tratamiento de la EIVP producida por otros microorganismos como los estreptococos del grupo viridans, S. bovis, estreptococos con dependencia nutricional, corinebacterias, microorganismos del grupo HACEK y bacilos gramnegativos remitimos al lector a las guías de tratamiento antibiótico de la EI56,70.
Todo el tratamiento antibiótico de la EIVP se realiza en el hospital. Sólo casos muy seleccionados con EIVP tardía por estreptococos del grupo viridans o S. bovis sensibles a la penicilina podrían ser candidatos para finalizar el tratamiento antibiótico en su domicilio tras ser tratados las dos primeras semanas en el hospital56.
Tratamiento quirúrgicoLa cirugía, asociada al tratamiento antibiótico, ha mejorado el pronóstico de la EIVP. En la actualidad, el 40-50% de pacientes con EIVP precisará un tratamiento quirúrgico en el curso de la infección23,25,83,84. En general este tratamiento consiste en retirar el material infectado e implantar una nueva prótesis valvular. En los pacientes con gran destrucción del anillo aórtico la implantación de un homoinjerto es, posiblemente, la técnica quirúrgica de elección.
Los pacientes con EIVP que presenten insuficiencia cardíaca moderada o grave por disfunción de la prótesis, abscesos perivalvulares o fístulas o dehiscencia valvular parcial tienen una indicación clara de recambio valvular precoz1,5,7,8,56. Ésta también debe considerarse en pacientes que tengan embolismos sistémicos de repetición tras el inicio del tratamiento antibiótico efectivo o persistan con fiebre o bacteriemia más de 10 días a pesar de un tratamiento antibiótico adecuado, como en las EIVP por cocos grampositivos resistentes (p. ej., SARC, E. faecium), bacilos gramnegativos (diferentes a los del grupo HACEK), hongos y levaduras, o en aquellos casos con cultivos negativos1,5,7,8,51,56,85,86. Finalmente debe considerarse la cirugía en la recidiva de la EIVP1,5,7,8.
La EIVP complicada es más frecuente en la posición aórtica y en la EIVP precoz (< 12 meses)51. El tratamiento combinado médico y quirúrgico en la EIVP complicada se acompaña de una mayor supervivencia y de menos recidivas, rehospitalizaciones para cirugía valvular y mortalidad tardía relacionada con la EIVP que el tratamiento médico aislado51,86–88.
Si la indicación quirúrgica está clara, ha de procederse a la misma sin dilación, aunque el paciente sólo haya recibido unas horas de tratamiento antibiótico, ya que el retraso de la cirugía aumentará la mortalidad1,5,7,56,86,89. La mortalidad postoperatoria es proporcional a la gravedad de la afectación hemodinámica en el momento de la cirugía50,90. Por otra parte, la recidiva de la endocarditis por el mismo patógeno sobre la prótesis recién implantada es muy poco frecuente50,91,92. Ocasionalmente, los pacientes con EIVP que han respondido al tratamiento antibiótico desarrollan una disfunción valvular, pero permanecen hemodinámicamente estables. La cirugía cardíaca en estos casos puede retrasarse hasta la fase final del tratamiento antibiótico.
La mortalidad de los pacientes con un absceso perivalvular o una fístula intracardíaca es elevada93,94, aunque no tengan insuficiencia cardíaca, cuando sólo son tratados con antibióticos. Por el contrario, aunque la cirugía reconstructiva es compleja, se ha asociado a tasas de supervivencia del 80%87,95,96. La recidiva de la EIVP después de un tratamiento antimicrobiano adecuado refleja, por lo general, una enfermedad invasiva no diagnosticada. Estos paciente han de volver a ser tratados con antibióticos y cirugía51,85.
El pronóstico de la EIVP por S. aureus ha mejorado con la cirugía valvular precoz. Con sólo tratamiento médico, el 70% de los pacientes fallecen97,98. Las complicaciones intracardíacas de la EIVP por S. aureus incrementan la mortalidad casi 14 veses. Sin embargo, la mortalidad se puede reducir 20 veces (p = 0,004) mediante la intervención quirúrgica durante el tratamiento antibiótico66. La mejoría de la supervivencia también se observó en aquellos pacientes sin complicaciones intracardíacas. Varios estudios de EIVP por S. aureus sugieren que el pronóstico es mejor con el tratamiento combinado médico y quirúrgico86,99–101.
El papel de la cirugía para prevenir los embolismos sistémicos no es claro56. Los paciente con una EI sobre válvula nativa que tienen vegetaciones mayores de 10 mm tienen más embolias sistémicas que los que tienen vegetaciones más pequeñas102. Aunque no hay estudios que correlacionen el tamaño de la vegetación y los embolismos sistémicos en pacientes con EIVP, las tasas globales de embolismos son similares a los de la EI sobre válvula nativa. Además, estas tasas disminuyen con el tratamiento antibiótico efectivo. Por tanto, no queda claro si hay que operar a los pacientes simplemente por tener vegetaciones grandes (> 10 mm). La decisión ha de tomarse de manera individualizada y según el contexto clínico del paciente1,5,7,56.
La supervivencia de los pacientes con EIVP complicada intervenidos quirúrgicamente en centros de referencia oscila entre el 70 y el 90%30,87,95,96,103–106. Los resultados a largo plazo también son optimistas. La EIVP recurrente es baja y afecta al 6-15% de pacientes. Una nueva intervención quirúrgica por una endocarditis recurrente o por disfunción de la nueva prótesis implantada se necesita en el 18-26% de casos30,50,51,87,96,104,106. La supervivencia a los 5 años de la cirugía por una EIVP oscila entre el 54 y el 87%30,50,96,103,104
La EIVP tardía por estreptococos del grupo viridans, S. bovis, enterococo o microorganismos del grupo HACEK sin evidencia de disfunción protésica ni invasión perivalvular, puede ser curada sólo con tratamiento antibiótico1,5,7,56,70
Finalmente, los pacientes con EIVP pueden requerir otro tipo de intervenciones quirúrgicas1,5,7,56. La aparición de abscesos viscerales secundarios a embolias sépticas puede obligar a la práctica de intervenciones quirúrgicas para su tratamiento. La situación más frecuente es la del absceso esplénico que obliga a efectuar una esplenectomía. Más difícil es la actuación terapéutica en los raros casos en los que se diagnostica un aneurisma micótico antes de su rotura. En esta situación tiene que considerarse su ablación por técnicas angioinvasivas o cirugía de acuerdo con la accesibilidad del aneurisma.
Tratamiento anticoagulanteEl tratamiento anticoagulante (dicumarínicos o heparina) en los pacientes con una EIVP activa es controvertido56,107–111. En un estudio en pacientes con una EI sobre válvula mecánica se observaron accidentes vasculares cerebrales en 16 de 133 pacientes (12%) que recibían anticoagulantes frente a 32 de 76 pacientes (42%) que no los recibían. Además, las hemorragias cerebrales no fueron más frecuentes entre los pacientes anticoagulados107. En general, si un paciente con EIVP estaba previamente anticoagulado con dicumarínicos se recomienda mantener la anticoagulación cambiando de dicumarínicos a heparina sódica durante todo el tratamiento con el fin de poder manejar mejor la antiacoagulación en caso de complicaciones1,5,7,56. Si el paciente presenta una hemorragia cerebral o tiene alguna contraindicación para recibir tratamiento anticoagulante (p. ej., coagulación intravascular diseminada en la EIVP por S. aureus), éste se debe parar hasta que se resuelva la complicación. Finalmente, ha de recordarse que la rifampicina es un potente inductor enzimático y aumenta el metabolismo de los dicumarínicos, por lo que cuando se administra se requerirá un aumento de dosis de los dicumarínicos y cuando se suspenda tendrá que reducirse su dosis para tener el mismo efecto anticoagulante.
PronósticoLa EIVP es la forma más grave de endocarditis, con una mortalidad global que oscila entre el 15 y el 45%84. En un estudio reciente del ICE de 556 episodios de EIVP, la mortalidad fue del 23%23. En el análisis multivariado las variables que se asociaron de forma independiente a un peor pronóstico fueron: la edad, la EIVP asociada a los cuidados sanitarios, la infección por S. aureus, la bacteriemia persistente, la insuficiencia cardíaca, la presencia de abscesos perivalvulares y la existencia de un accidente vascular cerebral23.
PrevenciónLos pacientes a los que se implantan prótesis valvulares, y por tanto tienen riesgo de desarrollar una EIVP, deben recibir instrucciones sobre medidas de prevención de la enfermedad y también de medidas de actuación ante la aparición de un síndrome febril. Es importante que los pacientes acudan con regularidad al dentista y tengan una excelente higiene bucal. Por otra parte, tienen que saber que si presentan fiebre durante varios días sin focalidad aparente, nunca han de tomar antibióticos sin que previamente se haya considerado la posibilidad diagnóstica de endocarditis y se haya valorado la obtención de hemocultivos. En los pacientes con prótesis valvulares que están ingresados en centros sanitarios o que requieren manipulaciones instrumentales se ha de ser extremadamente cuidadoso en la manipulación de vías venosas o catéteres para intentar evitar el riesgo de endocarditis nosocomial34.
Las recomendaciones de la profilaxis antibiótica de la EI de la Sociedad Americana de Cardiología (AHA) del año 2007 son considerablemente distintas a las anteriores112. Un panel de expertos internacional determinó que no existen pruebas concluyentes que relacionen la mayoría de los procedimientos dentales, gastrointestinales o genitourinarios con el desarrollo de endocarditis infecciosa. Estas nuevas recomendaciones harán que se deba actualizar la mayoría de recomendaciones en los países europeos113. La AHA sólo recomienda administrar profilaxis antibiótica a los pacientes con cardiopatías de alto riesgo (tabla 5), como son las prótesis valvulares, la endocarditis previa, algunas cardiopatías congénitas y a los receptores de trasplante cardíaco con una enfermedad cardíaca valvular112.
Cardiopatías de alto riesgo en las que la profilaxis antibiótica está recomendada según la Asociación Americana de Cardiología112
|
Cardiopatía congénita cianótica que no ha sido corregida, que abarca aquellas con derivaciones o conductos paliativos; cardiopatía congénita corregida por completo con un dispositivo o un material protésico, colocado mediante una cirugía o cateterismo, durante los primeros seis meses posteriores al procedimiento, ya que la epitelización ocurre durante ese periodo de tiempo; y cardiopatía congénita con un parche protésico o una prótesis (que inhibe la epitelización) con defectos residuales en el sitio o al lado de este.
Además, sólo considera la profilaxis antibiótica en los procedimientos dentales que incluyan la manipulación de tejido gingival o de la zona periapical de los dientes o la perforación de la mucosa bucal (p. ej., una extracción dentaria)112. No se recomienda la profilaxis antibiótica en los procedimientos gastrointestinales o genitourinarios. Debe administrarse profilaxis si se efectúa un procedimiento del tracto respiratorio o sobre un tejido infectado en los pacientes de alto riesgo. Sin embargo, los autores de este capítulo creemos que se puede reservar la indicación de hacer profilaxis antibiótica en otras circunstancias dependiendo de las características individuales de cada caso.
Los antibióticos han de ser eficaces frente a los estreptococos del grupo viridans en los procedimientos dentales112. En la tabla 6 se indica el antibiótico de elección en condiciones normales y en los pacientes alérgicos a la penicilina, las dosis y las vías de administración. Es suficiente con administrar una única dosis de antibióticos antes del procedimiento, ya que se ha comprobado que la bacteriemia es de corta duración.
Profilaxis antibiótica de la endocarditis infecciosa para adultos según la Asociación Americana de Cardiología112
| Tipo de procedimiento | Pauta de elección | Pautas en alérgicos a la penicilinab |
| 1. Procedimientos dentales | Vía oral, administrar 1 h antes (dosis única):
| Vía oral, administrar 1 h antes (dosis única):
|
Vía parenteral, administrar 30 min antes i.m. o i.v. (dosis única):
| Vía parenteral, administrar 30 min antes i.m. o i.v. (dosis única):
| |
| 2. Procedimientos gastrointestinales o genitourinarios | No se recomienda la profilaxis antibiótica | |
| 3. Cirugía cardíaca valvulard |
|
|
Cuando se sospecha que el paciente tiene cepas de estreptococos del grupo viridans resistentes a la penicilina (antibioticoterapia previa) se recomienda utilizar clindamicina, un macrólido o un glicopéptido.
Las cefalosporinas no deberían utilizarse en los pacientes con antecedentes de hipersensibilidad inmediata a las penicilinas (urticaria, angioedema o anafilaxis).
El antibiótico debe administrarse en la inducción anestésica, debiéndose repetir la dosis en las intervenciones prolongadas (> 3-4 h) o al finalizar la cirugía extracorpórea en los casos de cirugía cardíaca valvular. En los pacientes sometidos a cirugía de revascularización coronaria o implantación de un marcapasos/desfibrilador una sola dosis de antibiótico en la inducción anestésica es suficiente.
La vancomicina debe administrarse lentamente i.v. (1-2 h) ya que puede producir hipotensión y exantema cutáneo, lo que puede ser especialmente peligroso durante la inducción anestésica. En Europa, la teicoplanina (400-600 mg) puede ser una alternativa a la vancomicina al poder administrarse en bolus i.v. o i.m y no tiene los efectos secundarios de la vancomicina.
Aunque el recambio de una válvula cardíaca se considera cirugía limpia y, por tanto, con un riesgo de infección inferior al 5%, su gravedad justifica la utilización de antibióticos profilácticos, tal como se recomienda en la tabla 6112.
Infecciones asociadas a las prótesis vascularesIncidenciaLa infección es una de las complicaciones más graves de las prótesis implantadas en el territorio vascular arterial1–5. La incidencia es inferior al 1% en los implantes colocados para la reconstrucción de la aorta y de las arterias ilíacas y del 2 al 5% en las prótesis que atraviesan el área inguinal, como las aortofemorales o las femoropoplíteas114,115. En una serie reciente, con unos 14.000 pacientes intervenidos, la incidencia de infección quirúrgica en la reparación mediante prótesis de los aneurismas a nivel aórtico se sitúa en cifras inferiores al 1% a los 2 años de seguimiento, sin observarse diferencias significativas entre los métodos empleados para la reparación, cirugía abdominal abierta o colocación endoluminal de la prótesis116.
La mortalidad relacionada con las infecciones de las prótesis vasculares puede alcanzar el 40% en las colocadas en aorta abdominal, la amputación de miembros inferiores se realiza en el 10-30% de los casos, sobre todo en prótesis infrainguinales, y se produce una reinfección en casi el 20% de los pacientes intervenidos117.
PatogeniaLos mecanismos patogénicos que determinan el desarrollo de la infección de una prótesis vascular son la contaminación durante el acto operatorio de su implantación, la extensión de la infección desde un foco adyacente, como puede ser el tubo digestivo en la aorta abdominal o la infección de la herida quirúrgica inguinal, o en raras ocasiones la diseminación hematógena desde un foco distante de infección1–3,5.
La contaminación del material protésico durante la cirugía es el mecanismo más frecuente de infección de las prótesis vasculares. Las bacterias que permanecen en la pared arterial proliferan en la zona de unión entre el material protésico y la arteria, diseminándose a través de la superficie exterior del vaso y dando lugar a una colección purulenta que rodea toda la prótesis y que progresa por los tejidos adyacentes. Cuando la infección se produce como consecuencia de una herida contaminada adyacente, generalmente de localización en la zona inguinal, la prótesis queda englobada dentro del tejido infectado afectando a toda la superficie externa de la misma, así como a los puntos de sutura arterial1–3,5,118,119.
La erosión de una prótesis de aorta abdominal sobre el tubo digestivo, a menudo sobre la pared duodenal, puede ocasionar un contacto de la misma con la luz intestinal y una infección aguda o crónica de la misma, que generalmente es muy grave ocasionando una hemorragia digestiva masiva por afectación de los vasos adyacentes1–3,5.
MicrobiologíaLos microorganismos causantes de esta infección varían dependiendo del mecanismo patogénico implicado1–3,5. Así, en las infecciones precoces de las prótesis vasculares en que el microorganismo se adquiere en el momento de la intervención o por contigüidad a partir de la herida quirúrgica infectada, el principal agente etiológico es S. aureus en el 25-35% de los casos, seguido de enterobacterias y P. aeruginosa. Cuando se produce una comunicación entre la prótesis vascular y el intestino (prótesis intrabdominales) pueden aislarse, a partir del hemocultivo, enterobacterias, enterococos y microorganismos anaerobios. En estos casos las infecciones son polimicrobianas en el 15-35% de los pacientes. Las infecciones tardías de las prótesis vasculares suelen estar causadas por S. epidermidis. En los pacientes sometidos a hemodiálisis a través de una prótesis arteriovenosa, el microorganismo implicado con más frecuencia es también S. aureus seguido de S. epidermidis y enterobacterias5,120,121. Con frecuencia los estafilococos son resistentes a la cloxacilina.
Manifestaciones clínicasLas manifestaciones clínicas de las infecciones de las prótesis vasculares dependen de su lugar anatómico de implantación1–3,5. Las prótesis que atraviesan la zona inguinal generalmente tienen sintomatología de infección en los primeros meses después de la cirugía1–3,5. La manifestación clínica más característica es la aparición de una tumoración inguinal, que puede ser dolorosa y eritematosa, acompañada de fiebre o febrícula. En ocasiones, puede aparecer un trayecto fistuloso de drenaje a dicho nivel por progresión de la infección protésica hacia el exterior. En algunos pacientes puede formarse un seudoaneurisma en la zona de la anastomosis de la prótesis con la arteria, que puede condicionar la aparición de hemorragia, embolias distales o trombosis de la prótesis.
La infección de las prótesis implantadas en la aorta abdominal produce una clínica solapada de febrícula, molestias abdominales difusas y, a veces, sangrado retroperitoneal1–3,5. La aparición de un seudoaneurisma puede dar lugar a una masa abdominal palpable o a hidronefrosis por obstrucción de los uréteres. Pueden producirse embolismos en las extremidades inferiores y aparecer petequias distales. La erosión de la pared abdominal adyacente a una prótesis, por el trauma pulsátil crónico, puede presentarse tras varios años de su implantación en forma de fiebre, embolismos periféricos y hemorragia digestiva, que puede ser poco cuantiosa si la erosión se produce sobre la pared de la prótesis o masiva si afecta a la zona de la anastomosis con la aorta1–3,5. En algunos pacientes se documenta la presencia de bacteriemia por bacterias entéricas (bacilos gramnegativos o enterococos). La aparición de hemorragia digestiva, en forma de hematemesis o melenas, en un paciente portador de una prótesis vascular aórtica ha de hacer sospechar la existencia de una fístula aortoentérica1–3,5,120–122.
DiagnósticoLa presencia de signos locales de infección, la hemorragia anastomótica, la trombosis de la prótesis o la aparición de un seudoaneurisma facilitan el diagnóstico clínico de una infección protésica vascular. La observación de un trayecto fistuloso adyacente a la prótesis o la propia prótesis en el fondo de una herida abierta son también signos claros de infección de la misma1–3,5,121.
En los pacientes sin signos clínicos evidentes de infección es necesario la realización de una tomografía computarizada abdominal (TCA)1–5,121. Esta técnica es la herramienta fundamental para el diagnóstico, su sensibilidad supera el 90% y su especificidad es mayor del 70%. La TCA permite visualizar signos de infección, como son la ausencia de incorporación de la prótesis a los tejidos contiguos, la existencia de un seudoaneurisma, la presencia de colecciones líquidas periprotésicas o aire adyacente a la prótesis, o bien, sangre retroperitoneal si hay una dehiscencia de la anastomosis. Si existe la sospecha de una fistula aortoentérica es necesario la administración de contraste oral para su detección radiológica. En estos casos, si el paciente está estable, el diagnóstico puede establecerse también mediante la observación del punto de la erosión duodenal o yeyunal mediante una endoscopia digestiva. Con la TCA puede efectuarse una aspiración del líquido periprotésico para practicar una tinción de Gram y un cultivo del mismo, de gran utilidad para establecer el diagnóstico etiológico de la infección. En el postoperatorio inmediato los hallazgos de la TCA son difíciles de interpretar1–3,5,123,124.
La resonancia magnética puede ser de utilidad para el diagnóstico de la infección, aunque la sensibilidad y especificidad son similares a la TCA1–5. La arteriografía puede ser útil para demostrar la permeabilidad de la prótesis y ofrecer un mapa arterial preoperatorio adecuado1–5. Sin embargo, es una técnica invasora con riesgo de complicaciones asociadas. Los estudios ecográficos son de poca utilidad, ya que solamente pueden detectar la presencia de un seudoaneurisma, de masas inguinales o de colecciones periprotésicas a nivel de prótesis superficiales. Además, esta técnica no permite diferenciar entre hematoma y colección infecciosa1–3,5,124.
Las técnicas de medicina nuclear1–5, mediante el uso de diversos isótopos, como el tecnecio, el citrato de galio, los leucocitos marcados con indio o la fluorodeoxiglucosa, son de utilidad para la confirmación de una infección protésica en pacientes asintomáticos con sospecha por los hallazgos de la TCA. En el postoperatorio inmediato pueden obtenerse resultados de difícil interpretación124,125.
Los hemocultivos son generalmente negativos porque la infección no afecta a la luz de la prótesis. La demostración etiológica de la infección se realizará por el cultivo de la prótesis o del material de la colección periprotésica obtenidos por punción y aspiración guiada por una técnica de imagen o durante el procedimiento quirúrgico de reparación de la infección1–3,5. Los microorganismos están incorporados en una biocapa alrededor de la prótesis, por lo que es aconsejable realizar una sonicación de la misma de forma previa para incrementar la rentabilidad de los cultivos bacterianos1–3,5,121.
Tratamiento y prevenciónLa infección de las prótesis vasculares requieren siempre de una evaluación cuidadosa del cirujano vascular para su reparación quirúrgica. En la mayoría de ocasiones es imprescindible la extracción amplia del material infectado y la reperfusión del área afectada mediante la colocación de una nueva prótesis a través de una zona extraanatómica no infectada. En algunos pacientes, puede implantarse un homoinjerto criopreservado, una nueva prótesis impregnada de antibióticos o una vena autóloga en la misma zona de la infección, una vez efectuada una adecuada limpieza quirúrgica de la misma1–3,5,126. En un mataanálisis reciente sobre las diferentes modalidades de tratamiento quirúrgico de las infecciones protésicas vasculares se concluye que, a pesar de las limitaciones metodológicas de los estudios analizados, no existen diferencias significativas entre las técnicas empleadas y que, por lo tanto, debería cuestionarse la elección en primera instancia de la derivación extraanatómica en estas infecciones127.
El tratamiento antimicrobiano de estas infecciones no está bien establecido. Las pautas empíricas de las infecciones precoces deben incluir antimicrobianos activos frente a S. aureus y a bacilos gramnegativos, durante al menos 4 o 6 semanas1–3,5. En las infecciones de aparición tardía es necesario ampliar la cobertura para estafilococos coagulasa negativos. La obtención de cultivos positivos del material quirúrgico de la reparación permite adecuar el tratamiento antimicrobiano, que muchas veces se administra durante un período de 3 a 6 meses1–3,5,120,121.
A pesar de las tasas reducidas de infección quirúrgica asociada a la colocación de una prótesis vascular, la administración de profilaxis antimicrobiana es una práctica claramente recomendada. La cefazolina a dosis de 2 g cada 8 h, durante un período no superior a las 48 h, es la pauta estándar de profilaxis1–5,128,129. La vancomicina puede utilizarse en casos de hipersensibilidad tipo I a los betalactámicos o si existe una prevalencia elevada de SARC1–5,128,129.
Infecciones asociadas a los dispositivos de electroestimulación cardíacosIntroducciónLos marcapasos (MCP) cardíacos y los desfibriladores implantables (DI) para cardioversión, sistemas de electroestimulación cardíaca, han revolucionado el tratamiento de los pacientes con trastornos del ritmo y su uso se ha aumentado de forma considerable en los últimos años1–3,5. Se estima que en el mundo más de 200.000 personas son portadores de DI y que los enfermos con MCP permanentes superan ampliamente los 3 millones. En el registro de la Sociedad Española de Cardiología se documenta una tasa de implantación cercana a 30.000 generadores de MCP para el año 2005130 y superior a 3.000 DI para 2006131.
Aunque las tasas de infección de estos dispositivos han disminuido en relación con la reducción de su tamaño y de la mejoría en la técnica quirúrgica para su implantación, la frecuencia de infección se sitúa entre el 1 y el 6%, en especial en aquellos casos en que es necesaria la reimplantación de un nuevo generador132,133. En una serie de 8.303 MCP insertados en una institución se constató una infección relacionada con el dispositivo en 468 pacientes (5,6%). En 44 pacientes (0,5% del total) se diagnosticó una endocarditis134. En estudios poblacionales se ha observado una incidencia de 550 casos de infección por cada millón de receptores de MCP135. La incidencia anual estimada es, aproximadamente, de 1 episodio de infección por cada 1.000 MCP implantados136.
ClasificaciónLas infecciones de los MCP o los DI pueden dividirse en dos categorías1–3,5: a) infección de la zona del generador y/o del trayecto subcutáneo de los electrodos, que es la más frecuente, y se produce generalmente durante la implantación del sistema, y b) infección de la porción transvenosa de los electrodos con o sin afectación del bolsillo del generador. En esta categoría estarían incluidas las endocarditis relacionadas con estos dispositivos1.
En ocasiones, el generador o los electrodos producen una erosión en la piel adyacente, en ausencia de signos evidentes de infección. La posibilidad de contaminación del sistema, a través de estas erosiones, hace que se tenga que actuar como si se tratara de una infección a dicho nivel.
PatogeniaExisten diversos mecanismos patogénicos que contribuyen al desarrollo de una infección de MCP o DI1–3,5. La infección precoz, diagnosticada generalmente en los meses siguientes a la implantación o a la manipulación del sistema, depende de la contaminación intraoperatoria del dispositivo o del tejido donde se implanta. En un estudio reciente, se ha demostrado mediante técnicas de biología molecular que los aislados de estafilococos productores de infecciones precoces son idénticos a los obtenidos tras el cultivo de muestras cutáneas adyacentes al lugar de la inserción, tanto de forma previa como posteriormente a la implantación137. La infección tardía se asocia generalmente a una erosión mecánica primaria de la piel adyacente al bolsillo del generador con posterior penetración de los microorganismos a través de la misma. En cualquiera de estas situaciones, la infección puede progresar desde el generador a través de los electrodos y llegar a afectar las superficies endocárdicas del corazón.
La infección del sistema desde sitios distantes por vía hematógena es extremadamente infrecuente y solamente se han descrito casos producidos en el contexto de una bacteriemia por S. aureus1–3,5. La respuesta del huésped a los electrodos intravenosos puede ofrecer una protección frente a la infección desde focos distantes de bacteriemia. Aproximadamente una semana después de la implantación, la parte del electrodo en contacto con la íntima del vaso empieza a estar parcialmente incorporada en la pared vascular por un tejido conectivo y un recubrimiento endotelial. Este tejido fibroso, además de dificultar la retirada de los electrodos, puede proteger al electrodo frente a la adherencia de bacterias circulantes por el torrente sanguíneo138.
Factores de riesgoLos factores de riesgo para el desarrollo de una infección de MCP o DI incluyen procesos generales como la malnutrición, las neoplasias, la diabetes mellitus, las enfermedades cutáneas crónicas, y el uso de corticoides, inmunosupresores o anticoagulantes1–3,5. Entre los factores relacionados con la cirugía, la duración prolongada, la reoperación, el recambio del generador y la hemorragia del bolsillo del generador son factores relacionados con la aparición de la infección1–3,5.
La manipulación reciente del sistema (nueva implantación, revisión o recambio del generador) es el factor de riesgo más importante relacionado con la aparición de una infección. Asimismo, la inserción previa de un sistema temporal de electroestimulación cardíaca, generalmente por acceso en vena femoral, puede aumentar el riesgo de infección135. En el análisis multivariante de un estudio de casos y controles se ha demostrado que el riesgo de infección aumenta de forma significativa e independiente en pacientes con tratamiento esteroideo prolongado y con más de dos electrodos y que el uso previo de profilaxis antibiótica tiene un efecto protector139. En un estudio prospectivo realizado durante el año 2000 en 44 instituciones francesas se ha comprobado que la tasa de infección a los 12 meses de la implantación de un electroestimulador cardíaco fue del 0,68%. La aparición de una infección se asoció con la presencia de fiebre en las 24 h previas al implante, el uso de sistema de estimulación temporal previo y la reintervención precoz, mientras que fueron factores de protección la implantación de un nuevo sistema y el uso de profilaxis antibiótica140.
MicrobiologíaLos microorganismos implicados más a menudo en la etiología de esta infección son S. aureus, especies coagulasa negativos de estafilococos, Enterococcus faecalis, Pseudomonas aeruginosa, Candida albicans, y enterobacterias1–3,5,9,35,141. En las endocarditis diagnosticadas en el mes posterior a la implantación del dispositivo, S. aureus es el responsable de aproximadamente el 80% de los casos, mientras que en las de aparición tardía S. epidermidis seguido de S. lugdunensis son las especies de estafilococo más frecuentemente aisladas1–3,5,142,143. En las infecciones nosocomiales o relacionadas con los cuidados sanitarios, los estafilococos son generalmente resistentes a la cloxacilina1–3,5,141.
En nuestra experiencia y en series recientes de endocarditis sobre MCP o DI de la Clínica Mayo y del ICE9,35,141 se constata que entre el 66 y el 82% de los casos están causados por estafilococos, S. aureus o ECN, el resto por otras bacterias u hongos o con cultivo negativo (tabla 1).
Manifestaciones clínicasLas manifestaciones clínicas de estas infecciones son muy variadas y dependen fundamentalmente del momento de su aparición, de la localización del proceso infeccioso y del microorganismo causal1–3,5. Las infecciones precoces se acompañan de síntomas locales, como dolor, eritema, drenaje purulento por la herida operatoria o por una fístula, erosión o aumento de la temperatura de la zona de implantación del generador. Los episodios causados por S. aureus que se presentan durante las primeras dos semanas desde la implantación pueden acompañarse de bacteriemia y los pacientes tienen síntomas sistémicos de infección144.
La infección de la porción intravascular de los electrodos, con o sin endocarditis asociada, ocasiona fiebre o febrícula y escalofríos de duración prolongada e intermitente en la mayoría de casos. Los casos más graves pueden acompañarse de sepsis y shock. Si la infección es consecuencia de una progresión desde el lugar de la implantación, pueden observarse las alteraciones características de infección del bolsillo del generador junto con los síntomas de afectación sistémica. En estos casos existe, en general, el antecedente de varias manipulaciones a nivel local de forma previa al inicio de la infección1–3,5,145.
En los pacientes con infecciones tardías de curso prolongado es frecuente observar síntomas respiratorios en forma de neumonía, abscesos pulmonares o embolismos sépticos. La existencia de soplos cardíacos nuevos o cambiantes o esplenomegalia es infrecuente, aún en los casos demostrados de endocarditis asociada1–3,5,132,144.
DiagnósticoLa sintomatología clínica de los pacientes con infección precoz o tardía que afecta al bolsillo del generador es de diagnóstico fácil. Siempre es necesario la obtención de muestras del exudado local y realizar hemocultivos para conocer la etiología de la infección. La presencia de leucocitosis y elevación de la velocidad de sedimentación globular, junto con la comprobación de bacteriemia, son sugestivos de afectación de los electrodos intravasculares, con o sin endocarditis asociada1–3,5.
La demostración de bacteriemia persistente o intermitente, en especial si la misma es por cocos grampositivos1–3,5,146, en pacientes portadores de MCP o DI obliga a descartar la existencia de una infección del sistema.
La endocarditis asociada a estos dispositivos se diagnostica mediante la demostración de lesiones compatibles, del tipo de vegetaciones endocárdicas o trombos adheridos al electrodo intracardíaco, mediante ecocardiografía, en un paciente con síntomas compatibles y hemocultivos positivos (tablas 2 y 3)64,65. La ETT tiene una sensibilidad no superior al 30%, mientras que la ETE puede demostrar lesiones de endocarditis en más del 90% de los pacientes141,145,147–150.
La observación de infiltrados focales múltiples en la radiografía de tórax o los defectos de perfusión demostrados por ganmagrafía pulmonar son diagnósticos de embolismos pulmonares por infección de los electrodos intracardíacos o por endocarditis1–3,5.
TratamientoEl éxito terapéutico en una infección asociada a los electroestimuladores cardíacos generalmente precisa de su extracción completa junto a la administración de antimicrobianos adecuados para el agente responsable1–3,5,139,150. Existen tres componentes generales del tratamiento: los antimicrobianos, la retirada del generador y habitualmente de los electrodos y la reimplantación de un nuevo sistema. La aproximación terapéutica depende de la extensión de la infección, del patógeno y del perfil clínico del paciente1–3,5,143.
Las infecciones de los dispositivos que afectan exclusivamente al bolsillo del generador o al trayecto subcutáneo de los electrodos, que cursan sin bacteriemia asociada, pueden tratarse en un solo tiempo con la extracción completa del sistema y la colocación de uno nuevo en un lugar de inserción diferente, mediante cobertura antibiótica1–3,5,143. El tratamiento antibiótico se ha de mantener durante un período corto de tiempo, en general hasta que desaparezcan los signos locales de infección a nivel del bolsillo del generador extraído. En algunos pacientes con dificultades para la extracción del sistema o para la reinserción de uno nuevo puede plantearse la administración de un tratamiento antimicrobiano por períodos prolongados de tiempo, que en ninguna ocasión serán inferiores a 3 o 6 meses1–3,5,141,150.
La terapéutica de las infecciones que cursan con bacteriemia, que implican afectación del trayecto endovascular de los electrodos con o sin endocarditis asociada, es objeto de controversia por no disponerse de estudios controlados sobre la eficacia de las distintas posibilidades de actuación. Existe un consenso en la literatura a favor de la extracción completa del sistema como parte fundamental del tratamiento1–3,5,143.
El patógeno causal de la bacteriemia es un factor de importrancia en la elección de la retirada total del sistema, especialmente si se trata de una infección producida por S. aureus1–3,5,151.
Los electrodos que llevan insertados más de 18 o 24 meses generalmente no pueden ser extraídos por tracción simple, por lo que es necesario la utilización de técnicas de extracción ayudadas por láser o por procedimientos de despegamiento del extremo distal endocavitario guiados por hemodinámica1–3,5,152. En los pacientes en que el sistema no pueda retirarse con seguridad mediante estos procedimientos es necesario plantear la necesidad de una cardiotomía para la extracción completa de los electrodos1–3,5. Si los pacientes precisan continuar con un sistema de electroestimulación, es obligatorio la colocación de un sistema transitorio transvenoso, a través de la vena femoral generalmente, o epicárdico que se mantendrá hasta la reinserción de un sistema definitivo cuando el tratamiento antibiótico haya controlado la infección. Este nuevo sistema no ha de colocarse, a ser posible, antes de transcurridas dos semanas de un tratamiento antibiótico parenteral adecuado para el agente etiológico de la infección y ha de completarse una pauta de tratamiento antibiótico de al menos 4 semanas1–3,5,143.
La endocarditis asociada a los electroestimuladores cardíacos, tanto la que afecta a las válvulas de las cavidades derechas como las que asientan sobre el extremo distal del electrodo o sobre el lugar de su inserción mural, tiene un pronóstico favorable si se puede retirar con éxito la totalidad del sistema y se administra un tratamiento antibiótico apropiado (tabla 4) durante un período no inferior a las 4 semanas134,135,141,143,149,150. Los pacientes con endocarditis asociadas pueden presentar vegetaciones de gran tamaño, en ocasiones superiores a 2 cm. La actitud en estas situaciones no está bien definida, aunque está bien documentada la ausencia de complicaciones metastásicas pulmonares tras la extracción del sistema por tracción153. En casos de realizarse una cardiotomía se podría plantear la resección quirúrgica de estas vegetaciones de gran tamaño, sobre todo si afectan a las válvulas pulmonar o tricuspídea153.
Por último, es importante señalar que la recolocación de nuevos sistemas no es necesario en todos los pacientes con infecciones asociadas a estos dispositivos1–3,5,143. En algunas series, se ha publicado que hasta una quinta parte de los casos puede evitarse la nueva colocación tras una reevaluación de la situación cardíaca que motivó la indicación previa.
PrevenciónLa adecuada técnica quirúrgica y la asepsia máxima durante la implantación y las manipulaciones del sistema constituyen las medidas más importantes de prevención de las infecciones. Dada la baja tasa de infecciones de estos dispositivos no existen estudios prospectivos aleatorizados que hayan demostrado la eficacia de un régimen profiláctico antibiótico. En un metaanálisis de siete estudios aleatorizados (sólo uno de ellos doble ciego y controlado con placebo), que evaluaban la eficacia de la profilaxis antibiótica previa a la implantación de un MCP permanente en 2.023 pacientes, se ha comprobado un efecto protector de las infecciones precoces, tanto a nivel local como sistémico154. Recientemente, en un estudio consecutivo de 852 pacientes, con inserción de nuevos sistemas o recambio del generador que recibieron 2 g de cefazolina en los 20 min previos al procedimiento, se ha observado una tasa de infecciones menores precoces (menos de 2 meses tras la implantación) en el 1% y mayores tardías (más de 12 meses tras el procedimiento) en el 0,7%155.
Las recomendaciones de profilaxis tendrían que realizarse en la mayoría de pacientes, aunque la existencia de algunas circunstancias asociadas, como obesidad, diabetes mellitus o cirugía de implantación complicada, podrían hacerla de uso obligatorio. Una cefalosporina de primera o segunda generación, o bien de un glucopéptido en casos de colonización previa por patógenos resistentes a los betalactámicos, en dosis única antes de realizar la incisión de la implantación del sistema es la pauta recomendada1–3,5.