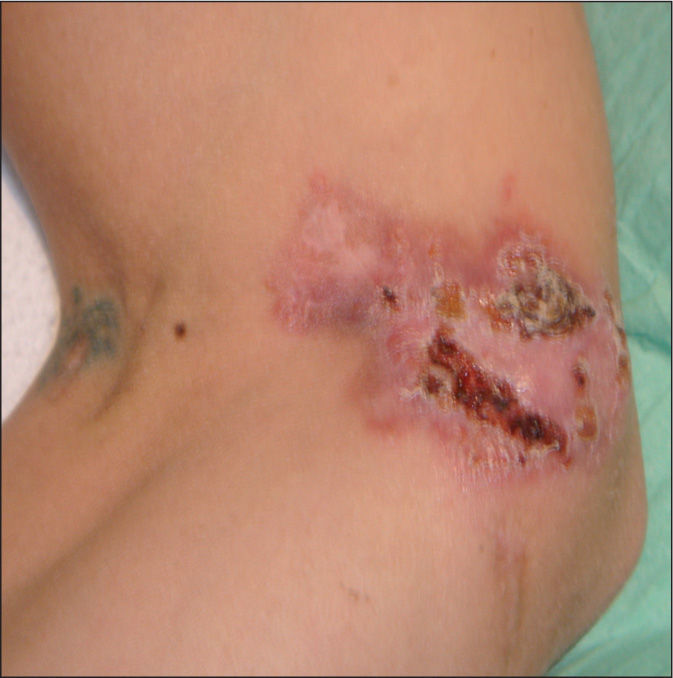
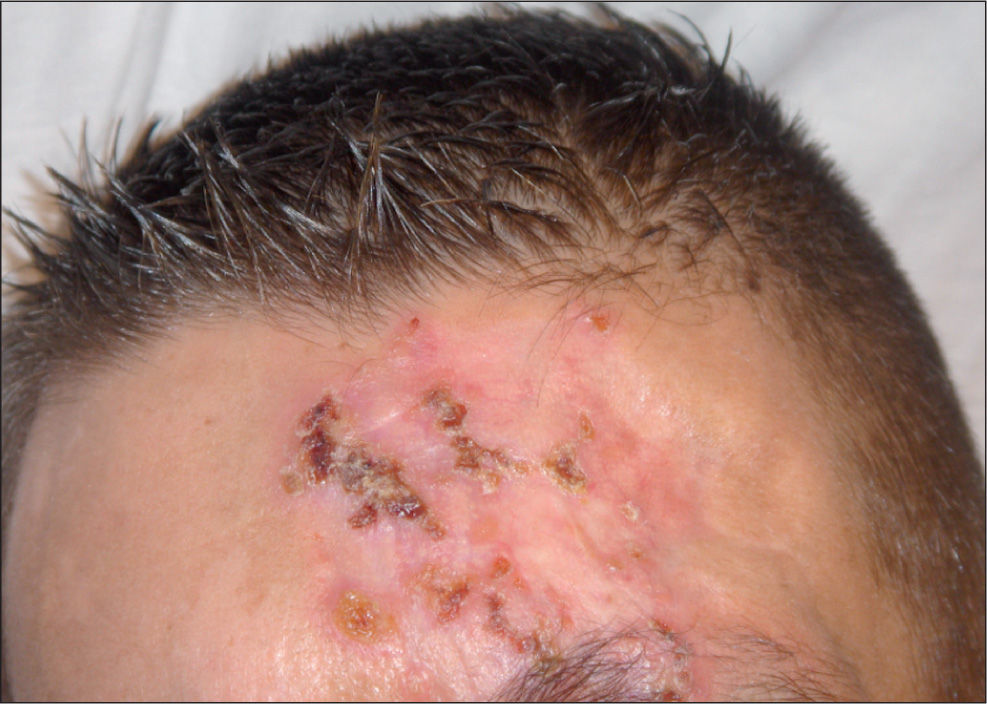
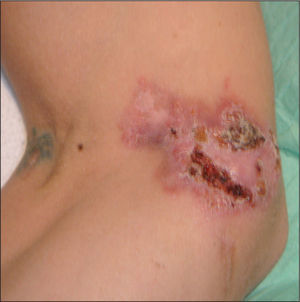
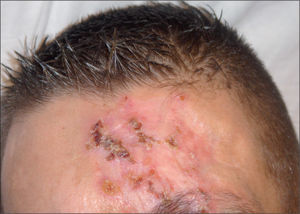
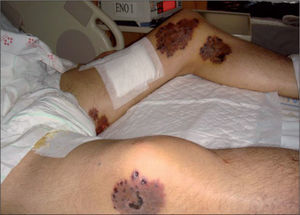
Varón de 37 años, español, que acudió al Servicio de Urgencias de nuestro hospital por presentar tos productiva, con restos hemáticos, fiebre y pérdida de unos 5 kg de peso en los últimos 2 meses. Como antecedentes personales destacan: era fumador de 60 paquetes de cigarrillos al año y consumidor de alcohol y cocaína de forma ocasional; ex usuario de drogas inyectables (UDI) y padecía infección por el virus de la inmunodeficiencia humana (VIH) sin tratamiento antirretroviral de gran actividad (TARGA) y virus de la hepatitis C (VHC) positivo. En la exploración física se observaron múltiples lesiones cutáneas nodulares, eritemato-costrosas, en diferentes estadios evolutivos, algunas de ellas ulceradas, localizadas en los miembros inferiores y en la zona facial (figs. 1 y 2). El resto de la exploración física, el hemograma y la bioquímica sanguínea fueron normales. La carga viral de VIH era de 3.911.825 copias/ml y el recuento de CD4 de 67 cél./μl. En la radiografía de tórax se observó una lesión cavitada en el ápex pulmonar izquierdo.
EvoluciónDurante el ingreso el paciente permaneció afebril con el resto de las constantes y clínica estables. La baciloscopia de esputo fue positiva y en el cultivo para micobacterias en medio líquido (Bact ALERT® 3D) y sólido (Lowenstein-Jensen) (bioMérieux, Marcy l'Étoile, Francia) creció una micobacteria escotocromógena a partir del décimo día de incubación a 37 °C. Se identificó como Mycobacterium szulgai por pruebas bioquímicas convencionales y se confirmó la identificación mediante hibridación de ADN con sondas genéticas (GenoType® Mycobacterium AS, Hain Lifesciencie GMBH, Alemania).
El resultado anatomopatológico de las lesiones cutáneas fue de dermatitis granulomatosa focalmente necrosante, muy sugestiva de afectación por micobacterias. En el laboratorio de microbiología se aisló el mismo microorganismo que el encontrado en el esputo.
Se instauró profilaxis con cotrimoxazol en dosis de 160 mg de trimetoprima y 800 mg de sulfametoxazol (1 comprimido tres veces/semana) y se inició tratamiento empírico con RIFATER® (rifampicina 120 mg, isonizida 50 mg y pirazinamida 300 mg) 5 comprimidos al día durante 2 meses, tras lo cual se sustituyó la pirazinamida por etambutol (20 mg/kg/día, vía oral) y se añadió azitromicina (500 mg tres veces/semana, vía oral) durante 5 meses más. A los 2 meses de iniciado el tratamiento tuberculostático se instauró TARGA (TRUVADA®: 200 mg emtricitabina/300 mg tenofovir 1 comprimido/día y SUSTIVA®: efavirenz 600 mg/día), sin producirse interacciones significativas entre ambos tratamientos.
El estudio de resistencias determinó que la micobacteria era resistente a los siguientes tuberculostáticos: isoniazida, estreptomicina, etambutol y rifampicina, y el resultado se confirmó en el Instituto de Salud Carlos III (Majadahonda, Madrid). A pesar de la resistencia in vitro a rifampicina, ésta se mantuvo en la pauta de tratamiento siguiendo las recomendaciones de la American Thoracic Society.
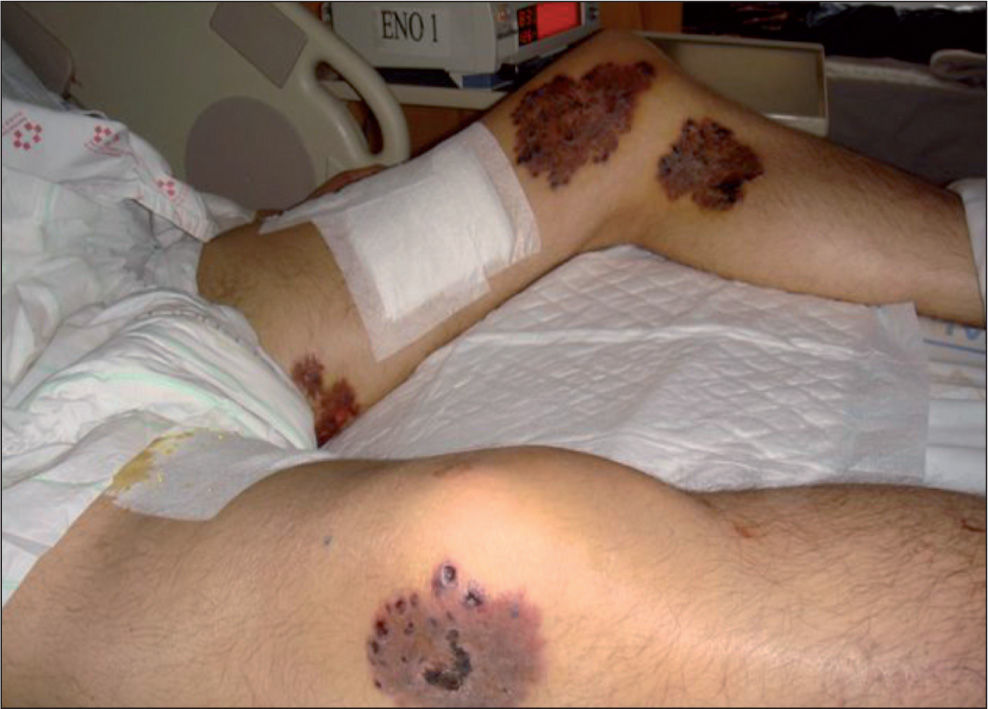
Inicialmente se produjo una buena respuesta al tratamiento pautado y la evolución clínica fue favorable, con regresión de las lesiones cutáneas y negativización de los cultivos posteriores de control tanto de muestras de esputo como de piel al cabo del año de iniciado el tratamiento. Lamentablemente, el paciente abandonó el tratamiento antirretroviral y dejó de acudir a las consultas de control clínico posteriores, por lo que se perdió su seguimiento. Al cabo de 2 años volvió a ingresar con un cuadro de inmunosupresión grave, caquexia, tuberculosis ganglionar muy evolucionada y micobacteriosis cutánea diseminada por abandono del tratamiento (fig. 3), que desencadenó un cuadro de distrés respiratorio agudo, sepsis y finalmente, su fallecimiento. Dada la precaria situación clínica y la rápida evolución no se realizaron nuevas biopsias durante el segundo ingreso.
DiagnósticoMicobacteriosis cutaneopulmonar por Mycobacterium szulgai.
ComentarioLa infección pulmonar y/o cutánea en pacientes VIH positivos puede estar causada por una amplia variedad de especies de micobacterias no tuberculosas. Entre las más frecuentemente aisladas se encuentran M. avium, M. kansasii, M. xenopi y M. haemophilum1. La afectación cutánea y/o pulmonar por M. szulgai es una entidad muy poco frecuente y se aísla en menos del 1% de todas las micobacteriosis no tuberculosas. Su aislamiento en humanos siempre ha estado asociado a la presencia de enfermedad2. Presentamos el primer caso descrito en España de micobacteriosis cutánea por M. szulgai en un paciente VIH positivo.
La inmunosupresión, el alcoholismo crónico, así como el tabaquismo, EPOC y los antecedentes de tuberculosis pulmonar son los factores de riesgo que se asocian con mayor frecuencia a este microorganismo3,4.
M. szulgai se caracteriza por ser susceptible in vitro a la mayoría de los fármacos antituberculosos. En casos publicados previamente, los resultados terapéuticos fueron satisfactorios cuando se combinan más de dos fármacos. La sensibilidad de esta micobacteria a quinolonas y a los nuevos macrólidos está bien documentada, así como aún no está del todo establecido cuál debería ser la duración óptima del tratamiento. En la actualidad se utilizan regímenes terapéuticos no estandarizados; de ellos, el más recomendado debido a los buenos resultados obtenidos es el que combina tres o cuatro fármacos, entre los que se incluyen claritromicina, isoniazida, etambutol y rifampicina durante un período no inferior a 9-12 meses después de que los cultivos se hayan negativizado y dependiendo de la respuesta clínica4–9.