Introducción
Los arbovirus (arthropod borne viruses) son un grupo heterogéneo de virus, pertenecientes a distintas familias y géneros, con la característica común de ser transmitidos por artrópodos. La mayoría de ellos pertenecen a las familias Togaviridae, Flaviviridae, Reoviridae, Rhabdoviridae y Bunyaviridae1. Hay 534 especies virales registradas en el Catálogo Internacional de Arbovirus, de las cuales 134 son patógenos para el hombre y prácticamente todas ellas son virus ARN. El hombre se infecta accidentalmente cuando es picado por el vector en lugar de su huésped vertebrado principal. El resultado suele ser una vía muerta para la transmisión del virus, ya que el hombre no es, en general, el huésped preferido del artrópodo hematófago, y por lo tanto habrá pocas posibilidades de que sea picado por otro artrópodo. Además la viremia es de corta duración y de bajo título.
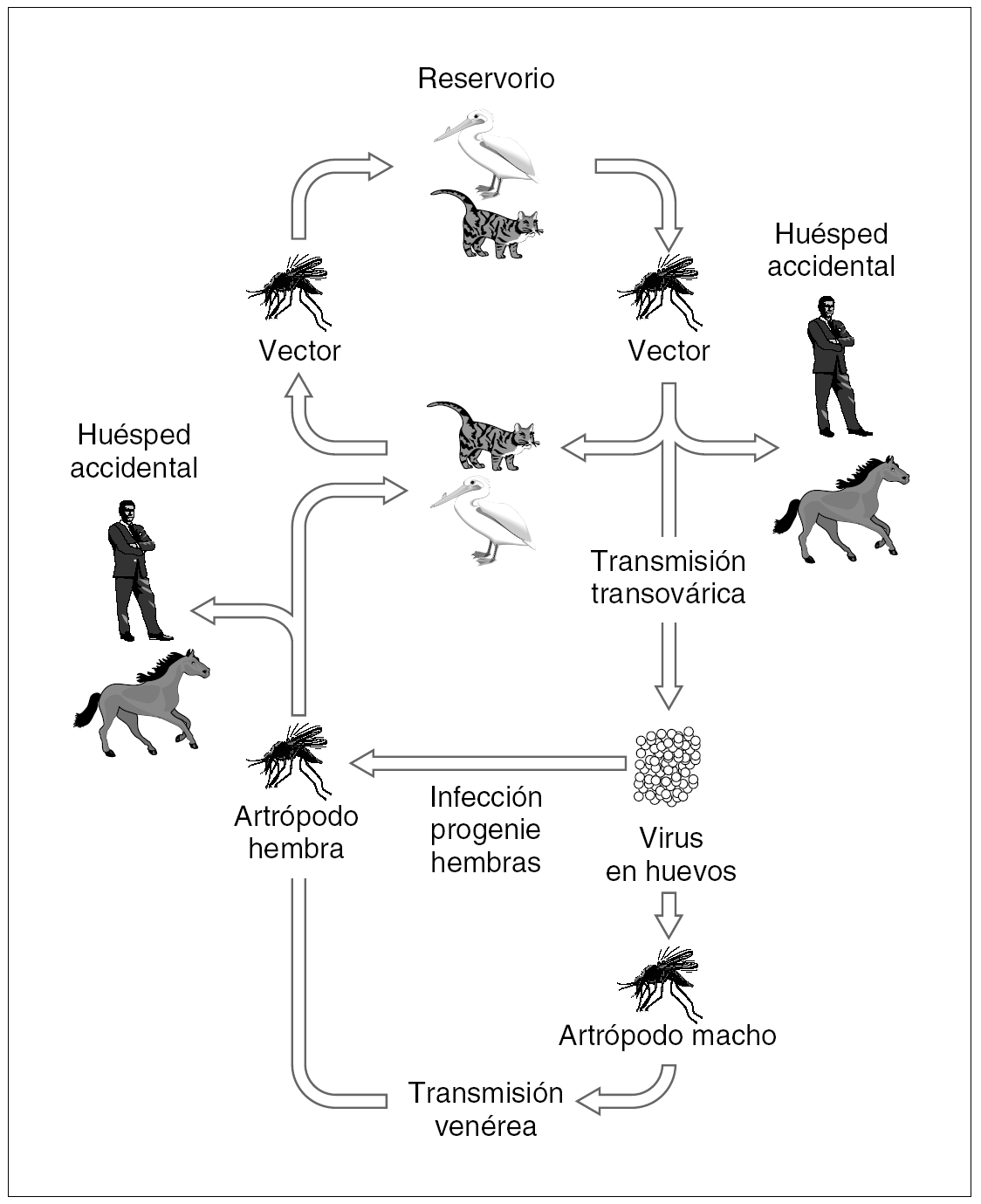
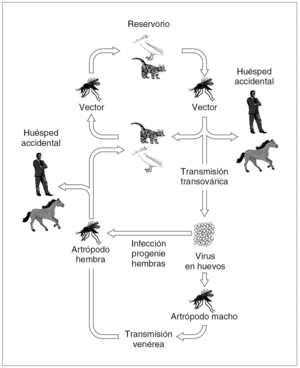
Los principales reservorios vertebrados para los arbovirus de importancia en salud pública son las aves y los roedores, y los principales vectores son dípteros y garrapatas. En la figura 1 se muestra en términos generales cuál sería el ciclo biológico de un arbovirus.
Figura 1. Ciclo biológico general de los arbovirus.
Para algunos arbovirus la distribución es universal, mientras que para otros es más restringida puesto que viene determinada en gran medida por el rango de sus artrópodos vectores al haberse adaptado a un binomio vector transmisor/huésped vertebrado específico. Por lo tanto, para realizar un adecuado diagnóstico de estas infecciones es fundamental que en la historia clínica se recojan los antecedentes de viajes y posibles exposiciones del paciente.
La mayoría de las infecciones por arbovirus son asintomáticas. El cuadro clínico, cuando se manifiesta, puede ser muy variado: desde un síndrome febril autolimitado, indistinguible clínicamente de otras infecciones virales comunes, ocasionalmente exantemático, hasta graves cuadros neurológicos (meningitis o meningoencefalitis) o de fiebres hemorrágicas, muchos de ellos mortales 2.
La incidencia de estas infecciones tiende a presentar un patrón estacional, siendo mayor durante el verano en las regiones templadas y en las lluviosas en los trópicos, debido a la mayor actividad de los vectores durante estas estaciones.
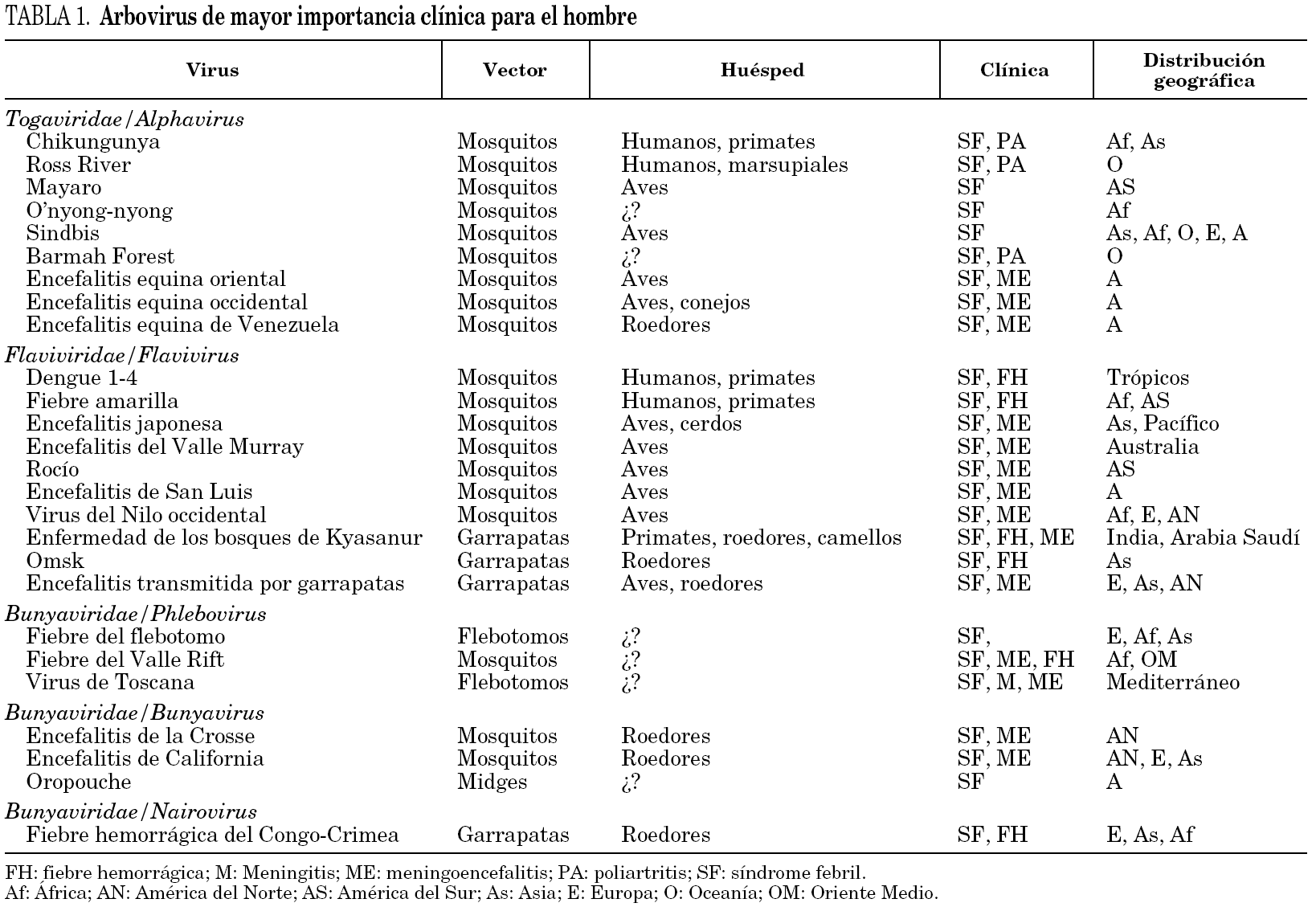
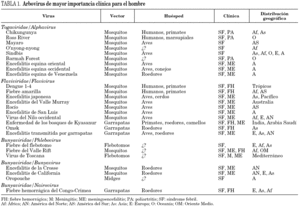
En la tabla 1 se relacionan los principales arbovirus que afectan a los seres humanos, su distribución geográfica fundamental y las enfermedades asociadas con más frecuencia a éstos.
En las últimas décadas se ha detectado un incremento de arbovirosis que se creían controladas o que se han introducido en nuevas áreas geográficas que antes no se veían afectadas, lo cual ha ocasionado serios problemas de salud pública. La aparición de estas enfermedades se ve favorecida por múltiples factores como el crecimiento de la población mundial, la incursión humana en nuevos ecosistemas, el incremento de la movilidad de la población, el desarrollo de las comunicaciones que permite viajes más rápidos, los cambios climáticos y el colapso de los programas de salud pública y de control de los vectores, entre otros. Algunos ejemplos en este sentido son las recientes epidemias de dengue, fiebre amarilla, fiebre del Valle del Rift, encefalitis japonesa, encefalitis por el virus del Nilo occidental (West Nile, VWN) o encefalitis equina venezolana.
Las arbovirosis más importantes en Europa son la encefalitis transmitida por la mordedura de garrapatas (tick borne encephalitis, TBE), sobre todo en países del centro y este europeos, e infecciones transmitidas por picadura de flebotomos en países ribereños del Mediterráneo. No obstante, cada vez se comunican con más frecuencia casos esporádicos de encefalitis por VWN, y existe una gran preocupación por la introducción de arbovirosis propias de otras latitudes como los virus Chikungunya, Sindbis, fiebre del valle del Rift o fiebre hemorrágica de Crimea-Congo.
En España las arbovirosis que requieren mayor atención en la actualidad son, por un lado, la infección por VWN, ya que se han descrito casos recientes en países limítrofes como Francia, Portugal 3,4 y en el norte de África, y la infección por el virus de Toscana (VTOS), que hasta la fecha es el único arbovirus patógeno para el hombre detectado en nuestro país.
Morfología, ciclo biológico
El VTOS es uno de los miembros del complejo de los virus productores de la fiebre de los flebotomos, dentro de la familia Bunyaviridae, en el género Phlebovirus. En este género hay además otros patógenos importantes para el ser humano como los serotipos de Nápoles y Sicilia, productores de un síndrome febril denominado "fiebre de los flebotomos", así como el virus productor de la fiebre del Valle del Rift 1. VTOS es un virus esférico, de 80-120 nm de diámetro, envuelto y cuyo genoma está compuesto por tres moléculas de ARN (S, M y L) 5. La polaridad del genoma es negativa excepto para el segmento S, el más pequeño, que tiene una estrategia de codificación en ambos sentidos: la proteína N, que forma las nucleocápsidas y es muy inmunogénica, se traduce a partir de un ARN mensajero (ARNm) subgenómico complementario al ARN viral correspondiente al extremo 3´ del segmento, mientras un ARNm subgenómico correspondiente al extremo 5´ codifica una proteína no estructural (NSs) cuya función no se conoce. El fragmento M codifica las glucoproteínas G1 y G2 que se insertan en la envuelta viral y son responsables del reconocimiento del receptor celular, confieren al virus capacidad de hemaglutinación e inducen respuesta inmunitaria protectora. El segmento L es el más grande y en él está codificada la polimerasa que forma también parte de las nucleocápsidas. Los segmentos genómicos tienen además secuencias complementarias, propias de grupo, en los extremos 3´ y 5´ que pueden hibridar formando bucles que se cree son importantes en los procesos de replicación, transcripción y empaquetamiento y ensamblaje. El VWN forma parte, junto con virus como el de la fiebre amarilla o los virus dengue, del serogrupo de la encefalitis japonesa, dentro del género Flavivirus en la familia Flaviviridae1. Es un virus esférico, de 50 nm de diámetro, envuelto y cuyo genoma está compuesto por una molécula de ARN de polaridad positiva y banda simple de unos 11.000 nucleótidos con una fase de lectura abierta que codifica 10 proteínas: NS1, NS2a, NS2b, NS3, NS4a, NS4b y NS5 (no estructurales) y C (core) M (membrana) y E (envuelta), responsables estas últimas del tropismo, rango de huésped, replicación, ensamblaje y estimulación de respuesta de linfocitos T y B. Los anticuerpos neutralizantes van dirigidos frente a los determinantes antigénicos situados en la proteína E. El ARN tiene una zona 5´ no codificante seguida de una única fase de lectura abierta con los genes de las tres proteínas estructurales y luego los de las no estructurales 6.
Filogenéticamente las cepas de VWN forman dos linajes, I (dentro del que se pueden diferenciar tres Clados con diferente distribución geográfica) y II, aunque recientemente se ha descrito un nuevo virus que podría formar un tercer linaje 7,8.
Epidemiología
El VTOS es transmitido por Phlebotomus perniciosus, de donde se aisló por primera vez en 1971 en la región de Toscana (Italia central), y por P. perfiliewi5. Se cree que existe un reservorio animal aunque no se ha identificado. Así, tras las campañas de desinsectación de 1940 para la erradicación de la malaria, otras infecciones virales transmitidas por flebotomos desaparecieron prácticamente, mientras que no ocurrió lo mismo con el VTOS. Se ha descrito la transmisión vertical en colonias de flebotomos en el laboratorio, aunque el porcentaje de hembras infectadas disminuye tras cada generación, lo cual sugiere la necesidad de un huésped amplificador 9.
La distribución del virus es típicamente mediterránea aunque ha sido mediante el estudio de viajeros, fundamentalmente suecos y alemanes, como se describió la presencia de estos virus en España, Portugal, Chipre y Turquía, además de en Italia 10,11. En España el virus está ampliamente distribuido, y recientemente se han descrito los primeros casos de infección por VTOS en Francia 12-14. La elevada tasa de infección de viajeros procedentes de zonas no endémicas y la caída en la incidencia de la infección paralela al incremento en la edad de la población, residente en zonas de circulación viral, sugieren una inmunidad duradera 15.
En Italia, en un estudio realizado durante 7 años en muestras de pacientes con afectación neurológica de posible etiología viral, se demostró que, aunque la mayoría de las infecciones son asintomáticas, el VTOS era la causa del 52,3% de los casos estudiados y podía aumentar hasta un 80% en la época de verano, coincidiendo con una mayor actividad del vector 15,16.
En nuestro país se aísla por primera vez el virus en 1988, en pacientes con meningitis linfocitaria. La tasa de anticuerpos frente al virus en la población general es alta 12,13. Además, se ha secuenciado parte de los segmentos S y L de algunas de estas muestras, y se ha determinado que existen diferencias del 15-19% a nivel de nucleótidos con el aislado italiano, lo cual indica que tal vez en España circule una variante, presente también en Francia según resultados recientes, diferente a la que circula en Italia, lo cual es posible que ponga de manifiesto las diferencias entre las poblaciones de flebotomos presentes en ambos países, hecho aún por determinar 17,18.
El VWN está ampliamente distribuido: el linaje I puede afectar a seres humanos, caballos y aves y en él hay cepas procedentes de África, Europa, Oriente Medio, América del Norte, India y Australia, mientras que el linaje II sólo infecta a animales y en él hay cepas del África subsahariana y Madagascar 6,8.
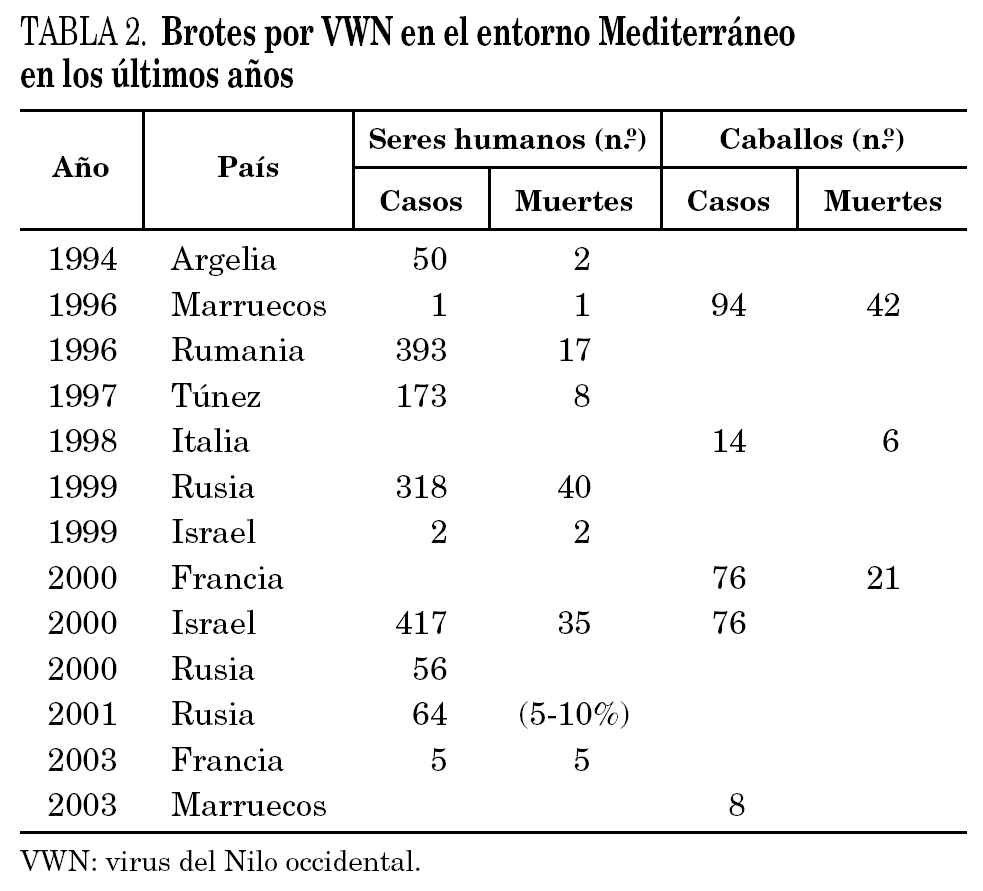
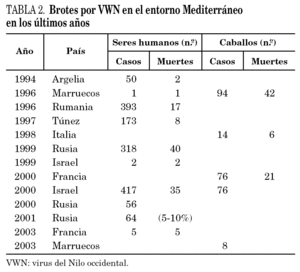
El virus se aisló por primera vez en 1937 de la sangre de una mujer con síndrome febril en la provincia de West Nile, Uganda, y posteriormente de pacientes, mosquitos y aves en Egipto. Históricamente ha sido responsable de brotes importantes, humanos y equinos, y en los últimos años se ha detectado un aumento en su número y su virulencia (tabla 2) 19-21. Debe destacarse su rápida expansión en América del Norte, donde se detectó por primera vez en 1999, y avanzó de forma contenida hasta 2001 (unos 60 casos anuales) y explosiva a partir de entonces, extendiéndose de costa a costa y produciendo más de 10.000 casos en seres humanos entre 2002 y 2003. Se ha propagado también a Canadá, México y el Caribe.
En Europa se aísla en 1963 en los deltas del Ródano y del Volga y posteriormente en Portugal (1972), Eslovaquia (1974), Moldavia (1974), Ucrania (1975), Hungría (1976), Rumania (1996), República Checa (1997) e Italia (1998). En la década de 1960 se observaron casos en Francia, Rusia, Rumania, y desde entonces en Bielorrusia, Ucrania, Rumania y República Checa (tabla 2) 21. La circulación del virus es mayor durante el período de máxima actividad de los vectores: de julio a septiembre.
En España, mediante estudios seroepidemiológicos llevados a cabo en el entorno del Delta del Ebro y el noroeste español y entorno de Doñana, se han visto indicios de la presencia de VWN y/o de otros flavivirus relacionados 22,23.
La principal ruta de transmisión del VWN es la de las picaduras de mosquitos ornitófagos, principalmente culícidos, aunque se han descrito otras menos importantes. Los focos endémicos se localizan en las inmediaciones de zonas húmedas, donde el ciclo selvático entre vector y aves silvestres se mantiene gracias a la abundancia de los mismos. El riesgo de epidemias aumenta si en las cercanías hay zonas urbanas con aguas superficiales que atraigan a las aves migratorias, que desempeñan un papel fundamental en la diseminación del virus. A diferencia de las aves, los mamíferos no son reservorios eficientes.
El VWN es considerado un paradigma de virus emergente. La expansión y aumento en incidencia parecen deberse a causas de naturaleza antropogénica (cambio climático, incremento en la circulación de personas y mercancías, etc.). Sin embargo, existen diferencias importantes en el patrón epidemiológico de la circulación del virus en América del Norte y en Europa, o incluso en México y el Caribe: a) el virus ha avanzado continua y rápidamente por toda América del Norte, mientras que en Europa ha quedado confinado en brotes localizados y no recurrentes; b) la afectación en seres humanos es mayor en la epidemia americana, y c) la patogenicidad en algunas especies de aves es muy superior a la observada en Europa. Estas diferencias pueden surgir de factores intrínsecos a la propia variante del virus que predomina en cada caso, si bien el virus americano tiene su origen en Israel 24, o bien de factores ambientales propios de cada zona. Existe cierta controversia en cuanto a posibles diferencias en el comportamiento de los principales vectores, pertenecientes al complejo Culex pipiens, tanto en América del Norte como en Europa: en América del Norte picarían indistintamente a aves y a seres humanos, y en Europa habría poblaciones de mosquitos ornitófagos y antropófagos, faltando un vector "puente" eficaz entre ambas especies 25. Sólo acontecimientos como la aparición de un vector con distinto comportamiento desencadenaría el tipo de brote que ha predominado en Europa en los últimos años. Por otro lado, la descripción en el continente europeo de nuevos virus similares a VWN permite plantear una nueva hipótesis según la cual este nuevo virus u otro(s) relacionado(s) estaría(n) circulando en la población del viejo continente sin causar sintomatología grave y permitirían la adquisición de inmunidad frente a infecciones por VWN.
Patogenia
Existen muy pocos datos concluyentes sobre la patogenia de la infección por el VTOS. Mucho mejor estudiada es la referida a otras arbovirosis, en particular aquellas relacionadas con procesos neurológicos, y en especial la infección por VWN. En general, se transmiten al hombre por picadura del vector apropiado, aunque en algunos casos, tal como se ha descrito en los recientes brotes de VWN en Estados Unidos, pueden producirse infecciones tras transfusiones de hemoderivados, postrasplante de órganos sólidos, a través de lactancia materna, por transmisión vertical maternofetal o postexposición en personal de laboratorio 26. En cualquier caso, el virus, tras superar la barrera cutánea, se deposita directamente en linfa o sangre, y se produce una diseminación precoz y una posterior multiplicación en células del endotelio vascular, células reticuloendoteliales de nódulos linfáticos, fibroblastos y células de Langerhans, para después, tras la replicación, reintroducirse a través de la linfa en el torrente circulatorio y alcanzar los órganos diana.
Se produce así una fase de viremia, de duración variable entre 3 y 7 días, que en seres humanos suele ser de baja intensidad, lo que dificulta la infección de nuevos artrópodos. Este período puede ser asintomático, cursar como un cuadro seudogripal con fiebre, escalofríos y malestar general que se autolimita en el tiempo (20% de los infectados) o evolucionar a un cuadro más agresivo, generalmente por afectación del sistema nervioso central (SNC) (1 de cada 150-300 infectados).
El virus a veces se aísla en sangre durante los primeros días tras el inicio de la enfermedad y antes de que aparezcan los síntomas neurológicos. Si alcanza el SNC, lo hace a través del endotelio vascular, por transferencia pasiva o por replicación en las células endoteliales, o por transporte axonal a través de las neuronas olfatorias.
Trabajos recientes demuestran que la respuesta temprana de células B y de anticuerpos tiene un papel fundamental para evitar la diseminación y el posterior alcance del SNC por VWN 27. La producción de anticuerpos dirigidos frente a epítopos de la proteína E confieren una protección duradera, a veces de por vida, frente a futuras reinfecciones. Asimismo, la producción intratecal de anticuerpos neutralizantes parece desempeñar un papel clave en la evolución y la recuperación de los pacientes con problemas neurológicos.
Dentro del cerebro los virus se diseminan entre las células por contigüidad. Los cambios patológicos pueden variar desde congestión e inflamación meníngea hasta edema cerebral y/o encefalitis generalizada con predilección por el hipocampo, la corteza temporal, el tálamo, la sustancia negra, el cerebelo, las áreas periventriculares del cerebro y la médula espinal anterior. Puede aparecer degeneración neuronal focal y necrosis que facilita la formación de nódulos gliales y estructuras espongiformes, así como inflamación y degeneración del asta anterior de la médula que puede explicar los cuadros de parálisis flácida asociados a la infección por VWN.
Se producen además infiltrados inflamatorios perivasculares consistentes en linfocitos T CD4 y CD8 activados, macrófagos y linfocitos B. En líquido cefalorraquídeo (LCR) los linfocitos T se encuentran en mayor proporción que en sangre periférica y su activación se evidencia por la expresión de HLA-DR seguida por CD25 (receptores de IL-2) y CD71 (receptores de transferrina) y aumento de la concentración en LCR de neopterina y b2-microglobulina.
Por último, diferentes procesos pueden contribuir a la muerte neuronal como apoptosis, hinchazón citoplasmática, vacuolización y rotura de la membrana celular.
La inmunopatología tiene un papel importante en la meningoencefalitis por VWN y otros flavivirus; este hecho viene apoyado por diferentes modelos experimentales y la observación de que en pacientes inmunodeprimidos, a pesar de tener viremias muy elevadas, las manifestaciones neurológicas tardan más en producirse que en pacientes inmunocompetentes.
La edad avanzada se considera el factor de riesgo más importante para el desarrollo de complicaciones neurológicas tras infección por el VWN, bien por el retraso en la respuesta de anticuerpos (inmunosenescencia), que en sangre periférica no frenaría el avance del virus, con el consiguiente aumento de la duración y los niveles de viremia, bien por cambios estructurales o funcionales en el SNC, que de alguna manera alterarían la barrera hematoencefálica facilitando la invasión del SNC por parte del virus 28. En los años 1999 y 2000 se determinó en Nueva York, utilizando como referencia a pacientes con infección por el VWN de entre 0 y 19 años, que la incidencia de enfermedad grave neurológica en pacientes de 50 a 59 años fue 10 veces mayor y que en pacientes mayores de 80 años fue 43 veces mayor 29.
Clínica
Infección por el VTOS
Las altas tasas de seroprevalencia de infección por el VTOS encontradas en España y en otras áreas, que en algunas zonas alcanza el 20% de la población global y casi el 50% en mayores de 65 años, unido al relativamente bajo número de casos de enfermedad descritos, permiten suponer que mayoritariamente se trata de una infección subclínica y que sólo de forma ocasional se manifiesta provocando cuadros neurológicos, fundamentalmente meningitis aséptica y muy rara vez encefalitis o meningoencefalitis 31. Las manifestaciones clínicas de la infección son más frecuentes en adultos jóvenes, aunque también ocurren en niños 32.
Los principales brotes de infección neurológica por el VTOS han ocurrido entre población susceptible procedente de países en los que no circula VTOS y que llega a un área endémica 10. Esto apunta a la posibilidad de que la población nativa de estas zonas se vea afectada en menor medida debido a la inmunidad adquirida a lo largo de años en contacto con el virus.
En general, la meningitis por VTOS se caracteriza por cursar con fiebre alta, cefalea, vómitos, y por tener carácter benigno y resolverse de manera espontánea, a corto o medio plazo, sin secuelas neurológicas permanentes 32,33. Ocasionalmente, la enfermedad se presenta de una forma más virulenta, como meningoencefalitis o encefalitis sin meningitis 34, en algunos casos de curso grave 35.
En cuanto a los datos analíticos complementarios, en una serie de 17 pacientes con meningitis por VTOS detectados en España entre 1988 y 2003, el 100% presentaron en LCR pleocitosis con predominio linfocitario, valores de glucosa normales y proteínas elevadas en el 70% de casos; el 29,4% presentó leucocitosis en sangre periférica y sólo el 5,9% leucopenia 32.
El período de incubación del VTOS no está bien estudiado, pero debe de ser prolongado ya que en la mayoría de los casos están presentes en el suero de los pacientes en el momento de iniciarse los síntomas tanto anticuerpos IgM como IgG 36. En los casos de infección importada, la enfermedad suele manifestarse alrededor del quinto día del regreso de la zona endémica visitada.
Infección por el VWN
Aunque la presentación clínica varía según los brotes, aproximadamente el 80% de infecciones por VWN son asintomáticas y el 20% restante, tras un período de incubación de 3 a 14 días, desarrollan una enfermedad febril ligera (fiebre por VWN) de comienzo agudo, que dura de 3 a 6 días y se acompaña, en mayor o menor grado, de malestar general, anorexia, náuseas, vómitos, dolor ocular, cefalea, fotofobia, mialgias, artralgias, exantema y linfadenopatía.
Sólo uno de cada 150-300 casos de infección por VWN presenta una enfermedad neurológica grave, siendo más frecuente la encefalitis que la meningitis. Los síntomas generales más comúnmente asociados a estos pacientes son: fiebre (91-98%), cefalea (47-77%), rigidez de nuca (19-57%) debilidad (56%), síntomas gastrointestinales (31-53%) y deterioro mental (34-46%). Algunos presentan exantema maculopapular o morbiliforme (19-21%) extendido por cuello, tronco y ambas extremidades. El daño neurológico puede manifestarse por la presentación de ataxia y signos extrapiramidales, alteración de pares craneales, mielitis, neuritis óptica, polirradiculitis y convulsiones. De forma ocasional puede presentarse un cuadro de debilidad muscular y parálisis flácida, similar a la poliomielitis 28-30.
En los análisis complementarios destacan habitualmente: leucocitosis moderada con linfocitopenia y ocasionalmente anemia, hiponatremia, pleocitosis con predominio linfocitario en LCR, proteínas universalmente elevadas y glucosa normal.
En el 30% de los pacientes con encefalitis con resonancia magnética (RM) se observa ensanchamiento de leptomeninges y áreas periventriculares.
Muy rara vez pueden aparecer complicaciones en otros órganos y tejidos, como miocarditis, pancreatitis o hepatitis fulminante.
La mortalidad de los pacientes con cuadros graves por VWN varía según las series publicadas, y varía desde el 4% (Rumania, 1996), hasta el 12% (Nueva York, 1999) o el 14% (Israel, 2000) 29,30.
Se debe sospechar infección neurológica por VWN, como se expresa en la tabla 3, en adultos, sobre todo mayores de 50 años, que desarrollan una encefalitis o meningitis inexplicable, en verano y principios de otoño. El índice de sospecha aumenta si existe actividad por VWN enzoótica, otros casos humanos cercanos en el tiempo o antecedente de viajes recientes a zonas de riesgo.
Diagnóstico de laboratorio
En las arbovirosis en general resulta de especial relevancia recoger en la historia clínica datos como viajes recientes o picaduras de insectos. En nuestro medio el índice de sospecha aumenta en cuadros neurológicos que se presentan en meses cálidos (de junio a septiembre).
Para el diagnóstico de arbovirosis en el laboratorio podemos recurrir a técnicas de detección directa mediante cultivo y/o amplificación del genoma viral (ya que normalmente, cuando existe afectación neurológica, hay también replicación intratecal del virus) y a técnicas indirectas de medida de la respuesta serológica 6,19.
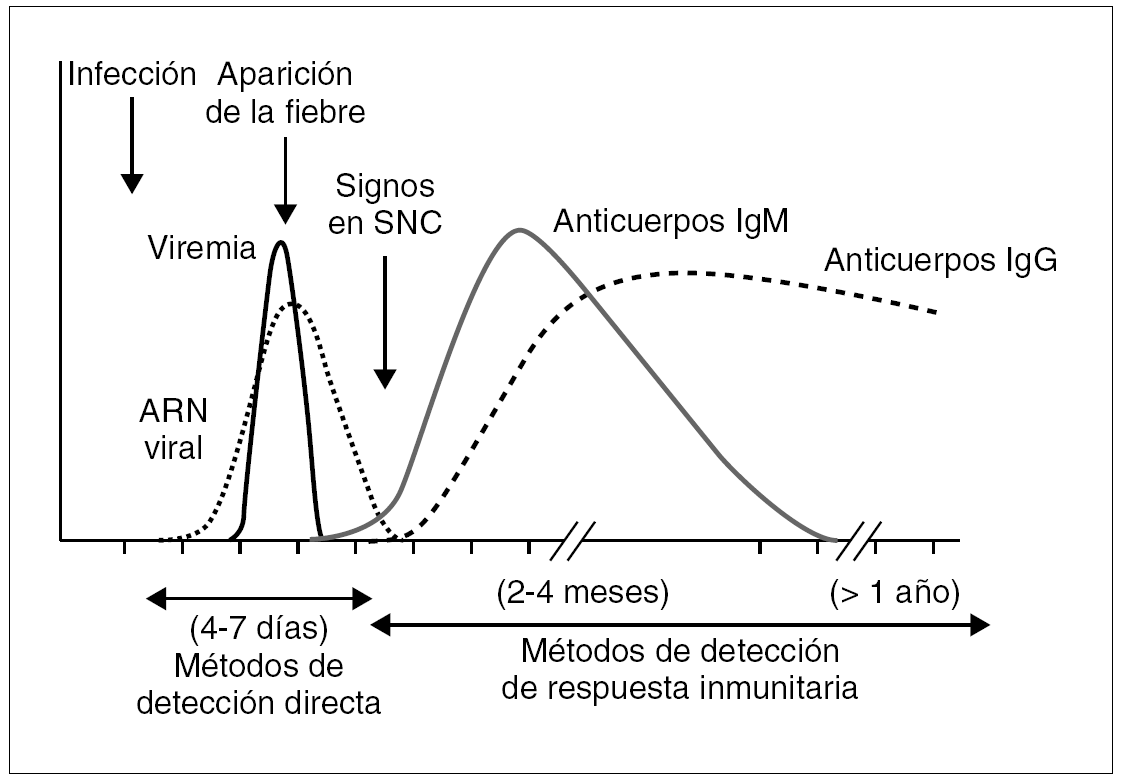
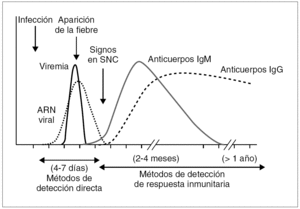
La muestra fundamental para el diagnóstico directo es el LCR; ocasionalmente puede enviarse suero, pero debido a que en general existe un período breve de viremia en estos procesos, su utilidad es mucho menor. El LCR y/o suero deben tomarse en los primeros días de la infección (fig. 2) y es imprescindible una buena conservación hasta su análisis (a 4 °C si se tarda en procesar menos de 48-72 h y a 80 °C o en nitrógeno líquido si el proceso se demora más).
Figura 2. Cinética de aparición de la viremia y la respuesta inmunitaria en las arbovirosis.
El aislamiento en el laboratorio de los arbovirus a partir de muestra clínica se puede realizar, en general, en ratones lactantes o en cultivo celular, generalmente en células Vero. Sin embargo, dicho aislamiento sólo se consigue en una pequeña proporción de casos debido a la corta viremia y a la baja carga viral. El aislamiento del virus requiere de una posterior confirmación mediante amplificación genómica por técnicas de transcripción inversa-reacción en cadena de la polimerasa (RT-PCR), inmunofluorescencia con anticuerpo monoclonal específico, o neutralización con antisueros específicos, que en el caso de VWN debe realizarse en un laboratorio con nivel 3 de bioseguridad.
Dentro de las técnicas de detección directa, se obtiene una mayor rentabilidad con la detección y amplificación del genoma viral. El diagnóstico molecular es rápido y capaz de detectar el virus en pequeña concentración; sin embargo, en los virus con genoma ARN (la mayoría de los arbovirus) es preciso tener muy en cuenta la variabilidad genética inherente a los mismos. Así, las técnicas moleculares clásicas para la detección de VTOS han sido diseñadas a partir del conocimiento de secuencias de cepas italianas, y se ha demostrado que no funcionan con las cepas de nuestro entorno debido a la variabilidad genética presente en la zona de unión de los iniciadores de la reacción de amplificación, por lo que resulta más adecuado utilizar técnicas específicas o genéricas en las que esta variabilidad genética se haya tenido en cuenta 17,37,38. Lo mismo puede aplicarse a la detección molecular del VWN, para lo que deben utilizarse técnicas específicas en cuyo diseño se hayan estudiado las secuencias de diferentes cepas de los distintos linajes o técnicas genéricas de amplio espectro de detección 39.
Los métodos serológicos se consideran complementarios al diagnóstico directo por cultivo y/o biología molecular.
Las muestras adecuadas para el diagnóstico serológico son suero y LCR y fundamentalmente se detectan inmunoglobulinas de tipo IgM e IgG.
Las técnicas más utilizadas son las inmunoenzimáticas (ELISA) tanto para detectar IgG como IgM frente a la proteína N, que contiene los epítopos inmunodominantes 40,41. La detección de IgM en LCR es el procedimiento más sensible en el caso de síndrome neurológico por el VWN, aunque debe considerarse la posibilidad de que existan anticuerpos IgM, con bajo título, en períodos de varios meses y que en los primeros días tras la infección el resultado puede ser aún negativo, por lo que sería necesario tomar una muestra de suero y/o LCR en fase aguda y otra en fase convaleciente (10-15 días después del inicio del proceso) para poder realizar el diagnóstico mediante seroconversión o seroincremento (aumento cuádruple del título de anticuerpos entre fase aguda y convaleciente) 42.
Por otro lado, debido a reacciones cruzadas entre miembros del mismo género, sobre todo en el caso de los flavivirus, la interpretación de las técnicas de ELISA puede ser complicada; por este motivo, para la confirmación del diagnóstico se requieren ensayos más complejos como seroneutralización de placas de crecimiento del virus, como ya se ha mencionado, que en el caso del VWN precisa para su ejecución de un laboratorio con nivel 3 de bioseguridad.
Otras técnicas serológicas menos comunes que se han utilizado para el VTOS y el VWN son: inhibición de la hemaglutinación, inmunofluorescencia, fijación de complemento, Western-blot o neutralización del efecto citopático.
Tratamiento
Hasta la fecha no existe ninguna medicación antiviral que se haya mostrado plenamente eficaz para tratar la infección grave por el VWN o el VTOS, por lo que el tratamiento es fundamentalmente sintomático y de soporte. En el caso del VWN, están en marcha diferentes ensayos clínicos, con distintas orientaciones terapéuticas que incluyen desde la utilización, de forma aislada o en diferentes combinaciones, de antivirales como la ribavirina, el interferón a (IFN-a) o la inmunización pasiva con anticuerpos monoclonales o sueros hiperinmunes.
La ribavirina ha demostrado su eficacia frente a otros flavivirus, como el virus de la hepatitis C (VHC), el dengue, la fiebre amarilla y la encefalitis japonesa, así como frente al virus Lassa, y en estudios in vitro a muy altas dosis muestra actividad frente al VWN 43. No obstante, el requerimiento de alcanzar estas altas dosis en tejido neurológico limita en gran medida su utilidad para tratar infecciones graves por VWN en seres humanos.
También en modelos experimentales se ha demostrado la posible utilidad del IFN-a, pero aún no existen estudios concluyentes en seres humanos 44.
La administración de inmunoglobulinas específicas está justificada tras comprobarse, como reflejamos en el apartado de patogenia de la infección, el papel fundamental que tiene la respuesta de anticuerpos en la progresión de la enfermedad; esta vía es probablemente la que cuente con mayores posibilidades de éxito como medida terapéutica en el futuro, dentro de las que actualmente están en desarrollo.
Profilaxis
A diferencia de lo que sucede con otros flavivirus, como el virus de la fiebre amarilla, en la actualidad no existe ninguna vacuna eficaz frente a la infección por el VWN o por el VTOS, por lo que la prevención se basa fundamentalmente en la utilización de medidas que minimicen el riesgo de exposición a posibles vectores en zonas de riesgo, entre ellas las más adecuadas son el uso de repelentes de mosquitos y ropas adecuadas que cubran la mayor superficie corporal posible y evitar salidas al exterior en las primeras horas de la tarde y la noche.
Vigilancia y control de las arbovirosis
Ante el riesgo de diseminación y posible emergencia de las diferentes arbovirosis se hace necesario implantar medidas de vigilancia y control de las mismas. Éstas deben adoptarse sobre cada uno de los elementos que intervienen en el ciclo vital del virus: vector, huésped intermediario y huéspedes finales (seres humanos y caballos). En el caso de infección por el VWN, el grado de implementación de medidas que se adopte en cada país por los distintos sistemas nacionales de salud será proporcional a la posibilidad de aparición de la arbovirosis en su medio; pudiendo variar desde la implantación de medidas de vigilancia y control activo y continuo sobre todos y cada uno de los distintos elementos que configuran el ciclo vital del virus, justificada en países donde la infección por el VWN está claramente establecida y la probabilidad de brotes en seres humanos es muy alta, hasta la vigilancia sobre algunos elementos del ciclo, como la búsqueda de la presencia del virus en cuadros neurológicos en seres humanos compatibles con infección por el VWN o en vectores de forma temporal, en países donde la probabilidad es baja, como sucede actualmente en España 26.
NOTA
Los artículos publicados en la sección "Formación Médica Continuada" forman parte de grupos temáticos específicos (antibiograma, antimicrobianos, etc.). Una vez finalizada la publicación de cada tema, se irán presentando al Sistema Español de Acreditación de la Formación Médica Continuada (SEAFORMEC) para la obtención de créditos.
Una vez concedida la acreditación, esta se anunciará oportunamente en la Revista y se abrirá un período de inscripción gratuito para los socios de la SEIMC y suscriptores de la Revista, al cabo del cual se iniciará la evaluación, durante un mes, que se realizará a través de la web de Ediciones Doyma.
RELACIÓN DE SERIES ACREDITADAS:
"Avances en el tratamiento de la infección por el virus VIH"
Disponible en: http://www.doyma.es/eimc/formacion
1 junio / 31 diciembre 2005