Introducción
En la actualidad, más de 20 millones de personas en todo el mundo están afectadas por enfermedades llamadas "autoinmunes". En ellas, el reconocimiento erróneo de lo propio como extraño produce respuestas inflamatorias intensas en diferentes tejidos u órganos. La psoriasis, la esclerosis múltiple, la artritis reumatoide y la colitis ulcerosa o la enfermedad de Crohn son algunos ejemplos de ellas 1,2.
En los últimos años se han desarrollado nuevas terapias, llamadas "biológicas", que intentan contrarrestar los mecanismos patogénicos naturales de la enfermedad y que han demostrado su eficacia en el tratamiento de algunos de los procesos mencionados 3,4. Sin embargo, se ha producido un notable aumento de procesos infecciosos, algunos de gravedad, relacionados con su utilización. Las potenciales complicaciones infecciosas asociadas al uso de estos fármacos van a ser motivo de consulta frecuente para microbiólogos clínicos e infectólogos. Su reconocimiento, prevención y tratamiento no deben limitar el uso de unos fármacos que tantos beneficios están aportando en la calidad de vida de los pacientes afectados.
De la evidencia clínica a las bases patogénicas de la infección
La parte del sistema inmunitario más implicada en este tipo de enfermedades autoinmunes es la inmunidad mediada por células 5. El infiltrado inflamatorio en la mayoría de las lesiones está predominantemente formado por células mononucleares, incluyendo linfocitos T y B, células plasmáticas y macrófagos 6,7. La inmunidad de mediación celular necesita para ponerse en marcha la activación, proliferación y diferenciación de las células T naive en células T efectoras armadas, capacitadas para enfrentarse a antígenos específicos 3,8,9. Estos antígenos son presentados por las células dendríticas, los macrófagos y las células B.
Las células T efectoras se dividen en tres clases funcionales que detectan antígenos derivados de diferentes tipos de agentes patógenos o partículas propias consideradas como autoantígenos. A partir de este punto pueden distinguirse tres respuestas:
1. Los antígenos derivados de microorganismos que se multiplican en el interior del citoplasma de la célula son transportados a la superficie celular por moléculas del complejo mayor de histocompatibilidad (CMH) de clase I y son presentados a células T CD8, que se diferenciarán a células T citotóxicas. Éstas destruyen las células infectadas, bien por mecanismos directos de destrucción celular, bien por medio de la muerte celular programada o apoptosis. Ejemplos típicos son las respuestas frente al virus de la gripe, Epstein-Barr y frente a Listeria monocytogenes.
2. Los antígenos derivados de toxinas y de bacterias extracelulares (Clostridium tetani, Staphylococcus aureus, Streptococcus pyogenes, Streptococcus pneumoniae, Neisseria meningitidis) son transportados a la superficie celular por moléculas del CMH de clase II y son presentados a células T CD4. Estos antígenos tienden a estimular la diferenciación de células Th2, que inician la respuesta humoral, activando las células B específicas para que produzcan anticuerpos tipo IgM. A partir de la producción de estas inmunoglobulinas, autoanticuerpos o de la conformación de complejos inmunes circulantes se originan las enfermedades autoinmunes.
3. Los antígenos de los microorganismos que se multiplican dentro de las vesículas intracelulares de los macrófagos se transportan a la superficie celular por moléculas del CMH de clase II y son presentados a células T CD4. Estos antígenos tienden a estimular la diferenciación de células Th1. Las células Th1 activan, a su vez, los macrófagos que fagocitan microorganismos intracelulares con mayor eficacia (Mycobacterium tuberculosis y otras micobacterias, Brucella, Actinomyces, Histoplasma, Coccidioides, Candida, Criptococcus, Treponema, Leishmania spp., etc.) e inducen en las células B la producción de anticuerpos IgG, que opsonizan microorganismos extracelulares capturados por las células fagocíticas. Para ello, las células Th1 producen moléculas efectoras conocidas como citocinas: el interferón g (IFN-g), principal citocina activadora de macrófagos; la interleucina 2 (IL-2), IL-3, el factor estimulador de macrófagos, el factor de necrosis tumoral (TNF) y los receptores del TNF (TNFR I y TNFR II).
Todas ellas, y en especial la familia de citocinas del TNF, tienen una importancia clave en la respuesta inmune frente a la infección intracelular, activando macrófagos infectados, matando macrófagos viejos crónicamente infectados, estimulando la producción de nuevos macrófagos en la médula ósea y reclutando macrófagos a los sitios de infección e inflamación donde liberarán todas sus moléculas proinflamatorias.
Las moléculas efectoras de la familia del TNF actúan en la superficie celular y se reconocen cuatro moléculas: el TNF-α, TNF-β o linfotoxina, y dos ligandos de membrana celular (el ligando del Fas y el ligando de CD40).
El TNF-α es producido por las células T en forma soluble o asociado a membrana. Activa los macrófagos, y por medio de su receptor TNFR I puede producir muerte celular programada y sinergiza con IFN-γ para inducir la producción de óxido nítrico. Varias son las acciones que la molécula de TNF-α produce en otros órganos y tejidos con distintos efectos tanto a nivel local como sistémico 7,10-12.
Patogenia de la artritis reumatoide. Papel del TNF
En los pacientes con artritis reumatoide, las articulaciones afectadas experimentan una intensa infiltración de monocitos y linfocitos T, y los leucocitos polimorfonucleares migran al interior del líquido sinovial. Se produce una activación de las células T por medio del CMH clase I, y de las interacciones con los macrófagos resulta la liberación de citocinas como IL-1 y TNF-α. El TNF-α es una citocina que contribuye a la inflamación crónica, así como a la destrucción del cartílago y del hueso 13. En la articulación es capaz de estimular la producción de otras citocinas, de enzimas metaloproteasas y prostaglandinas por los sinoviocitos, la proliferación de osteoclastos, e inhibir la síntesis de proteoglucanos y colágeno por los condrocitos, induciendo la destrucción articular.
La inhibición directa o indirecta del TNF-α ha sido una de las estrategias biológicas más desarrolladas y eficaces en el tratamiento de la artritis reumatoide 14 y de otros procesos autoinmunes. Actualmente existen tres inhibidores del TNF disponibles para el tratamiento de la artritis reumatoide en Europa y Estados Unidos: etanercept (Enbrel®) 15, un receptor soluble del TNF; infliximab (Remicade®) 16, y adalimumab (Humira®), ambos anticuerpos monoclonales.
Fármacos inhibidores del TNF
Características
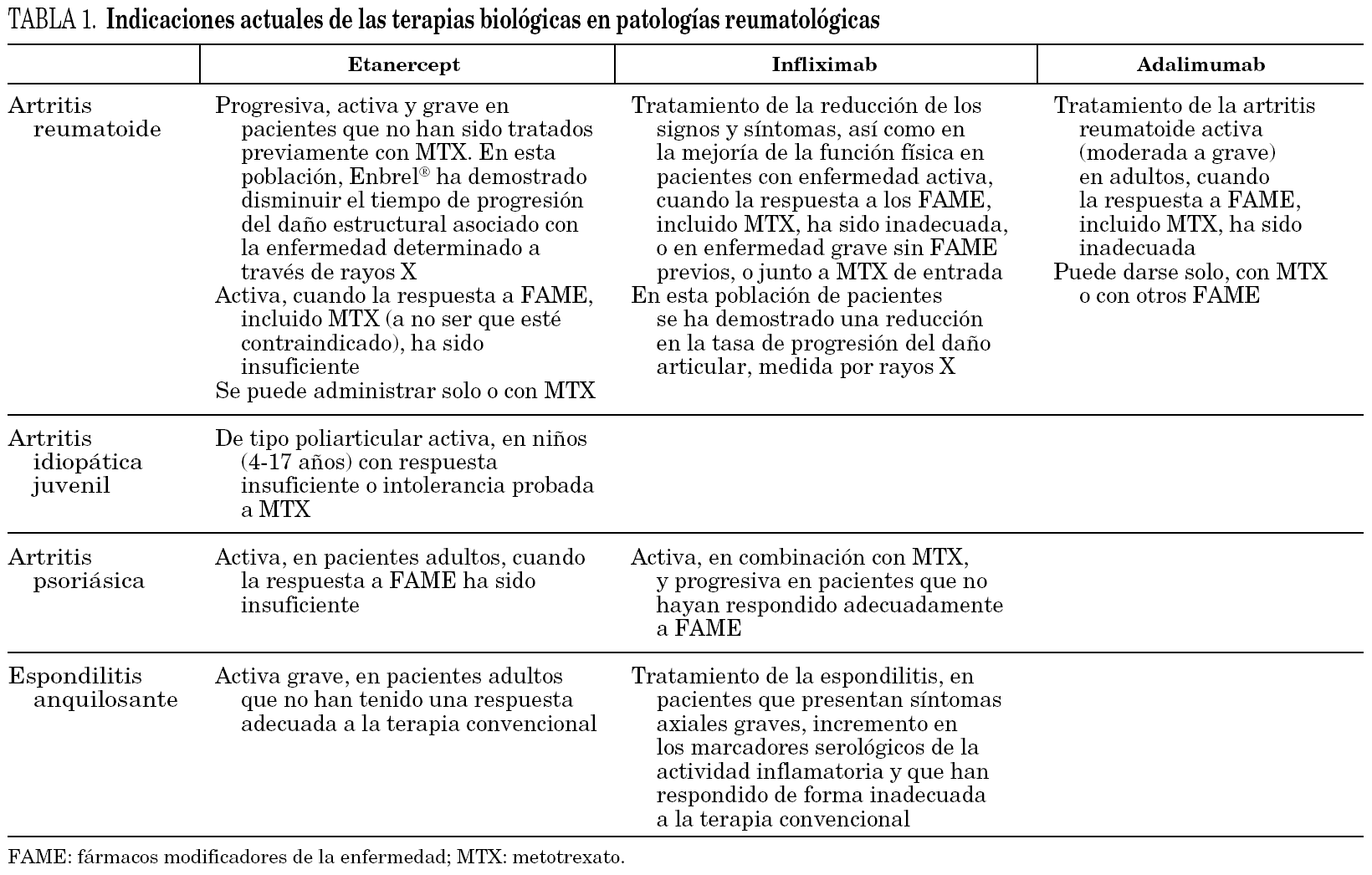
Etanercept (Enbrel®, Wyeth) es una proteína humana resultado de la fusión de dos unidades (dímeros): el dominio extracelular del receptor de 75 kDa del TNF humano unido al fragmento Fc de la inmunoglobulina humana G1 (IgG1). Este fármaco se une competitivamente tanto al TNF-α como al TNF-β. Es un antagonista con mayor afinidad por el TNF que su receptor natural, que es un monómero, y con menor inmunogenicidad (menos efectos adversos). Etanercept forma complejos inestables permitiendo la liberación del TNF e incrementando la semivida de esta citocina. Se administran 25 mg dos veces por semana por vía subcutánea. Se absorbe lentamente desde el lugar de inyección subcutánea, y alcanza una concentración máxima aproximadamente 48 h después de una sola dosis. Su biodisponibilidad absoluta es del 76%. Su semivida es de aproximadamente 70 h. No se han observado interacciones entre su administración y antiinflamatorios no esteroideos, glucocorticoides, analgésicos o salicilatos. Recientemente se ha confirmado que la administración conjunta de etanercept y metotrexato no afecta a la farmacocinética del primero 17. Fue aprobado en septiembre de 1998 para la artritis reumatoide, en mayo de 1999 para el tratamiento de la artritis idiopática juvenil 18,19 y en junio de 2002 para la artritis psoriásica y la espondilitis anquilosante 20. Tiene una excelente tolerabilidad a largo plazo, respuesta clínica rápida y sostenida, permite la reducción de dosis concomitantes de metotrexato y corticoides, y la estabilización e incluso reparación de la lesión radiológica a los 2 años 15.
Infliximab (Remicade®, Centocor Inc.) es un anticuerpo monoclonal quimérico IgG1 formado por un 75% de proteína humana y un 25% de proteína de ratón producto de la ingeniería genética. Su peso molecular es de 149 kDa. La porción murina contiene el lugar de unión del TNF-α, mientras que la porción humana es responsable de la función efectora o de inmunogenicidad. El infliximab se une al TNF-α soluble y su membrana, inhibiendo una amplia gama de sus actividades biológicas 21,22. No se une a la linfotoxina o TNF-β. La unión del infliximab al TNF produce complejos estables, que no permiten la disociación de una molécula de TNF biológicamente activa. Por otra parte, la unión de este anticuerpo monoclonal al TNF de membrana induce la lisis de la célula que expresa el TNF por activación de complemento 23. Este fármaco se comercializó en Estados Unidos en agosto de 1998 para el tratamiento de la enfermedad de Crohn. En octubre de 1999, la Food and Drug Administration (FDA) en Estados Unidos y la Agencia Europea para la Evaluación de Medicamentos (EMEA) en Europa aprobaron su comercialización para el tratamiento de la artritis reumatoide refractaria al tratamiento inicial con metotrexato. Infliximab se encuentra indicado también para el tratamiento de la espondilitis anquilosante y la artritis psoriásica. Cada vial de Remicade® contiene 100 mg de infliximab (10 mg/ml). Se utiliza en adultos a dosis entre 3 y 5 mg/kg de peso, por vía intravenosa, con una pauta especial (de inducción en la semana 0, 2 y 6; de mantenimiento cada 8 semanas); no se ha estudiado en niños (0-17 años). La semivida oscila entre 8 y 9 días, aunque puede detectarse la presencia de infliximab en suero tras 8 semanas de ser administrado.
Adalimumab (Humira®) es un anticuerpo monoclonal humano IgG1 específico para su unión con el TNF y producido por tecnología de ADN recombinante. Su peso molecular es de aproximadamente 148 kDa. Al igual que el infliximab, al ser un anticuerpo monoclonal induce la lisis de la célula que expresa el TNF por activación del complemento. Se administra en dosis de 40 mg cada 15 días por vía subcutánea. Del mismo modo que para el infliximab, la concentración sérica del adalimumab es dependiente de la dosis. Su semivida oscila entre 14,7 y 19,3 días y tampoco afecta la farmacocinética del metotrexato. Adalimumab de momento sólo está indicado para la artritis reumatoide.
Indicaciones actuales de los inhibidores del TNF
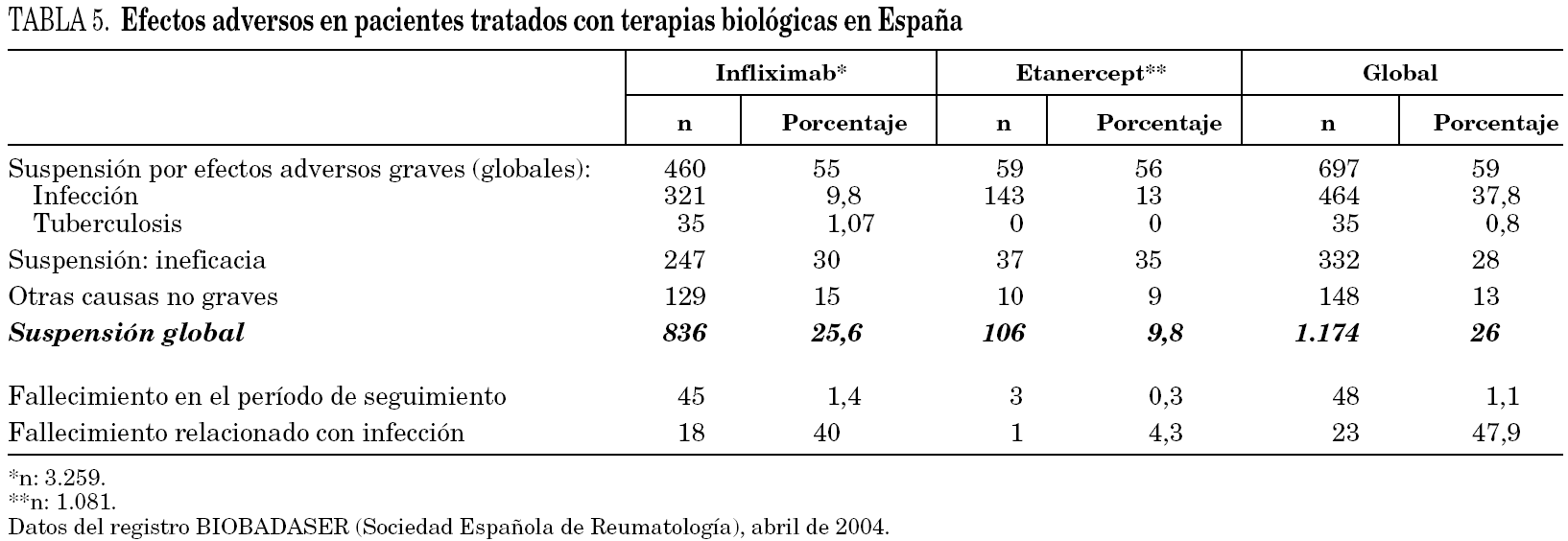
En la tabla 1 se resumen las indicaciones actuales para patologías reumatológicas de los tres anti-TNF disponibles en la actualidad (etanercept 15,24, infliximab 25,26 y adalimumab). En general, los distintos agentes anti-TNF se utilizan en artritis reumatoides activas, que no han respondido al tratamiento con fármacos modificadores de la enfermedad (FAME), como el metotrexato. Además, el infliximab se usa para el tratamiento de la enfermedad de Crohn activa grave, en pacientes que no han respondido a pesar de un curso de terapia con un corticoide y/o un inmunosupresor, y para el tratamiento de la enfermedad de Crohn fistulizante, en pacientes que no han respondido a pesar de un curso de terapia completo con tratamiento convencional 27. Otras enfermedades en las que el infliximab y el etanercept han demostrado su eficacia en estudios abiertos o series cortas de casos son: enfermedad de Still del adulto, uveítis autoinmune, esclerodermia, dermatomiositis y enfermedad de Wegener 28.
Efectos adversos
Entre los efectos adversos que se han comunicado del resultado de los ensayos clínicos controlados tanto con etanercept (1.272 pacientes) como con infliximab (1.372 pacientes) y adalimumab (2.468 pacientes) se encuentran: reacciones en el punto de inyección, reacciones a la perfusión, exantema cutáneo, trastornos neurológicos (19 casos con clínica de desmielinización durante el tratamiento) 29, trastornos hematológicos, insuficiencia cardíaca congestiva, neoplasias y trastornos linfoproliferativos o procesos autoinmunes, entre otros. Otro de los efectos adversos que merece una mención especial por su frecuencia son las infecciones.
Antagonistas anti-TNF e infección
Muchos de los efectos adversos que potencialmente pueden contribuir a una tasa elevada de morbimortalidad en este grupo de pacientes se deben a la disminución de la resistencia a las infecciones. El uso de tratamientos prolongados con inmunodepresores (ciclosporina, corticoides, metotrexato) ha aumentado el riesgo de infección en ellos 30,31. El fármaco más relacionado con la aparición de infecciones oportunistas en pacientes con artritis reumatoide es el metotrexato 32-34. Hay que tener presente que la mayoría de pacientes sometidos a terapia biológica reciben de forma previa o concomitante metotrexato y también corticoides. Si los inhibidores del TNF-α predisponen a un mayor riesgo de infecciones, se hace necesario conocer a fondo y específicamente cómo se producen, de qué tipo son y cómo prevenirlas.
Antagonistas anti-TNF e infecciones granulomatosas: tuberculosis
La pérdida de función de las citocinas puede afectar a los macrófagos que están infectados de manera crónica por bacterias intracelulares y perder la capacidad de ser activados. Algunas micobacterias (Histoplasma y L. monocytogenes) pueden escapar de las vesículas y entrar en el citoplasma, donde no son susceptibles a los efectos bactericidas de los macrófagos activados, por lo que puede desarrollarse una infección crónica con inflamación. En ella es característica la presencia de granulomas. En la tuberculosis, el centro de los granulomas queda aislado, lo cual favorece la muerte celular secundaria a la falta de oxígeno y la citotoxicidad directa de los propios macrófagos activados, formándose un tejido muerto conocido como "necrosis caseosa o caseum". La micobacteria destruye los macrófagos alveolares mediante apoptosis y la formación de granulomas caseificantes 35. En casos de infección persistente, el TNF-α tiene un papel protector que limita la capacidad patógena de la micobacteria. La adición de anti-TNF-α a cultivos in vitro de macrófagos infectados evita su destrucción ya que las cepas virulentas de M. tuberculosis no inducen la apoptosis de los macrófagos, utilizándolos como vehículos de infección del parénquima y pudiendo reactivar infecciones latentes 36-38.
Desde la aparición de la terapia anti-TNF, en los ensayos clínicos preliminares, ya se comunicaron varios casos de tuberculosis diseminadas, especialmente en pacientes con otros tratamientos (esteroides a dosis elevadas > 20 mg, metotrexato, azatioprina y ciclosporina) 39,40.
Keane et al 41, y posteriormente Wallis et al 42, han analizado en profundidad los casos de tuberculosis y otras enfermedades granulomatosas después del tratamiento con infliximab y etanercept, registrados por la FDA, desde el inicio de su utilización en 1998 hasta septiembre de 2002. Tras más de 233.000 pacientes tratados con infliximab y más de 110.000 tratados con etanercept, se registraron 639 acontecimientos adversos relacionados con infecciones (556 con infliximab y 83 con etanercept). La tasa de infecciones granulomatosas por cada 100.000 pacientes tratados con infliximab fue de 239 y de 74 con etanercept. Es importante destacar que en ambos estudios hubo igual número de pacientes que recibieron corticoides y metotrexato concomitantemente.
Por un lado, Keane et al 41 recogieron 70 casos de tuberculosis con infliximab (17 en Estados Unidos, 45 en Europa, de los cuales 10 casos se comunicaron en España, y 8 de otros países) hasta el 2001. Wallis et al 42 recogieron 374 casos, la mayoría producidos después del tercer ciclo de tratamiento, con un intervalo entre la administración de la primera dosis y el diagnóstico de 12 semanas (3 meses). Un 22% de los casos de tuberculosis aparecieron antes de los 3 meses de tratamiento con infliximab, mientras que con etanercept esta circunstancia no se produjo, y además el tiempo medio de aparición de los acontecimientos adversos fue más prolongado (40 días para infliximab frente a 236 días para etanercept). La afección tuberculosa fue en un 31% pulmonar, en un 24% diseminada y en un 33% extrapulmonar no diseminada. Las localizaciones extrapulmonares fueron muy variadas: pleural, peritoneal, meníngea, intestinal, paravertebral, ósea y genitourinaria en dos ocasiones. El cultivo confirmó el diagnóstico en el 57% de casos. Fallecieron 12 pacientes, cuatro de ellos de forma relacionada directamente con la tuberculosis.
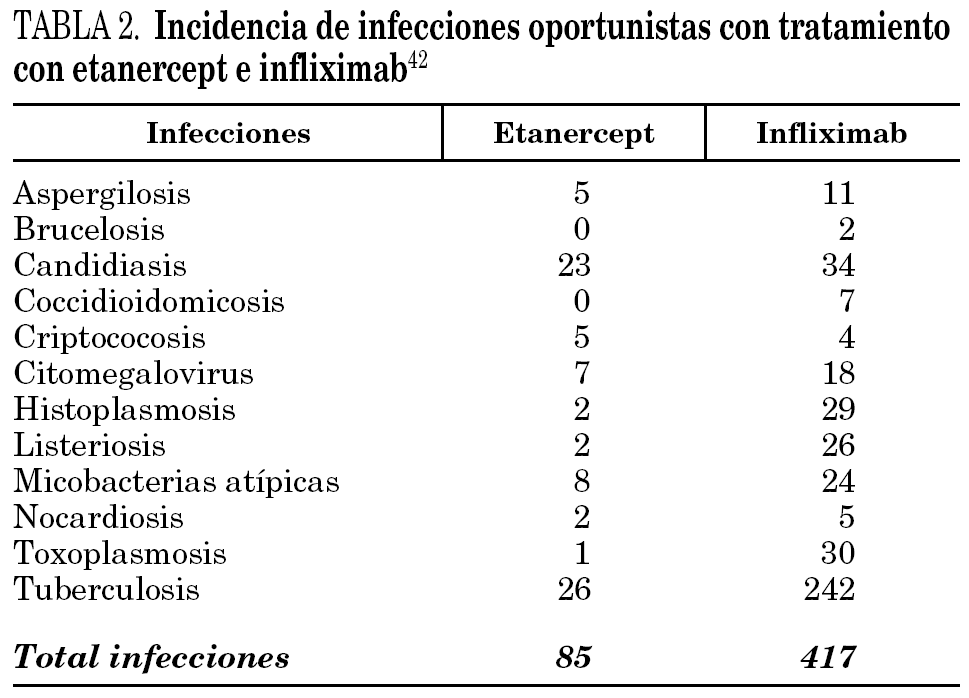
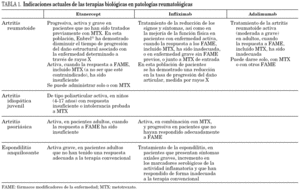
Tras los acontecimientos adversos comunicados hasta septiembre de 2002, la tasa de tuberculosis en pacientes con artritis reumatoide, establecida en 6,2 casos por cada 100.000 pacientes/año, pasó a 24,4 casos por cada 100.000 pacientes/año tratados con infliximab. Además, los autores describieron 42 histoplasmosis (39 infliximab, 3 etanercept), 44 candidiasis (11 sistémicas), 38 listeriosis (36 con infliximab y 2 con etanercept), 39 aspergilosis, 37 casos de otras micobacterias, 19 criptococosis y 11 nocardiosis. Ninguna de estas infecciones tuvo una frecuencia significativamente mayor en los pacientes tratados con etanercept; por el contario, la tuberculosis y otras micobacterias, histoplasmosis, aspergilosis, listeriosis, candidiasis y nocardiosis se dieron con más frecuencia de la esperada en los tratados con infliximab en comparación con los tratados con etanercept 42 (tabla 2).
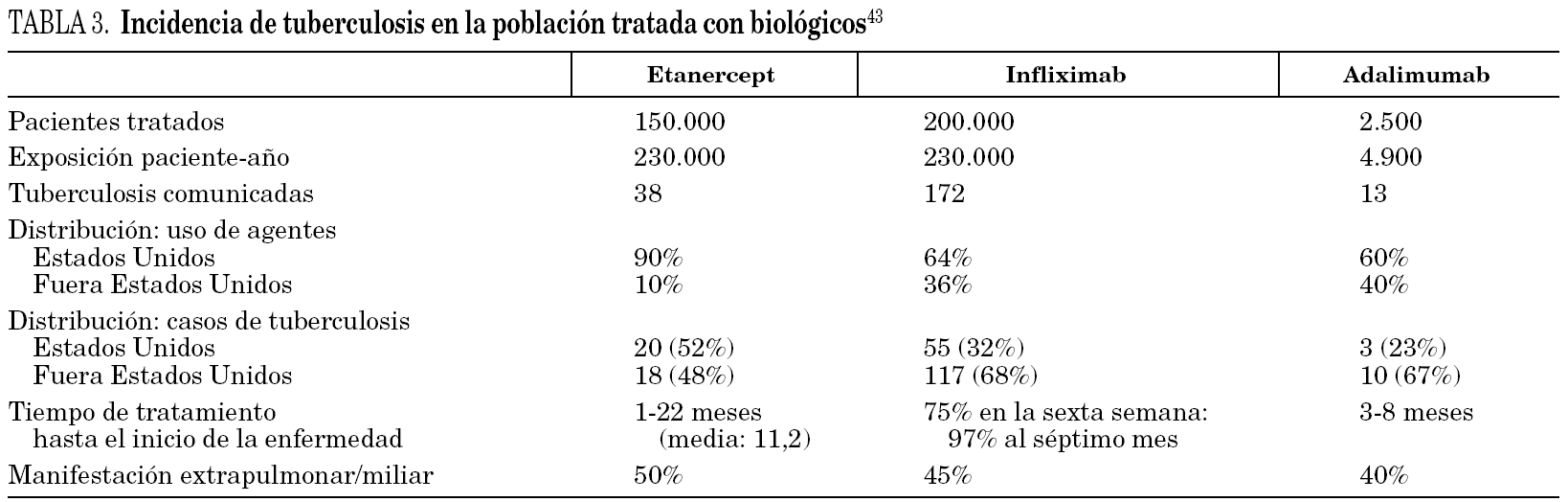
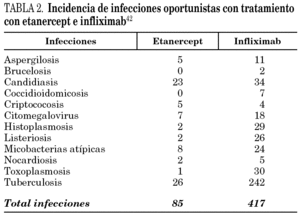
En el último informe emitido por la FDA se describe la aparición de tuberculosis en 172 de 200.000 pacientes tratados con infliximab, 13 de 2.500 pacientes tratados con adalimumab procedentes de ensayos clínicos, frente a 38 de 150.000 pacientes que recibieron etanercept (tabla 3) 43.
Mohan et al 44 revisaron 25 casos de tuberculosis asociados al uso de etanercept, 13 de ellos extrapulmonares, con una muerte relacionada. Los casos provenían de Estados Unidos (17), de Europa (7) y de India (1). Doce de ellos recibían corticoides y metotrexato al mismo tiempo. Los casos extrapulmonares fueron: pleural, articular, ganglionar (5 casos), espinal, peritoneal, meníngeo y diseminada (3 casos). El cultivo fue diagnóstico en un 48% de los casos y el resto se diagnosticó tras la visualización de tinción de esputo o de biopsia. El tiempo medio de aparición del cuadro tras el inicio de etanercept fue de 11,5 meses. La tasa de tuberculosis fue de 10 casos por cada 100.000 pacientes/año.
En nuestra experiencia (datos no publicados), de 232 pacientes reumatológicos tratados con infliximab en 2 años, se recogieron 35 infecciones asociadas con 7 casos de tuberculosis (5 extrapulmonares). No se registró ningún caso con etanercept. Extrapolando los datos a la incidencia de nuestra comunidad, esto significaba un aumento desde los 20 casos de tuberculosis por 100.000 habitantes hasta los 4.000 casos en nuestra área de influencia. En nuestra serie, el tratamiento con antagonistas fue suspendido en 77 pacientes tratados con infliximab por efectos adversos graves (33,2%). De ellos, 35 (15%) fueron por trastornos cutáneos y reacciones infusionales y nueve por infección (3,9%), tres de los cuales fueron tuberculosis extrapulmonar (1,3%).
Seis conclusiones fundamentales podemos destacar a la vista de estos hallazgos:
1. Es evidente el aumento de la tasa de tuberculosis en pacientes tratados con fármacos antagonistas del TNF, especialmente con infliximab.
2. Las manifestaciones clínicas de la tuberculosis en pacientes tratados con anti-TNF-α son atípicas (fiebre prolongada, intensa astenia) y con formas inusuales, mayoritariamente extrapulmonares y algunas diseminadas, en las que el pulmón puede no ser una alerta necesaria ni suficiente.
3. Esta clínica inusual puede retrasar el diagnóstico etiológico y contribuir a un aumento de la morbimortalidad.
4. Respecto a la enfermedad de base, otros tratamientos concomitantes hacen que los pacientes tengan una profunda inmunodepresión, por lo que las pruebas cutáneas de hipersensibilidad (tuberculina, histoplasmina), e incluso algunos tests serológicos, den resultados negativos.
5. Muchos de los casos han ocurrido en pacientes con historia previa de tuberculosis no tratada o con enfermedad latente que se inicia en forma de reactivaciones. siendo más frecuente en los pacientes tratados en Europa que en Estados Unidos 41 ya que la tuberculosis es más prevalente y existen muchas formas de tuberculosis críptica o ganglionar.
6. Mientras que los casos de tuberculosis descritos con etanercept aparecen tras un tiempo medio de tratamiento de 12 meses y podrían encontrarse relacionados con primoinfecciones tuberculosas, los casos relacionados con la administración de infliximab se producen en el 75% de los pacientes aproximadamente en la sexta semana de tratamiento, y se encontrarían relacionados con procesos de reactivación tuberculosa latente.
La falta de encapsulación de M. tuberculosis en el granuloma y el déficit en su fagocitosis 45,46, junto a la alteración de los fenómenos de apoptosis característicos de los granulomas tuberculosos 47, hacen que las reactivaciones de formas latentes sean el patrón más frecuente de presentación clínica 35,36,38. Por otro lado, el riesgo es dependiente de la dosis (a mayor dosis, más casos de tuberculosis) y es menor con etanercept 15,48, tanto en Europa como en Estados Unidos, lo cual habla de un mecanismo de regulación más fino mediado por la expresión de los receptores solubles del TNF 49,50.
Dada la morbimortalidad alcanzada por los casos de tuberculosis 42,48, y la incidencia tan alta en España tras la introducción de los agentes biológicos (de 23 casos por 100.000 preterapia a 134 por 100.000 posterapias entre 1990-2000; riesgo de tuberculosis pulmonar en pacientes con artritis reumatoide con terapia biológica de 3,68) 51, la Agencia Española del Medicamento junto con la EMEA han difundido una serie de recomendaciones que deben ser adaptadas a cada centro:
1. Si existe sospecha de tuberculosis activa, el tratamiento con antagonistas anti-TNF debe interrumpirse hasta que el diagnóstico pueda descartarse o la infección haya sido tratada de acuerdo con las directrices actuales.
2. Antes de iniciar el tratamiento con antagonistas anti-TNF, se debe evaluar la existencia de una infección tuberculosa activa y/o inactiva ("latente"), mediante una detallada historia clínica que incluya antecedentes personales de tuberculosis o posible contacto con la enfermedad y considerar la pertinencia de realizar pruebas de detección adecuadas (radiografía de tórax, prueba de la tuberculina o Mantoux) 52 en el momento inicial o cuando aparezca el más mínimo síntoma. Es preciso recordar que pueden aparecer falsos negativos en la prueba de la tuberculina en pacientes que están gravemente enfermos o inmunodeprimidos.
3. En presencia de una prueba de tuberculina positiva (PPD > 5 mm) aislada, los pacientes deben realizar tratamiento profiláctico con isoniazida (300 mg/día) durante 9 meses. En nuestra experiencia, 53 pacientes presentaron prueba de la tuberculina positiva y todos recibieron tratamiento profiláctico con isoniazida.
4. En casos con alta sospecha (tos productiva, pérdida de peso, debilidad y fiebre de bajo grado, vespertina persistente) se debe intentar confirmar el diagnóstico lo más rápidamente posible (pruebas rápidas de reacción en cadena de la polimerasa [PCR] en muestra directa) o iniciar tratamiento anticipado hasta la confirmación definitiva.
5. En caso positivo, debe mantenerse durante 6 meses en pacientes no tratados con anterioridad, y 9 meses en aquellos ya tratados con algún ciclo de infliximab (su efecto biológico se prolonga más de 2 meses).
Gómez-Reino et al 53 han demostrado que la detección y el tratamiento de casos de tuberculosis latente entre estos pacientes evita el desarrollo de tuberculosis.
Nuestra actitud ante pacientes que necesitan estos tratamientos y han tenido contacto con tuberculosis en el pasado depende de la gravedad de la enfermedad reumatológica: si es muy invalidante y de rápida progresión, se inicia terapia antituberculosa (con tres o cuatro fármacos) y se administran dos o tres ciclos de tratamiento anti-TNF. Las fórmulas de tratamiento de tuberculosis activas deberán seguir los regímenes clásicos pero adaptados a cada individuo particular en función del estado basal y de la presencia de otros tratamientos concomitantes (el metotrexato es hepatotóxico, la leflunomida es hepatotóxica e induce diarrea, disfagia y reacciones cutáneas).
Antagonistas anti-TNF y otro tipo de infecciones
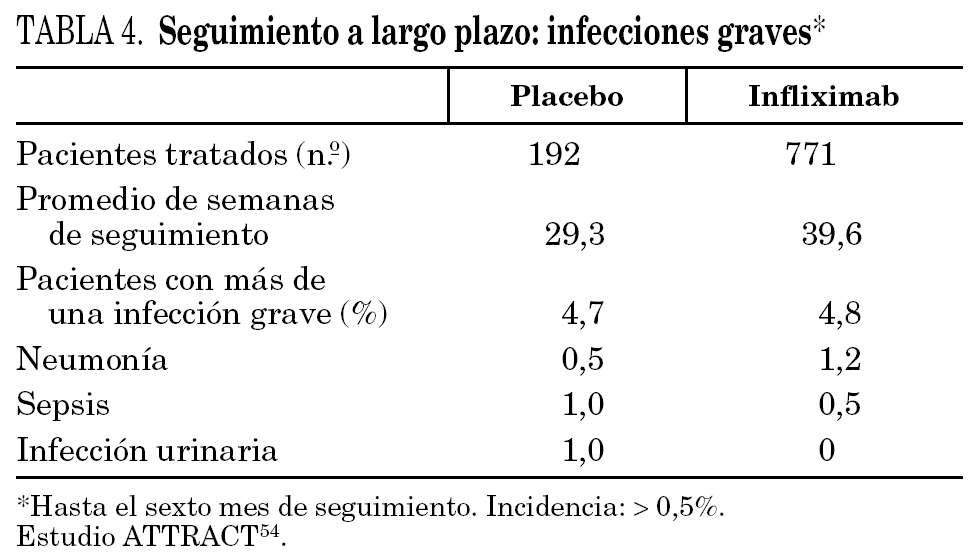
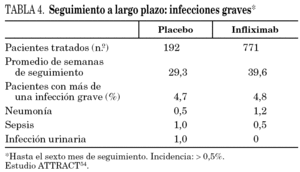
Como hemos visto, el TNF-α modula respuestas inmunitarias celulares. Es importante en la resistencia contra los agentes patógenos intracelulares y en la defensa contra virus y parásitos. Aproximadamente el 32% de los pacientes tratados con infliximab han desarrollado infecciones oportunistas, frente al 22% de los casos tratados con placebo. En el estudio ATTRACT 48,54, que englobaba a 340 pacientes tratados con una media de cinco dosis de infliximab, el número de pacientes con infecciones que requirieron tratamiento antibiótico tras 54 semanas fue similar en el grupo que recibió sólo metotrexato (35%) y en los grupos tratados con infliximab y metotrexato (44%). En el 5% de los pacientes de ambos grupos se registraron infecciones graves, como sepsis, neumonía, artritis séptica y gangrena (tabla 4).
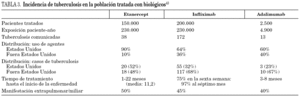
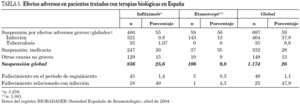
Aunque en los últimos años se han publicado casos de infecciones graves, rabdomiólisis y artritis séptica por S. aureus, en pacientes con artritis reumatoide sometidos a tratamiento con infliximab 55 hay un predomino de neumonías (nueve de ellas por Pneumocystis jiroveci) e infecciones de vías respiratorias inferiores. Con etanercept también se han descrito casos de infecciones graves y sepsis fulminante 56. De hecho, en el registro BIOBADASER (base de datos nacional de la Sociedad Española de Reumatología sobre pacientes tratados con terapias anti-TNF-α) se comunicaron 143 casos de infecciones asociadas a la terapia con etanercept (13%) y 321 episodios de infección con infliximab (9,8%) hasta abril de 2004 57. La mayoría de ellas eran infecciones de vías respiratorias inferiores y de piel y partes blandas (tabla 5).
La posibilidad de una neumonía oportunista 58 obliga a realizar pruebas diagnósticas, microbiológicas (hemocultivos, cultivos de líquido pleural u otras muestras respiratorias desde el esputo inducido para bacterias, hongos, micobacterias, inmunofluorescencia para P. jiroveci y cultivos para virus, hasta la biopsia transbronquial) y radiológicas, que en caso de negatividad orientarán hacia el diagnóstico de neumonitis no infecciosa, muchas veces relacionada con la terapia supresora, en particular con metotrexato 59. Este cuadro se ha descrito hasta en un 12% de pacientes con artritis reumatoide y bajas dosis del fármaco 60,61. Tiene una excelente respuesta al tratamiento con altas dosis de corticoides tras la suspensión del metotrexato. La hemorragia pulmonar, la bronquiolitis obliterante con neumonía organizativa y la fibrosis pulmonar son otros cuadros que hay que tener en cuenta en el diagnóstico diferencial.
En nuestra experiencia encontramos 26 infecciones tras terapia con infliximab (n = 232), de los cuales destacaron 7 casos de infección de piel, partes blandas y artritis séptica (un caso de celulitis orbitaria por grampositivos, recurrente; un caso de osteomielitis crónica estafilocócica; 3 casos de celulitis; un caso de erisipela estreptocócica, y otro de bursitis), cuatro candidiasis, cuatro herpes zóster, tres infecciones urinarias de repetición y dos neumonías (una de ellas mortal por Pseudomonas aeruginosa). En el grupo tratado con etanercept (n = 75) encontramos 11 episodios de infección, de los que se destacaba cuatro infecciones de vías respiratorias superiores, dos infecciones por herpes zóster, una sinusitis y una sepsis por S. aureus resistente a meticilina (SARM) tras absceso, infección de prótesis y bacteriemia. Es destacable que la presencia de actores de riesgo añadidos como virus de la inmunodeficiencia humana (VIH), diabetes, vasculopatías, infecciones recurrentes y presencia de heridas abiertas aumentan la posibilidad de padecer complicaciones piógenas relacionadas. Resulta interesante comprobar cómo en pacientes VIH+ con artritis psoriásica, que recibieron etanercept 24, a pesar de la buena respuesta clínica y mejoría funcional de la artritis, el tratamiento tuvo que ser suspendido por reiteración de infecciones polimicrobianas.
De forma práctica conviene recordar que:
1. La supresión del TNF-α puede enmascarar la fiebre, síntoma principal de infección de igual modo que los corticoides y los AINE 62.
2. Durante el tratamiento con antagonistas del TNF se debe vigilar estrechamente el posible desarrollo de infecciones (en especial, neumonías e infecciones de piel y partes blandas) y éste debe ser interrumpido si el paciente desarrolla una infección grave o una sepsis.
3. Aunque las infecciones pueden producirse inmediatamente después del inicio de la terapia 63, la eliminación de algunos de ellos puede prolongarse hasta 6 meses, por lo que es importante someter a una estrecha vigilancia a los pacientes durante este período 64. En el seguimiento se han comunicado infecciones oportunistas además de la tuberculosis, como neumonía por P. jiroveci31,34,65, histoplasmosis, coccidioidomicosis, aspergilosis 66 y candidiasis esofágica 41.
4. Si un paciente precisa una intervención quirúrgica durante el tratamiento con infliximab, es preciso adoptar las precauciones necesarias en cada caso. En 3 pacientes en tratamiento por enfermedad de Crohn que requirieron intervención quirúrgica durante el tratamiento con infliximab se han descrito defectos en la cicatrización de la herida quirúrgica 67.
Conclusiones
El tratamiento con antagonistas del TNF-α tiene que ser supervisado por médicos especialistas con experiencia en el diagnóstico y tratamiento de enfermedades reumatológicas e inflamatorias, y debe contar con la colaboración de infectólogos preparados en este tipo de terapias biológicas y sus mecanismos de acción y consecuencias. Es necesario un seguimiento estrecho de estos pacientes para detectar la aparición de potenciales efectos adversos 64. Por lo tanto, si se diagnostica una tuberculosis inactiva ("latente"), deben tomarse las medidas apropiadas para impedir su activación y evaluar la relación riesgo-beneficio para el paciente antes de iniciar la terapia con inhibidores del TNF. A la obligatoriedad de realizar una detección pretratamiento sobre la presencia de infección latente o enfermedad granulomatosa y la administración de profilaxis antituberculosa a los pacientes candidatos, hay que realizar un control y seguimiento estrechos de todos los pacientes en tratamiento, con un cribado de su historia clínica pasada y presente, y de entidades nosológicas con potencial predisposición para producir infección (lesiones cutáneas, infecciones urinarias, lesiones bronquiales crónicas) para la detección y el tratamiento precoces de infecciones bacterianas, fúngicas o por micobacterias.
Agradecimientos
Agradezco a las Dras. María Montoro y Laura Cebrián, del Servicio de Reumatología del Hospital General Universitario Gregorio Marañón, la elaboración de las tablas y el mantenimiento de las bases de datos.